化学必修一物质的量的计算知识点总结
高中化学必修一1.2物质的量-知识点
小初高个性化辅导,助你提升学习力! 1 高中化学必修一1.2物质的量-知识点
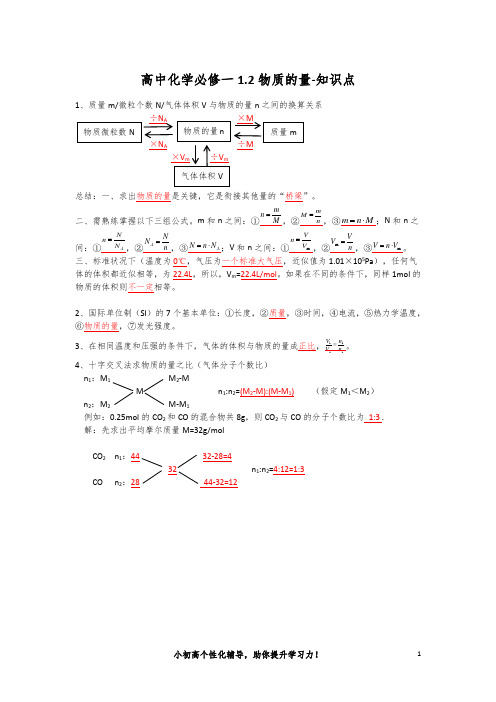
1、质量m/微粒个数N/气体体积V 与物质的量n 之间的换算关系
×N A ÷M
总结:一、求出物质的量是关键,它是衔接其他量的“桥梁”。
二、需熟练掌握以下三组公式。
m 和n 之间:①
M m n =,②n m M =,③M n m ⋅=;N 和n 之间:①A N N n =,②n N N A =,③A N n N ⋅=;V 和n 之间:①m V V n =,②n V V =m ,③m V n V ⋅=。
三、标准状况下(温度为0℃,气压为一个标准大气压,近似值为1.01×105Pa ),任何气体的体积都近似相等,为22.4L ,所以,V m =22.4L/mol 。
如果在不同的条件下,同样1mol 的物质的体积则不一定相等。
2、国际单位制(SI )的7个基本单位:①长度,②质量,③时间,④电流,⑤热力学温度,⑥物质的量,⑦发光强度。
3、在相同温度和压强的条件下,气体的体积与物质的量成正比,21
21n n V V =。
4、十字交叉法求物质的量之比(气体分子个数比)
n 1:M 1 M 2-M
M n 1:n 2=(M 2-M):(M-M 1) (假定M 1<M 2)
n 2:M 2 M-M 1
例如:0.25mol 的CO 2和CO 的混合物共8g ,则CO 2与CO 的分子个数比为 1:3 .
解:先求出平均摩尔质量M=32g/mol
CO 2 n 1 32-28=4
n 1:n 2=4:12=1:3
CO n 2:28 44-32=12。
高一化学必修一计算公式大全

1. 有关物质的量( mol )的计算公式1)物质的量( mol )2)物质的量( mol )3)气体物质的量( mol )4)溶质的物质的量( mol )=物质的量浓度( mol/L )×溶液体积( 有关溶液的计算公式1)基本公式①溶液密度( g/mL )③物质的量浓度( mol/L )(2)溶质的质量分数、溶质的物质的量浓度及溶液密度之间的关系:①溶质的质量分数②物质的量浓度L ) ②溶质的质量分数3)溶液的稀释与浓缩(各种物理量的单位必须一致):①浓溶液的质量×浓溶液溶质的质量分数=稀溶液的质量×稀溶液溶质的质量分数(即溶质的质量不变)②浓溶液的体积×浓溶液物质的量浓度=稀溶液的体积×稀溶液物质的量浓度[即c(浓)· V(浓)=c(稀)· V(稀)](4)任何一种电解质溶液中:阳离子所带的正电荷总数=阴离子所带的负电荷总数(即整个溶液呈电中性)3. 有关溶解度的计算公式(溶质为不含结晶水的固体)(1)基本公式:2)相同温度下,溶解度(S)与饱和溶液中溶质的质量分数(w%)的关系:3)温度不变,蒸发饱和溶液中的溶剂(水),析出晶体的质量m的计算:4)降低热饱和溶液的温度,析出晶体的质量m 的计算:4. 平均摩尔质量或平均式量的计算公式( 1)已知混合物的总质量 m (混)和总物质的量 n (混):2)已知标准状况下,混合气体的密度 (混):(混)注意:该方法只适用于处于标准状况下( 0℃, )的混合气体。
(3)已知同温、同压下,混合气体的密度与另一气体 A 的密度之比 D (通常称 作相对密度):4)阿伏加德罗定律及阿伏加德罗定律的三个重要推论①恒温、恒容时: ,即任何时刻反应混合气体的总压强与其总物质的量 成正比。
②恒温、恒压时: ,即任何时刻反应混合气体的总体积与其总物质的量 成正比。
说明:这种求混合物平均摩尔质量的方法, 也同样适用。
高一化学必修一物质的量知识点总结

高一化学必修一物质的量知识点总结高一化学必修一物质的量知识点总结高一的学生在学习必修一的化学课本时,会碰见很多理论性的知识概念,你知道物质的量是什么吗?关于物质的量这个内容我们需要掌握哪些知识点呢?下面是店铺为大家整理的高一化学必修一知识点,希望对大家有用!高一化学必修一物质的量知识点总结1一、物质的量的单位——摩尔1.物质的量(n)是表示含有一定数目粒子的集体的物理量。
2.摩尔(mol): 把含有6.02 ×1023个粒子的任何粒子集体计量为1摩尔。
3.阿伏加德罗常数:把6.02 X1023mol-1叫作阿伏加德罗常数。
4.物质的量 = 物质所含微粒数目/阿伏加德罗常数 n =N/NA5.摩尔质量(M)(1)定义:单位物质的量的物质所具有的质量叫摩尔质量.(2)单位:g/mol 或 g..mol-1(3)数值:等于该粒子的相对原子质量或相对分子质量.6.物质的量=物质的质量/摩尔质量 ( n = m/M )二、气体摩尔体积1.气体摩尔体积(Vm)(1)定义:单位物质的量的气体所占的体积叫做气体摩尔体积.(2)单位:L/mol2.物质的量=气体的体积/气体摩尔体积n=V/Vm3.标准状况下, Vm = 22.4 L/mol三、物质的量在化学实验中的应用1.物质的量浓度.(1)定义:以单位体积溶液里所含溶质B的物质的量来表示溶液组成的物理量,叫做溶质B的物质的浓度。
(2)单位:mol/L(3)物质的量浓度 = 溶质的物质的量/溶液的体积 CB = nB/V2.一定物质的量浓度的配制(1)基本原理:根据欲配制溶液的体积和溶质的物质的量浓度,用有关物质的量浓度计算的方法,求出所需溶质的质量或体积,在容器内将溶质用溶剂稀释为规定的体积,就得欲配制得溶液.(2)主要操作a.检验是否漏水.b.配制溶液1计算.2称量.3溶解.4转移.5洗涤.6定容.7摇匀8贮存溶液.(3)注意事项A 选用与欲配制溶液体积相同的容量瓶.B 使用前必须检查是否漏水.C 不能在容量瓶内直接溶解.D 溶解完的溶液等冷却至室温时再转移.E 定容时,当液面离刻度线1―2cm时改用滴管,以平视法观察加水至液面最低处与刻度相切为止.3.溶液稀释:C(浓溶液)/V(浓溶液) =C(稀溶液)/V(稀溶液)高一化学必修一物质的量知识点总结2胶体1、胶体的定义:分散质粒子直径大小在10-9~10-7m之间的分散系。
人教版高中高一化学必修一知识点总结归纳

第一章从实验学化学一、化学计量①物质的量定义:表示一定数目微粒的集合体符号n 单位摩尔符号 mol阿伏加德罗常数:0.012kgC-12中所含有的碳原子数。
用NA表示。
约为6.02x1023微粒与物质的量N公式:n=NA②摩尔质量:单位物质的量的物质所具有的质量用M表示单位:g/mol 数值上等于该物质的分子量质量与物质的量m公式:n=M③物质的体积决定:①微粒的数目②微粒的大小③微粒间的距离微粒的数目一定固体液体主要决定②微粒的大小气体主要决定③微粒间的距离体积与物质的量V公式:n=Vm标准状况下,1mol任何气体的体积都约为22.4L④阿伏加德罗定律:同温同压下,相同体积的任何气体都含有相同的分子数⑤物质的量浓度:单位体积溶液中所含溶质B的物质的量。
符号CB 单位:mol/l公式:C B=n B/V n B=C B×V V=n B/C B溶液稀释规律 C(浓)×V(浓)=C(稀)×V(稀)⑥溶液的配置(l)配制溶质质量分数一定的溶液计算:算出所需溶质和水的质量。
把水的质量换算成体积。
如溶质是液体时,要算出液体的体积。
称量:用天平称取固体溶质的质量;用量简量取所需液体、水的体积。
溶解:将固体或液体溶质倒入烧杯里,加入所需的水,用玻璃棒搅拌使溶质完全溶解.(2)配制一定物质的量浓度的溶液(配制前要检查容量瓶是否漏水)计算:算出固体溶质的质量或液体溶质的体积。
称量:用托盘天平称取固体溶质质量,用量简量取所需液体溶质的体积。
溶解:将固体或液体溶质倒入烧杯中,加入适量的蒸馏水(约为所配溶液体积的1/6),用玻璃棒搅拌使之溶解,冷却到室温后,将溶液引流注入容量瓶里。
洗涤(转移):用适量蒸馏水将烧杯及玻璃棒洗涤2-3次,将洗涤液注入容量瓶。
振荡,使溶液混合均匀。
定容:继续往容量瓶中小心地加水,直到液面接近刻度2-3mm处,改用胶头滴管加水,使溶液凹面恰好与刻度相切。
把容量瓶盖紧,再振荡摇匀。
高一化学必修一知识点所有公式

高一化学必修一知识点所有公式化学是一门研究物质的组成、性质以及变化规律的科学。
在学习化学的过程中,我们会接触到许多知识点和公式,这些公式是化学计算和问题解决的基础。
下面是高一化学必修一课程中的一些重要知识点和相应的公式:1. 质量、物质的量和摩尔质量质量是物体所含物质的多少,用 m 表示。
物质的量是物质基本组成单位的多少,用 n 表示。
摩尔质量是一个物质所含有的物质的量所对应的质量,用 M 表示。
它们之间的关系可以用以下公式表示:n = m / M其中,n 为物质的量,m 为质量,M 为摩尔质量。
2. 摩尔体积摩尔体积指的是物质在一定温度下所占的体积。
摩尔体积可以用以下公式计算:V = V0 / n其中,V 为摩尔体积,V0 为气体在标准状态下的体积,n 为物质的量。
3. 质量分数质量分数表示的是某种物质在混合物中所占的质量比例。
计算质量分数的公式如下:质量分数 = 某种物质的质量 / 混合物的总质量4. 定比例定律定比例定律是指当两种或多种物质反应生成其他物质时,它们之间的质量比保持不变。
可以用以下公式表示:质量比 = 质量1 / 质量2 = 整数比例5. 质量守恒定律质量守恒定律是指一个封闭系统中,化学反应前后的总质量不变。
可以用以下公式表示:质量反应物 = 质量生成物6. 浓度和溶液的配制浓度表示的是溶液中溶质的质量或摩尔数与溶液体积的比值。
可以用以下公式计算:浓度(质量分数)= 质量溶质 / 质量溶液浓度(摩尔浓度)= 物质的量溶质 / 溶液体积7. 摩尔浓度与物质的量摩尔浓度表示的是单位体积或单位质量的溶液中溶质的摩尔数。
可以用以下公式计算:摩尔浓度 = 物质的量溶质 / 溶液的体积或质量8. 气体状态方程气体状态方程描述了气体在不同条件下的状态。
常用的气体状态方程有以下几种:理想气体状态方程:PV = nRT其中,P 为气体的压强,V 为气体的体积,n 为物质的量,R 为气体常数,T 为温度。
高一化学必修一物质的量笔记

高一化学必修一物质的量笔记
高一化学必修一物质的量笔记
物质的量是高一化学必修一中的重要概念、重要内容,物质量的计算主要针对物质的质量和物质的体积,是测定物质的数量的重要方法。
从物质的体积计算物质量,可以根據比表計算密度來計算物质量,它是物质在某種溫度、壓力及特定液體中每立方厘米的質量。
通過量測物质体積及計算密度就可以求出物質質量,即D= m/V。
也可以用質量定律m=M×V,其中M為物質的摩爾質量而V為体積。
另一種量度物质的方法是以質量為基礎,即針對質量進行測量。
質量量測的類型有衡量天平、電子秤等多種,只要得到物質的質量,求出質量後再除以体積,即可得到物質的摩爾質量,即M= m/V,除以時間后可得到該物質的摩爾質量流速,即n=m/V×t。
物質的量是一個重要的概念,物質的量可以將質量、体積、濃度等參數結合起來計算出來。
它的量的幾種計算方式也是高一化学必修一所研究的重要內容,對于學生來說,弄清楚這些概念有助于以后的學習。
化学必修一 第一章 第三节 物质的量

(1) 称量时所引起的误差
使所配溶液的物质的量浓度偏高的主要原因
① ①天平的砝码沾有其他物质或已锈蚀;
② ②试剂、砝码的左右位置颠倒
③ ③调整天平零点时,游码放在了刻度线的右端
④ ④用量筒量取液体时,仰视读数,使所读液体的体积偏大等待
2、一定物质的量浓度溶液的配制:
例:配制0.5mol/L的溶液500ml:
(1) 计算:溶质用量:0.5×0.5×58.5=14.6(g)
(2) 称量:称取已研细的NaCl 14.6g
(3) 溶解:在烧杯中进行
(4) 转移:
(5) 洗涤:
(6) 定容:
(7) 摇匀:
(8) 保存:
(4)容量瓶内温度高于20℃,造成所量取的溶液的体积小于容量瓶上所标注的液体的体积,致使溶液浓度偏高。
(5)在给容量瓶定容时,仰视读数会使溶液的体积致使溶液浓度偏高。
例题精选:某学生进行中和滴定实验,需要用到浓度为0.10mol/L氢氧化钠约75ml,实验过程中用到的主要仪器有托盘天平和容量瓶。现有以下几种规格的容量瓶,实验过程中宜选用的是( )
A.50mL B.100mL C.250mL D.500mL
第 1 页 共 4 页 溶质的量(mol)溶液的体积(L)
使所配溶液的物质的量浓度偏低的主要原因
①直接称量热的物质
②砝码残缺
③在敞口容器中称量易吸收空气中其他成分或易于挥发的物质时的动
作过慢
④用量筒量取液体时,俯视读数,使所读液体的体积偏小等待
(2)用于溶解稀释溶液的烧杯未用蒸馏水洗涤,使溶质的物质的量减少,致使溶液的浓度偏低。
02物质的量(基础)知识讲解-高中化学必修一

物质的量1.【学习目标】了解物质的量的单位——摩尔。
2.掌握物质的量、物质的质量、微粒数目、标准状况下气体体积之间的关系。
【要点梳理】知识点一:物质的量及其单位(摩尔)大量的微观粒子如何计量是化学研究中面临的重要问题。
由于一切反应都是以微观粒子的相互作用为基础的,所以必须找到合适的方法来计量微粒。
数目巨大和看不见摸不着是最大的障碍。
用下面的方法把具有一定质量的微粒规定为一个集体,一切的其他微粒群体都和它进行比较来衡量微粒的多少是很好的一种解决方案。
所以就产生了新的物理量——物质的量。
物质的量通常是表示物质所含微观粒子数目多少的物理量。
要点诠释:化学实验中,取用的药品无论是单质还是化合物,都是可以用器具称量的。
而物质间发生的化学反应是原子、离子或分子之间按一定的数目关系进行的,对此,不仅我们用肉眼直接看不到,也难以称量。
国际科学家建议用“物质的量”将一定数目的原子、离子或分子等微观粒子与可称量物质联系起来(1).物质的量的含义:表示含有一定数目粒子的集合体。
特别提示:(1)物质的量(符号为n),是国际单位制中的七个基本物理量之一,其单位为摩尔(符号为mol)。
除SI外,物质的量的单位还有kmol、mmol等。
(2)“物质的量”四个字是一个整体,不可分割或插入其他字。
它不具有字面含义,不能望文生义。
将其理解为“物质的质量”或“物质的数量”,这些都是错误的。
(3)物质的量是一个基本物理量,它与国际单位制中的其他六个基本物理量呈并列关系。
“物质的量”与“摩尔”的关系,就像“长度”与“米”、“质量”与“千克”、“时间”与“秒”的关系一样,是基本物理量与其单位名称的关系。
(4)物质的量的计量对象是构成物质的微观粒子(如分子、原子、离子、电子等)或某些微观粒子的特定组合(如NaCl)等。
不可用其计量宏观物质。
如“1mol铁钉”“1mol牛”等说法都是错误的。
使用摩尔作单位时必须用化学式指明粒子的种类,如1mol H表示1摩尔氢原子,1mol H2表示1摩尔氢分子,1mol H+表示1摩尔氢离子。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
有关物质的量的计算知识点总结
1.物质的量
(1)定义:物质的量是量度一定量粒子的集合体中所含粒子数量的物理量。
符号为n ,它是把微观粒子与宏观可称量物质联系起来的一种物理量。
是国际单位制中规定的7个基本物理量之一。
说明:物质的量是描述物质属性的一个物理量,与质量长度等一样。
(2)物质的量的单位:摩尔,简称摩,符号为mol 适用对象:“摩尔”这个单位不适用于宏观物理,只适用于微观粒子,如,分子、原子、离子、质子、中子、电子等以及他们的特定组合(缔合分子、原子团、官能团等)说明:使用摩尔量度微观粒子时,一定要指明微粒的种类,一般加化学式或微粒符号。
如1molS 是正确的,但1mol 氢是错误的。
好多学生不理解物质的量的概念,在授课过程中要注意语言简洁,不用冗余的语言去解释它的概念。
2.阿伏加德罗常数
(1)定义:国际上规定1mol 任何粒子集合体所含的粒子数,称为阿伏加德罗常数,其准确数值与0.012kg 12C 中所含原子数相同,约为6.02×1023。
(2)表示:用符号N A 来表示,同上使用6.02×1023mol -1这个近似值表示,单位mol -1。
(3)物质的量(n )与粒子数(N )、阿伏加德罗常数(N A )之间的关系: A A
nN N N N n ==, 3.摩尔质量
(1)定义:单位物质的量的物质所具有的质量,符号M ,常用单位g/mol 或g.mol -1,具体物质的物质的量为常数,不随物质的量的多少而改变。
说明:表示某物质的摩尔质量时,要指明具体粒子种类。
如,氮分子(原子)的摩尔质量是正确的,但氮的摩尔质量是错误的。
(2)任何微粒的摩尔质量若以“g/mol ”为单位时,在数值上等于其相对原子(分子)质量,但二者单位不同。
(3)摩尔质量与物质的量之间的关系
物质的质量(m )、物质的量(n )、摩尔质量(M )之间的关系: n
m N M m n ==, 4.气体摩尔体积
(1)定义:单位物质的量的气体所占的体积叫作气体摩尔体积。
符号为V m ,常用的单位有 L/mol (或L · mol -1)和 m 3/mol (或m 3· mol -1)
(2)特例:在标准状况下(0℃、101kPa ),气体摩尔体积约为22.4L/mol 。
(3)V m 值与温度、压强的关系
温度和压强不同,气体的摩尔体积V m 值不同。
当温度和压强一定时,气体摩尔体积V m 为一定值。
压强一定,温度越高V m 越大;温度一定,压强越高V m 越小。
(4)物质的量(n )、气体的体积(V )和气体摩尔体积(V m )之间存在的关系: n V
m V = ; )()
(11−−⋅⋅=L g mol g M m V ρ
注意:①气体摩尔体积适用对象为气体,既包括纯净物也包括混合物;
②22.4L/mol 是任何气体在标准状况下的摩尔体积,因此在非标准状况时不能随意使用。
但在非标准状况下V m 也可能是22.4L/mol ,比如温度高压强大时。
5.阿伏伽德罗定律及其推论(PV=nRT )
(1)阿伏伽德罗定律
①定律:在同温、同压下,相同体积的任何气体都含有相同的分子数(即“四同”)
②解释:同条件下的气体,同体积时,分子数必相同;反之,分子数相同时,体积也必相同
(2)阿伏伽德罗定律的推论 条件
结论
公式
语言描述 T 、p 相同
2121V V n n = 同温同压下,气体的物质的量与其体积成正比 T 、V 相同
2121n n p p = 温度、体积相同的气体,压强与其物质的量成正比 n 、p 相同
2121T T V V = 物质的量相等、压强相同的气体,体积与其温度成正比 n 、T 相同 1
221V V p p = 物质的量相等、温度强相同的气体,压强与其体积成反比 T 、p 相同 2
121M M =ρρ 同温同压下,气体的密度与其相对分子质量(摩尔质量)成正比 T 、p 、V 相同 2
121M M m m = 同温同压下,体积相同的气体,质量与其相对分子质量(摩尔质量)成正比 T 、p 、m 相同 1221V V M M = 同温同压下,等质量的气体,相对分子质量(摩尔质量)与其体积成反比
有关物质的量的综合计算对先修的学生来说有一定的难度,需要多练习。
