电化学保护1..
高考化学精讲及练习:金属的电化学腐蚀与防护 2021届word答案版

第四节金属的电化学腐蚀与防护基础知识落实一、金属的腐蚀1.金属的腐蚀(1)概念:金属与周围的气体或液体物质发生氧化还原反应而引起损耗的现象。
其实质是金属原子失去电子变为阳离子,金属发生氧化反应。
(2)根据与金属接触的气体或液体物质不同,金属腐蚀可分为两类:①化学腐蚀:金属与接触到的干燥气体(如O2、Cl2、SO2等)或非电解质液体(如石油)等直接发生化学反应而引起的腐蚀。
腐蚀的速率随温度升高而加快。
②电化学腐蚀:不纯的金属跟电解质溶液接触时,会发生原电池反应,比较活泼的金属失去电子而被氧化。
2.钢铁的电化学腐蚀根据钢铁表面水溶液薄膜的酸碱性不同,钢铁的电化学腐蚀分为析氢腐蚀和吸氧腐蚀:(1)析氢腐蚀:当钢铁表面的电解质溶液酸性较强时,腐蚀过程中有氢气放出。
①负极反应式为Fe-2e-===Fe2+;②正极反应式为2H++2e-===H2↑;③总反应方程式为Fe+2H+===Fe2++H2↑。
(2)吸氧腐蚀:当钢铁表面的电解质溶液呈中性或呈弱酸性并溶有一定量的氧气时,将会发生吸氧腐蚀。
①负极反应式为2Fe-4e-===2Fe2+;②正极反应式为2H2O+O2+4e-===4OH-;③总反应方程式为2Fe+2H2O+O2===2Fe(OH)2。
铁锈(Fe2O3·x H2O)的形成:2Fe(OH)3===Fe2O3·x H2O+(3-x)H2O。
总结归纳:1化学腐蚀和电化学腐蚀往往同时发生,只是电化学腐蚀比化学腐蚀更普遍,危害更大。
2析氢腐蚀和吸氧腐蚀取决于金属表面电解质溶液的酸碱性,实际情况中以吸氧腐蚀为主。
3钢铁发生析氢腐蚀或吸氧腐蚀时,负极都是铁,失电子生成Fe2+,而非Fe3+。
二、金属的防护方法1.电化学保护法(1)牺牲阳极的阴极保护法——原电池原理如图1所示,在被保护的钢闸门上装上若干的金属锌块(比铁活泼),锌块作原电池的负极;钢闸门作原电池的正极。
图1图2(2)外加电流的阴极保护法——电解原理如图2所示,被保护的钢闸门作阴极,与电源的负极相连;惰性电极作阳极,与电源的正极相连。
高中化学电化学保护法

高中化学电化学保护法电化学保护法是一种保护金属腐蚀的方法,通过利用电化学原理,将金属与特殊金属或化合物连接在一起,形成电池系统,从而减缓金属的腐蚀速度。
在工业生产和日常生活中,电化学保护法被广泛应用于金属结构、管道、船舶等领域,起到延长金属使用寿命、节约资源的作用。
1. 电化学保护原理电化学保护法主要通过两个原理来实现金属的保护:阳极保护和阴极保护。
阳极保护是指通过在金属表面形成一个保护层,使其成为阳极,从而抑制金属的电化学反应。
常见的阳极保护方法有镀层、热浸镀、电解镀等。
例如,在钢铁制品上镀一层锌,形成锌层保护钢铁,就能有效避免钢铁的腐蚀。
阴极保护是通过在金属表面形成一个促进电子流动的保护层,使其成为阴极,从而减少金属的电化学反应。
常见的阴极保护方法有通过外加电流保护、利用阳极保护金属等。
通过外加电流保护是指将金属与一个更活泼金属连接起来,通过外部电源加在金属上,使金属表面形成一个保护层。
例如,将镁棒与铁件连接,并施加外部电源,使镁成为阴极,起到防腐蚀的作用。
2. 电化学保护法的应用2.1. 工业领域在石油、化工、电力等工业领域,金属设备常常会受到腐蚀的侵害,使用电化学保护法能够延长设备的使用寿命、减少维修成本。
例如,在石油储罐中,通过在罐体上安装一组金属阳极,将其与储罐连接形成电化学保护系统,能够有效地降低罐体的腐蚀速度。
2.2. 建筑领域金属结构是建筑物中常用的结构形式,然而在湿润的环境中容易受到腐蚀。
电化学保护法可以在金属表面形成一个保护层,延缓金属的腐蚀速度。
例如,在海洋环境中,钢铁构件会暴露在海水中,容易发生腐蚀。
通过在钢铁表面施加一个保护电位,形成一个保护层,能够大大延长钢铁的使用寿命。
3. 电化学保护法的优缺点3.1. 优点电化学保护法不需要使用化学品,对环境友好,能够延长金属的使用寿命,减少资源浪费。
同时,电化学保护法操作简便,维护成本低,广泛适用于各种金属结构。
3.2. 缺点电化学保护法需要一定的电源供应,增加了能源消耗。
傅献彩《物理化学》第五版课件及习题答案_10电解与极化作用
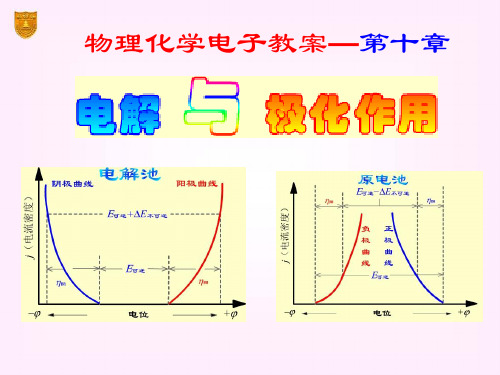
§10.2 极化作用
例如电解一定浓度的硝酸银溶液 阴极反应
Ag + (mAg+ ) e Ag(s)
可逆
电解时
RT 1 Ag |Ag ln F aAg+
阴
可逆 > 不可逆 阳极上有类似的情况,但 可逆 < 不可逆
动势达极大值 Eb,max。
电 流 I
3
再增加电压,使I 迅速增 加。将直线外延至I = 0 处, 得E(分解)值,这是使电解
2 1
池不断工作所必需外加的 最小电压,称为分解电压。
E分解
电压E
测定分解电压时的电流-电压曲线
实际分解电压
要使电解池顺利地进行连续反应,除了克服作
为原电池时的可逆电动势外,还要克服由于极化在
生消耗氧的还原反应:
O2 (g)+4H+ 4e 2H2O
(O2 |H2O,H+ )
RT 1 ln 4 4F aO2 aH +
1.229 V
设 aO2 1, aH+ 107 , 则 (O2 |H2O,H+ ) 0.816V
这时与 E(Fe2+ |Fe) (-0.617V)阳极组成原电池的电动 势为 1.433 V 显然耗氧腐蚀比析氢腐蚀严重得多。
所以铁很快腐蚀形成铁锈。
CO2 SO2
Fe2+
H 2或 H 2O
O2
O2
H
Cu
+
H2 O
Fe
2e-
H2 O
H+
Cu
电化学腐蚀示意图
电化学保护

电化学保护
通过改变极性或移动金属的阳极极化电位达到钝态区来抑制或降低金属结构腐蚀的材料保护技术。
从伽法尼电池的两个金属电极来观察﹐腐蚀总是发生在阳极上。
阴极保护就是在潮湿的土壤或含有电解质(如盐等)的水液等电解液中﹐利用牺牲阳极(如锌﹑铝等)或外加电流的惰性阳极﹐使被保护的钢铁结构成为这种人为的伽法尼电池中的阴极。
在同一腐蚀环境中﹐活性较大的是阳极﹐较小的是阴极﹐例如在海水中﹐锌与低碳钢间如构成电解电池﹐锌就是阳极﹐钢就是阴极﹔但如果钢与不锈钢形成电解电池时﹐钢又变为阳极﹐不锈钢是阴极。
所谓阴极﹐实际上是使电解液中的阳离子获得电子而还原的一个电极。
因此﹐利用外加直流电源使它获得电子补充﹐也属於阴极保护方法。
在不同的腐蚀介质中所需的保护电流密度不一。
钢在土壤内﹐约为0.0001~0.005安/分米﹐在流动海水中约为0.0003~0.0015安/分米﹐而在流动淡水中为0.005安/分米。
阴极保护广泛用於保护地下管道﹑通信或电力电缆﹑闸门﹑船舶和海上平台等以及与土壤或海水等接触面积很大的工件﹐电化学保护与涂装结合则更为经济。
城市和大型工厂的地下金属设备可採用这种保护方法﹐但需要注意杂散电流不致影响邻近地下金属设施的加速腐蚀。
阳极保护主要用於保护钢﹑不锈钢和鈦等在浓硫酸和磷酸等强介质中的腐蚀。
活性-钝性金属在阳极极化时﹐即电流导入而產生电位变化时﹐其极化曲线中有显著的活化﹑钝化和过钝化区(见图阳极保护原理的极化曲线
对於这种情况﹐可利用稳压电源将电位控制在钝化区间﹐使腐蚀电流值降到最低限度。
电化学腐蚀与防护

6
● 介质成分:介质中的盐分、酸、碱、盐等成分可以影响金属的电化学性质,从而影响腐蚀速率。例如, 酸性介质通常会加速钢铁的腐蚀
7 ● 流速:流速的增加会导致金属表面与周围介质的交换速率增加,从而加速电化学腐蚀的进程
为了防止和减缓电化学腐蚀的发生,可以 采取以下几种常见的防护方法
● 涂层保护:在金属表面涂覆一层耐腐蚀 材料,如油漆、树脂、橡胶等,以隔离金 属表面与周围介质的接触,从而防止腐蚀 的发生 ● 缓蚀剂:向介质中添加能够降低腐蚀速 率的物质,如酸碱中和剂、阻垢剂等。这 些物质可以在金属表面形成保护膜,降低 氧化还原反应的速率 ● 阴极保护:通过向金属表面施加电流或 使其成为原电池的阴极,以减缓或防止金 属表面的腐蚀。这种方法通常用于保护埋 地管道、船舶、建筑物等
● 阳极保护:通过将金属表面处理成阳极 状态,使其表面形成一层保护性的氧化膜, 从而防止进一步的腐蚀。这种方法通常用 于保护铝、镁等较活泼的金属材料
● 选用耐腐蚀材料:根据具体应用场合选 择耐腐蚀性能较好的材料,如不锈钢、钛 合金等,以降低腐蚀速率
● 控制环境因素:对于高温、高湿、恶劣 环境下的设备,应采取相应的措施控制环 境因素对腐蚀的影响,如加装空调、除湿 设备等
汇报结束
不妥之处敬请批评指正
产生电流
随着时间的推移, 金属表面的腐蚀逐 渐扩大,最终导致 金属结构的破坏
电化学腐蚀的发生和进展受到多种因素的影响,包括金属材料的性质、表面状态、温度、湿度、介质成
1 分、流速等。以下是一些主要因素
● 金属材料的性质:不同金属材料对电化学腐蚀的敏感性不同。例如,较活泼的金属如铁、铝、镁等容
2 易发生电化学腐蚀,而较不活泼的金属如金、银、铂等则不易受腐蚀
5
金属的电化学腐蚀与防护

一二
思考感悟 电化学防护的实质是什么? 提示:电化学防护的实质是把被保护的金属作原电池的正极或电 解池的阴极,不参与电极反应,从而不被氧化。
一、化学腐蚀与电化学腐蚀的区别和联系
中性或碱性
性较强
现象 无电流产生
有微弱电流产生
化学腐蚀 电化学腐蚀(主要)
反应
负极:Fe-2e- Fe2+
式(以 2Fe+3Cl2 铁腐蚀 2FeCl3
为例)
正极:2H2O+O2+4e4OH-
正极:2H++2eH2↑
联系
两种腐蚀往往同时发生,只是电化学腐蚀比化学腐蚀 更普遍,危害更大
特别提醒只有在金属活动ቤተ መጻሕፍቲ ባይዱ顺序中位于氢前面的金属才可能发生 析氢腐蚀,位于氢之后的金属只能发生吸氧腐蚀。
知识点1 知识点2 知识点3
点拨主要从以下几个方面来解决此类题目。 ①正确地判断出金属腐蚀是化学腐蚀还是电化学腐蚀。 ②如果是电化学腐蚀,判断出正、负极,一般活泼的金属为负极
被腐蚀,不活泼的金属为正极被保护。
知识点1 知识点2 知识点3
金属腐蚀快慢的比较 【例题2】 如图,各烧杯中盛有海水,铁在其中被腐蚀由快到慢的 顺序为( )
三、金属的电化学防护 1.金属的防护方法
2.金属的电化学防护 (1)牺牲阳极的阴极保护法。 将还原性较强的金属作为保护极与被保护金属相连构成原电池, 还原性较强的金属将作为负极发生氧化反应而被损耗,被保护金属 作为正极就可以避免被腐蚀。这种保护法牺牲了阳极保护了阴极。 (2)外加电流的阴极保护法。 将被保护金属与外加直流电源的负极相连让其成为阴极,而将外 加直流电源的正极接到惰性电极上,让其成为阳极。
化学选修四4-4金属的电化学腐蚀与防护

(2)铁锅锈蚀的电极反应方程式为:
负极 2Fe- 4e- =2Fe2+ ,正极2H2O+O2+4e-=4OH-。 正、负极电极反应的产物会继续发生反应,反应的离
子方程式或化学方程式为
2Fe+O2+2H2O=2Fe(OH)2、 4Fe(OH)2+O2+2H2O=
4Fe(OH)3
2Fe(OH)3=Fe2O3·xH2O+(x-3)H2O
电化 学
防护
应用
牺牲阳极的 阴极保护法
一些钢铁设备如锅炉 内壁、船体外壳等装
上镁合金或锌片
外加电流的 阴极保护法
土壤、海水及水中的 金属设备
实例
示意 图
●案例精析
【例1】关于金属腐蚀的叙述中,正确的是( C )
A.金属被腐蚀的本质是M+nH2O=M(OH)n+ n/2H2↑
B.马口铁(锡铁)镀层破损后被腐蚀时,首先是 镀层被氧化
以下现象与电化学腐蚀无关的是 ( D ) A.黄铜(铜锌合金)制作的铜锣不易产生铜绿 B.生铁比纯铁芯(几乎是纯铁)容易生锈 C.铁质器件附有铜质配件,在接触处易生铁
锈
D.银质奖牌(纯银制成)久置后表面变暗
以下现象与电化学腐蚀无关的是( D ) A.镀锡铁器比镀锌铁器表面破损时更易被腐
蚀
B.生铁比纯铁容易生锈 C.镶有相邻的银牙和金牙容易引起头痛 D.输送氯气的钢管易被氯气腐蚀
(2)钢铁吸氧腐蚀的原理:
在潮湿的空气中,钢铁表面溶解有氧气,它与钢 铁中的碳和铁形成了原电池。这些微小的原电池 遍布钢铁表面。
负极(Fe):2Fe-4e-=2Fe2+(氧化反应)
正极(C):2H2O+O2+4e-=4OH-(还原反应) 总反应:2Fe+O2+2H2O=2Fe(OH)2 Fe(OH)2继续与空气中的O2作用,生成Fe(OH)3, 再生成铁锈。
材料腐蚀与防护

材料腐蚀与防护名词解释:1、高温氧化:金属与环境介质中的气相或凝聚想物质发生化学反应而遭到破坏的过程称高温氧化。
2、缓蚀率:缓蚀剂的缓蚀效率,即缓蚀剂降低的腐蚀速度与原腐蚀速度的比值。
3、PB比:氧化物与金属的体积差对氧化物的保护性的影响,即氧化生成的金属氧化膜的体积与生成这些氧化膜所消耗的金属的体积的比值叫PB比。
4、平衡电极电位:当金属电极上只有唯一一种电极反应,并且该反应处于动态平衡时,金属的溶解速度等于金属离子的沉积速度,则此时电极获得的不变的电位值,称为平衡电极电位。
5、去极化:凡是能消除或印制原电池阳极或阴极极化过程的均叫做去极化。
6、应力腐蚀:是指金属材料在特定腐蚀介质或拉应力共同作用下发生的脆性断裂。
7、自腐蚀电位:在一个电极表面同时进行两个不同的氧化还原过程,当平衡时仅仅是电荷平衡而无物质平衡的电极电位,即外电流为零时的电极电位,称作自腐蚀电位。
简答:1、高温氧化条件下,金属氧化膜具有保护作用的条件有哪些?(充分条件)必要条件:PBR值大于1充分条件:(1)膜要致密,连续无孔洞,晶体缺陷少。
(2)稳定性好,蒸气压低,熔点高。
(3)膜与基体的附着力强,不易脱落。
(4)生长内应力小。
(5)与金属基体具有相近的热膨胀系数。
(6)膜的自愈能力强。
2、简述提高合金抗氧化的可能途径有哪些?通常利用合金化来提高金属的抗氧化性。
方法有:(1)、减少基体氧化膜中晶格缺陷的浓度;(2)、生成具有保护性的稳定相;(3)、通过选择性氧化生成优异的保护膜。
3、流速对扩散控制下的腐蚀速度有什么影响?溶液流速增加使扩散层厚度减小,腐蚀速度增加。
对于活化体系,腐蚀速度随溶液流速增加而增加,但当流速增大到一定值后,由于氧供应充足,阴极由氧的扩散控制变成了活化控制,此时活化控制的腐蚀速度与介质的流速无关。
对于可钝化体系,在氧扩散控制的条件,体系未进入钝态前,腐蚀速度随流速增加而增加。
当速度达到或超过临界值时,即极限扩散电流密度已达到或超过临界钝化电流密度时,金属由活化态变为钝态,此时阳极的腐蚀由阳极扩散控制转变为阳极电阻极化控制,腐蚀速度为维钝电流密度,但当溶液流速继续增加时,腐蚀过程又转为氧扩散控制,腐蚀速度将迅速增加。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
•阳极保护
(1)原理 对具有活态—钝态转变而不能自钝化的腐 蚀体系,通过阳极极化电流,使金属的电 位正移到稳定钝化区内,金属的腐蚀速度 就会大大降低,这种防护方法称为阳极保 护。
阴极保护中电流遮蔽作用的例
阴极保护适合的体系:
不是任何金属结构或设备都可以使用阴极保 护的,必须符合一定条件和范围。 在工程上作为一种腐蚀控制技术还要求保护 电流密度比较小,在经济上才合算。阴极保 护的经济指标可以用保护效益Z来衡量 腐蚀体系的阴极极化率大,阳极极化率小(即 阴极极化曲线陡而阳极极化曲线平),则随 着电位负移,金属腐蚀速度减小快,而保护 电流密度增加慢,保护效益也就较大,可以 满足经济指标方面的要求。
阴极保护举例:
测量阴极极化曲线 ,确定是否适宜采用阴极 保 护。 从极化曲线上确定保护电位,及相应的保护 电流密度。 计算保护度 :测量极化曲线得出保护电位的 大致范围后,将试样恒定在不同的极化电位, 经过适当的暴露时间,用失重法测量金属的 腐蚀速度,从而计算不同极化电位下的保护 度。
防护技术
第十二章 防护方法
电化学保护
阴极保护
(1)保护原理
金属—对被保护金属施加阴极极化,
使电位移动到阴极区,消除金属表面电 化学不均匀性,降低阳极溶解速度而得 到保护。因而金属腐蚀速度减小,称为 阴极保护效应。利用阴极保护效应减轻 金属设备腐蚀的防护方法叫做阴极保护 。
防护技术
直流电源
- +
辅助 阳极
辅助阳极和参比电极分布平面图
A1 R1 A3 R3 As
控制室
A7
R5
A9
船尾 三 货 舱
尾 轴 弄 A2 R2 A4
主 机 舱 A6
副 机 舱 R4
行 李 舱 As
二 货 舱
一 货 舱 A10 R6
船 首
辅助阳极:合金阳极,左右对秒,基本均匀分布,阳极间距25-28M, 安装在重戴水线到船底基线展开面的1/3处。 参比电极:Ag/Agce 电极,共6支,左右舷各3支,分布在两个阳极之 间,阳极屏蔽层边缘。
就被称之为牺牲阳极。常用的有铝及其合金、锌及其合金、镁及其
合金等阳极。 外加电流阴极保护法是通过外加直流电源来提供所需的保护电
流。将被保护的金属作阴极,选用特定材料作为辅助阳极,从而使
被保护金属结构受到保护的方法。
防护技术
直流电源
+
辅助 阳极
-
地面
接线盒
腐蚀 介质
被保护设备
埋地管道
.外加电流保护法. 箭头表示电流方向
∆
黄浦江这 江引水钢 管外加电 流阴极保 护
(4)联合保护
1)阴极保护与涂层的联合保护 对于大面积的结构,如用涂料与阴极保护相结 合,由于绝大部分阴极面积为涂料所覆盖,电 流的消耗大大降低了,同时可以克服单独使用 涂料容易出现针孔和局部损坏的缺点。 2)阴极保护与缓蚀剂的联合保护 有些表面复杂的结构单独用阴极保护,由于遮 蔽作用而保护效果不好,而单独用缓蚀剂效果 又不显著,这时用阴极保护与缓蚀剂联合保护 就可得到比较理想的效果。
工业上应用阴极保护的腐蚀体系是:
土壤、海水、河水等环境中的碳钢管道、 构筑物、设备。
*确定保护电位时应考虑两个方面的因素:第 一,从保护效果来讲,Epr越负越好。第二, 析氢反应的影响。析氢是使极化电流密度迅 速增大,保护效益降低;析氢还可能造成对 设备金属材料的危害,如氢脆问题,以及对 金属表面涂层的破坏。
●●
牺牲阳极法阴极保护
牺牲阳极的性能 (1)电位要足够负 (2)阳极溶解性能 好 (3)理论发生电量 大 (4)实际发生电量和电流效率 实际发生电量总是小于理论发生电量,所 占百分比称为电流效率。
防护技术
- +
-
+
(a)对管内壁保护
(b) 管束间实施保护
- +
©有突出部分结构
引自« 电化学保护在化 肥生产中的应用» P83.84
长征舱外加电流阴极保护
<腐蚀与防护>1980,No3
防护技术
参
× -
+
黄浦江 参比 电极 过江钢管 沉井 阳 极 深 井
阳极:石墨 阳极井深度 50M。第中井 垂直安装阳 术8至9个, 参水厂
∆
4
∆
6 10 11
阴极保护站
阳极深井 ∆参比电极井编 号为沉井号
(1)材料:被保护金属材料在所处介质中容易 发生阴极极化,即通过较小的阴极电流就可使 其电位较大的负移。 钝态金属如外加阴极极化可能会使其活化而加 速腐蚀,因而不宜用阴极保护。 (2)介质:被保护金属必须处在电解质溶液中 才能收到阴极保护,同时电解质溶液的量要大。 (3)结构:被保护设备的结构形状一般不宜太 复杂,结构复杂的设备在靠近辅助阳极部位电 流密度大,远离辅助阳极部位电流密度小,得 不到足够的保护电流。
(3)、阴极保护的种类及特点
所谓阴极保护就是向被保护金属结构通以一定的阴极极化电流, 使被保护的金属结构电位降至稳定区而得到保护。根据所提供电流 的方式不同,可分为牺牲阳极保护法和外加电流保护法。 牺牲阳极保护法就是选择电位较低的金属材料,在电解液中与 被保护的金属相连,依靠其自身腐蚀所产生的电流来保护其他金属 的方法。这种为了保护其他金属而自身被腐蚀损耗的金属或合金,
牺牲阳极
.牺牲阳极保护法. 箭头表示电流方向
两种阴极保护示意图
电化学阴极保护法的比较
种 类 优 点 缺 点
不需要外加电流,安装方 便,结构简单,安全可靠,保护周期短,需要定 牺牲阳极法 电位均匀,平时不用管理,期更换 一次性投资小
电位、电流可调,可实现 一次性投资较大,设 自动控制,保护周期较长, 外加电流法 备结构复杂,需要管 辅助阳极排流量大而安装 理维护 数量少
外加电流阴极保护 I- - +
I Icor Ic
阴 极
Icor=Oa=/Ic/
Ic
阴 极
Ia
阳 极
辅助
阳极
Ia
阳 极
Ia
I电流关系:ⅠIcⅠ=ⅠIcⅠ-Ia
腐蚀电池
外加电流阴极保护示意图
(2) 保护参数
保护电位Epr:阴极保护中所取的极化电位。显 然,要使金属的腐蚀速度降低到零,达到 “完全保护”(即保护度η =100%),必须取 阳极反应平衡电位作为保护电位,即取Epr = Eea。 (最小)保护电流密度ipr:与所取保护电位对应的 外加极化电流密度叫做保护电流密度。 *在两个保护参数中,保护电位是基本的控制指 标。
