【总结】高中化学——有机化合物及其官能团的化学性质
[超全]官能团的性质及有机知识总结最全面(精华版)
![[超全]官能团的性质及有机知识总结最全面(精华版)](https://img.taocdn.com/s3/m/acf87b96caaedd3382c4d376.png)
有 机 物官 能 团 代 表 物 主 要 化 学 性 质烷烃 C-C 甲烷 取代(氯气,光照),裂化烯烃C=C 乙烯 加成,氧化(使 KMnO 4 褪色),加聚 烃炔烃 C=C乙炔 加成,氧化(使 KMnO 4 褪色),加聚 苯及其同 系物 取代(液溴,铁),硝化,加成 — R 苯甲苯 氧化(使 KMnO 4 褪色,除苯外)卤代烃— X 溴乙烷 水解( NaOH/H 2O ),消去( NaOH/ 醇)有 机 物 官 能 团 与 性 质[知识归纳 ]烃醇 — OH乙醇 置换,催化氧化,消去,脱水,酯化 地 衍 酚— OH苯酚 弱酸性,取代(浓溴水),显色,氧化(露置空气中变粉红色) 生 醛 — CHO 乙醛仍原,催化氧化,银镜反应,斐林反应 物 羧酸 — COOH乙酸弱酸性,酯化酯葡萄糖— COO —— OH ,— CHO乙酸乙酯/水解具有醇与醛地性质重要 地蔗糖麦芽糖 前者无— CHO 前者有— CHO/无仍原性,水解(产物两种)有仍原性,水解(产物单一) 营养 淀粉 纤维素 ( C 6H 10O 5 ) n 后者有— OH / 水解 水解 物 油脂 — COO — /氢化,皂化 质氨基酸 蛋白质NH 2-,-COOH — CONH —/两性,酯化水解其中:1,能使 KMnO 4 褪色地有机物:烯烃,炔烃,苯地同系物,醇,酚,醛,葡萄糖,麦芽糖,油脂2,能使 Br 2 水褪色地有机物:烯烃,炔烃,酚,醛,葡萄糖,麦芽糖,油脂 3,能与 Na 反应产生 H 2 地有机物:醇,酚,羧酸,氨基酸,葡萄糖 4,具有酸性(能与NaOH ,Na 2CO 3 反应)地有机物:酚,羧酸,氨基酸5,能发生银镜反应或与新制Cu(OH) 2 反应地有机物:醛,甲酸,甲酸盐,甲酸酯,葡萄糖,麦芽糖 6,既有氧化性,又有仍原性地有机物:醛,烯烃,炔烃7,能发生颜色(显色)反应地有机物:苯酚遇FeCl 3显紫色,淀粉遇I2 变蓝,蛋白质遇浓硝酸变黄,葡萄糖遇Cu(OH) 2 显绛蓝有机物地物理性质1,状态:固态:饱与高级脂肪酸,脂肪,葡萄糖,果糖,蔗糖,麦芽糖,淀粉,维生素,醋酸(16.6℃以下);气态: C 4以下地烷,烯,炔烃,甲醛,一氯甲烷,新戊烷;液态:油状:乙酸乙酯,油酸;粘稠状:石油,乙二醇,丙三醇;2,气味:无味:甲烷,乙炔(常因混有PH3,H 2 S 与AsH 3 而带有臭味);稍有气味:乙烯;特殊气味:甲醛,乙醛,甲酸与乙酸;香味:乙醇,低级酯;3,颜色:白色:葡萄糖,多糖黑色或深棕色:石油4,密度:比水轻:苯,液态烃,一氯代烃,乙醇,乙醛,低级酯,汽油;比水重:溴苯,乙二醇,丙三醇,CCl 4;5,挥发性:乙醇,乙醛,乙酸;6,水溶性:不溶:高级脂肪酸,酯,溴苯,甲烷,乙烯,苯及同系物,石油,CCl 4;易溶:甲醛,乙酸,乙二醇;与水混溶:乙醇,乙醛,甲酸,丙三醇;有机化学知识点总结1. 需水浴加热地反应有:(1 ),银镜反应(2),乙酸乙酯地水解(3)苯地硝化( 4 )糖地水解(5 ),酚醛树脂地制取(6)固体溶解度地测定凡为在不高于100 ℃地条件下反应,均可用水浴加热,其优点:温度变化平稳,不会大起大落,有利于反应地进行;2. 需用温度计地实验有:(1 ),实验室制乙烯(170 ℃)(2 ),蒸馏.. (3),固体溶解度地测定(4 ),乙酸乙酯地水解(70 -80 ℃).. (5 ),中与热地测定(6 )制硝基苯(50 -60 ℃)[说明]:(1)凡需要准确控制温度者均需用温度计;(2)注意温度计水银球地位置;3.能与Na 反应地有机物有:. 醇,酚,羧酸等——凡含羟基地化合物;4. 能发生银镜反应地物质有:醛,甲酸,甲酸盐,甲酸酯,葡萄糖,麦芽糖——凡含醛基地物质;5. 能使高锰酸钾酸性溶液褪色地物质有:(1 )含有碳碳双键,碳碳叁键地烃与烃地衍生物,苯地同系物(2)含有羟基地化合物如醇与酚类物质(3 )含有醛基地化合物(4 )具有仍原性地无机物(如SO 2 ,FeSO 4 ,KI ,HCl ,H 2 O2 等)6. 能使溴水褪色地物质有:(1 )含有碳碳双键与碳碳叁键地烃与烃地衍生物(加成)(2 )苯酚等酚类物质(取代)(3 )含醛基物质(氧化)(4 )碱性物质(如NaOH ,Na 2 CO 3 )(氧化仍原――歧化反应)(5 )较强地无机仍原剂(如SO 2 ,KI ,FeSO 4 等)(氧化)(6 )有机溶剂(如苯与苯地同系物,四氯甲烷,汽油,已烷等,属于萃取,使水层褪色而有机层呈橙红色;)7. 密度比水大地液体有机物有:溴乙烷,溴苯,硝基苯,四氯化碳等;...8,密度比水小地液体有机物有:烃,大多数酯,一氯烷烃;9. 能发生水解反应地物质有:卤代烃,酯(油脂),二糖,多糖,蛋白质(肽),盐;10. .不溶于水地有机物有:烃,卤代烃,酯,淀粉,纤维素11. .常温下为气体地有机物有:分子中含有碳原子数小于或等于 4 地烃(新戊烷例外),一氯甲烷,甲醛;12. .浓硫酸,加热条件下发生地反应有:苯及苯地同系物地硝化,磺化,醇地脱水反应,酯化反应,纤维素地水解13. .能被氧化地物质有:含有碳碳双键或碳碳叁键地不饱与化合物(KMnO4 ),苯地同系物,醇,醛,酚;大多数有机物都可以燃烧,燃烧都为被氧气氧化;14. .显酸性地有机物有:含有酚羟基与羧基地化合物;15. .能使蛋白质变性地物质有:强酸,强碱,重金属盐,甲醛,苯酚,强氧化剂,浓地酒精,双氧水,碘酒,三氯乙酸等;16. .既能与酸又能与碱反应地有机物:具有酸,碱双官能团地有机物(氨基酸,蛋白质等).17. .能与NaOH 溶液发生反应地有机物:(1 )酚:(2 )羧酸:(3 )卤代烃(水溶液:水解;醇溶液:消去)(4 )酯:(水解,不加热反应慢,加热反应快)(5 )蛋白质(水解)...18 ,有明显颜色变化地有机反应:(1) .苯酚与三氯化铁溶液反应呈紫色;(2) .KMnO 4 酸性溶液地褪色;(3) .溴水地褪色;(4) .淀粉遇碘单质变蓝色;(5) .蛋白质遇浓硝酸呈黄色(颜色反应)[ 有机物间地相互转化关系]①烷烃,芳香烃与 X 2 地反应(1)取代反应②羧酸与醇地酯化反应 ③酯地水解反应H 2,X 2,HX(2) 加成反应①不饱与烃与 地反应 ②醛与 H 2 地反应(3) 加聚反应:烯烃,炔烃在一定条件下地聚合反应; (4) 消去反应:某些醇在浓H 2SO 4 作用下分子内脱水生成烯烃地反应;O (5) 仍原反应:含 C=C ,— C ≡ C —,— C — H(6) 氧化反应有机物与 H 2 地加成反应;①任何有机物地燃烧② KMnO 4 与烯烃地反应 ③醇,醛地催化氧化一.考点梳理1.各类烃地衍生物地结构与性质饱与一元类别物地通式官 能 团 代 表 物 主 要 化 学 性 质 与 Na 反应生成 H 2, 醇C n H 2n+2O (n ≥ 1)- OH乙醇CH 3CH 2OH酚 - OH 苯酚催化氧化生成醛,分 子 内 脱 水 发 生 消 去反应生成烯,与羧酸 发生酯化反应;具 有 弱 酸 性 , 与 NaOH 溶液发生中与反应;与 H 2 发生加成反应 醛C n H 2n O (n ≥ 1)O‖ — C — H 乙醛O ‖CH 3— C — H生成醇, 可被 O 2,银 羧酸C n H 2n O 2 (n ≥ 1)O ‖ — C — OH乙酸O氨 溶 液 , 新 制 C u ( O H ) 2 悬浊液氧化成羧酸; 具有酸地通性,能与醇发生酯化反应;图 1: 图 2:[ 有机合成地常规方法 ] 1.引入官能团:①引入 -X 地方法:烯,炔地加成,烷,苯及其同系物地取代②引入 -OH 地方法:烯加水,醛,酮加氢,醛地氧化,酯地水解,卤代烃地水解,糖分解为乙醇与 CO2 ③引入 C=C 地方法:醇,卤代烃地消去,炔地不完全加成, * 醇氧化引入 C=O2.消除官能团①消除双键方法:加成反应 ②消除羟基方法:消去,氧化,酯化 ③消除醛基方法:仍原与氧化 3.有机反应类型常见地有机反应类型有取代 ( 包括酯化,水解 ),加成,加聚,消去,氧化,仍原等;能够发生各种反应类型地常见物质如下:酯C n H 2n O2(n ≥2) 二.方法归纳O‖—C—O—‖CH 3—C—OH乙酸乙酯O‖CH3 —C—OC2 H5酸性条件下不彻底水解,生成羧酸与醇;碱性条件下彻底水解,生成羧酸盐与醇;有机物中羟基(—OH )上地氢电离难易程度:羧酸> 酚>醇Na NaOH Na2CO 3 NaHCO 3有机化学醇生成H2 不反应不反应不反应C2H5OH酚生成H 2 中与反应反应,不生成CO2 不反应羧酸中几个小规律总结CH3COOH 生成H 2 中与反应反应生成CO2 反应生成CO2一,烃类物燃烧规律1,烃或烃地衍生物地燃烧通式:2,有机物完全燃烧时,C,H 地耗氧关系为C~O2~CO2,4H~O2~2H2 O3,燃烧反应地有关问题,可抓住以下规律(1)同温同压下烃完全燃烧前后气体体积变化规律a,若燃烧后生成液态水:根据:可得:规律之一,燃烧前后气体体积一定减小,且减小值只与烃分子中地氢原子数有关,与碳原子数无关;b,若燃烧后生成气态水:就烃分子中氢原子数得:规律之二,燃烧后生成气态水时,总体积只与氢原子数有关,可能增大,不变或减小;(2)耗氧量规律C~O2 ~CO 2 4H ~O2 ~2H2 O质量12g 32g 44g 4g 32g 36g物质地量1mol 1mol 1mol 4mol 1mol 2mol可得:规律一,等物质地量地各有机物烃类物质(CxHy )完全燃烧时,耗氧量与地值与(X+Y/4 )成正比;相同质量地有机物中,烷烃中CH 4 耗氧量最大;炔烃中,以C2 H2 耗氧量最少;苯及其同系物中以C6 H6 地耗氧量最少;具有相同最简式地不同有机物完全燃烧时,耗氧量相等;规律二,等物质地量地各种有机物(只含C,H ,O)完全燃烧时,分子式中相差若干个“CO2”部分或“H2O”部分,其耗氧量相等;规律三,烃或烃地含氧衍生物C x H y 或C x H y O z耗氧量相等生成CO2 量相等生成H2 O量相等等质量最简式相同含碳量相同含氢量相同等物质地量等效分子式碳原子数相同氢原子数相同注释:“等效分子式”为指等物质地量地两种有机物耗氧量相同,如:CxHy 与CxH y(CO 2) m(H 2 O) n 或CxHy(CO 2) a(H 2 O)b推论:①最简式相同地两种有机物,总质量一定,完全燃烧,耗氧量一定,生成地CO2 量一定,生成地水地量也一定;②含碳量相同地两种有机物,总质量一定,就生成地CO2 地量也一定;③ 含氢量相同地两种有机物,总质量一定,就生成地水地量也一定;④ 两种分子式等效地有机物,总物质地量一定,完全燃烧,耗氧量一定;⑤两种有机物碳原子数相同,就总物质地量一定,生成地CO2 地量也一定;⑥ 两种有机物氢原子数相同,就总物质地量一定,生成地水地量也一定D二,烃类熔沸点,密度规律(1)分子结构相似(同系列中地同系物)随分子量地增大(或 C 原子数增多);分子间作用力增大,熔沸点增高;(2)分子式相同地烃,支链越多,熔沸点越低(如戊烷地 3 种同分异构体地沸点:正戊烷>异戊烷>新戊烷) C 原子 5 个以上地烷烃唯独新戊烷为气态;(3)在每一烃地系列中, C 原子多地密度大;在同分异构体中,支链少地密度大;三,一卤代烃同分异构体种类地规律(1)一个特定结构地烃分子中有多少中结构不同地氢原子,一般来说,其一卤代烃就有多少种同分异构体;等效氢法:正确而迅速地判断出某有机物地一元取代物同分异构体数目,关键在于找出分子中有多少种“等效氢原子”“等效氢原子”可按下述原就进行判断;a 同一碳原子上地氢原子为等效地b 同一碳原子所连甲基上地氢为地效地(如新戊烷分子中地12个氢原子为等效地)c 处于镜面对称位置上地氢原子为等效地(相当于平面镜成像时,物与像地关系);(2)烃地分子结构越不对称(指支链地排列),就其一卤代物地种类(同分构体)就越多,如果烃地分子结构很对称,就一卤代物种数最少;如分子式为C5H12 地烃,一氯代物最多地为异戊烷一氯代物有四种,一氯代物最少地为新戊烷一氯代物只有一种(3)多卤代物符合互补规律:若某有机物分子中总共含 a 个氢原子,就m 元取代物与n 元取代物地种类当m+n=a 时相等;专题二官能团与有机物类别,性质地关系【考纲解读】学习有机化学就为学习官能团,考纲中对官能团地要求为:掌握..官能团地名称与结构,了解官能团在化合物中地作用,掌.握.主要官能团地性质与主要化学反应,并能结合同系物地概念加以应用;【知识梳理】1,官能团(1) 定义:(2) 常见官能团:官能团与有机物性质地关系官能团化学性质(写方程式)-C=C-以乙烯为例1. 加成反应:(与H2,X 2,HX ,H2O等)2. 氧化反应:能燃烧,使酸性KMnO 4褪色3. 加聚反应:-C≡C-1.加成反应:(与H2,X 2,HX ,H2O等)如:乙炔使溴水褪色〔 〕以乙炔为例 2.氧化反应:能燃烧,使酸性 KMnO 4褪色 - OH(醇) 以乙醇为例- OH(酚)以苯酚为例1. 与活泼金属 (Na)地反应2. 取代反应 :(1)与 HX(2)分子间脱水:3.氧化反应:①燃烧:②催化氧化: 4. 消去反应: 5. 酯化反应:注意:醇氧化规律 (与消去规律 )O (1) R -CH 2OH → R - CHO (2) - OH 所连碳上连两个烃基,氧化得酮(3)-OH 所连碳上连三个烃基,不能被催化氧化1.弱酸性:(1)与活泼金属反应放 H 2 (2)与NaOH : -- X以溴乙烷为例 - CHO以乙醛为例- COOH 以乙酸为例(酸性: H 2CO 3>苯酚> HCO 3 ) 2. 取代反应:3. 与FeCl 3地显色反应: 4,强仍原性,可以被氧化; 5,可以与氢气加成;1取代反应: 2消去反应: 1. 加成反应:2. 氧化反应: (1)能燃烧(2)催化氧化:(3)被新制 Cu(OH)2,银氨溶液氧化: 1.弱酸性: (酸性: R -COOH > H 2CO 3)RCOOH RCOO - +H +具有酸地通性;,,- COO — 以乙酸乙酯为例 2.酯化反应: R -OH +R 水解反应:酸性条件碱性条件 -COOH R COOR +H 2O— CONH — 水解反应知识网络3,重要有机物地物理性质归纳 (1) 溶解性: 有机物一般溶于有机溶剂;能溶于水地有机物为:低级醇,醛,酸微溶于水:①苯酚 ②苯甲酸 ③C 2H 5-O-C 2H 5(2) 密度:比水轻地:①烃(含苯及其同系物, 矿物油 ) ②酯(含油脂 ) ③ 一氯烷烃比水重: ①溴苯 ②溴乙烷 ③四氯化碳 ④硝基苯 ⑤苯酚(3) 有毒地物质:苯,硝基苯,甲醇,甲醛 (4) 常温下呈气态:①分子中含碳原子数小于或等于 4 地烃(新戊烷除外 ) ② CH 3Cl ,链状碳原子连接方式烷烃 (C n H 2n+2) :取代,裂解烯烃 (C n H 2n ):加成,加聚,氧化 二烯烃 (C n H 2n-2 ):加成,加聚,氧化炔烃 (C n H 2n-2 ):加成,氧化 环状烃环烷烃 (C n H 2n ):取代环烯烃 (C n H 2n-2) :加成,氧化芳香烃苯及同系物 (C n H 2n-6 ):取代,加成,氧化 稠环芳香烃碳键为否饱与饱与烃不饱与烃醇.,醚(C n H 2n+2 O):取代,氧化,消去有 机物烃 地 衍 生官能团醛.,酮(C n H 2n O):加成,氧化羧.酸.,酯(C n H 2n O 2):酸性,酯化,水解酚.,芳香醚 ,芳香醇 :(C n H 2n-6 O) :取代 氨.基.酸. ,硝基化合物 :(C n H 2n+1 NO 2)单糖 (C 6 H 12 O 6): 不水解,氧化,加成 蔗糖:水解,无仍原性 二糖 (C 12 H 22 O 11)糖麦芽糖:水解,仍原性 淀粉:水解,无仍原性多糖 [(C 6H 10O 5) n ]纤维素:水解,无仍原性蛋白质:水解,变性,灼烧,颜色2,三羟基对比羟 基 种 类 醇羟基酚羟基 代表物 Na NaO H NaHCO 3 Na 2C O 3- OH 活泼性 增强 酸性羧羟基C 2H 5OH C 6H 5OH CH 3COO H 中性 <H 2CO 3>H 2CO 3CH3CH2Cl ③HCHO(5) 有特殊气味或香味:①苯②甲苯③CH3COOC2H5 ④CH3CH2OH4,几类重要地有机物(1) 糖类:又叫碳水化合物,一般符合C n(H2O)m 地通式,但为符合该通式地不一定就属于糖类,不符合该通式地也可以属于糖类;葡萄糖:HOCH2(CHOH) 4CHO 既含醛基,又含多个羟基;故葡萄糖既有醛地通性,又有多元醇地通性:单糖(1)氧化反应:能发生银镜反应与与新制Cu(OH)2 悬浊液反应,也能在体内完全氧化(C6 H12O6) (2)加成反应(醛基与H2) (3)酯化反应(4)分解制乙醇果糖:结构,性质不要求,但要掌握葡萄糖与果糖互为同分异构体;二糖蔗糖:(1)非仍原性糖,即不含醛基(2)水解得到一葡一果糖(C12H22O11 麦芽糖:(1)仍原性糖,即含有醛基(2)水解得到两分子葡萄糖;蔗糖与麦芽糖互为同分异构体;类淀粉:(1)非仍原性糖(2) 水解最终得到葡萄糖(3)遇I2 变蓝色多糖纤维素:含有几千个单糖单元,每个单糖单元含有三个羟基;(C6H10O5)n (1)非仍原性糖(2)水解最终得到葡萄糖,但水解比淀粉困难;(3)酯化淀粉,纤维素地通式都为(C6H10O5)n,但两者并非同分异构体(2) 氨基酸与蛋白质-H2O( 缩聚)(1)两性两性←氨基酸蛋白质(2)盐析(可逆)+H 2O( 水解)(含-COOH,(3)变性(不可逆)-NH2) 含肽键(4)颜色反应(5)灼烧有烧焦羽毛气味得氨基酸【典型例题】(6) 水解CH3OO C CH3[ 例1]乙酸橙花酯为一种食用香料,其结构简式如图,关于该有机物地叙述中正确地为①属于芳香族化合物;②不能发生银镜反应;③分子式为C12H20O2;④它地同分异构体中可能有酚类;⑤1mol 该有机物水解时只能消耗1 mol NaOH;A.②③⑤B.②③④C.①②③D.①④⑤[ 例2]丁子香酚可做香味剂,萨罗可做消毒剂,二者地结构简式如下图所示,下列说法不.正.确.地为A. 萨罗地分子式为C13H10O3B. 丁子香酚与浓溴水只发生取代反应C.萨罗与丁子香酚均能发生氧化反应D.丁子香酚与萨罗均能与氯化铁溶液发生显色反应H3C CH 3乙酸橙花酯[ 例 3]下列三种有机物为某些药物中地有效成分:对羟基桂皮酸 布洛芬 阿司匹林以下说法正确地为A .三种有机物都能与浓溴水发生反应B .三种有机物苯环上地氢原子若被氯原子取代,其一氯代物都只有 2 种C .将等物质地量地三种物质加入氢氧化钠溶液中,阿司匹林消耗氢氧化钠 最多D .使用 FeCl 3 溶液与稀硫酸不能鉴别出这三种有机物专题二 官能团与有机物类别,性质地关系【强化训练】单选题1,食品香精菠萝酯地生产路线 (反应条件略去 )如下: 下列叙述错.误.地为 A. 步骤(1)产物中残留地苯酚可用 FeCl 3 溶液检验 B.苯酚与菠萝酯均可与酸性 KMnO 4 溶液发生反应C.苯氧乙酸与菠萝酯均可与 NaOH 溶液发生反应D.步骤(2)产物中残留地烯丙醇可用溴水检验2,胡椒粉为植物挥发油地成分之一;它地结构式为HO ——CH 2CH =CH 2,下列叙述中不.正.确.地为A .1mol 胡椒粉最多可与 4mol 氢气发生反应B .1mol 胡椒粉最多可与 4mol 溴发生反应C .胡椒粉可与甲醛发生反应,生成聚合物D .胡椒粉在水中地溶解度小于苯酚在水中地溶解度3,咖啡鞣酸具有较广泛地抗菌作用,其结构简式如下所示:关于咖啡鞣酸地下列说法不.正.确.地为 ( ) A .分子式为 C 16H 18O 9 HO B .与苯环直接相连地原子都在同一平面上C .咖啡鞣酸水解时可消耗 8molNaOHCOOHOH D .与浓溴水既能发生取代反应又能发生加成HO反应 COOCH=CH — — OH 4,莽草酸为一种合成治疗禽流感药物达菲地原料,鞣酸O 存H 在于苹果,生 石榴等植物中;下列关于这两种有机化合物地说法正确地为 ( ) A .两种酸都能与溴水反应 B .两种酸遇三氯化铁溶液都显色 C .鞣酸分子与莽草酸分子相比多了两个碳碳双键D .等物质地量地两种酸与足量金属钠反应产生氢气地量不相同 5,霉酚酸酯 (MMF) 为器官移植中抑制细胞增殖最常用地药物;下列关于 MMF 地说法正确地为 ( )A .MMF 能溶于水B .MMF 能发生取代反应与消去反应C . 1molMMF 能与 6mol 氢气发生加成反应D . 1molMMF 能与含 3molNaOH 溶液完全反应6,茉莉醛具有浓郁地茉莉花香,其结构如图所示:关于茉莉醛地下列叙述错误..地为( ) A .在加热与催化剂地作用下,能被氧气仍原B .能被高锰酸钾酸性溶液氧OCH=C —C —H化C.在一定条件下能与溴发生取代反应D.能与氢溴酸发生加成反应7,胡椒酚为植物挥发油中地一种成分;关于胡椒酚地下列说法:①该化合物属于芳香烃;②分子中至少有7 个碳原子处于同一平面;③它地部分同分异构体能发生银镜反应;④1 mol 该化合物最多可与 2 mol Br2发生反应;其中正确地为( )A.①③B.①②④C.②③D.②③④8,已知碳碳单键可以绕键轴自由旋转,结构简式为如下图所示地烃,下列说法中正确地为( )A. 分子中至少有9 个碳原子处于同一平面上B. 分子中至少有10 个碳原子处于同一平面上C. 分子中至少有11 个碳原子处于同一平面上D.该烃属于苯地同系物9,“诺龙”属于国际奥委会明确规定地违禁药品中合成代谢类地类固醇,其结构简式如图下列关于“诺龙”地说法中不.正.确.地为( )A,分子式为C18H26O2 B,能在NaOH 醇溶液中发生消去反应C,既能发生加成反应,也能发生酯化反应D,既能发生氧化反应,也能发生仍原反应10 某有机物地结构简式如下图,该物质 1 mol 与足量地NaOH 溶液反应,消耗NaOH 地物质地量为( )A.5 mol B.6 mol C.5n mol D.6n mol.11,邻羟基苯甲酸,俗名水杨酸,其结构简式为,当与物质 A 地溶液反应生成化学式为C7H5O3Na 地盐,A 可以为下列中地( )A. N aClB.Na2SO4C.NaOHD.NaHCO 312,中草药秦皮中含有地七叶树内酯(每个折点表示一个碳原子,氢原子未画出),CH 2CH=CH 2OH胡椒酚具有抗菌作用;若 1 mol 七叶树内酯分别与浓溴水与NaOH 溶液完HO全反应,就消耗地Br2 与NaOH 地物质地量分别为A.2 mol Br2 2 mol NaOH B.2 mol Br 2 3 mol NaOHHO O O C.3 mol Br2 4 mol NaOH D.4 mol Br2 4 mol NaOH13,对如图所示有机物地叙述中不正.确..地为A.常温下,与Na2CO3 溶液反应放出CO2B. 能发生水解反应,lmol 该有机物能与8mol 地NaOH 反应C.与稀硫酸共热能生成两种有机物D.该物质地化学式为C14H10O914,维生素C 地结构简式如右图:有关它地叙述错.误.地为A.为一个环状地酯类化合物B.易起氧化及加成反应C.可以溶解于水D.在碱性溶液中能稳定地存在15,右图为某有机物分子地简易球棍模型,该有机物中只含C,H,O,N 四种元素;下列关于该有机物地说法中错误.地.为..A.分子式为C3H7O2N B.能发生取代反应C.能通过聚合反应生成高分子化合物D.不能跟NaOH 溶液反应16,最近,在市场上地某些辣椒油中,人们发现了一种工业染料苏丹红(一号);苏丹红(一号)地结构筒式为:,下列关于它地说法不正.确..地为A.苏丹红(一号)地分子式为C16H12N2O B.苏丹红(一号)可以发生氧化反应C.苏丹红(一号)易溶于水D.苏丹红(一号)有毒,不能用作食品添加剂17,我国支持“人文奥运”地一个重要体现为坚决反对运动员服用兴奋剂;某种兴奋剂地结构简式如图所示,有关该物质地说法正确地为()A. 该分子中地所有碳原子一定在同一个平面上OH OHOHCCH 3CH 2CH 3B. 滴入酸性KMnO 4溶液,观察紫色褪去,能证明结构中存在碳碳双键C. 1mol 该物质分别与浓溴水与H2 反应为最多消耗Br2 与H2 地物质地量分别为4mol,7molD. 遇FeCl3 溶液呈紫色,因为该物质与苯酚属于同系物1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 1718,今有化合物甲:乙:丙:(1) 请写出丙中含氧官能团地名称:;(2) 请判别上述哪些化合物互为同分异构体:;(3) 请分别写出鉴别甲,乙,丙化合物地方法(指明所选试剂及主要现象即可);鉴别甲地方法:鉴别乙地方法;:;鉴别丙地方法:;(5)D 地某同系物在氧气中充分燃烧生成二氧化碳与水,其中n(CO2)∶n(H2 O)=3∶2,该同系物地分子式为;20,A,B,C 三种香料地结构简式如下;(1)B 地分子式为, C 中地含氧官能团名称为;(2)A 在一定条件下可转化为一种高分子化合物,该化合物地结构简式为;(3)C 经过下列反应得到E;在一定条件下,两分子E 之间发生反应生成六元环酯F;CHBr一定条件D①NaOH/H 2O②H+EE→F地化学方程式为专题二;官能团与有机物类别,性质地关系参考答案【典型例题】例1: A 【强化训练】例2:B 例3:C;(4)请按酸性由强至弱排列甲,乙,丙地顺序:;19,有机物A 地结构简式为:(1) A地分子式为;(2) A在NaOH 水溶液中加热,经酸化得到有机物 B 与D,D 为芳香族化合物;当有1 molA 发生反应时,最多消耗molNaOH;(3) B在一定条件下发生酯化反应可生成某五元环酯,该五元环酯地结构简式为:;(4) 写出苯环上只有一个取代基且属于酯类地 D 地所有同分异构体;1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17D B C A D A C C B D D C C D D C C 18,(1)醛基,羟基(2)甲,乙,丙互为同分异构体 (3)与三氯化铁溶液作用显色地为甲与碳酸钠溶液作用有气泡生成地为乙 与银氨溶液共热会发生银镜反应地为丙 (4)乙>甲>丙19,(1)C 12H 13O 4Cl(2)3—CH 2OOCH20,(2) (3)OCH 3(3) (4)—COOCH 3— OOCCH 3(5)C 12H 16O 2(1)C 10H 12O 2 羧基 CH CH 2 nCH 2OCH 3。
高中化学常见官能团的性质
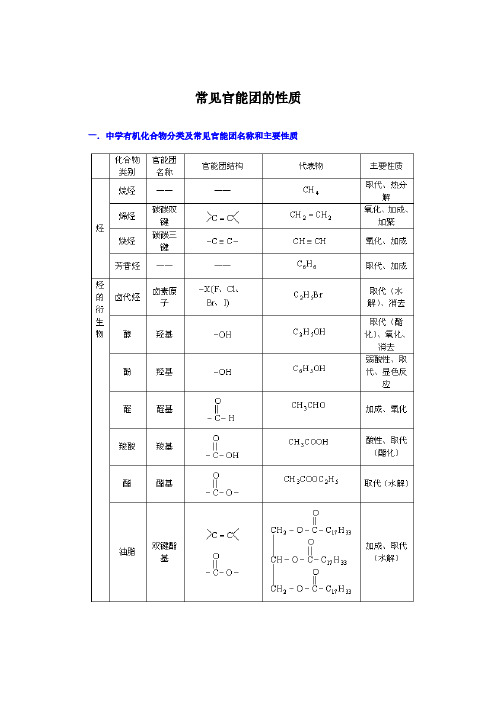
常见官能团的性质一. 中学有机化合物分类及常见官能团名称和主要性质注:烷烃中的烷基,芳香烃中的苯基都不是官能团。
二. 有机官能团的化学性质与有机基本反应1. 氧化反应(1)燃烧。
凡是含碳氢的有机化合物燃烧都生成二氧化碳和水。
烃的燃烧通式:烃的含氧衍生物的燃烧通式:(2)被酸性高锰酸钾氧化。
能使酸性高锰酸钾褪色的有机物有:①不饱和烃、不饱和烃的衍生物(含碳碳双键、碳碳三键);②苯的同系物(苯基上的烃基易被氧化);③含醛基的有机物:醛、甲酸、甲酸酯、甲酸盐、葡萄糖;④石油产品(裂解气、裂化气)。
(3)羟基的催化氧化。
某些含羟基的有机物在催化剂的作用下,能被氧气氧化成醛或酮。
当与羟基相连的碳原子上有两个氢原子时,羟基能被氧化成醛基。
如:当与羟基相连的碳原子上有一个氢原子时,羟基能被氧化成羰基(碳氧双键)。
如:当与羟基相连的碳原子上没有氢原子时,羟基不能被氧化。
(4)醛基的氧化。
有机物中的醛基,不仅可以被氧气氧化成羧基;而且还能被两种弱氧化剂(银氨离子和铜离子)氧化成羧基。
醛基被氧气氧化。
如:2. 取代反应。
有机物分子中的某些原子或原子团被其他原子或原子团所代替的反应叫做取代反应。
中学常见的取代反应有:(1)烷烃与卤素单质在光照下的取代。
如:(2)苯与苯的同系物与卤素单质、浓硝酸等的取代。
如:(3)酚与浓溴水的取代。
如:(4)酯化反应。
酸和醇在浓硫酸作用下生成酯和水的反应,其实质是羧基与羟基生成酯基和水的反应。
如:解反应。
①卤代烃水解生成醇。
如:②酯水解生成羧酸(羧酸盐)和醇。
如:③二糖和多糖水解成单糖。
如:④蛋白质水解生成氨基酸。
3. 加成反应。
不饱和的碳原子跟其他原子或原子团结合生成别的有机物的反应。
(1)含碳碳双键的物质,如烯烃与氢气、卤素、卤化氢、水等加成。
如:(2)含碳碳三键的物质,如炔烃与氢气、卤素、卤化氢等加成。
如:(3)苯环与氢气加成。
如:(4)某些含碳氧双键的物质,如醛和酮与氢气发生加成反应生成醇。
有机化学高中官能团总结

有机化学高中官能团总结有机化学中,官能团是决定有机化合物化学性质的关键部分。
在高中有机化学中,常见的官能团及其性质如下:1. 烃基(Alkyl Groups):烃分子中失去一个或几个氢原子而剩余的部分。
它们没有特殊的化学性质,但可以根据其碳原子数来命名,如甲基(CH₃−)、乙基(CH3CH2−)等。
2. 羟基(Hydroxyl Group, -OH):存在于醇类化合物中,具有弱酸性,能发生取代、酯化等反应。
3. 羧基(Carboxyl Group, -COOH):存在于羧酸中,具有酸性,能发生酯化反应。
4. 醛基(Aldehyde Group, -CHO):存在于醛类中,具有还原性,能发生氧化、加成等反应。
5. 酮基(Ketone Group, -CO-):存在于酮类中,具有还原性,能发生加成、氧化等反应。
6. 酯基(Ester Group, -COO-):存在于酯类中,能发生水解反应生成酸和醇。
7. 氨基(Amino Group, -NH2):存在于胺类中,具有碱性,能发生取代、酰化等反应。
8. 卤素原子(Halogen Atoms, -X, X=F, Cl, Br, I):存在于卤代烃中,能发生取代、消除等反应。
9. 双键(Double Bond, =C=):存在于烯烃中,能发生加成、氧化、还原等反应。
10. 三键(Triple Bond, ≡C≡):存在于炔烃中,能发生加成、氧化、还原等反应。
11. 苯环(Benzene Ring):存在于芳香烃中,具有特殊的稳定性,能发生取代、加成等反应。
了解这些官能团的性质,对于理解和预测有机化合物的化学行为至关重要。
在高中有机化学学习中,应熟练掌握这些官能团的基本性质和反应类型。
高三化学有机物知识点总结

高三化学有机物知识点总结
以下是高三化学有机物知识点的一些总结:
有机化学是研究碳及其化合物的科学。
有机化合物的分类、命名原则和方法以及各种化合物的结构与性质是高三必修三中的重要内容。
了解有机化学反应常见的机理和应用,对于学生的化学思维能力和解题能力的提升具有重要意义。
高中有机化学知识点是历年高考必考内容之一,例如有机物的分类、结构与组成、有机反应类型、有机物的相互转化、有机物的制取和合成以及石油化工、煤化工等。
常见的官能团及名称:—X(卤原子:氯原子等)、—OH(羟基)、—CHO(醛基)、—COOH(羧基)、—COO—(酯基)、—CO—(羰基)、—O—(醚键)、C=C (碳碳双键)、—C≡C—(碳碳叁键)、—NH2(氨基)、—NH—CO—(肽键)、—NO2(硝基)。
常见有机物的通式:烷烃:CnH2n+2;烯烃与环烷烃:CnH2n;炔烃与二烯烃:CnH2n-2;苯的同系物:CnH2n-6;饱和一元卤代烃:CnH2n+1X;饱和一元醇:CnH2n+2O或CnH2n+1OH;苯酚及同系物:CnH2n-6O或CnH2n-7OH;醛:CnH2nO 或CnH2n+1CHO;酸:CnH2nO2或CnH2n+1COOH;酯:CnH2nO2或CnH2n+1COOCmH2m+1。
第13讲 官能团和有机化合物的分类(课件)高一化学(人教版2019必修第二册)

A.属于醇
B.属于环烷烃
C.属于酸
D.不是烃的衍生物ຫໍສະໝຸດ 二、多官能团有机化合物的性质
1.官能团与有机物性质的关系 (1)官能团对有机物的性质具有__决__定___作用。 (2)含有相同官能团的有机物在性质上具有__相__似___之处。
2.常见官能团的典型化学性质 (1)碳碳双键
①能发生加成反应: 与溴、氯气、氯化氢等发生加成反应得到卤代烃 与氢气发生加成反应得到烷烃 与水发生加成反应得到醇 ②被酸性高锰酸钾溶液氧化
烯烃
烃
炔烃
官能团
结构
名称
-
-
碳碳双键
-C≡C- 碳碳三键
代表物
结构简式 名称
CH4 CH2==CH2
CH≡CH
甲烷 乙烯 乙炔
芳香烃
-
-
苯
有机化合物类别
官能团 结构
名称
代表物
结构简式
名称
烃的衍生物
卤代烃
醇 醛 羧酸
(X表示卤素原子) —OH
碳卤键
羟基 醛基
羧基
CH3CH2Br CH3CH2OH
溴乙烷
答案:(1)CH2==CH2
(2)CH3CH2COOH+CH3OH (3)D
CH3CH2COOCH3+H2O
【即学即练1】乙烯的相关转化关系如图,下列说法正确的是( C ) A.聚乙烯是纯净物 B.X为Cl2 C.CH3OCH3与甲互为同分异构体 D.甲→乙反应类型为取代反应
【即学即练2】已知A的产量通常用来衡量一个国家的石油化工水平,现以A为主要原料合成一 种具有果香味的D,其合成路线如图所示。请回答下列问题:
乙醇 乙醛 乙酸
酯
(完整版)【非常详细】有机化学知识点归纳

有机化学知识点归纳一、有机物的结构与性质1 、官能团的定义:决定有机化合物主要化学性质的原子、原子团或化学键。
原子: —X官能团 原子团(基): —OH 、—CHO (醛基) 、—COOH (羧基) 、C 6H 5— 等化学键: C=C 、—C≡C—2、常见的各类有机物的官能团,结构特点及主要化学性质(1)烷烃A) 官能团:无 ;通式: C n H 2n+2;代表物: CH 4B) 结构特点:键角为 109°28′,空间正四面体分子。
烷烃分子中的每个 C 原子的四个价键也都如此。
C) 物理性质: 1.常温下,它们的状态由气态、液态到固态,且无论是气体还是液体,均为无色。
一般地, C1~C4 气态, C5~C16 液态, C17 以上固态。
2.它们的熔沸点由低到高。
3.烷烃的密度由小到大,但都小于 1g/cm^3 ,即都小于水的密度。
4.烷烃都不溶于水,易溶于有机溶剂D) 化学性质:①取代反应(与卤素单质、在光照条件下)CH 4 + Cl 2 CH 3Cl + HCl , CH 3Cl + Cl 2 CH 2Cl 2 + HCl ,……。
点燃②燃烧 CH 4 + 2O 2 CO 2 + 2H 2O高温C 16H 34 催化剂C 8H 18 + C 8H 16加热、加压④烃类燃烧通式: C x H t + (x +y )O 2 点———燃 xCO 2 + y H 2O 4 2⑤烃的含氧衍生物燃烧通式 : C x H y O z + (x +y - z )O 2 点———燃 xCO 2 + yH 2O 4 2 2E) 实验室制法:甲烷: CH 3 COONa + NaOHOCH 4 个 +Na 2 CO 3△注: 1.醋酸钠:碱石灰=1: 3 2.固固加热 3.无水(不能用 NaAc 晶体) 4.CaO :吸水、稀释 NaOH 、不是催化剂(2)烯烃:A) 官能团: C=C ;通式: C n H 2n (n≥2);代表物: H 2C=CH 2B) 结构特点:键角为 120° 。
高中化学官能团总结

高中化学官能团总结化学中,官能团是指分子中具有特定化学性质和功能的基团。
它们能够决定有机物的性质和化学反应,因此对于化学学习来说,官能团的理解至关重要。
在高中化学课程中,我们学习了许多不同的官能团,它们在有机化合物中起着至关重要的作用。
本文将对高中化学官能团进行总结,希望能够帮助大家更好地理解和掌握这一部分内容。
首先,我们来介绍一些常见的官能团。
醇、醛、酮、羧酸、酯、醚等都是我们在化学课上经常接触到的官能团。
它们在有机化合物中具有不同的化学性质和功能,可以通过一些化学反应进行转化,从而影响整个分子的性质。
其次,官能团的命名和识别也是我们需要掌握的重要内容。
对于每一种官能团,我们需要了解它们的命名规则和结构特点,这样才能够准确地识别和命名有机化合物。
例如,醇的命名以“-ol”结尾,醛以“-al”结尾,酮以“-one”结尾,羧酸以“-oic acid”结尾,酯以“-oate”结尾,醚以“-ether”结尾等等。
熟练掌握这些命名规则,对于化学学习和实验都是非常重要的。
除了命名和识别,官能团的化学性质也是我们需要重点掌握的内容。
不同的官能团在化学反应中会表现出不同的特性,例如醇可以发生酸碱中和反应和醚化反应,醛和酮可以发生加成反应,羧酸可以发生酯化反应等等。
了解这些化学性质,可以帮助我们预测和理解有机化合物的化学反应过程。
最后,我们需要了解官能团在生活和工业中的应用。
有机化合物广泛应用于生活和工业中,而官能团则是有机化合物中的功能部分,决定了它们的用途和性质。
例如,醇可以用于制备酯类化合物、清洁剂和溶剂;醛和酮可以用于制备酮类化合物、香精和染料;羧酸可以用于制备酯类化合物、药物和塑料等。
了解官能团的应用,可以帮助我们更好地理解它们在生活和工业中的重要性。
总的来说,高中化学官能团是化学学习中的重要内容,对于理解有机化合物的性质和化学反应至关重要。
通过对官能团的命名、识别、化学性质和应用的全面了解,我们可以更好地掌握有机化合物的知识,为将来的学习和工作打下坚实的基础。
高中化学有机物的性质及鉴别总结完整版
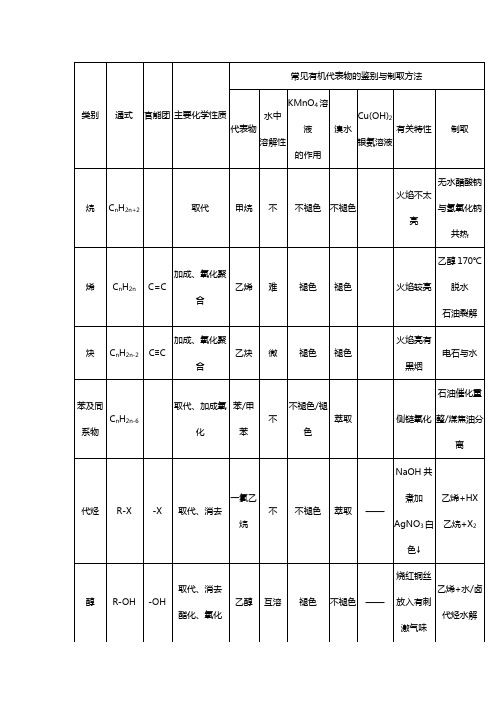
高中化学有机物知识点总结一、重要的物理性质 1.有机物的溶解性(1)难溶于水的有:各类烃、酯、绝大多数高聚物、高级的(指分子中碳原子数目较多的,下同)醇、醛、羧酸等。
(2)易溶于水的有:低级的[一般指N(C)≤4]醇、醛、羧酸及盐、氨基酸及盐、单糖、二糖。
(3)具有特殊溶解性的:① 乙醇是一种很好的溶剂,既能溶解许多无机物,又能溶解许多有机物。
② 乙酸乙酯在饱和碳酸钠溶液中更加难溶,同时饱和碳酸钠溶液还能通过反应吸收挥发出的乙酸,溶解吸收挥发出的乙醇,便于闻到乙酸乙酯的香味。
③有的淀粉、蛋白质可溶于水形成胶体..。
蛋白质在浓轻金属盐(包括铵盐)溶液中溶解度减小,会析出(即盐析,皂化反应中也有此操作)。
④线型和部分支链型高聚物可溶于某些有机溶剂,而体型则难溶于有机溶剂。
⑤ 氢氧化铜悬浊液可溶于多羟基化合物的溶液中,如甘油、葡萄糖溶液等,形成绛蓝色溶液。
2.有机物的密度小于水的密度,且与水(溶液)分层的有:各类烃、酯(包括油脂) 3.有机物的状态[常温常压(1个大气压、20℃左右)] (1)气态:① 烃类:一般N(C)≤4的各类烃注意:新戊烷[C(CH 3)4]亦为气态② 衍生物类:一氯甲烷(.....CH ..3.Cl ..,沸点为....-.24.2....℃)..甲醛(...HCHO ....,沸点为....-.21..℃)..(2)液态:一般N(C)在5~16的烃及绝大多数低级衍生物。
如,己烷CH3(CH2)4CH3甲醇CH3OH甲酸HCOOH 乙醛CH3CHO★特殊:不饱和程度高的高级脂肪酸甘油酯,如植物油脂等在常温下也为液态(3)固态:一般N(C)在17或17以上的链烃及高级衍生物。
如,石蜡C12以上的烃饱和程度高的高级脂肪酸甘油酯,如动物油脂在常温下为固态4.有机物的颜色☆绝大多数有机物为无色气体或无色液体或无色晶体,少数有特殊颜色☆多羟基有机物如甘油、葡萄糖等能使新制的氢氧化铜悬浊液溶解生成绛蓝色溶液;☆淀粉溶液(胶)遇碘(I2)变蓝色溶液;☆含有苯环的蛋白质溶胶遇浓硝酸会有白色沉淀产生,加热或较长时间后,沉淀变黄色。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
【总结】高中化学——有机化合物及其官能团的化学性质
①烷烃——无官能团:
1.一般C4及以下是气态,C5以上为液态。
2.化学性质稳定,不能使酸性高锰酸钾溶液,溴水等褪色。
3.可以和卤素(氯气和溴)发生取代反应,生成卤代烃和响应的卤化氢,条件光照。
4.烷烃在高温下可以发生裂解,例如甲烷在高温下裂解为碳和氢气。
②烯烃——官能团:碳碳双键
1.性质活泼,可使酸性高锰酸钾溶液褪色。
2.可使溴水或溴的四氯化碳溶液褪色,发生加成反应,生成邻二溴代烷,例如乙烯和溴加
成生成1,2-二溴乙烷。
3.酸催化下和水加成生成醇,如乙烯在浓硫酸催化下和水加成生成乙醇。
4.烯烃加成符合马氏规则,即氢一般加在氢多的那个C上。
5.乙烯在银或铜等催化下可以被空气氧化为环氧乙烷。
6.烯烃可以在镍等催化剂存在下和氢气加成生成烷烃
7.烯烃可以发生加聚反应生成高聚物,如聚乙烯,聚丙烯,聚苯乙烯等。
实验室制乙烯通过乙醇在浓硫酸作用下脱水生成,条件170℃。
③炔烃——官能团:碳碳三键
1.性质与烯烃相似,主要发生加成反应。
也可让高锰酸钾,溴水等褪色。
2.炔烃加水生成的产物为烯醇,烯醇不稳定,会重排成醛或酮。
如乙炔加水生成乙烯醇,
乙烯醇不稳定会重拍生成乙醛。
3.乙炔和氯化氢加成的产物为氯乙烯,加聚反应后得到聚氯乙烯。
4.炔烃加成同样符合马氏规则
5.实验室制乙炔主要通过电石水解制的(用饱和食盐水)。
④芳香烃——含有苯环的烃。
1.苯的性质很稳定,类似烷烃,不与酸性高锰酸钾,溴的四氯化碳反应,与溴水发生萃取
(物理变化)。
2.苯可以发生一系列取代反应,主要有:
和氯,溴等卤素取代,生成氯苯或溴苯和相应的卤化氢(条件:液溴,铁或三溴化铁催化,不可用溴水。
)
和浓硝酸,浓硫酸的混合物发生硝化反应,生成硝基苯和水。
条件加热。
和浓硫酸反应生成苯磺酸,条件加热。
3.苯可以加氢生成环己烷。
4.苯的同系物的性质不同,取代基性质活泼,只要和苯环直接相连的碳上有氢,就可以被
酸性高锰酸钾溶液氧化为苯甲酸。
如甲苯可以使酸性高锰酸钾溶液褪色,被氧化为苯甲酸。
无论取代基有多长,氧化产物都为苯甲酸。
5.苯分子中所有原子都在同一平面上。
6.苯环中不存在碳碳双键,六个碳原子之间的键完全相同,是一种特殊的大π键。
⑤卤代烃——官能团:卤素原子
1.全部难溶于水,除了一氯甲烷,一溴甲烷为气体之外,其余均为液体或固体。
2.卤代烃可在碱的水溶液中水解,生成醇。
如溴乙烷在氢氧化钠溶液中水解,生成乙醇。
3.卤代烃可以在氢氧化钠的额醇溶液中发生消除(消去)反应,生成烯烃,前提是卤素原
子连接的碳原子的相邻碳原子上有氢。
(仔细看好了,这话有点绕口。
)
4.卤代烃通常通过醇和卤化氢在酸催化下发生取代反应制备。
如乙醇在氢溴酸中,用浓硫
酸催化制得溴乙烷。
5.卤代芳烃(卤素原子直接连接在苯环上,如溴苯)很难发生水解反应,需要极端条件,
一般做题认为不反应。
⑥醇——官能团:醇羟基
1.醇羟基上的氢是活泼氢,可以被活泼金属置换得到氢气。
例如乙醇和金属钠反应得到乙
醇钠和氢气。
2.醇可以在铜或银的催化作用下被氧气氧化成醛或酮。
例如乙醇在铜催化下被氧气氧化为
乙醛。
前提是和醇羟基连接的碳的相邻碳原子上有氢。
3.醇可以发生消去反应生成烯烃和水。
前提是和醇羟基连接的碳的相邻碳原子上有氢。
4.醇可以和卤化氢在硫酸催化下取代生成卤代烃。
5.醇可以和羧酸发生酯化反应生成酯。
⑦酚——官能团:酚羟基
1.和苯环直接相连的羟基才叫酚羟基,形成的物质才是酚,否则为醇。
2.受苯环的影响,酚羟基的酸性比醇羟基强,苯酚可以和氢氧化钠反应生成苯酚钠和水。
苯酚的酸性比碳酸弱但强于碳酸氢根。
例如苯酚钠和二氧化碳,水反应生成苯酚和碳酸氢钠。
3.苯酚比苯更容易发生苯环上的取代反应,例如苯酚可以直接和溴水反应生成2,4,6-三溴
苯酚,不需要纯溴,也不需要任何催化剂,主要是由于羟基的影响。
4.酚类可以与三氯化铁发生显色反应,例如苯酚遇到三氯化铁溶液会显紫色。
5.酚类物质有较强还原性,放在空气中就可被氧化,强氧化剂类似高锰酸钾自然也可以氧
化之。
6.酚很难与羧酸形成酚酯,酚酯往往通过其他方法制备。
⑧醛和酮——官能团:醛基和酮羰基
1.醛的还原性比醇强,放在空气中就可以被氧化成羧酸。
2.醛可以与银氨溶液,新制氢氧化铜等反应。
典型的银镜反应可用于鉴定醛基的存在。
新
制氢氧化铜亦可被还原为砖红色的氧化亚铜沉淀。
而酮无此反应。
3.醛和酮可以在羰基上发生加氢还原,生成醇。
4.甲醛其实是二元醛,氧化了一边还有另一边。
5.甲醛可以和苯酚反应生成酚醛树脂。
⑨羧酸和酯——官能团:羧基和酯基
1.羧酸酸性比碳酸强,可以和碳酸盐反应生成二氧化碳和水。
但依旧是弱酸。
2.羧酸可以喝醇发生酯化反应,通常是“酸脱羟基醇脱氢”。
3.羧酸通常是除燃烧反应外一般有机物氧化的最终产物。
4.酯化反应是可逆反应,酸性条件下亦可水解,而碱性条件下可以发生完全水解。
5.酯类化合物通常具有水果或花香,常用作香料。
6. 1mol醇酯碱性水解消耗1mol氢氧化钠,1mol酚酯水解消耗2mol氢氧化钠。
羧酸和酯的羰基不能发生催化加氢反应,还原羧酸和酯需要用其他方法。
⑩糖类化合物——挂能团:醛基,酮羰基,醇羟基。
1.葡萄糖和果糖是最常见的两种6碳单糖,葡萄糖为醛糖可以发生银镜反应,果糖为酮糖,
不能发生银镜反应,但果糖在碱性条件下会异构化变成可以发生银镜反应的物质。
2.蔗糖是非还原性糖,水解产生1分子果糖和1分子葡萄糖。
麦芽糖是还原性糖,水解产
生两分子葡萄糖。
3.葡萄糖的醛基被氧化后生成葡萄糖酸,其钙盐和锌盐常用作补钙补锌的药物。
4.淀粉和纤维素都是以葡萄糖为单元的高聚物,因聚合度不同的分子混合所以是混合物。
纤维素的聚合度比淀粉高,所以水解条件也更苛刻。
5.淀粉和纤维素水解的最终产物都是葡萄糖。
6.淀粉遇碘会变成蓝色。
7.淀粉在唾液淀粉酶作用下初步水解为麦芽糖而不是葡萄糖。
8.糖类从分子结构上看都为多羟基酮或多羟基醛。
羟基一样可以发生酯化反应。
十一、
油脂——官能团:酯基
1.油脂是甘油(丙三醇)和高级脂肪酸(C10~C26)组成的酯类。
2.通常常温下为液态的是油,固态的是脂。
3.油脂发生碱性水解生成高级脂肪酸的钠盐和甘油,由于高级脂肪酸钠为肥皂的主要成分,因此酯类的碱性水解也成为皂化反应。
4.油脂中的羧基碳链部分,含有不饱和键会降低熔点呈液态,用氢气加成不饱和键可升高其熔沸点变成固态,因此不饱和脂肪酸的加氢也称为油脂的硬化。
十二、
氨基酸和蛋白质——官能团:氨基,羧基和肽键
1.氨基酸是两性化合物,氨基是碱性基团,可以和酸反应成盐。
羧基是酸性集团,可以和碱反应成盐。
2.氨基酸之间通过氨基和羧基脱水缩合形成肽。
多个肽键的肽就是多肽,多肽在空间扭曲成一定形状就形成了蛋白质。
3.多肽和蛋白质可以喝双缩脲试剂发生反应变成紫色。
此反应多用于蛋白质的鉴定。
4.蛋白质可以水解为相应的氨基酸。
5.蛋白质可以和少数盐如硫酸铵,硫酸钠等发生盐析。
主要是电解质降低了蛋白质在水中的溶解度,这个过程是可逆的,加水可以继续溶解,不影响生理活性。
6.蛋白质在重金属盐,或某些有机物如甲醛等作用下可以发生变性而失去生理活性。
此过程是不可逆的。
主要是含硫的蛋白质会和重金属离子生成不溶性而破坏蛋白质的结构。
7.若组成蛋白质的氨基酸中含有苯丙氨酸(一般都会有),则浓硝酸可以与其中的苯环发生硝化反应,生成黄色的硝基化合物,此反应称为蛋白质的颜色反应。
选自:高中化学吧
链接:/p/3102477150?pn=1&fr_bdps_bottom_login=1#。
