2010版中国药典与2005版中国药典中重金属检查法第一法的区别
[原创]中国药典2005版与2010版“含量测定”的对比
![[原创]中国药典2005版与2010版“含量测定”的对比](https://img.taocdn.com/s3/m/48c65de39b89680203d82566.png)
中国药典2005版与2010版“含量测定”的对比一·基本规则为方便统计,简写相关名词。
列表如下。
含量测定 简写 数量化学滴定,双相滴定,电位滴定,永停滴定 滴定旋光度测定法 旋光原子吸收分光光度计 原子吸收氧瓶燃烧法 氧瓶燃烧氨基酸分析法 氨基酸气相色谱法 气相维生素A,B,D检定法 维生素A分子排阻色谱法 分子排阻紫外-可见分光光度计 紫外放射化学 放射高效液相色谱 HPLC生物检定 生物物理称重 称重薄层色谱 TLC无 无挥发油测定法 挥发油氮测定法 氮测定法荧光分析法 荧光桉油精含量测定法 桉油精含量测定法火焰光度法 火焰光度法水分测定法 水分测定法照氮测定法 照氮测定法二·药品统计2.1总数统计2005版记载 2005版实测 2010版记载 2010版实测一部 1146 1189 2165 1839 二部 1967 1982 2271 2280 合计 3113 3171 4436 4119 注:1.统计时对于复方药物的【含量测定】,采取单列成分均计算在内的方案,所以实测的理论上应大于记载的数量。
2.对于2010版一部,实际发现药典目录记载的约1700种,但药典摘要中记载为2165种,目前尚不清楚原因。
实际统计时发现时部分药物的后面会附录某一种物质的浸出物的相关规定,推测药典可能亦把该项列为一种药,目前,该猜测未得任何资料证实。
3.由于第一条的原因,该统计反映的是药典中所有涉及到【含量测定】的单列药物的不同技术方法的统计分析。
2.2各部统计2.2.1中国药典2005版一部【含量测定】统计 项目 含量测定 数量 百分比 无 无 494 41.55 高效液相色谱 HPLC 478 40.20 薄层色谱 TLC 50 4.21 化学滴定 滴定 413.45 紫外分光光度计 紫外 383.20 气相色谱法 气相 33 2.78 挥发油测定法 挥发油 33 2.78 物理称重 干燥 12 1.01 氮测定法 氮测定法 7 0.59 原子吸收分光光度计原子吸收 1 0.08 氨基酸分析法 氨基酸 1 0.08 桉油精含量测定法 桉油精含量测定法1 0.08各方法所占比例如图2.2.2中国药典2005版二部【含量测定】统计 项目 含量测定 数量 百分比 化学滴定 滴定 780 39.35 高效液相色谱 HPLC 565 28.51 紫外分光光度计 紫外 383 19.32 生物检定 生物 90 4.54 无 无 88 4.44 物理称重 干燥 201.01 维生素检定法 维生素 13 0.66 旋光度测定法 旋光 12 0.61 放射化学 放射 11 0.55 原子吸收分光光度计原子吸收 6 0.30 氮测定法 氮测定法 6 0.30 分子排阻色谱法 分子排阻 3 0.15 气相色谱法 气相 2 0.10 荧光分析法 荧光 2 0.10 氧瓶燃烧法 氧瓶燃烧 1 0.05各方法所占比例如图项目 含量测定 数量 百分比 高效液相色谱 HPLC 1206 65.58 无 无 348 18.92 气相色谱法 气相 98 5.33 化学滴定 滴定 532.88 紫外分光光度计 紫外 45 2.45 薄层色谱 TLC37 2.01 氮测定法 氮测定法 19 1.03 物理称重 干燥 16 0.87 挥发油测定法挥发油 13 0.71 原子吸收分光光度计 原子吸收 3 0.16 旋光度测定法旋光10.05各方法所占比例如图项目 含量测定 数量 百分比 高效液相色谱 HPLC 1001 43.90 化学滴定 滴定 716 31.40 紫外分光光度计 紫外 254 11.14 无 无 131 5.745614 生物检定 生物 84 3.68 气相色谱法 气相 19 0.83 物理称重 干燥 17 0.75 旋光度测定法 旋光 130.57 电位滴定 电位 12 0.53 氮测定法 氮测定法 8 0.350877 原子吸收分光光度计 原子吸收 5 0.22 离子色谱 离子色谱 4 0.175439 氧瓶燃烧法 氧瓶燃烧 3 0.13 氨基酸分析法 氨基酸 3 0.13 分子排阻色谱法 分子排阻 3 0.13 维生素A 检定法 维生素A 2 0.09 荧光分析法 荧光 2 0.087719 火焰光度法 火焰光度法 1 0.04386 水分测定法 水分测定法 1 0.04386 照氮测定法 照氮测定法 1 0.04386 各方法所占比例如图项目 2005版 2010版 无 41.55 18.92 高效液相色谱 40.20 65.58 薄层色谱 4.21 2.01 化学滴定 3.45 2.88 紫外分光光度计 3.20 2.45 气相色谱法 2.78 5.33 挥发油测定法 2.78 0.71 物理称重 1.01 0.87 氮测定法 0.59 1.03 原子吸收分光光度计0.08 0.16 氨基酸分析法 0.080.00 桉油精含量测定法 0.08 0.00 旋光度测定法 0.00 0.05各方法所占比例如图项目 2005版 2010版 化学滴定 39.35 31.05 高效液相色谱 28.51 46.55 紫外分光光度计 19.32 11.76 生物检定 4.54 3.92 无 4.44 3.59 物理称重 1.01 0.51 维生素A检定法 0.66 0.09 旋光度测定法 0.61 0.61 放射化学 0.55 0.00 氮测定法 0.30 0.37 原子吸收分光光度计 0.30 0.23 分子排阻色谱法 0.15 0.14 气相色谱法 0.10 0.51 荧光分析法 0.10 0.05 氧瓶燃烧法 0.05 0.14 离子色谱 0.00 0.19 氨基酸分析法 0.00 0.14 火焰光度法 0.00 0.05 水分测定法 0.00 0.05 照氮测定法 0.00 0.05 各方法所占比例如图三·结论1.由2.3的数据可知,无【含量测定】的中药占的比例正在减低。
05、2010版药典比对1

高效液相色谱法2005版高效液相色谱法系采用高压输液泵将规定的流动相泵入装有填充剂的色谱柱,进行分离测定的色谱方法。
注入的供试品,由流动相带入柱内,各成分在柱内被分离,并依次进入检测器,由积分仪或数据处理系统记录色谱信号。
1.对仪器的一般要求所用的仪器为高效液相色谱仪。
仪器应定期检定并符合有关规定。
(1)色谱柱最常用的色谱柱填充剂为化学键合硅胶。
反相色谱系统使用非极性填充剂,以十八烷基硅烷键合硅胶最为常用,辛基硅烷键合硅胶和其他类型的硅烷键合硅胶(如氰基硅烷键合和氨基硅烷键合等)也有使用。
正相色谱系统使用极性填充剂,常用的填充剂有硅胶等。
离子交换填充剂用于离子交换色谱;凝胶或高分子多孔微球等用于填充剂分子排阻色谱等;手性键合填充剂用于对映异构体的拆分分析填充剂的性能(如载体的形状、粒径、孔径、表面积、键合基团的表面覆盖度、含碳量和键合类型等)以及色谱柱的填充,直接影响待测物的保留行为和分离效果。
孔径在15nm(1nm=10Å)以下的填料适合于分析分子量小于2000 的化合物,分子量大于2000 的化合物则应选择孔径在30nm 以上的填料。
以硅胶为载体的一般键合固定相填充剂pH 值应控制在2~8 的流动相。
当pH 值大于8 时,可使载体硅胶溶解;当pH 值小于2 时,与硅胶相连的化学键合相易水解脱落。
当色谱系统中需使用pH 值大于8 的流动相时,应选用耐碱的填充剂,如采用高纯硅胶为载体并具有高表面覆盖度的键合硅胶填充剂、包覆聚合物填充剂、有机-无机杂化填充剂或非硅胶填充剂等;当需使用pH 值小于2 的流动相时,应选用耐酸的填充剂,如具有大体积侧链能产生空间位阻保护作用的二异丙基或二异丁基取代十八烷基硅烷键合硅胶填充剂,或有机-无机杂化填充剂等。
(2)检测器最常用的检测器为紫外检测器,其他常见的检测器有二极管阵列检测器,荧光检测器、示差折光检测器、蒸发光散射检测器、电化学检测器和质谱检测器等。
2005、2010版药典比对

2005、2010版药典⽐对附录Ⅺ H ⽆菌检查法2005版⽆菌检查法系⽤于检查药典要求⽆菌的药品、医疗器具、原料、辅料、及其他品种是否⽆菌的⼀种⽅法。
若供试品符合⽆菌检查法的规定,仅表明了供试品在该检验条件下未发现微⽣物污染。
⽆菌检查应在环境洁净度10000级下的局部洁净度100级的单向流空⽓区域内或隔离系统中进⾏,其全过程应严格遵守⽆菌操作,防⽌微⽣物污染,单向流空⽓区、⼯作台⾯及环境应定期按《医药⼯业洁净室(区)悬浮粒⼦、浮游菌和沉降菌的测试⽅法》的现⾏国家标准进⾏洁净度验证。
隔离系统应按相关的要求进⾏验证,其内部环境的洁净度须符合⽆菌检查的要求。
⽆此项培养基培养基的制备培养基可按以下处⽅制备,也可使⽤按该处⽅⽣产的符合规定的脱⽔培养基。
配制后应采⽤验证合格的灭菌程序灭菌。
制备好的培养基应保存在 2 ℃~ 25 ℃、避光的环境,培养基若保存于⾮密闭容器中,⼀般在三周内使⽤;若保存于密闭容器中,⼀般可在⼀年内使⽤。
1.硫⼄醇酸盐流体培养基(⽤于培养好氧菌、厌氧菌)酪胨 ( 胰酶⽔解) 15.0g葡萄糖L-胱氨酸硫⼄醇酸钠(或硫⼄醇酸)2005版同于2010版除葡萄糖和刃天青溶液外,取上述成分混合,微温溶解,调节pH为弱碱性,煮沸,滤清,加⼊葡萄糖和刃天青溶液,摇匀,调节pH值使灭菌后为7.1±0.2。
分装⾄适宜的容器中,其装量与容器⾼度的⽐例应符合培养结束后培养基氧化层(粉红⾊)不超过培养基深度的1/2。
灭菌。
在供试品接种前,培养基氧化层的⾼度不得超过培养基深度的1/5,否则,须经100℃⽔浴加热⾄粉红⾊消失(不超过20分钟),迅速冷却,只限加热⼀次,并防⽌被污染。
硫⼄醇酸盐流体培养基置30℃~35℃培养。
2.改良马丁培养基胨酵母浸出粉葡萄糖2005版与2010版相同除葡萄糖外,取上述成分混合,微温溶解,调节 pH 值约为 6.8 ,煮沸,加⼊葡萄糖溶解后,摇匀,滤清,调节 pH 值使灭菌后为 6.4 ± 0.2 ,分装,灭菌。
2005与2010药典对比(药学概论)

药学概论⏹1对比2005药典,2010新增的内容和新的特点⏹ 1.1药典的概述《中华人民共和国药典》(简称《中国药典》),按照药典委员会确定的设计方案和要求编制而成。
经药典委员会执行委员会审议通过,并经国家食品药品监督管理局批准颁布实施。
⏹ 1.2 2005年版药典简介本版药典分一部、二部和三部。
药典一部收载药材及饮片、植物油脂和提取物、成方制剂和单味制剂等,这一部收载品种1146种,其中新增154种、修订453种;药典二部收载化学药品、抗生素、生化药品、放射性药品以及药用辅料等,这一部收载1967种,其中新增327种、修订522种;药典三部收载生物制品,这一部收载101种,其中新增44种、修订57种。
本版药典收载的品种有较大幅度的增加,共收载3214种,其中新增525种。
⏹ 1.3 2010年版新药典简介2010年版《中国药典》总共收载药品品种4567种,新增1386种,它也分为三部出版。
一部为中药,其中它收载品种2165种,其中新增1019种、修订634种;二部为化学药,它包括化学药品、抗生素、生化药品、放射性药品以及药用辅料等,它收载品种2271种,其中新增330种、修订1500种;三部为生物制品,它收载品种131种,其中新增37种、修订94种。
各部内容主要包括凡例、标准正文和附录三部分,其中附录由制剂通则、通用检测方法、指导原则及索引等内容构成。
新版药典在凡例、品种的标准要求、附录的制剂通则和检验方法等方面均有较大的改进和发展,特别是对药品的安全性、有效性和质量可控性方面尤为重视。
新版药典在继承前版药典的基础上,做了大量发展和创新性的工作。
总的来说,2010年版《中国药典》在2005年版的基础上,做了大幅度的增修订和新增品种的工作。
⏹ 1.4 2010年版新药典在2005版药典的基础上新增的内容⏹ 1.4.1无菌检查2005版药典与2010新版药典的区别1. 2010版药典增加对人员的要求2. 无菌检查人员必须具备微生物专业知识,并经过无菌技术的培训。
2010年版《中国药典》和2005年版《中国药典》、《美国药典》31版甲氨蝶.呤质量指标的对比
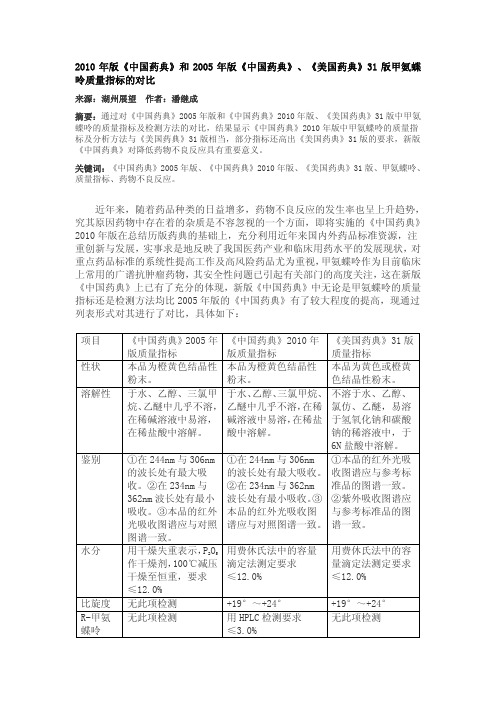
≤12.0%
≤12.0%
无此项检测
+19°~+24°
+19°~+24°
无此项检测
用 HPLC 检测要求
无此项检测
≤3.0%
有关物 质 炽灼残 渣
重金属 含量
单杂质、总杂质: 无此项检测 无此项检测
无此项检测 HPLC 法以干燥品计 ≥90.0%
单杂质:≤0.5% 总杂质:≤2.0% 于 700~800℃炽灼至 恒重,要求≤0.1%
362nm 波长处有最小 波长处有最小吸收。③ ②紫外吸收图谱应
吸收。③本品的红外 本品的红外光吸收图 与参考标准品的图
光吸收图谱应与对照 谱应与对照图谱一致。 谱一致。
图谱一致。
用干燥失重表示,P2O5 用费休氏法中的容量 用费休氏法中的容
作干燥剂,100℃减压 滴定法测定要求
量滴定法测定要求
干燥至恒重,要求 ≤12.0%
2010 年版《中国药典》和 2005 年版《中国药典》、《美国药典》31 版甲氨蝶 呤质量指标的对比
来源:湖州展望 作者:潘继成
摘要:通过对《中国药典》2005 年版和《中国药典》2010 年版、《美国药典》31 版中甲氨 蝶呤的质量指标及检测方法的对比,结果显示《中国药典》2010 年版中甲氨蝶呤的质量指 标及分析方法与《美国药典》31 版相当,部分指标还高出《美国药典》31 版的要求,新版 《中国药典》对降低药物不良反应具有重要意义。
要求≤50PPm HPLC 法以无水物计为 98.0%~102.0%
单杂质:≤0.5% 总杂质:≤2.0% 于 800±25℃下炽 灼至恒重,要求 ≤0.1% 无此项检测 HPLC 法以无水物计 为 98.0%~102.0%
中国药典10版与05版的差别-7页精选文档

【话题】阿奇霉素原料【2019版页数】291【2019版页数】395【更改分析】变更:1、有关物质检测方法由2019版的TLC方法升级为HPLC方法,口服用原料和供注射用原料有关物质限度值分别制定;2、含量测定方法由由2019版的效价测定升级为HPLC测定。
分析1、有关物质的检查方法的改变是个进步,首先说TLC的方法为常用的定性方法或半定量方法,HPLC方法是个定性和定量的方法,其进步的之处在于对有关物质的检查向一个定性且定量的方向转变。
2、一个品种不同用途对有关物质的检查限度区别对待,这个体现了不同给药途径存在的风险和其对药物内在质量的要求,客观或者说是合理地设定限度,既满足使用要求,又兼顾潜在风险,是个不错的进步。
3、对于含量测定,从抗生素的治疗效果方面考虑,我个人还是比较倾向效价测定,效价测定更能反应抗生素的治疗效果;当然效价测定也存在着一定的不足,比如说菌种的选择和菌液的制备、接种杯的规则、培养皿的铺制、加样后的培养、接种环的测量(以往的是人工测定,现在多用仪器了)等,这些过程中的影响因素很多,需要很多的经验的试验人员操作……HPLC法具有操作简便,快速(相对于抑菌培养),影响因素少等优点。
【话题】干燥失重测定法的变化【2019版页数】附录【2019版页数】附录【更改分析】变更:10版:供试品如未达规定的干燥温度即融化时,除另有规定外,应先将供试品在低于熔点5~10℃的温度下干燥至大部分水分出去后,再按规定条件干燥。
05版:供试品如未达规定的干燥温度即融化时,应先将供试品于较低的温度下干燥至大部分水分出去后,再按规定条件干燥。
10版:规定干燥剂应及时予以更换。
05版:除另有规定外,温度为60℃,干燥剂应保持在有效状态。
分析:1、明确了05版中较低的温度的具体范围,避免了以往无据可依的现象;低于熔点温度5~10℃,范围比较科学,一方面即使样品不是很纯净,熔点一般也要高于这个范围;对于水分的蒸发,这个温度一般大家都会认可,毕竟(专指后期啊)温度越高,水分蒸发得越快,达到平衡时间也就越快,而且指明温度范围,大家也好操作。
2005药典附录ⅷ h重金属检测法一法

2005年药典附录ⅷ h重金属检测法一法一、概述2005年药典附录ⅷ h中的重金属检测法一直备受关注,因为重金属对人体健康有着巨大的危害。
在这篇文章中,我们将深入探讨2005年药典附录ⅷ h中的重金属检测法,从简单到复杂,由浅入深地了解这一重要的检测方法。
二、什么是重金属检测法?重金属检测法是一种用于检测药品中重金属含量的方法。
药品中的重金属含量是非常重要的,因为重金属对人体健康有着严重的影响。
按照2005年药典附录ⅷ h的要求,药品中的重金属含量必须符合一定标准,否则将会影响药品的质量和安全性。
三、2005年药典附录ⅷ h中的重金属检测标准根据2005年药典附录ⅷ h的规定,药品中铅、汞、砷的含量必须符合相应的标准。
这些标准是根据国际上对于重金属含量的限制制定的,并且是为了保护人体健康而设定的。
在进行重金属检测时,必须严格按照这些标准来进行,以确保药品的质量和安全性。
四、重金属检测法的方法2005年药典附录ⅷ h中列举了几种重金属检测方法,包括原子吸收光谱法、荧光分析法、原子荧光光谱法等。
这些方法在进行重金属检测时各有其特点和适用范围,但都可以用于药品中重金属含量的快速、准确检测。
五、我对重金属检测法的理解在我看来,重金属检测法是一项非常重要的技术,它可以保证药品的质量和安全性。
在药品生产过程中,必须严格按照2005年药典附录ⅷ h中的重金属检测方法来进行检测,以确保药品中的重金属含量符合标准,可以安全使用。
六、总结通过本文的介绍,我们对于2005年药典附录ⅷ h中的重金属检测法有了更深入的了解。
这些方法在实际的药品生产中起着重要的作用,可以帮助保证药品的质量和安全性。
在今后的工作中,我们应该更加重视重金属检测法,不断提高检测的准确性和可靠性,以保障人们的健康和安全。
七、延伸阅读如果你对重金属检测法还有更多的了解和兴趣,可以阅读一些相关的文献和论文,以便更加深入地了解这一重要的检测方法。
结束撰写。
中国药典2005版与2010版比较解读

鉴别(1)
1…调ph至 细化和调整 9~10… 检验参数 2展开剂预饱 和15分 钟
两版药典比较~元胡止痛片
修订项目 05版
10版
修订说明
薄层扫描法
高效液相法
含量测定
(延胡索乙素)
含量:不少于 含量:不少于 20ug 75ug
规格 (片重)
无
薄膜衣片:0.26g 糖衣片芯:0.25g
两版药典比较~复方丹参片
2010版药典简介
正文 分三部,收载品种4567种,新增1386种。 一部:品种共计2165种,新增1019种(包括439 个饮片标准),修订634种。 二部:品种共计2271种,新增330种,修订 1500种。 三部:品种共计131种,新增37种,修订94种。
2010版药典简介
两版药典比较~银黄颗粒
金银花提取物制法比较 内容 煎煮次数 煎煮时间 提取液精 制 提取物 性状 部颁第六册 2次 每次2h 10版 3次
第一、二次各1h, 第三次0.5h 石灰乳调节pH、 删除 沉淀、硫酸调节 pH 稠膏 清膏加淀粉制成 干浸膏
两版药典比较~银黄颗粒
黄芩提取物比较 内容 部颁第六册
四、对药品质量可控性、有效性的技术保障 得到进一步提升。
中药特点的专属性鉴别、有效活性的专属性检测;含量测定大 量应用液相色谱法、大部分口服制剂增订了溶出度检查等等。
2010版药典简介
五、药品标准内容更趋科学规范合理。
制剂通则新增药用辅料总体要求;可见异物检查法中 规定抽样要求、检测次数和时限;一部明确入药均 为饮片等等。
修订项目
制法
05版
无大片
10版
修订说明
增加大片 规范 规定片重 增加大片规 格
