(完整版)YY_T0450.3-2016_一次性使用无菌血管内导管辅件第3部分:球囊扩张导
无菌医疗器械产品检验相关标准(附件)

无菌医疗器械质量检验相关标准(一)医疗器械生物相容性试验GB/T 16886。
3 医疗器械生物学评价第3部分:遗传毒性、致癌性和生殖毒性试验GB/T 16886.4 医疗器械生物学评价第4部分:与血液相互作用试验选择GB/T 16886.5 医疗器械生物学评价第5部分:体外细胞毒性试验GB/T 16886。
6 医疗器械生物学评价第6部分:植入后局部反应试验GB/T 16886。
7 医疗器械生物学评价第7部分:环氧乙烷灭菌残留量GB/T 16886.8 医疗器械生物学评价第8部分:生物学试验参照样品的选择和定性GB/T 16886.10 医疗器械生物学评价第10部分:刺激与致敏试验GB/T 16886。
11 医疗器械生物学评价第11部分:全身毒性试验GB/T 16886。
12医疗器械生物学评价第12部分:样品制备和参照样品GB/T 16886.13 医疗器械生物学评价第13部分:聚合物医疗器械降解产物的定性与定量GB/T 16886。
14 医疗器械生物学评价第14部分:陶瓷降解产物的定性与定量分析GB/T 16886。
15 医疗器械生物学评价第15部分:金属与合金降解产物的定性与定量GB/T 16886.16 医疗器械生物学评价第16部分:降解产物与可溶出物的毒代动力学研究设计)GB/T 16886.17 医疗器械生物学评价第17部分:根据健康风险评价确定可溶出物允许极限的方法GB/T 16886。
18 医疗器械生物学评价第18部分:材料化学定性GB/T 16886.19 医疗器械生物学评价第19部分:材料理化、机械和形态定性GB/T 16886。
20 医疗器械生物学评价第20部分:医疗器械免疫毒理学试验原理和方法GB/T16175医用有机硅材料生物学评价试验方法GB/T 16886。
9医疗器械生物学评价第9部分:潜在降解产物的定性与定量总则YY/T 0473外科植入物聚交酯共聚物和共混物体外降解试验YY/T 0474外科植入物用聚L—丙交酯树脂及制品体外降解试验YY/T XXXX 一次性使用橡胶手套生物学评价要求与试验方法GB /TXXXX 医疗器械微生物法第3部分:细菌内毒素试验方法用于常规监测和跳批检验YY/T 0567。
国家食品药品监督管理总局关于批准...

国家⾷品药品监督管理总局关于批准发布《⾎管内导管⼀次性使⽤⽆菌导管第1部分:通⽤要求》等8项医疗器械⾏业标准和1项修改单的公告⽂号:国家⾷品药品监督管理总局公告2017年第84号颁布⽇期:2017-07-17执⾏⽇期:2017-07-17时效性:现⾏有效效⼒级别:部门规章YY 0285.1-2017《⾎管内导管⼀次性使⽤⽆菌导管第1部分:通⽤要求》等8项医疗器械⾏业标准和YY 0669-2008《医⽤电⽓设备第2部分:婴⼉光治疗设备安全专⽤要求》第1号修改单已经审定通过,现予以公布。
标准编号、名称、适⽤范围、实施⽇期及修改单内容见附件。
特此公告。
附件:1.YY 0285.1-2017《⾎管内导管⼀次性使⽤⽆菌导管第1部分:通⽤要求》等8项医疗器械⾏业标准编号、名称、适⽤范围及实施⽇期2.YY 0669-2008《医⽤电器设备第2部分:婴⼉光治疗设备安全专⽤要求》第1号修改单及实施⽇期国家⾷品药品监督管理总局2017年7⽉17⽇附件1YY 0285.1-2017《⾎管内导管⼀次性使⽤⽆菌导管第1部分:通⽤要求》等8项医疗器械⾏业标准编号、名称、适⽤范围及实施⽇期⼀、强制性⾏业标准(6项)(⼀)YY 0285.1-2017《⾎管内导管⼀次性使⽤⽆菌导管第1部分:通⽤要求》(2019年1⽉1⽇实施)本标准规定了以⽆菌状态供应并⼀次性使⽤的各种⽤途的⾎管内导管的通⽤要求。
本标准适⽤于⽆菌状态供应并⼀次性使⽤的各种⽤途的⾎管内导管。
本标准不适⽤于⾎管内导管辅件,如YY 0450.1《⼀次性使⽤⽆菌⾎管内导管辅件第1部分:导引器械》。
本标准代替YY 0285.1-2004《⼀次性使⽤⽆菌⾎管内导管第1部分:通⽤要求》。
(⼆)YY 0285.3-2017《⾎管内导管⼀次性使⽤⽆菌导管第3部分:中⼼静脉导管》(2019年1⽉1⽇实施)本标准规定了⽆菌供应并⼀次性使⽤的中⼼静脉导管的要求。
本标准代替YY 0285.3-1999《⼀次性使⽤⽆菌⾎管内导管第3部分:中⼼静脉导管》。
YY028513一次性使用无菌血管内导管

一次性使用无菌血管内导管第1部分:通用要求Sterile, single-use intravascular cathetersPart 1: General requirements1 范围本标准规定了以无菌状态供应并一次性使用的各种用途的血管内导管的通用要求。
本标准不适用于血管内导管附件,附件的要求将在其他标准中规定。
2 引用标准下列标准所包含的条文,通过在本标准中引用而构成本标准的条文。
本标准出版时,所示版本均为有效。
所有标准都会被修订,使用本标准的各方面应探讨使用下列标准最新版本的可能性。
GB 1962:1995 注射器、注射针及其他医疗器械的6:100圆锥接头GB 15810-1995 一次性使用无菌注射器ISO 594-2:1991 注射器、注射针及其他医疗器械6%(鲁尔)圆锥接头第2部分:锁定锥头3 定义本标准使用下列定义。
3.1 血管内导管 intravascular catheter可部分或全部插入或植入人心血管系统,用于诊断和/或治疗目的的单腔或多腔管状器械。
3.2 末端 distal end导管最大程度插入患者体内的末尾部分。
3.3 邻近端;接近端 proximal end; access end导管用于连接的端3.4 座 hub导管邻近端的连接件,或者与导管为一整体,或者能牢固地安装于导管的邻近端。
3.5 有效长度, l effective length, l导管能插入患者体内的长度(见图1)。
3.6 外径 outside diameter能插入血管的那部分导管的最大直径。
3.7 联接件 junction导管上一条与多条管路相连接的部分。
4 要求4.1 总则应通过一种有效的方法对导管进行灭菌,导管在无菌的状态下应符合4.2至4.7的要求。
注1:适宜的灭菌方法见ISO11134、ISO11135和ISO11137。
4.2 生物相容性导管应无生物学危害。
注2:相应试验方法的选择见GB/T 16886.1-19974.3 外表面当用正常视力或矫正视力在放大2.5倍的条件下检查时,导管外表面不应看到汇聚的润滑剂液滴。
无菌医疗器械的标准【45页】

实验环境 实验操作所处环境应不得导入明显的微粒,可以在超净室、层流净化台或能符合要求的洁净实验室中进行。实验所用仪器、取样杯等都应洁净、无微粒。
热原
家兔法细菌内毒素 该项目常作为出厂检验进行控制 1.鲎试剂 2.水浴锅
化学性能
可以是生物安全柜或层流柜(必须是垂直流) 3、检查企业是否做无菌室及层流柜的高效过滤器检漏试验,是否定期验证; 4、是否配齐检测设施、设备;
5.恒温培养箱的温控装置是否定期进行校验;6.检验仪器、设备有无使用、维护、保养记录; (第八章监视和测量中第六十三条要求: 应当定期对测量装置进行校准或检定和予以标示,并保存记录; 应当规定在搬运、维护、贮存期间对监视和测量装置的防护要求,防止检验结果失准; 当发现监视和测量装置不符合要求时,应当对以往监控和测量结果的有效性进行评价和记录,并且应对装置和受影响的产品采取适当的措施,保存装置的校准和产品验证结果的记录。)
环氧乙烷灭菌监测方法(常规控制)
生物指示菌片法 生物指示剂系一类特殊的活微生物品,可用于确认灭菌设备的性能、灭菌程序的验证、生产过程灭菌效果的监控等。用于灭菌验证中的生物指示剂一般是细菌的孢子。
环氧乙烷灭菌监测方法(常规控制)
将一些生物指示剂片事先放入多个产品中最难灭菌的部位,再将这些含菌“产品”放在灭菌过程中确认为灭菌柜中最难灭菌的地方和指定的地方,灭菌后将其逐一取出对其进行培养。以培养结果为阴性来推断“灭菌后产品上的污染微生物均被杀灭”。 在EO灭菌过程的常规控制中,生物指示菌片放置的位置一定要与灭菌确认时完全一致。
醇溶出物(DEHP)
DEHP(DOP)邻苯二甲酸(2-乙基己基酯)PVC血袋、一次性使用输液器等聚氯乙烯和聚乙烯材料中的增塑剂DEHP类增塑剂的毒性 生殖系统毒性 致癌性
国家食品药品监督管理总局关于批准发布《血管内导管一次性使用无

国家食品药品监督管理总局关于批准发布《血管内导管一次性使用无菌导管第1部分:通用要求》等8项医疗器械行业标准和1项修改单的公告【法规类别】医疗器械药品药材进出口【发文字号】国家食品药品监督管理总局公告2017年第84号【发布部门】国家食品药品监督管理总局【发布日期】2017.07.17【实施日期】2017.07.17【时效性】现行有效【效力级别】XE0303国家食品药品监督管理总局关于批准发布《血管内导管一次性使用无菌导管第1部分:通用要求》等8项医疗器械行业标准和1项修改单的公告(国家食品药品监督管理总局公告2017年第84号)YY 0285.1-2017《血管内导管一次性使用无菌导管第1部分:通用要求》等8项医疗器械行业标准和YY 0669-2008《医用电气设备第2部分:婴儿光治疗设备安全专用要求》第1号修改单已经审定通过,现予以公布。
标准编号、名称、适用范围、实施日期及修改单内容见附件。
特此公告。
附件:1.YY 0285.1-2017《血管内导管一次性使用无菌导管第1部分:通用要求》等8项医疗器械行业标准编号、名称、适用范围及实施日期2.YY 0669-2008《医用电器设备第2部分:婴儿光治疗设备安全专用要求》第1号修改单及实施日期国家食品药品监督管理总局2017年7月17日附件1YY 0285.1-2017《血管内导管一次性使用无菌导管第1部分:通用要求》等8项医疗器械行业标准编号、名称、适用范围及实施日期一、强制性行业标准(6项)(一)YY 0285.1-2017《血管内导管一次性使用无菌导管第1部分:通用要求》(2019年1月1日实施)本标准规定了以无菌状态供应并一次性使用的各种用途的血管内导管的通用要求。
本标准适用于无菌状态供应并一次性使用的各种用途的血管内导管。
本标准不适用于血管内导管辅件,如YY 0450.1《一次性使用无菌血管内导管辅件第。
无菌医疗器械产品检验相关标准(附件)

无菌医疗器械质量检验相关标准(一)医疗器械生物相容性试验GB/T 16886.3 医疗器械生物学评价第3部分:遗传毒性、致癌性和生殖毒性试验GB/T 16886.4 医疗器械生物学评价第4部分:与血液相互作用试验选择GB/T 16886.5 医疗器械生物学评价第5部分:体外细胞毒性试验GB/T 16886.6 医疗器械生物学评价第6部分:植入后局部反应试验GB/T 16886.7 医疗器械生物学评价第7部分:环氧乙烷灭菌残留量GB/T 16886.8 医疗器械生物学评价第8部分:生物学试验参照样品的选择和定性GB/T 16886.10 医疗器械生物学评价第10部分:刺激与致敏试验GB/T 16886.11 医疗器械生物学评价第11部分:全身毒性试验GB/T 16886.12医疗器械生物学评价第12部分:样品制备和参照样品GB/T 16886.13 医疗器械生物学评价第13部分:聚合物医疗器械降解产物的定性与定量GB/T 16886.14 医疗器械生物学评价第14部分:陶瓷降解产物的定性与定量分析GB/T 16886.15 医疗器械生物学评价第15部分:金属与合金降解产物的定性与定量GB/T 16886.16 医疗器械生物学评价第16部分:降解产物与可溶出物的毒代动力学研究设计) GB/T 16886.17 医疗器械生物学评价第17部分:根据健康风险评价确定可溶出物允许极限的方法GB/T 16886.18 医疗器械生物学评价第18部分:材料化学定性GB/T 16886.19 医疗器械生物学评价第19部分:材料理化、机械和形态定性GB/T 16886.20 医疗器械生物学评价第20部分:医疗器械免疫毒理学试验原理和方法GB/T16175医用有机硅材料生物学评价试验方法GB/T 16886.9医疗器械生物学评价第9部分:潜在降解产物的定性与定量总则YY/T 0473外科植入物聚交酯共聚物和共混物体外降解试验YY/T 0474外科植入物用聚L-丙交酯树脂及制品体外降解试验YY/T XXXX 一次性使用橡胶手套生物学评价要求与试验方法GB /TXXXX 医疗器械微生物法第3部分:细菌内毒素试验方法用于常规监测和跳批检验YY/T 0567.1 医疗产品的无菌加工第1部分:通用要求YY/T 0567.2 医疗产品的无菌加工第2部分:过滤GB XXXX.1 医疗器械生产用动物组织及其衍生物第1部分:风险分析与管理GB XXXX.2 医疗器械生产用动物组织及其衍生物第2部分:索源、收集和处置GB XXXX.3 医疗器械生产用动物组织及其衍生物第3部分:病毒和传播媒介的去除与灭活GB XXXX.4 医疗器械生产用动物组织及其衍生物第4部分:液体灭菌剂灭菌的确认和常规控制(二)医用输液(血)、注射器具标准GB/T14233.1医用输液、输血、注射器具检验方法第1部分:化学分析方法GB/T14233.2医用输液、输血、注射器具检验方法第2部分:生物试验方法GB15593输血(液)器具用软聚氯乙烯塑料YY0114医用输液、输血、注射器用聚乙烯专用料YY0242医用输液、输血、注射器用聚丙烯专用料GB 8368一次性使用输液器GB 18671一次性使用静脉输液针YY 0286.1专用输液器第1部分:一次性使用精密过滤输液器YY 0286.2专用输液器第2部分:一次性使用滴定管式输液器YY 02868.3专用输液器第3部分:一次性使用避光式输液器,重力输液式YY 02868.4专用输液器第4部分:一次性使用压力输液装置用输液器YY 0286.5专用输液器第5部分:一次性使用吊瓶式和分液袋式输液器YY 0286.6专用输液器第6部分: 一次性使用非PVC输液器YY 0286.7 专用输液器第7部分: 一次性使用流量可设定输液器YY XXXX 一次性使用静脉营养袋YY 0451 一次性使用输注泵YY XXXX一次性使用高压造影输注器YY 0585.1压力输液设备用一次性使用液路及附件第1部分:液路YY 0585.2压力输液设备用一次性使用液路及附件第2部分:附件YY 0585.3压力输液设备用一次性使用液路及附件第3部分:过滤器YY0585.4 压力输液设备用一次性使用液路及附件第4部分:防回流阀YY 0586输液用肝素帽YY/T 0582.1输液瓶悬挂装置第1部分:一次性使用悬挂装置YY/T 0582.2输液瓶悬挂装置第2部分:多用悬持装置GB8369一次性使用输血器GB 14232.1人体血液及血液成分袋式塑料容器第1部分:传统型血袋GB 14232.2 人体血液及血液成分袋式塑料容器第2部分:图形符号GB 14232.3 人体血液及血液成分袋式塑料容器第3部分:带特殊组件的血袋系统YY 0327一次性使用紫外线透疗血液容器GB 19335一次性使用血路产品通用技术条件YY0113一次性使用采血器YY 03282一次性使用机用采血器YY 0326.1一次性使用离心式血浆分离器第1部分:血浆分离杯YY 0326.2一次性使用离心式血浆分离器第2部分:血浆管路YY 0326.3 一次性使用离心式血浆分离器第3部分:血浆袋YY 0329-2009一次性使用去白细胞过滤器YY0031硅橡胶输液(血)管YY 0584一次性使用离心杯式血液成分分离器材YY XXXX一次性使用离心袋式血液成分分离器材YY/T 0289一次性使用微量采血吸管YY 0314一次性使用人体静脉血样采集容器YY 0464-2009 一次性使用血液灌流器YY 0465-2009一次性使用空心纤维血浆分离器GB 15810 一次性使用无菌注射器GB 15811 一次性使用无菌注射针YY/T 0243 一次性使用无菌注射器用橡胶活塞YY/T 0282-2009 注射针(三)医用导管、插管标准YY 0285.1一次性使用血管内导管第1部分:通用要求YY 0285.2一次性使用无菌血管内导管第2部分:造影导管YY 0285.3一次性使用无菌血管内导管第3部分:中心静脉导管YY 0285.4一次性使用无菌血管内导管第4部分:球囊扩张导管YY 0285.5一次性使用无菌血管内导管第5部分:套针外周导管YY/T 0586医用高分子制品X透射线不透性试验方法YY 0450.1一次性使用无菌血管内导管辅件第1部分:导引器械YY 0450.2一次性使用无菌血管内导管辅件第2部分:套针外周导管管塞YY 0450.3一次性使用无菌血管内导管辅件第3部分:球囊扩张导管扩张泵GB/T15812.1非血管内导管第1部分:一般性能试验方法GB/T15812.2非血管内导管第2部分:弯曲性能试验方法YY 0030 腹膜透析管YY 0325一次性使用无菌导尿管YY 0489一次性使用无菌引流导管及其辅助器械YY 0488一次性使用无菌直肠导管YY 0483一次性使用肠营养导管、肠给养器及其连接件设计与试验方法YY 1040.1 麻醉和呼吸设备圆锥接头第1部分:锥头与锥套YY 0337.1气管插管第1部分:常用型插管及接头YY 0337.2气管插管第2部分:柯尔型插管YY 0338.1气管切开插管第1部分:成人用插管及接头YY 0338.2气管切开插管第2部分:小儿用气管切开插管YY 0339-2009 呼吸道用吸引导管YY 0461 麻醉机和呼吸机用呼吸管路(四)无菌植入物标准YY 0484外科植入物双组分加成型硫化硅橡胶YY 0334硅橡胶外科植入物通用要求YY 0332植入式给药装置YY 0333软组织扩张器YY 0487一次性使用无菌脑积水分流器及其组件YY0308医用透明质酸钠凝胶YY/TXXXX医用天然高分子降解多糖材料:通用要求及试验方法(五)卫生材料、敷料YY/T 0471.1接触性创面敷料试验方法第1部分:液体吸收性YY /T 0471.2接触性创面敷料试验方法第2部分:透气膜敷料水蒸汽透过率YY/T 0471.3接触性创面敷料试验方法第3部分:阻水性YY/T 0471.4 接触性创面敷料试验方法第4部分:舒适性YY /T 0471.5接触性创面敷料试验方法第5部分:阻菌性YY /T 0471.6接触性创面敷料试验方法第6部分:气味控制YY/T 0471.7 创伤敷料试验方法第7部分:颗粒脱落YY /T0471.8 创伤敷料试验方法第8部分:关于粘连(创面和皮肤)YY/T 0472.1医用非织造敷布试验方法第1部分:敷布生产用非织造布YY/T 0472.2医用非织造敷布试验方法第2部分:成品敷布YY 0330医用脱脂棉YY 0331脱脂棉纱布和脱指棉与粘胶纱布性能要求和试验方法YY 0594 外科纱布敷料通用要求YY/T 0148医用粘贴胶带通用要求YY/T 0506.2-2009病人、医护人员和器械用手术单、手术衣和洁净服第2部分:性能要求和性能水平YY/T 0506.3病人、医护人员和器械用手术单、手术衣和洁净服第3部分:试验方法YY/T 0506.4病人、医护人员和器械用手术单、手术衣和洁净服第4部分:干态落絮试验方法YY/T 0506.5-2009病人、医护人员和器械用手术单、手术衣和洁净服第5部分:干态阻菌试验方法YY/T 0506.6-2009病人、医护人员和器械用手术单、手术衣和洁净服第6部分:湿态阻菌试验方法YY/T 0506.7病人、医护人员和器械用手术单、手术衣和洁净服第7部分:阻污染气溶胶穿透试验方法YY/T 0506.8病人、医护人员和器械用手术单、手术衣和洁净服第8部分:抗激光性试验方法(六)其他标准YY/T 0720-2009 一次性使用产包自然分娩用YY 0321.1-2009一次性使用麻醉穿刺包YY 0321.2-2009一次性使用麻醉用针YY 0583—2005《一次性使用胸腔引流装置水封式》YY 0167非吸收性外科缝线YY 1116可吸收外科缝合线GB 7543-1996 橡胶医用手套GB 10213-1995 一次性使用橡胶检查手套GB 7544-2004 天然胶乳橡胶避孕套技术要求和试验方法*(非无菌医疗器械)YY /T0698.1-2009 最终灭菌医疗器械包装材料第1部分:吹塑包装复合塑料膜要求和试验方法YY /T0698.2-2009最终灭菌医疗器械包装材料第2部分:灭菌包裹材料要求和试验方法YY /T0698.3-2009最终灭菌医疗器械包装材料第3部分:纸袋、组合袋和卷材生产用纸要求和试验方法YY /T0698.4-2009 最终灭菌医疗器械包装材料第4部分:纸袋要求和试验方法;YY /T0698.5-2009 最终灭菌医疗器械包装材料第5部分:纸与塑料膜组合的热封和自封袋和卷材要求和试验方法;YY /T0698.6-2009 最终灭菌医疗器械包装材料第6部分:用于低温灭菌过程或辐射灭菌的无菌屏障系统生产用纸要求和试验方法;YY /T0698.7-2009 最终灭菌医疗器械包装材料第7部分:环氧乙烷或辐射灭菌的医用无菌屏障系统生产用可密封涂胶纸要求和试验方法;YY /T0698.8-2009 最终灭菌医疗器械包装材料第8部分:蒸汽灭菌器用重复性使用灭菌容器要求和试验方法;YY /T0698.9-2009 最终灭菌医疗器械包装材料第9部分:可密封组合袋、卷材和盖材生产用无涂胶聚烯烃非织造布材料要求和试验方法;YY/T0698.10-2009 最终灭菌医疗器械包装材料第10部分:可密封组合袋、卷材和盖材生产用涂胶聚烯烃非织造布材料要求和试验方法。
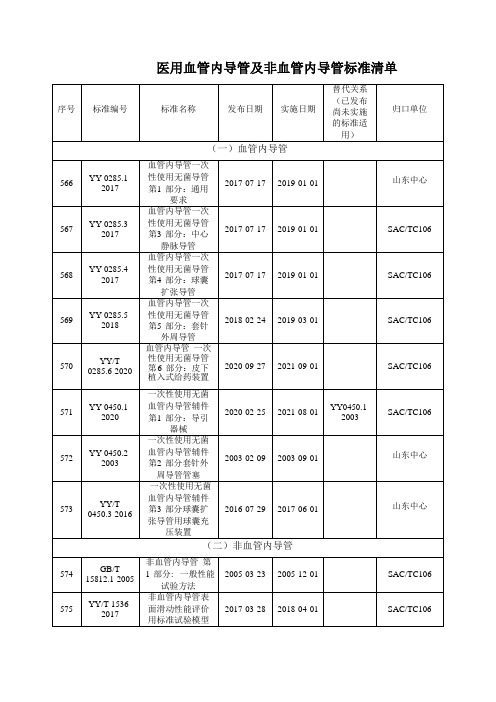
医用血管内导管及非血管内导管标准清单
SAC/TC106
序号
标准编号
标准名称
发布日期
实施日期
替代关系
(已发布 尚未实施
的标准适
用)
归口单位
576
YY0030-
2004
腹膜透析管
2004-07-16
2005-08-01
山东中心
577
YY0325-
2016
一次性使用无菌
导尿管
2016-03-23
2018-01-01
SAC/TC106
方法
2013-10-21
2014-10-01
SAC/TC106
584
YY/T0817-
2010
带定位球囊的肠
营养导管物理性 能要求及试验方 法
2010-12-27
2012-06-01
山东中心
医用血管内导管及非血管内导管
序号
标准编号
标准名称
发布日期
实施日期
替代关系
(已发布 尚未实施 的标准适 用)
归口单位
(一)血管内导管
566
YY0285.1-
2017
血管内导管一次
性使用无菌导管 第1部分:通用 要求
2017-07-17
2019-01-01
山东中心
567
YY0285.3-
2017
血管内导管一次
578
YY0483-
2004
一次性使用肠营
养导管、肠给养 器及其连接件 设计与试验方法
2004-07-16
2005-08-01
山东中心
579
YY0488-
2004
一次性使用无菌
医疗器械国家标准

91
YY 0300-2009
牙科学 修复用人工牙
2010-12-1
2009-6-16
92
YY 0302.1-2010
牙科旋转器械 车针 第1部分:钢质和硬质合金车针
2012-6-1
93
YY 0303-1998
医用羟基磷灰石粉料
1998-10-1
1998-4-8
94
YY 0304-2009
5
YY 0015-90
功量机
1991-4-1
1990-10-16
6
YY 0017-2008
骨接合植入物 金属接骨板
2010-6-1
2008-9-21
7
YY 0018-2008
骨接合植入物 金属接骨螺钉
2010-6-1
2008-9-21
8
YY 0019-2002
骨接合植入物 金属髓内针
2003-4-1
专用输液器 第5部分:一次性使用吊瓶式和袋式输液器
2009-12-1
2008-4-25
80
YY 0286.6-2009
专用输液器 第6部分:一次性使用流量设定微调式输液器
2010-12-1
2009-6-16
81
YY 0290.1-2008
眼科光学 人工晶状体 第1部分:术语
2010-6-1
2008-9-21
2009-6-16
68
YY 0271.2-2009
牙科水基水门汀 第2部分:光固化水门汀
2010-12-1
2009-6-16
69
YY 0272-2009
牙科学 氧化锌/丁香酚水门汀和不含丁香酚的氧化锌水门汀
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
YY/T 0450.3-2016 一次性使用无菌血管内导管辅件第3部分:球
囊扩张导管用球囊充压装置
基本信息
【英文名称】Accessory devices for sterile single-use intravascular catheters―Part
3:Inflation devices for balloon of balloon dilatation catheters
【标准状态】现行
【全文语种】中文简体
【发布日期】2007/7/2
【实施日期】2017/6/1
【修订日期】2016/7/29
【中国标准分类号】C31
【国际标准分类号】11.120.30
关联标准
【代替标准】YY 0450.3-2007
【被代替标准】暂无
【引用标准】GB/T 1962.2,GB 9706,GB 15810,GB/T 16886.1,GB/T 19633.1-2015,YY 0505,YY/T 0615.1
适用范围&文摘
YY/T 0450的本部分规定了血管内球囊扩张导管用一次性使用手动式充压装置(简称“充压装置”)的要求,该产品适用于对YY 0285.4所规定的球囊扩张导管的球囊打压,使其膨胀从而达到扩张血管或释放支架的目的。
血管内栓塞的释放装置和球囊阻断导管的充压装置具有与本部分所规定的充压装置相类似的结构。
本标准对这些装置不适用。
