元素与物质的分类
元素与物质世界 第1节 元素与物质的分类

第2章 元素与物质世界
(3)元素与物质的关系 元素―组―成→单 化质 合: 物:_只_由__由__多__一__种__种__元__元__素__素____组组成成的的纯纯净净物物 (4)元素在物质中的存在形态 ①游离态:元素以_单__质__形式存在的状态。 ②化合态:元素以_化__合__物__形式存在的状态。 (5)混合物和纯净物 ①纯净物:_由__同__种__单__质__或__化__合__物__组__成__的__物__质__。 ②混合物:_由__几__种__不__同__的__单__质__或__化__合__物__组__成__的__物__质__。
栏目 导引
第2章 元素与物质世界
栏目 导引
第2章 元素与物质世界
题组 物质的组成与分类
1.(2019·福建质检)甲物质与强碱溶液反应只生成盐和水,甲一
定不属于( )
A.酸
B.盐
C.金属单质
D.氧化物
栏目 导引
第2章 元素与物质世界
解析:选 C。酸与强碱溶液发生中和反应,生成盐和水,A 项 不符合题意;NaHCO3 和 NaOH 溶液反应生成 Na2CO3 和 H2O, NaHCO3、Na2CO3 均属于盐,B 项不符合题意;能和碱反应的 金属为两性金属,其与碱反应生成盐和 H2,C 项符合题意;酸 性氧化物和强碱溶液反应生成盐和水,D 项不符合题意。
第2章 元素与物质世界
[自我检测] 判断正误,正确的打“√”,错误的打“×” (1)分子、原子、离子的概念及物质组成成分的判断 ①“天宫二号”使用的碳纤维是一种新型有机高分子材料。 (×) ②现在人们借助扫描隧道显微镜,应用 STM 技术可以“看”到 越来越细微的结构,并实现对原子或分子的操纵。 ( √ ) ③Na、NaCl、SiO2、H2SO4 都称为分子式。( × ) ④含有金属元素的离子不一定是阳离子。( √ )
高一化学必修一 2.1 元素与物质分类 讲义

2.1元素与物质分类考点1 元素与物质的关系1.根据元素组成对物质分类(1)元素具有相同核电荷数的一类原子的总称。
(2)元素组成物质元素――→组成⎩⎪⎨⎪⎧单质:同种元素组成的纯净物化合物:不同种元素组成的纯净物(3)纯净物与混合物①纯净物:由同种单质或化合物组成的物质。
②混合物:由几种不同的单质或化合物组成的物质。
③纯净物和混合物的区别纯净物 混合物 有固定的组成和结构 无固定的组成和结构 有一定的熔、沸点 无一定的熔、沸点 保持一种物质的性质保持原有物质各自的性质2.游离态与化合态元素以单质形式存在时,称为元素的游离态;元素以化合物形式存在时,称为元素的化合态。
3.“价-类”二维图主要表明氢化物、单质、氧化物、酸、碱、盐等类别的物质考点2 物质的分类与物质的性质1.酸性氧化物与碱性氧化物(1)酸性氧化物.(大多数非金属氧化物,如:SO2、SO3、CO2、Mn2O7)能与碱反应生成盐和水的氧化物叫酸性氧化物(注意只生成盐和水,不变价)。
注意:①酸性氧化物都能跟强碱反应,生成盐和水②大多数酸性氧化物能跟水化合生成酸(SiO2除外),不是全部。
③大多数酸性氧化物都可由非金属与O2化合生成点燃例如:①2NaOH + CO2 === Na2CO3 + H2O ②CO2 + H2O === H2CO3③C + O2CO2(2)碱性氧化物.(大多数金属氧化物,如:CaO、MgO、CuO、Fe2O3)能与酸反应生成盐和水的氧化物叫碱性氧化物。
CaO、Fe2O3等大多数金属氧化物都是碱性氧化物(3)两性氧化物.既能与碱反应生成盐又能与酸反应生成盐和水的氧化物叫两性氧化物。
如Al2O3。
【注意】正确理解几个“一定”“不一定”(1)碱性氧化物一定是金属氧化物,但金属氧化物不一定是碱性氧化物,如Mn2O7为酸性氧化物。
(2)酸性氧化物不一定是非金属氧化物,如Mn2O7;非金属氧化物也不一定是酸性氧化物,如CO、NO。
元素与物质的分类
第1节 元素与物质的分类一。
教材分析 (一)知识脉络学生在初中化学中已经认识了几种具体物质的性质和单质、酸、碱、盐、氧化物的一般性质,但他们只是从单个物质的角度认识物质的性质,尚未从一类物质的角度认识物质的性质,更未建立起元素与物质的关系。
因此,通过元素与物质的关系的研究,引导学生以元素的观点认识物质;通过研究用不同的标准对物质进行分类,使学生建立分类的观点。
在分类的基础上,研究纯净物—-单质、氧化物、酸、碱、盐之间的相互关系;在学生原有的认知结构中已存在溶液、浊液等混合物的观点,进而引进一种新的混合物——胶体,建立分散系的概念,丰富学生对混合物的认识,并使学生了解胶体的一般性质,学会从粒度大小的角度对混合物进行分类。
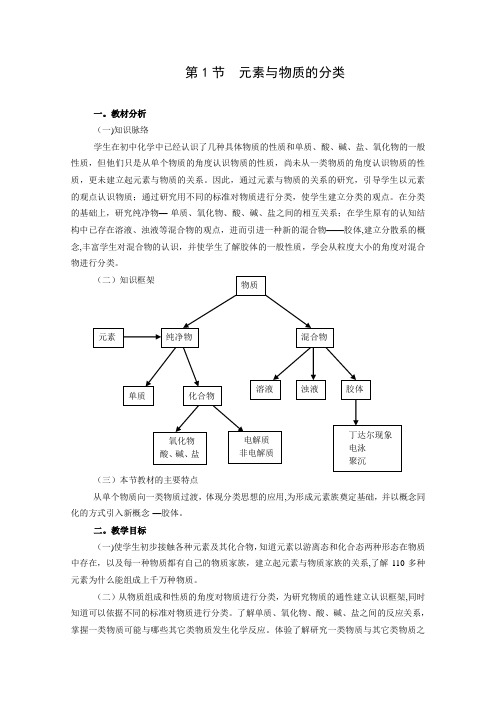
(二)知识框架(三)本节教材的主要特点从单个物质向一类物质过渡,体现分类思想的应用,为形成元素族奠定基础,并以概念同化的方式引入新概念-—胶体。
二。
教学目标(一)使学生初步接触各种元素及其化合物,知道元素以游离态和化合态两种形态在物质中存在,以及每一种物质都有自己的物质家族,建立起元素与物质家族的关系,了解110多种元素为什么能组成上千万种物质。
(二)从物质组成和性质的角度对物质进行分类,为研究物质的通性建立认识框架,同时知道可以依据不同的标准对物质进行分类。
了解单质、氧化物、酸、碱、盐之间的反应关系,掌握一类物质可能与哪些其它类物质发生化学反应。
体验了解研究一类物质与其它类物质之物质元素纯净物混合物单质化合物溶液浊液胶体氧化物酸、碱、盐电解质非电解质丁达尔现象 电泳 聚沉间反应的关系的过程方法.(三)知道胶体是一种重要的分散系,了解胶体的丁达尔现象、电泳、聚沉等特性,能够列举生活中胶体的实例,了解胶体性质的简单应用.三.教学重点(一)知识与技能:元素与物质的关系;胶体的性质.(二)过程与方法:探讨各类物质的通性及其相互反应关系,学会如何以元素为核心认识物质,从多角度依据不同标准对物质进行分类并体验分类的重要意义。
高中化学【元素与物质分类】优质课件

考点三
分散系、胶体
知识梳理
1.分散系 (1)概念: 把一种(或多种)物质分散在另一种(或多种)物质中所得到的体系。 (2)分类:根据分散质粒子的大小将分散系分为溶液、浊液和 胶体 ,可用 如下直观地表示。
2.三种分散系比较
分散系
溶液
胶体
浊液
分散质微粒直径大小 _<__1__n_m_ _1_~__1_0_0__n_m__ ___>_1_0_0_n_m____
4.简单分类法——交叉分类法和树状分类法 (1)交叉分类法的应用示例
(2)明确分类标准是对物质正确树状分类的关键
(3)树状分类法在无机化合物分类中的应用
氢化物:HCl、H2S、H2O、NH3等
无
不成盐氧化物:CO、NO等
机 化 合 物
碱性氧化物:Na2O、CaO等
氧化物成盐氧化物酸性氧化物:CO2、P2O5等
2.元素与物质的关系 (1)元素:元素是具有相同核电荷数的一类原子的总称。元素在自然界的 存在形式有 游离态 和 化合态 。 ①游离态:元素以 单质 形式存在的状态。 ②化合态:元素以 化合物 形式存在的状态。 (2)元素组成物质 元素―组―成→单化质合:物同:种不元同素种组元成素的组纯成净的物纯净物
内容索引
考点一 物质的组成与分类 考点二 物质的性质与变化 考点三 分散系、胶体 探究高考 明确考向 课时作业
考点一
物质的组成与分类
知识梳理
1.原子、分子、离子概念比较 (1)原子、分子、离子的概念 原子是 化学变化 中的最小微粒。分子是 保持物质化学性质 的最小微粒, 一般分子由原子通过共价键构成,但稀有气体是单原子分子。离子是带 电荷的原子或原子团。 (2)原子是怎样构成物质的?
元素与物质的分类

能否透过滤纸
能 能否透过半透膜 13131313
稳定性
稳定 较稳定 1616161616 1717171717
LOGO
xlmily@
Na(+1) Mg(+2) Cu(+1、+2) Ca(+2) C(+2、+4) H(+1) S(+4、+6) O(-2) Na2O、 NaCl、Na2S MgO、MgCl2、MgS
Cu2O、CuO、CuCl2、Cu2S、CuS CaO、CaCl2、CaS Cl(-1) CO、CO2、CCl4、CS2
动
探
究
酸
盐
非金属单质
金属
活 【预测2】
动
探
究
酸
酸性 氧化物
碱性 氧化物
水
活 【预测3】
动
探
究
碱
碱性 氧化物
酸性 氧化物
水
活
【预测4】
动
探
究
指 示 剂
碱
酸
盐
金属
碱性 氧化物
活 【预测5】
动
探
究
碱
活 【预测6】
动
探
究
酸Байду номын сангаас盐
金属
盐
碱
2、单质、氧化物、酸、碱、盐之间的相互关系
活
反应物
锌
类别: 单质
负价元素
O(-2) Cl(-1) S(-2)
一、元素与物质的关系
交
流
研
讨
问题1
(2)你知道这些元素还能组成哪些物质? 举例说明。
①若只由一种元素组成,请写出其化学式。这类 物质属于单质还是属于化合物?
元素与物质的分类课件

酸
HCl
指示剂
碱性 氧化物
CaO
24
活动· 探究
酸 盐酸
盐
AgNO3
盐 NaCl 金属 Fe 碱
Ca(OH)2
25
总结:单质、氧化物、酸、碱、盐之间的关系 金属、非金属、碱性氧化物、酸性氧化物、酸、 碱、盐分别能与哪些类别的物质反应?将下图中可能发 生反应的物质类别用线连接起来。 金属 碱性氧化物 碱 盐 答案 非金属 酸性氧化物 酸 盐
第二章 元素与物质世界
第1节 元素与物质的分类
1
本节的核心问题:
(1)110多种元素是如何构成几千万种物 质的?元素与物质的关系是怎样的? (2)为了更好地研究物质的性质和用途, 应怎样对物质进行分类? (3)各类物质之间具有怎样的关系?
活动:完成交流研讨
2
交流· 研讨
1.你已学习过许多物质,如金属镁(Mg)、金属铜(Cu)、 金属钠(Na)、氧化镁(MgO)、氯化钠(NaCl)、五水 合硫酸铜(CuSO4· 2O)、碳酸钙(CaCO3)、氯气 5H (Cl2)、氢气(H2)、氧气(O2)、硫酸(H2SO4)等。 ⑴组成这些物质的元素都有哪些? ⑵你知道这些元素还能组成哪些物质?举例说明。 1)若只由一种元素组成,请写出其化学式。
Cu(+1、+2)
Ca(+2)
HCl 2 CCl4 22 CaCl CuCl Cl (-1) MgCl NaCl
C(+2、+4)
H(+1) S(+4、+6)
S (-2)
H2S CS2S CaS CuS MgS Na2
3)若由三种元素组成,请写出其化学式。
Na
Mg Cu Ca
元素与物质的分类

【重点难点】重点:物质的分类及胶体的概念、性质。
难点:物质的分类,单质、氧化物、酸、碱和盐之间的相互关系。
【知识讲解】一、元素与物质的关系:1、元素组成物质:自然界中形形色色的物质都是由元素组成的,由元素组成的物质可能是单质,也可能是化合物。
2、元素在物质中的存在形态元素在物质中的存在形态有两种:游离态和化合态。
(1)游离态:元素以单质存在的形态。
例如:氧气中的氧元素就是以游离态存在。
(2)化合态:元素以化合物存在的形态。
例如:NaOH、Na2CO3中的氧元素就是以化合态存在。
元素的游离态、化合态可以相互转化,如O2与C反应生成CO或CO2,游离态的氧元素变成了化合态氧元素,又如KClO3加热制O2,化合态的氧元素又变成了游离态氧元素。
3、物质种类繁多的原因:(1)同种元素可形成不同的单质。
氧元素能形成O2、O3两种不同单质;碳元素形成金刚石、石墨、C60、C70等多种单质;磷元素能形白磷、红磷等单质。
(2)不同种类的元素形成不同种类的化合物。
大的方面可以分为氧化物、酸、碱、盐,而每种类别物质又可以再细分。
以后还要对物质进行详细分类。
(3)元素种类相同时,也可以组成不同的化合物。
如氮元素、氧元素可以组成N2O、NO、N2O3、NO2、N2O4、N2O5 等多种氧化物,主要就是氮元素的化合价不同,组成了不同种类的氧化物。
另外,有机物中还要出现同分异构体(分子式相同而结构不同的物质)。
以上这些原因都决定了元素种类虽然不多,但可以组成多种多样的物质。
二、物质的分类1、物质分类的方法依据不同的分类标准,可以对物质进行不同的分类。
例如:依据物质中所含物质种类的多少,可以把物质分为混合物和纯净物。
混合物是由两种或多种物质混合而成的物质,纯净物则是由一种物质组成的物质。
对于纯净物,依据所含元素种类的多少,可以划分为单质和化合物,由同种元素组成的纯净物叫单质,由不同种元素组成的纯净物叫化合物。
单质可以再分为金属单质、非金属单质、稀有气体单质。
高三化学一轮复习 元素与物质的分类课件

• 【思路点拨】 (1)将所给11种物质进行分 类→利用图示结合各类物质的性质确定 ①~⑤对应物质。
• (2)注意纯碱为Na2CO3。
• 【解析】 氧化物为Al2O3、Fe2O3、CO、 CO2,酸为H2SO4,碱为NaOH,单质为Al、 Fe、C,纯碱为Na2CO3,烧碱为NaOH, 小苏打为NaHCO3。氧化物①既与酸反应, 又与碱反应,说明该氧化物为两性氧化物,
()
• A.溶液是电中性的,胶体是带电的
• B.通电时,溶液中的溶质粒子分别向两 极移动,胶体中的分散质粒子向某一极移 动
• C.溶液中溶质粒子的运动有规律,胶体 中分散质粒子的运动无规律,即布朗运动
• D.一束光线分别通过溶液和胶体时,后 者会出现明显的光带,前者则没有
• 【解析】 A项,胶粒带电,而胶体是电 中性的。B项,溶液中溶质若是非电解质, 通电时不向两极移动,胶体中分散质粒子 不带电时,不向某一极移动。C项,溶液 中溶质粒子运动也无规律。D项,胶体有 丁达尔效应而溶液没有,故选D。
出各类物质之间的关系。
• 1.金属氧化物一定是碱性氧化物吗?试举 例说明。
• 【提示】 不一定。多数金属氧化物为碱性 氧Al2化O物3为,两如性N氧a2化O等物,;但NaM2On22O为7过为氧酸化性物氧等化。物;
• 二、分散系、胶体 • 1.分散系的分类
• 2.胶体的性质及应用
• (1)丁达尔效应
1.不同标准下的物质分类及相关概念辨析。 2.各类物质关系转化的应用。 3.胶体与其他分散系的区别,胶体性质及其 应用。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
溶液 1nm
胶体
100nm
浊液
一、胶体
定义: (1)定义: 分散质微粒的直径大小在1nm 100nm之间的分 1nm— 分散质微粒的直径大小在1nm—100nm之间的分 散系叫 胶体 性质: (2)性质:
电
泳
说明胶粒 带电
二、胶体的重要性质
【实验】把胶体和溶液分别置于暗处,使一束光射 实验】把胶体和溶液分别置于暗处, 向两杯液体,从侧面观察现象。 向两杯液体,从侧面观察现象。
质 纯 净 物 混 合 物
分 物质 的 是否由同种 组成
根据化合 物的性质
物 质
化 合 物
化物
质 质
化 是否
〖问题2〗 问题2 单质、氧化物、 单质、氧化物、酸、碱、盐之间的关系 【预测1】 预测 】
酸 盐
非金属单质
金属
【预测2】 预测 】
酸
碱性 氧化物
酸性 氧化物
水
【预测3】 预测 】
碱
酸性 氧化物
金属 碱性氧化物 盐 非金属 酸性氧化物
碱
酸
讨论
给物质分类有何意义? 给物质分类有何意义?
☆认识一类物质 ☆制备物质 ☆鉴别物质 ☆提纯物质
第1节 元素与物质的分类
第2课时 一种重要的混合物 胶体 课时 一种重要的混合物—胶体
胶体
联想·质疑 联想 质疑
?
联想 质疑
清晨当太阳升起时, 清晨当太阳升起时,你漫步在茂密的森 林里, 林里,会看到缕缕阳光穿过林木的枝叶铺 洒在地面上. 洒在地面上.你知道为什么会产生这美丽 的景象吗? 的景象吗? 在晚上,当你打开手电筒时, 在晚上,当你打开手电筒时,会看到一 光柱”射向天空或射向远方, 道”光柱”射向天空或射向远方,你知道 这是为什么吗? 这是为什么吗?
二、胶体的重要性质
3、胶体的聚沉 (1)胶体稳定的原因:是由于同种胶粒带有相同的 )胶体稳定的原因: 电荷,它们相互排斥的缘故。 电荷,它们相互排斥的缘故。 (2)胶体的聚沉: )胶体的聚沉: 使胶体粒子聚集长大, 使胶体粒子聚集长大,形成的颗粒较大的沉淀 从分散剂里析出,这个过程叫聚沉。 从分散剂里析出,这个过程叫聚沉。
【预测4】 预测 】
指 示 剂
碱
酸
盐
碱 化
【预测5】 预测 】
碱
【预测6】 预测 】
酸 ቤተ መጻሕፍቲ ባይዱ 盐
金属
碱
通过实验探究和验证: 通过实验探究和验证: 金属、酸性氧化物、碱性氧化物、 金属、酸性氧化物、碱性氧化物、 酸、碱、盐的化学性质
用简图表示单质、氧化物、 用简图表示单质、氧化物、 讨 论 1 酸、碱、盐之间的转化关系
二、物质的分类
交流·研讨 交流 研讨
五 彩 缤 纷 的 铜 世 界 紫红色 黑色 红色 白色 蓝色 绿色 蓝色
Cu
CuO Cu2O CuSO4 CuSO4·5H2O Cu2(OH)2CO3 Cu(OH)2 碱 盐 氧化物
单质
化 合 物
〖问题1〗物质分类的依据 问题 〗
单
物质是否由同 一种分子组成
交流·研讨 交流 研讨
1.你已学习过许多物质,如金属镁(Mg)、金属铜(Cu)、 你已学习过许多物质,如金属镁( )、金属铜( )、 )、金属铜 你已学习过许多物质 金属钠( )、氧化镁( )、氧化镁 )、氯化钠 )、五水 金属钠(Na)、氧化镁(MgO)、氯化钠(NaCl)、五水 )、氯化钠( )、 合硫酸铜( )、碳酸钙 )、氯气 合硫酸铜(CuSO4·5H2O)、碳酸钙(CaCO3)、氯气 )、碳酸钙( )、氢气 氢气( )、氧气 氧气( )、硫酸 硫酸( (Cl2)、氢气(H2)、氧气(O2)、硫酸(H2SO4)等。 ⑴组成这些物质的元素都有哪些? 组成这些物质的元素都有哪些? 你知道这些元素还能组成哪些物质?举例说明。 ⑵你知道这些元素还能组成哪些物质?举例说明。 1)若只由一种元素组成,请写出其化学式。 若只由一种元素组成,请写出其化学式。 若只由一种元素组成
-4
0
C
+2
CO
+4
CO2 CaCO3 Na2CO3 NaHCO3
C
化学式 CH4
〖小结〗 小结〗
一、元素与物质的关系 元素是物质的基本组成成分, ⑴元素是物质的基本组成成分,物质都 是由元素组成的。 是由元素组成的。 同一种元素可以自身组成纯净物—单质 ⑵同一种元素可以自身组成纯净物 单质 ⑶不同种元素相互之间按照一定的规律 可以组成纯净物—化合物 可以组成纯净物 化合物 ⑷由于元素可以按照一定的规律以不同的 种类和不同的方式进行组合, 因而110多 种类和不同的方式进行组合, 因而 多 种元素能够构成庞大繁杂的物质世界。 种元素能够构成庞大繁杂的物质世界。
第1节 元素与物质的分类
第1课时 元素与物质的关系 物质的分类 课时
一、元素与物质的关系
联想·质疑 本节的核心问题) 联想 质疑(本节的核心问题) (1)110多种元素是如何构成几千万种 (1)110多种元素是如何构成几千万种 物质的? 物质的? (2)为了更好地研究物质的性质和用 (2)为了更好地研究物质的性质和用 途,应怎样对物质进行分类?用 应怎样对物质进行分类? 什么样的标准分类? 什么样的标准分类? (3)各类物质之间具有怎样的关系? (3)各类物质之间具有怎样的关系? 各类物质之间具有怎样的关系
CuSO4 溶液 的光学效应
Fe(OH)3 胶体 的光学效应
二、胶体的重要性质
2、电学性质 —— 电泳现象
胶体的U形管的两个 【实验】在盛有红褐色Fe(OH)3胶体的 形管的两个 实验】在盛有红褐色 管口,各插入一个电极。通直流电后, 管口,各插入一个电极。通直流电后,发现阴极附近 的颜色逐渐变深,阳极附近的颜色逐渐变浅。 的颜色逐渐变深,阳极附近的颜色逐渐变浅。 (1)内容:在外加电场作用下, 内容:在外加电场作用下, 胶体粒子在分散剂里向电极 阴极或阳极) (阴极或阳极)作定向移动的 现象,叫做电泳。 现象,叫做电泳。 (2)胶体粒子带有电荷,这 胶体粒子带有电荷, 是因为胶体粒子能够吸附阴离 子或阳离子造成的。 子或阳离子造成的。
1、光学性质 —— 丁达尔现象 内容:光束通过胶体, (1)内容:光束通过胶体,形成光亮的 通路”的现象叫做丁达尔效应。 “通路”的现象叫做丁达尔效应。 用途:用于区别 区别胶体与溶液 (2)用途:用于区别胶体与溶液
自然界中的云、 自然界中的云、雾、烟尘都是胶体, 烟尘都是胶体, 分散质是微小的尘埃或液滴,分散剂是空气。 分散质是微小的尘埃或液滴,分散剂是空气。
Na2SO4 NaOH MgSO3 CuCO 3
Na2SO3 MgCO 3 Cu(OH) 2
CaSO4 CaCO 3
化合物—— 化合物
由两种或两种以上的元素组成的纯净物。 由两种或两种以上的元素组成的纯净物。 元素以化合物的形式存在的状态称为该 元素的化合态 元素的化合态
2 .现有物质:碳单质、一氧化碳、二氧化碳、碳 现有物质: 现有物质 碳单质、一氧化碳、二氧化碳、 酸钙、碳酸( )、碳酸钠 碳酸钠( 酸钙、碳酸(H2CO3)、碳酸钠(Na2CO3). 这些物质中含有哪种相同的元素? ⑴这些物质中含有哪种相同的元素?该元素分别 与哪些元素组成了这些物质? 与哪些元素组成了这些物质? 这种元素常见的化合价为+2、 。 ⑵这种元素常见的化合价为 、+4。在以上物质 分别找出含有这些价态的该元素的物质。 中,分别找出含有这些价态的该元素的物质。 化合价
O (-2)
HCl CCl4 2 CaCl MgCl22 Cl (-1) CuCl NaCl
S (-2)
H2S CS2S CaS CuS MgS Na2
3)若由三种元素组成,请写出其化学式。 )若由三种元素组成,请写出其化学式。
Na Mg Cu Ca
NaClO Na2CO3 MgSO4 Mg(OH)2 CuSO4 Ca(ClO) 2 Ca(OH) 2
碱性 氧化物
水
酸性氧化物与碱性氧化物的辨析 1、常见的碱性氧化物:Na2O、K2O、CaO等 、常见的碱性氧化物: 、 、 等 2、常见的酸性氧化物:CO2、SO2、SO3等 、常见的酸性氧化物: 3、碱性氧化物一定是金属氧化物。 、碱性氧化物一定是金属氧化物。 金属氧化物不一定是碱性氧化物。 金属氧化物不一定是碱性氧化物。 如:Na2O2、Mn2O7等 4、酸性氧化物不一定是非金属氧化物。 、酸性氧化物不一定是非金属氧化物。 如:Mn2O7等。 非金属氧化物不一定是酸性氧化物。 非金属氧化物不一定是酸性氧化物。 如:H2O、CO、NO等 、 等
胶体聚沉后 一般情况下 都生成沉淀
二、胶体的重要性质
Mg、Cu、Na、Cl2、H2、O2 、 、 、
单质———由同种元素组成的纯净物叫单质。 由同种元素组成的纯净物叫单质。 单质 由同种元素组成的纯净物叫单质 元素以单质的形式存在的状态称为该元素的游离态 游离态) 元素以单质的形式存在的状态称为该元素的游离态)
2)若由两种元素组成,会形成哪些物质, )若由两种元素组成,会形成哪些物质, 请写出其化学式。 请写出其化学式。 Na(+1) ( ) Mg(+2) ( ) Cu(+1、+2) ( 、 ) Ca(+2) ( ) C(+2、+4) ( 、 ) H(+1) ( ) S(+4、+6) ( 、 ) Na2O H2O CO 2 SO CaO CuO MgO Na2O2 CO23 SO
元素形成物质的类别和化合物的关系: 元素形成物质的类别和化合物的关系: 1、金属元素: 、金属元素: 单质 → 氧化物 → 碱 → 盐 •在金属单质中,金属元素为0价,在氧化 在金属单质中,金属元素为 价 在金属单质中 盐中,金属元素显正价。 物、碱、盐中,金属元素显正价。 2、非金属元素: 、非金属元素: 氢化物→单质 氢化物 单质 → 氧化物 → 酸 → 盐 •在氢化物中,非金属元素显它的最低价, 在氢化物中,非金属元素显它的最低价, 在氢化物中 在氧化物、 盐中,非金属元素显正价。 在氧化物、酸、盐中,非金属元素显正价。
