高中化学复习知识点:氨与水的反应
高中化学复习知识点:铵盐的不稳定性
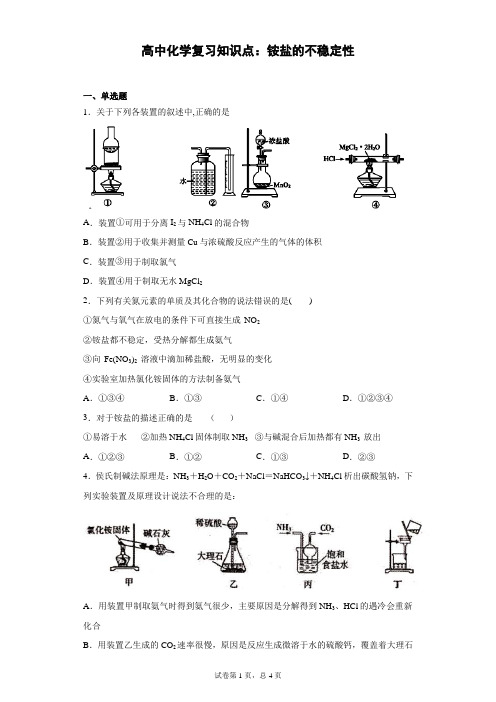
B.用装置乙生成的CO2速率很慢,原因是反应生成微溶于水的硫酸钙,覆盖着大理石的表面
C.用装置丙模拟侯氏制碱法,可以同时通入NH3、CO2,也可以先通氨气再通CO2
D.用装置丁分离得到产品NaHCO3,为得到干燥产品,也可采用减压过滤
【点睛】
本题从燃烧的必要条件以及NH4Cl的性质进行分析。
9.A
【解析】
【详解】
假设有1molNH4HCO3的分解,根据反应NH4HCO3 NH3↑+H2O↑+CO2↑,分解生成的NH3、H2O、CO2物质的量都为1mol;将所产生的气体依次通过Na2O2和浓H2SO4,Na2O2发生的反应为2Na2O2+2CO2=2Na2CO3+O2、2Na2O2+2H2O=4NaOH+O2↑,1molCO2参与反应使固体增重28g、1molH2O参与反应使固体增重2g,则Na2O2增重a=30g,浓硫酸吸收NH3:2NH3+H2SO4=(NH4)2SO4,则浓硫酸增重b=17g;将气体先通过浓H2SO4,再通过Na2O2,浓硫酸吸收NH3和H2O,浓硫酸增重d=17g+18g=35g,Na2O2只发生反应2Na2O2+2CO2=2Na2CO3+O2,1molCO2参与反应使固体增重c=28g;a、b、c、d由大到小的顺序为d>a>c>b,故答案为A。
12.碳酸锰(MnCO3)是理想的高性能强磁性材料,也是制备Mn2O3、MnO2等锰的氧化物的重要原料,广泛用于电子、化工、医药等行业。
(1)工业上制备方程式为:MnSO4+2NH4HCO3=MnCO3↓+ (NH4)2SO4+CO2↑+H2O。反应中通常需加入稍过量的NH4HCO3,且控制溶液的pH为6.8~7.4。加入稍过量的NH4HCO3的目的是_____。
2020届人教版高中化学必修1 最基础考点系列: 考点14 氨的性质含答案

考点14 氨的性质【考点定位】本考点考查氨的性质,涉及氨的结构与物理性质、氨气的还原性及氨水的弱碱性,掌握氨水喷泉实验的操作要点及常见氨气的制备原理与实验装置。
【精确解读】1.氨的物理性质:①氨是无色、有刺激性气味的气体,比空气轻;②氨易液化.在常压下冷却或常温下加压,气态氨转化为无色的液态氨,同时放出大量热.液态氨气化时要吸收大量的热,使周围的温度急剧下降;③氨气极易溶于水.在常温、常压下,1体积水中能溶解约700体积的氨气(因此,氨气可进行喷泉实验);④氨对人的眼、鼻、喉等粘膜有刺激作用.若不慎接触过多的氨而出现病症,要及时吸入新鲜空气和水蒸气,并用大量水冲洗眼睛.2.氨分子的结构:NH3的电子式为,结构式为,氨分子的结构为三角锥形,N原子位于锥顶,三个H原子位于锥底,键角107°18′,是极性分子.3.氨的化学性质:①跟水反应.氨气溶于水时(氨气的水溶液叫氨水),大部分的NH3分子与H2O分子结合成NH3•H2O(叫一水合氨).NH3•H2O为弱电解质,只能部分电离成NH4+和OH-:NH3+H2O⇌NH3•H2O⇌NH4++OH-a.氨水的性质:氨水具有弱碱性,使无色酚酞试液变为浅红色,使红色石蕊试液变为蓝色.氨水的浓度越大,密度反而越小(是一种特殊情况).NH3•H2O不稳定,故加热氨水时有氨气逸出:NH4++OH-=NH3↑+H2Ob.氨水的组成:氨水是混合物(液氨是纯净物),其中含有3种分子(NH3、NH3•H2O、H2O)和3种离子(NH4+和OH-、极少量的H+).c.氨水的保存方法:氨水对许多金属有腐蚀作用,所以不能用金属容器盛装氨水.通常把氨水盛装在玻璃容器、橡皮袋、陶瓷坛或内涂沥青的铁桶里.d.有关氨水浓度的计算:氨水虽然大部分以NH3•H2O形式存在,但计算时仍以NH3作溶质.②跟氯化氢气体的反应:NH3+HCl=NH4C1说明:a.当蘸有浓氨水的玻璃棒与蘸有浓盐酸的玻璃棒靠近时,产生大量白烟.这种白烟是氨水中挥发出来的NH3与盐酸挥发出来的HCl化合生成的NH4C1晶体小颗粒.b.氨气与挥发性酸(浓盐酸、浓硝酸等)相遇,因反应生成微小的铵盐晶体而冒白烟,这是检验氨气的方法之-.c .氨气与不挥发性酸(如H 2SO 4、H 3PO 4等)反应时,无白烟生成.③跟氧气反应:4NH 3+5O 2催化剂 △4NO+6H 2O 说明:这一反应叫做氨的催化氧化(或叫接触氧化),是工业上制硝酸的反应原理之一.4.氨气的用途:①是氮肥工业及制造硝酸、铵盐、纯碱的原料;②是有机合成工业如合成纤维、塑料、染料、尿素等的常用原料;③用作冰机中的致冷剂【精细剖析】1.喷泉实验的原理中学教材中喷泉实验装置如右图所示。
高中化学 氨气的性质用途有哪些注意事项

氨气的性质用途定义:氨气,无机化合物,常温下为气体,无色有刺激性恶臭的气味,易溶于水,氨溶于水时,氨分子跟水分子通过氢键结合成一水合氨(NH3·H2O),一水合氨能小部分电离成铵离子和氢氧根离子,所以氨水显弱碱性,能使酚酞溶液变红色。
氨与酸作用得可到铵盐,氨气主要用作致冷剂及制取铵盐和氮肥。
氨气的化学性质:(1)跟水反应氨在水中的反应可表示为:NH3+H2O=NH3·H2O氨水中存在三分子、三离子分子:NH3.NH3·H2O、H2O;离子:NH4+、OH-、H+;(2)跟酸反应NH3+HNO3==NH4NO32NH3+H2SO4===(NH4)2SO4NH3+HCl===NH4Cl3NH3+H3PO4===(NH4)3PO4NH3+CO2+H2O===NH4HCO3(3)在纯氧中燃烧4NH3+3O2==点燃==2N2+6H2O4NH3+5O2=催化剂加热=4NO+6H2O(氨气的催化氧化)(4)与碳的反应NH3+C=加热=HCN+H2↑(剧毒氰化氢)(5)与水、二氧化碳NH3+H2O+CO2==NH4HCO3该反应是侯氏制碱法的第一步,生成的碳酸氢铵与饱和氯化钠溶液反应生成碳酸氢钠沉淀,加热碳酸氢钠制得纯碱。
此反应可逆,碳酸氢铵受热会分解NH4HCO3=(加热)=NH3+CO2+H2O(6)与氧化物反应3CuO+2NH3==加热==3Cu+3H2O+N2 这是一个氧化还原反应,也是实验室常用的临时制取氮气的方法,采用氨气与氧化铜供热,体现了氨气的还原性。
氨气的物理性质:相对分子质量17.031氨气在标准状况下的密度为0.771g/L氨气极易溶于水,溶解度1:700熔点-77.7℃;沸点-33.5℃固氮:(1)人工固氮工业上通常用H2和N2在催化剂、高温、高压下合成氨最近,两位希腊化学家,位于Thessaloniki的阿里斯多德大学的GeorgeMarnellos和MichaelStoukides发明了一种合成氨的新方法(Science,2Oct.1998,P98)。
高中化学复习知识点:氨的还原性

一、单选题
1.下列关系图中,A是一种正盐,B是气态氢化物,C是单质,F是强酸。当X无论是强酸还是强碱时都有如下转化关系(其他反应产物及反应所需条件均已略去),当X是强碱时,过量的B跟Cl2反应除生成C外,另一产物是盐酸盐。
下列说法中不正确的是()
A.当X是强酸时,A、B、C、D、E、F中均含同一种元素,F可能是H2SO4
8.C
【解析】
【详解】
A.氮气转化为二氧化氮,要两步进行氮气放电生成一氧化氮,一氧化氮再被氧化生成二氧化氮,不能实现甲到丁的一步转化,故A错误;
B.氢氧化钠无法转化过氧化钠,不能实现甲到丁的一步转化,故B错误;
C.Fe在氧气中点燃生成Fe3O4,Fe与盐酸反应生成FeCl2,Fe在氯气中点燃生成FeCl3,FeCl2中通入氯气反应生成FeCl3,各步都可以实现一步转化,故C正确;
D.S无法一步转化为SO3,不能实现甲到丁的一步转化,故D错误;
故答案为C。
9.CD
【解析】
【分析】
A为单质,根据转化关系,A可能为S,B为H2S,C为SO2,D为SO3,E为H2SO4;A可能为N2,B为NH3,C为NO,D为NO2,E为HNO3。
【详解】
A. D不一定是最高价氧化物,比如NO2,故A错误;
C.二氧化硫与氧气常温下不反应,所以气体物的量不变,压强不变,故C选;
D.SO2和H2S发生SO2+2H2S═3S↓+2H2O,气体物质的量减小,压强发生变化,故D不选;
故选:C。
4.B
【解析】
【分析】
【详解】
A.NH3+O2→NO,反应条件是催化剂、加热,故A不选;
B.CH4→CH3Cl,反应条件是光照,故B选;
高三化学复习知识点

高三化学复习知识点高三化学复习知识点一、高中化学实验操作中的七原则掌握下列七个有关操作顺序的原则,就可以正确解答"实验程序判断题"。
1."从下往上"原则。
以Cl2实验室制法为例,装配发生装置顺序是:放好铁架台→摆好酒精灯→根据酒精灯位置固定好铁圈→石棉网→固定好圆底烧瓶。
2."从左到右"原则。
装配复杂装置应遵循从左到右顺序。
如上装置装配顺序为:发生装置→集气瓶→烧杯。
3.先"塞"后"定"原则。
带导管的塞子在烧瓶固定前塞好,以免烧瓶固定后因不宜用力而塞不紧或因用力过猛而损坏仪器。
4."固体先放"原则。
上例中,烧瓶内试剂MnO2应在烧瓶固定前装入,以免固体放入时损坏烧瓶。
总之固体试剂应在固定前加入相应容器中。
5."液体后加"原则。
液体药品在烧瓶固定后加入。
如上例中浓盐酸应在烧瓶固定后在分液漏斗中缓慢加入。
6.先验气密性(装入药口前进行)原则。
7.后点酒精灯(所有装置装完后再点酒精灯)原则。
二、高中化学实验中温度计的使用分哪三种情况?哪些实验需要温度计?1.测反应混合物的温度:这种类型的实验需要测出反应混合物的准确温度,因此,应将温度计插入混合物中间。
①测物质溶解度。
②实验室制乙烯。
2.测蒸气的温度:这种类型的实验,多用于测量物质的沸点,由于液体在沸腾时,液体和蒸气的温度相同,所以只要测蒸气的温度。
①实验室蒸馏石油。
②测定乙醇的沸点。
3.测水浴温度:这种类型的实验,往往只要使反应物的温度保持相对稳定,所以利用水浴加热,温度计则插入水浴中。
①温度对反应速率影响的反应。
②苯的硝化反应。
三、常见的需要塞入棉花的实验有哪些需要塞入少量棉花的实验:热KMnO4制氧气制乙炔和收集NH3其作用分别是:防止KMnO4粉末进入导管;防止实验中产生的泡沫涌入导管;防止氨气与空气对流,以缩短收集NH3的时间。
人教版高中化学必修第2册 第五章 第二节 第2课时 氨和铵盐

1、 实验室制氨气时不用氢氧化钠固体来代替氢 氧化钙固体 2、图中的反应装置和收集装置,应注意哪些问 题反?应装置:试管口向下倾斜
收集装置:导气管插到试管底部
若将棉花换为一个单孔橡皮塞可以吗?
3、装置中收集氨气的试管口的棉花的作用是什 么?你在以前学过的哪个实验中也用过棉花?
1、说明盐酸和浓氨水具有什么性质?
浓盐酸、浓氨水易挥发
2.将蘸有浓氨水和浓硝酸的玻璃棒靠近,
有何现象? 白烟
3.将蘸有浓氨水和浓硫酸的玻璃棒靠近,
有何现象? 无明显现象
写出与酸反应的方程式
NH3 + HCl = NH4Cl NH3 + HNO3 = NH4NO3 2NH3 + H2SO4 = (NH4)2SO4 浓氨水与挥发性酸相遇时均有白烟生成。
探究一:铵盐的性质
(1)实验探究: 实验操作
实验现象
结论
加热氯化铵固体
加热氯化铵固体的实验
加热碳酸氢铵固体
加热碳酸氢铵固体的实验
①试管中固体
氯化铵固体受热分解,
逐渐消失,
②试管口有白 色固体生成 ①试管中固体逐渐消
生成的NH3和HCl在试 管口反应生成N生成; ③石灰水变浑浊
实质: NH3 + H+ == NH4+
氨气是一种碱性气体,它能使湿润的红色石蕊试纸变蓝。
③与O2反应 ( 氨的催化氧化)
氨中氮元素化合价为最低价,具有还原性,
能与具有氧化性的物质发生反应。
高温 4NH3 + 5O2 催化剂 4NO + 6H2O
氨的催化氧化(工业制硝酸的一步)
?氧化剂、还原剂分别是?转移电子数为?
高中化学精讲氨、铵盐

高中化学58个考点精讲24、氨、铵盐1.复习重点1.氨的分子结构、性质和制取2.铵盐的结构、性质和用途3.氨和铵盐的检验2.难点聚焦一.氨1.氨的结构、性质和用途(1)氨的结构:电子式:结构式:空间构型:三角锥形;NH3是极性分子。
(2)物理性质:无色有特殊剌激性气味的气体,极易溶于水,常温常压下1体积水能溶解700体积的NH3。
(3)化学性质:①与水反应:NH3+H2O NH3·H2O NH4++OH―NH3是唯一能使湿润的红色石蕊试纸变蓝的气体,常用此性质检验NH3。
②与酸的反应:NH3+HCl=NH4Cl(生成白烟)NH3+CO2+H2O=NH4HCO3③与氧化剂反应:4NH3+3O24NO+6H2O2NH3+3CuO N2+3Cu+3H2O 8NH3+3Cl2= N2 + 6NH4Cl2.氨的实验室法:用铵盐与碱共热2NH4Cl+C a(O H)2C a C l2+2N H3↑+2H2O①发生装置:固+固+加热型。
与制备O2和CH4气体相似;收集NH3用向下排空气法收集。
②检验:a.用润湿的红色石蕊试纸检验;b.用沾有浓盐酸的玻璃棒检验,产生白烟。
③干燥:不能用CaCl2、P2O5、浓硫酸作干燥剂,因为NH3能与CaCl2反应生成CaCl2·8NH3。
P2O5与浓硫酸均能与NH3反应,生成相应的盐。
所以NH3通常用碱石灰干燥。
3.氨的工业制法N2+3H2 2NH3一.铵盐(1)结构:离子晶体,具有离子键、共价键和配位键,是由非金属元素组成的离子化合物。
(2)物理性质:都是晶体,都易溶于水。
(3)化学性质①不稳定性:铵盐受热易分解NH4Cl NH3+HCl NH4HCO3NH3↑+CO2↑+H2ONH4NO3受热分解较复杂:NH4NO3N2O+2H2O 2NH4NO32N2↑ +O2↑+4H2O②与碱反应NH4++OH― NH3·H2O 或NH4++OH―NH3↑+H2O③水解反应:NH4++H2O NH3·H2O+H+(4)用途:可用作氮肥,炸药,焊药。
高中化学复习知识点:氨水

一、单选题
1.下列叙述错误的是( )
A.金属被腐蚀,就是金属原子失去电子被氧化的过程
B.与金属反应时,稀HNO3可能被还原为更低价态,则稀HNO3氧化性强于浓HNO3
C.一水合氨易分解,在实验室里浓氨水密封保存在无色试剂瓶中,并放在阴凉通风处
D.硫在纯净氧气中燃烧,产生明亮的蓝紫色火焰
2.向一支试管中注入某红色溶液,将试管加热,溶液红色逐渐变浅,则原溶液可能是
①滴有石蕊的(NH4)2SO4溶液;②滴有酚酞的氨水;③滴有石蕊的盐酸;④滴有酚酞的Na2CO3溶液
A.①④B.②③C.①③D.②④
3.下列离子方程式中,正确的是
A.向氯化铝溶液中加入过量氨水Al3++ 4NH3·H2O → AlO2-+ 4NH4++ 2H2O
6.用图中所示的装置进行实验,实验现象与预测不一致的是
①中的物质
②中的物质
预测现象
A
浓氨水
FeCl3溶液
②中有红褐色沉淀
B
浓氨水
浓盐酸
③中有白烟
C
浓硝酸
淀粉KI溶液
②中溶液为蓝色
D
饱和亚硫酸溶液
蓝色石蕊试液
②中溶液先变红又褪色
A.AB.BC.CD.D
7.“封管实验”具有简易、方便、节约、绿色等优点。观察下列四个“封管实验”(夹持装置未画出),判断下列说法正确的是
酸性:醋酸>碳酸>苯酚
A.AB.BC.CD.D
三、综合题
11.火箭燃料偏二甲肼(CH3)2N-NH2与NO2反应放出巨大的能量,能把500t以上的仪器设备送入太空,这是液体推进剂的优点。
(1)液态偏二甲肼(CH3)2N-NH2与氨气性质相似,易溶于水显弱碱性。易溶于水的原因是_______,写出溶于水后的电离方程式______________。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
③NH3和N2:NH3与水互溶,而N2不溶于水,所以剩余气体体积为原来的 ;
综上所述可知:V1>V3>V2,
故选B。
5.B
【解析】
【分析】
【详解】
A.②中氨水显碱性,使酚酞变红,加热时,氨气逸出,②中颜色为无色,冷却后氨气溶解②中为红色;加热时,①溶液变红,冷却后二氧化硫使品红溶液褪色,变为无色,故A错误;
(5)标准状况下,在三个容积相同的干燥的烧瓶中,甲瓶装入干燥纯净的NH3,乙瓶装入含四分之一体积空气的HCl,丙瓶装入NO2和O2(体积比为4:1),以水为溶剂作喷泉实验。实验结束后三个烧瓶中溶液的物质的量浓度之比为______________,丙瓶中发生反应的总化学方程式为______________________。
(3)该装置存在明显缺陷,应在上述装置最后连接一个尾气吸收装置,你认为可选用____(填序号)。
a. b. c. d.
参考答案
1.B
【解析】
【详解】
A.该过程涉及的化学方程式有: , ,A错正确;
B. Fe在Cl2中燃烧,只会生成FeCl3,B错误;
C.该过程涉及的化学方程式有:Al3++3OH-=Al(OH)3↓,Al(OH)3+OH-=AlO2-+2H2O,C正确;
A.加热③时,溶液红色褪去,冷却后又变红色,体现SO2的漂白性
B.加热②时,溶液红色变浅,可证明氨气的溶解度随温度的升高而减小
C.加热①时,上部汇集了NH4Cl固体,此现象与碘升华实验现象相似
D.三个“封管实验”中所涉及到的化学反应不全是可逆反应
二、综合题
11.(1)把下列式子改成氧化物形式
①正长石(KAlSi3O8)__________________;
6.下列气体与对应的液体不易产生喷泉现象的是
A.
B.
C.
D.
气体
Cl2
HCl
NH3
SO2
液体
H2O
NaOH
H2O
NaOH
A.AB.BC.CD.D
7.下列说法中正确的是( )
A.氨水的密度比水的密度小,且浓度越大,密度越大
B.氨气是无色无味的气体
C.可用向上排空气法收集氨气
D.氨气溶于水所得的溶液可使酚酞试液变为红色
2.用人工方法在舞台上制造云雾缭绕的幻境的方法是
A.燃烧白磷B.燃烧镁粉C.使用干冰D.同时喷晒浓盐酸和浓氨水
3.下列实验过程中,始终无明显现象的是()
A.HCl通入Fe(NO3)2溶液中B.SO2通入溴水中
C.NH3通入CuSO4溶液中D.CO2通入Ba(NO3)2
4.同温同压下,在3支相同体积的试管中分别充有等体积混合的2种气体,它们是①NO和NO2,②NO2和O2,③NH3和N2。现将3支试管均倒置于水槽中,充分反应后,试管中剩余气体的体积分别为V1、V2、V3,则下列关系正确的是
II.甲同学设计了下图所示实验装置(部分夹持仪器未画出),探究氨气的还原性并检验产物。
实验现象为:黑色CuO变为红色,白色无水CuSO4粉末变为蓝色,同时生成一种无色、无污染的气体。
(1)写出氨气与CuO反应的化学方程式_____________________________。
(2)碱石灰的作用是__________________________________。
【解析】
【分析】
(1)硅酸盐由盐的书写改写为氧化物的形式:一般方法归纳为:碱性氧化物、两性氧化物、酸性氧化物、水,(xMO•nSiO2•mH2O)。注意:①氧化物之间以“•”隔开;②系数配置出现的分数应化为整数;③金属氧化物在前(活泼金属氧化物→较活泼金属氧化物),非金属氧化物在后,若同一元素有变价,那么低价在前,高价在后,H2O一般写在最后,以此解答该题;
D.可逆反应应在同一条件下进行。
【详解】
A.二氧化硫与有机色素化合生成无色物质而具有漂白性,受热又分解,恢复颜色,所以加热时,③溶液变红,冷却后又变为无色,故A错误;
B.加热时氨气逸出,②中颜色为无色,冷却后氨气溶解②中为红色,可证明氨气的溶解度随温度的升高而减小,故B正确;
C.加热时,①上部汇集了固体NH4Cl,是由于氯化铵不稳定,受热易分解,分解生成的氨气遇冷重新反应生成氯化铵,此现象与碘升华实验现象相似,故C正确;
8.已知氨气极易溶于水,而难溶于有机溶剂CCl4.下列装置中不适宜做氨气的尾气吸收的是( )
A. B. C. D.
9.下列气体溶于水,所得溶液呈碱性的是
A.NH3B.NO2C.SO2D.SO3
10.“封管实验”具有简易、方便、节约、绿色等优点,下列关于三个“封管实验”(夹持装置未画出)的说法错误的是
D.氨气与水的反应是可逆的,可逆反应应在同一条件下进行,题中实验分别在加热条件下和冷却后进行,不完全是可逆反应,故D正确;
故答案选A。
【点睛】
本题注意“封管实验”的实验装置中发生的反应分别在加热条件下和冷却后进行,不一定是可逆反应,要根据具体的化学反应进行判断。
11.K2O·Al2O3·6SiO23MgO·2SiO2· 2H2O同素异形体同位素加热至不再产生气体为止加过量盐酸后过滤、洗涤加溴水或酸性高锰酸钾溶液3Ag+4H++NO3-=3Ag++NO↑+2H2OPbO2+4HCl(浓)=PbCl2+Cl2↑+2H2O5:5:44NO2+O2+2H2O=4HNO3
A.V1>V2>V3B.V1>V3>V2C.V2>V3>V1D.V3>V1>V2
5.“封管实验”具有简约、绿色等优点。关于下列“封管实验”说法正确的是
A.加热时,①②溶液均变红,冷却后又都变为无色
B.④中浸泡在热水里的容器内的气体颜色变深
C.四个“封管”中所发生的化学反应都是可逆反应
D.③受热时上部汇集的仍然是氯化铵固体,说明氯化铵的热稳定性较好
D.CO2和Ba(NO3)2不反应,无明显现象,D符合题意;
答案选D。
【点睛】
D.假设CO2和Ba(NO3)2溶液反应,那么产物为BaCO3和HNO3,弱制强,不可能,故CO2和Ba(NO3)2溶液不反应。
4.B
【解析】
【分析】
【详解】
①NO和NO2:1体积NO2与水反应生成 体积的NO,即试管中,剩余气体体积为原来的 + × = ;
气体与液体极易反应,或气体极易溶于水,均可发生喷泉实验。
7.D
【解析】
【详解】
A.氨水的密度小于水,浓度越大密度越小,故A错误;
B.氨气是无色有刺激性气味的气体,故B错误;
C.氨气的密度小于空气,故应该用向下排空气法来收集,故C错误;
D.氨气溶于水,与水反应生成NH3·H2O,一水合氨电离,NH3+ H2O NH3·H2O NH4++OH-,所得的溶液显碱性,可使酚酞试液变为红色,故D正确;
D.该过程涉及的化学方程式有:2NH3·H2O+SO2=(NH4)2SO3+H2O,NH3·H2O+SO2=NH4HSO3,D正确;
故合理选项为B。
2.C
【解析】
【分析】
干冰为固态二氧化碳,升华时吸收大量的热,易使空气中的水凝结呈雾,结合其它物质的性质解答。
【详解】
A、白磷有剧毒,不适合用于舞台,故A错误;
B、镁粉燃烧剧烈,出发耀眼白光,创造不出所需环境,故B错误;
C、干冰挥发吸收大量热,使空气中水分凝结成雾,故C正确;
D、浓盐酸、浓氨水皆能挥发出刺激性气味气体,且二者反应有白烟,不宜应用于舞台,故D错误;
答案选C。
【点睛】
本题考查元素化合物的性质,注意适用于舞台的物质应无毒,对人体无害。
3.D
【解析】
高中化学复习知识点:氨与水的反应
一、单选题
1.研究反应物的化学计量数与产物之间的关系时,使用类似数轴的方法可以收到的直观形象的效果。下列表达不正确的是()
A.密闭容器中CuO和C高温反应的气体产物:
B.Fe在Cl2中的燃烧产物:
C.AlCl3溶液中滴加NaOH后铝的存在形式:
D.氨水与SO2反应后溶液中的铵盐:
12.I.实验室制取氨气的常见方法如下:
方法
装置
①
氯化铵与熟石灰固体混合加热
____②Βιβλιοθήκη 浓氨水加热____③
浓氨水滴加到固体烧碱上
____
(1)方法①的化学方程式为__________________________________。
(2)依据表中所列方法,从下图中选择合适的发生装置并将其序号填入表中装置栏中。
C.氨气极易溶于水,玻璃管插入水中会产生倒吸,故C符合题意;
D.球形漏斗可以防止倒吸,可用于吸收氨气尾气,故D不合题意;
故选C。
9.A
【解析】
【详解】
A.氨气溶于水发生NH3+H2O⇌NH3•H2O⇌NH4++OH-,溶液呈碱性,故A正确;
B.NO2溶于水,和水反应生成硝酸和NO,溶液呈酸性,故B错误;
C.SO2溶于水发生SO2+H2O⇌H2SO3⇌HSO3-+H+,溶液呈酸性,故C错误;
D.SO3和水反应生成硫酸,溶液呈酸性,故D错误;
故选A。
10.A
【解析】
【分析】
A.依据二氧化硫的漂白原理和漂白效果不稳定性解答;
B.加热时氨气逸出,②中颜色为无色,冷却后氨气溶解②中为红色;
C.氯化铵不稳定,受热易分解,分解生成的氨气遇冷重新反应生成氯化铵;
【分析】
【详解】
