环烷烃的结构通式
环烷烃的通式为

环烷烃是一类重要的有机化合物,它们由碳和氢原子构成的环状结构使它们具有独特的性质和广泛的应用。
本文将从分子结构、物理性质、合成方法、应用等多个方面对环烷烃进行全面探讨。
环烷烃的通式环烷烃是由碳和氢原子组成的环状化合物,其通式可表示为CnH(2n)。
分子结构环烷烃分子由碳原子构成的环状结构连接而成,每个碳原子上都有两个氢原子连接,形成CH键。
在环状结构中,碳原子之间还存在着C-C键的连接,使整个分子稳定性增强。
物理性质1.熔点和沸点:环烷烃的熔点和沸点随着分子量的增加而增加,在相同条件下,分子量较大的环烷烃具有较高的熔点和沸点。
2.密度:环烷烃的密度一般较小,它们在水中的溶解度较低,但是在有机溶剂中的溶解度较高。
3.稳定性:环烷烃分子由于碳原子之间的C-C键连接,使得分子结构稳定,不易发生化学反应。
合成方法环烷烃的合成方法多种多样,常用的有以下几种:烷基化反应烷基化反应是环烷烃的一种重要合成方法。
它是通过将烷基卤化物与饱和烃反应,生成环烷烃。
此反应常在酸性条件下进行。
磷酸酯缩合反应磷酸酯缩合反应是合成环烷烃的一种重要方法。
该反应利用酸性条件下磷酸酯的缩合反应,生成环烷烃。
环加成反应环加成反应是通过环状有机化合物与不饱和化合物之间的加成反应生成环烷烃。
该反应在酸性或碱性条件下进行。
脱水反应脱水反应是一种常用的合成环烷烃的方法。
该反应是通过使醇或卤代烷脱水生成烯烃,再将烯烃加氢生成环烷烃。
应用环烷烃在化工、医药、化妆品等领域具有广泛的应用:化工领域环烷烃在化工领域中可用作溶剂、润滑剂、添加剂等。
由于其稳定性和较低的毒性,环烷烃被广泛应用于涂料、油漆、塑料等化学产品的生产中。
医药领域环烷烃在医药领域中可用作药物合成的中间体。
许多药物的合成都离不开环烷烃,它具有较好的生物稳定性和药效,广泛应用于药物研发和生产过程中。
化妆品领域环烷烃在化妆品领域中可用作护肤品的成分。
环烷烃具有较好的渗透性和保湿性,在化妆品中常用作保湿剂、防晒剂等。
第二章 烷烃和环烷烃

支链烷烃: (CH3)2CH
(CH3)3C
称异(iso )某烷 称新(neo )某烷
6
CH3CH2CH2CH2CH3 CH3(CH2)10CH3 CH3CHCH2CH2CH3 CH3 CH3 CH3CCH2CH3 CH3
正戊烷(n-pentane) 正十二烷(n-dodecane) 异己烷(i-hexane)
CH3CH2CH2CH2 CH3CH2CHCH3 (CH3)2CHCH2 (CH3)3C
异戊基(iso-pentyl): (CH3)2CHCH2CH2
9
2.系统命名法命名原则
(1)选主链 :选择最长碳链作为主链称某烷 (2)编号:从靠近支链一端进行编号 (3) 在母体名称前写明取代基的名称、位次及数目 ①相同取代基合并 ②不同取代基按次序规则:优先基团后列出 甲基 <乙基 <丙基 <丁基 < 戊基 <己基 < 异戊基 < 异丁基 <异丙基 <叔丁基
燃烧热:在标准状态下,一摩尔烷烃完全燃烧 所放出的热量。单位:kJ/mol 燃烧热的差别反映了化合物内能的高低和稳定 性的大小。
32
内能越高,燃烧热越大; 内能越低,燃烧热越小。
直链烷烃比支链烷烃的燃烧热大,例如:
H
(kJ/mol)
正丁烷 2878.2
异丁烷 2869.8
33
环烷烃中,因它们的分子组成不同,但可比较 它们环中一个CH2的燃烧热环烷烃分子内能大 小和相对稳定性。
CH3CH2CH2CH3 CH3CHCH3 CH3
正丁烷 n-butane bp -0.5℃ C5H12: C6H14: 三种 五种
异丁烷 i-butane bp -11.7℃
环烷烃

• 环烷烃的化学性质
加氢
与卤素反应
+ Cl2
hv
+ Br2 300 ℃
Cl + HCl
Br + HBr
与氢卤酸反应
+HI +HI CH3 +HI
CH3CH2CH2I
CH3CH2CH2CH2I I
CH3CHCH2CH3
反应活性次序 :
• 第三章习题 • 1-1,2,4,5,6 • 3-1,2,5 •5 • 6-1,2,4,5 • 10-1
CH3 CH3
CH3 CH3
优势构象
多取代环己烷有不同取代基时,体积较大 的取代基在e键为优势构象
CH3
CH3
(CH3)2CH
CH(CH3)2
(CH3)2CH
CH3
优势构象
(CH3)2CH
CH3
CH3
(CH3)2CH
优势构象
(CH3)2CH CH3
• 思考题: 写出反-1-甲基-3-叔丁基环己烷的优势构象。
4
315
2
6
a键和e键:
6个a键
6个e键
• a键和e键的转换
H 5H 4H 3
H
H6 1 H2
4 5
3
6
2 1
• 取代环己烷的稳定构象
单取代环己烷一般以取代基在e键的 构象为优势构象
H
5H
4
3
HH
C
H
61
室温
2
4
3
5
2
6
CH3
1
CH3
H
多取代环己烷一般以取代基在e键较多者为 优势构象
CH3 CH3
第二章 第二节环烷烃
纽曼投影式
透视式
环己烷的椅型构象
(2) 船型构象
• 所有键角也接近 所有键角也接近109.5°,故也没有角 ° 故也没有角 张力.但相邻 但相邻C-H键却并非全是交叉 张力 但相邻 键却并非全是交叉 以及C-5和 的.C-2和C-3上的 C-H 键,以及 和 上的 以及 和 C-6上的 C-H键都是重叠式的 键都是重叠式的. 上的 键都是重叠式的 • C-1和 C-4上两个向内伸的 由于距 上两个向内伸的H由于距 和 上两个向内伸的 离较近而相互排斥,也使分子的能量 离较近而相互排斥 也使分子的能量 有所升高. 有所升高
取代基在e键上的构象较稳定 取代基在 键上的构象较稳定. 键上的构象较稳定 • 若有多个取代基 往往是 e 键取代基最多的构象最稳 若有多个取代基,往往是 取代基最多的构象最稳 定. • 若环上有不同取代基 则体积大的取代基连在 e键上 若环上有不同取代基,则体积大的取代基连在 键 的构象最稳定. 的构象最稳定 二甲基环己烷, 例1: 1,2-二甲基环己烷,顺式如下: 二甲基环己烷 顺式如下: •同一平面上的比较 同一平面上的比较. 同一平面上的比较 •在同侧为顺, a,e 在同侧为顺 在同侧为 •在异侧为反.a,a;e,e. 在异侧为反 在异侧为 •反式 反式(e,e)比顺式的稳定 (a,a)实际上不存在(能量太高) 比顺式的稳定. 反式 比顺式的稳定 )实际上不存在(能量太高)
5 2 3 4
1,2-二甲基环戊烷 二甲基环戊烷
• 例2:
例3:
1-甲基 乙基环己烷 甲基-3-乙基环己烷 甲基
1,1,4-三甲基环己烷 三甲基环己烷
**小取代基为 位. 小取代基为1位 小取代基为
环烷的顺反异构: 环烷的顺反异构 由于碳原子连接成环,环上 单键不能自由旋转. 由于碳原子连接成环 环上C-C单键不能自由旋转 环上 单键不能自由旋转 只要环上有两个碳原子各连有不同的原子或基团, 只要环上有两个碳原子各连有不同的原子或基团 就有构型不同的顺反异构体. 就有构型不同的顺反异构体 例: 1,4-二甲基环己烷 二甲基环己烷
2-第二章饱和烃:烷烃和环烷烃

稳定
下 降
17 稳定
2、结构与环的稳定性 、
⑴ 环丙烷的结构与稳定性 成键分析: 成键分析: 环丙烷分子中的碳为SP3杂化 环丙烷分子中的碳为 但其键角却为105.50,偏离了正常键角109.50;其成键电子云也不在 但其键角却为 偏离了正常键角 碳碳连线上,所形成的键为香蕉键或叫弯曲键;该键的特点是:轨 碳碳连线上,所形成的键为香蕉键或叫弯曲键;该键的特点是: 道交叠少,能量高,键弱。 道交叠少,能量高,键弱。 不稳定的原因: 不稳定的原因: ①角张力:键角偏离正常键角而引起的张力。 角张力:键角偏离正常键角而引起的张力。 ②扭转张力:由于构象是重叠式而引起的张力。 扭转张力:由于构象是重叠式而引起的张力。 总张力能:环烷烃比相同碳数的开链烷烃高出的能量。 总张力能:环烷烃比相同碳数的开链烷烃高出的能量。总张力能 来源 于角张力和扭转张力等。总张力能越大,环烷烃 于角张力和扭转张力等。总张力能越大, 越不稳定,越易开环。 越不稳定,越易开环。
烷烃的通式: 环烷烃的通式: 烷烃的通式 CnH2n+2,环烷烃的通式 CnH2n。 具有同一通式,组成上相差CH2及其整倍数的一系列化合物, 具有同一通式,组成上相差 及其整倍数的一系列化合物, 称为同系列。同系列中的各个化合物互为同系物。 称为系差 系差。 称为同系列。同系列中的各个化合物互为同系物。 CH2称为系差。 同系列 同系物 同系物具有类似的化学性质。 同系物具有类似的化学性质。
CH 3 CH 3 CHCH 3
(b)从靠近支链的一端(或按“最低系列”规则)编号 从靠近支链的一端(或按“最低系列”规则) 从靠近支链的一端
1 2 3 4 5 6 7
1
2
3
4
5
6
环烷烃

a键
e键
(3) 相邻两组a键伸展方向相反,一个向上,一个向下,e 键也如此。
a a
e e
e a
a e
e e a a
1
2
3
4
a
e
a 和e键的关系不清晰
5 a 和e 键的关系清晰
3.构象翻转:
Year 1883
Name of scientist Baeyer
1890 H.Sachse 1915-1918 W.M.Mohr
1920
1943 O.Hassel
1950 D.Barton
Point of view
Assumes that six carbon atoms are on the same plane
当环己烷由一种椅式构象翻转为另一种椅式构象时,原
来的a键变成e键,原来的e键变成a键。由于六个碳上连接的 都是氢原子,所以两种椅式构象完全等同。
5
61
43
2
456 3 21
O
O
O
O O O
4O
O1 O
O O
4O O
O O
O
O
O
环上原子或基团的空间关系保持。
O
O O O
O1 O
二. 取代环己烷的构象
3.3 环的张力
一、Bayer’s张力学说
Assumption: 1 成环的碳原子均在同一同面上,且呈正多边形 2 碳原子采取sp3杂化形式,正常键角应为约109.5度 3 为了满足平面正多边形的内角要求,成环的键必须向内或向
第二章 饱和烃:烷烃和环烷烃

3
5
CH
3
HC CH
4
CH
烷烃:饱和开链烃。 特征:C与C以单键相连,其余价键都为氢原子饱和。 通式为:CnH2n+2
环烷烃:饱和环烃。 特征:C与C以单键相连成环,其余价键都为氢 原子饱和。 通式为:CnH2n (单环烷烃)
烷烃和环烷烃统称为饱和烃
烷烃和环烷烃主要存在于石油和天然气中, 天然气主要由甲烷以及少量的乙烷、丙烷和丁烷 组成。石油是一种复杂混和物,主要是含1到40个 碳原子的烃,通过精馏可以将石油分离成沸点不 同的有用馏分。 天然气: 汽油: 煤油: 柴油: 沥青: CH4~C4H10 C5H12~C12H26 C12H26~16H34 C15H32~C18H38 C20以上
烷基自由基
伯
仲
叔
烷基自由基的类型
烷基自由基的结构
烷基自由基的稳定性:叔〉仲〉伯
烷基自由基的稳定性与C-H的均裂能有关:
CH3CH2CH2-H
离解能 (kJ/mol) 410
(CH3)2CH-H (CH3)3C-H
397 381
在烷烃氯化反应中,产生烷基自由基的步骤 是整个反应中最困难的一步。是控制反应速度的 步骤。生成的烷基自由基越稳定,所需的活化能 越小,反应越容易。
CH3CH2CH2CH2CH2CH3
正己烷
(CH3)2CHCH2CH2CH3
异己烷
(CH3)3CCH2CH3
新己烷
• 系统命名法:
采用IUPAC(International Union of Pure and Applied Chenistry)国际纯粹与应用化学联合会的命 名原则,结合我国文字特点制定的。
键旋转引起的位能变化曲线
2.烷烃和环烷烃

③ 写出少二个碳原子的直链式为主链
CH3 H3C C CH3
CH3
新戊烷
第一节 分类、构造异构和碳原子的级
烃:仅由C、H两种元素组成的化合物。
烷烃 脂肪烃 烯烃 烃 脂环烃 炔烃
芳香烃
(2)单环烷烃的构造异构 环的大小和环上取代基的不同而引起的异构; 与单烯烃互为异构。
C4H8
H2C C CH3 CH3
e
四、环己烷的构象
1、椅式、船式和扭船式构象 角偏差(α) = (109.5o-120o) / 2=-5.25o 较大。
通过环内C-Cσ键旋转,调整其内角接近109.5o, 使完全无角张力——椅式和船式构象。
(1)椅式构象
H
H
H
5
H
6
H
1
H
4
3H
H
H
2
H
H
① 无角张力。
② C1、C3、C5上或C2、C4、C6上处于竖直向上或 向下的三个氢原子间距离为2.3Å,约等于氢原子范 德华半径之和(2.5Å)——无范德华排斥力(跨环张力)。
把支链作为取代基。
1、常见的烷基: 相应的烷烃去掉一个氢原子后留下的原子团。
通式:CnH2n+1
常以 R- 表示
甲基(Me)—— CH3乙基(Et) —— C2H5-
异丙基(i-Pr)—— H3C CH
CH3
正丁基(n-Bu)—— CH3CH2CH2CH2-
异丁基(i-Bu)—— H3C CH CH2
一、烷烃的结构
结构
C:sp3 Csp3-Hs Csp3-Csp3 σ键
1、σ键:轴向重叠形成的共价键(头碰头), 呈圆柱形轴对称。
2、σ键特性 ① 原子轨道轴向重叠(重叠程度大,键较牢固)。 ② 成键轨道呈轴对称,可“自由旋转”。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
环烷烃的结构通式
环烷烃是一类分子中含有环状碳结构的有机化合物。
其中,碳原子按照一定的方式连接形成了环状结构。
环烷烃的通式可以表示为CnH2n,其中n代表碳原子数。
根据碳原子数的不同,环烷烃可以分为多个系列,每个系列的特点和应用都有所不同。
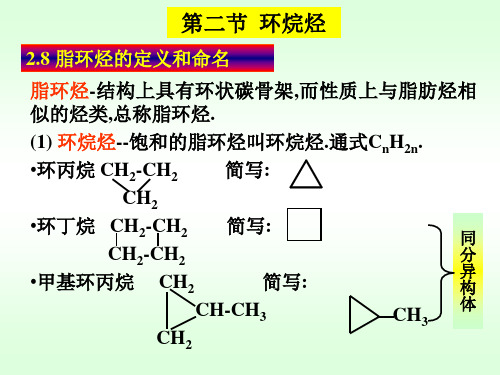
我们来看看最简单的环烷烃——环丙烷。
环丙烷是由三个碳原子组成的环状分子,其化学式为C3H6。
由于环丙烷的分子结构中没有任何取代基或双键,因此它是一种饱和的烷烃。
环丙烷常用作溶剂和燃料。
接下来,我们来看看四碳环烷烃——环丁烷。
环丁烷的化学式为C4H8,它是由四个碳原子组成的环状分子。
环丁烷也是一种饱和的烷烃,常用作燃料和溶剂。
在五碳环烷烃中,最常见的是环戊烷。
环戊烷的化学式为C5H10,它是由五个碳原子组成的环状分子。
环戊烷是一种无色液体,具有较低的沸点和熔点,常用作溶剂和反应物。
六碳环烷烃中,最常见的是环己烷。
环己烷的化学式为C6H12,它是由六个碳原子组成的环状分子。
环己烷是一种无色液体,具有较低的沸点和熔点,常用作溶剂和反应物。
七碳环烷烃中,最常见的是环庚烷。
环庚烷的化学式为C7H14,它是由七个碳原子组成的环状分子。
环庚烷也是一种无色液体,具有较低的沸点和熔点,常用作溶剂和反应物。
八碳环烷烃中,最常见的是环辛烷。
环辛烷的化学式为C8H16,它是由八个碳原子组成的环状分子。
环辛烷是一种无色液体,具有较低的沸点和熔点,常用作溶剂和反应物。
九碳环烷烃中,最常见的是环壬烷。
环壬烷的化学式为C9H18,它是由九个碳原子组成的环状分子。
环壬烷也是一种无色液体,具有较低的沸点和熔点,常用作溶剂和反应物。
十碳环烷烃中,最常见的是环癸烷。
环癸烷的化学式为C10H20,它是由十个碳原子组成的环状分子。
环癸烷是一种无色液体,具有较低的沸点和熔点,常用作溶剂和反应物。
除了以上所述的环烷烃,还存在着更多碳原子数较大的环烷烃。
它们的结构和性质也各不相同,但都具有环状结构。
总结起来,环烷烃是一类碳原子按照环状连接形成的有机化合物。
根据碳原子数的不同,环烷烃可以分为多个系列,每个系列的特点和应用也不尽相同。
研究环烷烃的结构和性质,对于认识有机化学的基本原理和应用具有重要意义。
