羧酸羧酸衍生物取代酸
合集下载
羧酸及其衍生物和取代酸

O R1 C NH2 NH3
3.氨解:产物为酰胺。
O R1 C Cl NH4Cl
O R1 C O
O C R2 R4 R3 N H O R1 C R4 N R3 +
O R2 C ONH4
O R1 C O R2 R 2 OH
O R1 C NH2 NH3
4.克莱森(Claisen)缩合反应:得到β-羰基酯 例如:
⑷ 酰胺的生成:
O R 1 C OH O O
+
NH3
R 1 C O NH4
△ -H2O
O
R 1 C O─NH2
△ -H2O
R1 C
+H2O N
R 1 C NH2
二元酸也有上述反应。 3.还原:用催化氢化法(H2/Pt)难以还原,LiAlH4可以还原羧基为羟基。
O R C OH LiAlH4 R CH2 OH
O CH2 CH2 C O Cl
PCl5 H3C ( CH 2) 6 COOH H3C ( CH 2) 6 C Cl
⑶ 酯的生成:
O R1 COOH
+
R2 OH
浓 H2SO4
△
R1 C
O
R2
+H2O
上述反应为可逆反应。提高反应速度的措施有两个: a 加入酸作为催化剂; b 升高温度。 提高反应的产率的措施有两个:a 增加反应物醇(一方面是因为副反应主要 来自于醇另一方面是因为醇相对于酸来说较为便宜);b 移去产物,使平衡向 右移动。
名称(俗名) 熔点 沸点 溶解度(克/100克水) PKa
甲酸(蚁酸) 乙酸(醋酸) 苯甲酸(安息香酸) 乙二酸(草酸) 丙二酸(缩苹果酸) 丁二酸(琥珀酸) 顺丁烯二酸(马来酸) 反丁烯二酸(延胡索酸) 邻苯二甲酸(酞酸)
羧酸、羧酸衍生物和取代羧酸

O RCHX C X + HX
O RCHX C X + RCH2COOH
O RCHXCOOH + RCH2C X
生成的一卤代物还可以被进一步卤代,直至所有-H的
全部被取代
43
羧酸的化学性质
应用
生成的α-卤代酸可以转化成各种取代酸:
BrCH2-COOH NaOH
BrCH2COONa NaCN NCCH2COONa
酸性
成-消除
(表现为羟基的
取代)
O
RC COH
H
还原成 CH2
α–H 反应
脱羧反应
14
羧酸的化学性质
酸性
在水溶液中
一般羧酸属弱酸,但比碳酸强,所以可以分解碳酸盐, 这个性质可用来区别或分离酚和酸。上述性质可用 来使羧酸与不溶解于水的或易挥发的物质分离
15
羧酸的化学性质
羧酸和醇在结构上只差一个C=O,但其酸性却相差 很大。
诱导效应的特点:
A. 具有加和性
Cl3CCOOH > Cl2CHCOOH > ClCH2COOH
pKa
0.64
1.26
2.86
B. 诱导效应强度与距离成反比,距离↑,诱导效应强度↓
α
CH3CH2CHCOOH
Cl
pKa
2.82
>
βα
CH3CHCH 2COOH
Cl
4.41
>
γ βα
CH2CH2CH2COOH
(3)芳香族羧酸命名,若羧基直接连在苯环上的以苯甲酸 为母体,若羧基连在侧链,则把芳环作为取代基来命名, 编号从羧基所连的碳原子开始
CH CHCOOH
CH3CHCOOH
3苯基丙烯酸(肉桂酸)
第十章羧酸及其衍生物和取代酸详解演示文稿

保留双键
第十七页,共53页。
4、 羧酸的受热分解-脱羧反应
羧酸分子脱去CO2的反应叫脱羧反应,根据羧酸结构不同可以得 到不同产物
(1) 一元羧酸
R – COONa NaOH-CaO
共熔
R - H + Na2CO3
羧酸的α位上有强吸电子基团时,容易脱羧
CCl3 – COOH
△
CHCl3 + CO2↑
R'
浓H2SO4
R
O C
O
△
R' + H2O
CH2COOH 浓H2SO4
OH
CH2
CO O
H3O+
CH2COOH OH
第十六页,共53页。
3、 还原
用LiAlH4可以将羧酸还原为醇,该还原剂不影响化合物中的
不饱和键.
O R C OH
LiAlH4
R CH2 OH 伯伯醇醇
H2C CH CH2 COOH LiAlH4 H2C CH CH2 CH2 OH
⑴ 酰氯、酰胺:将相应的“酸”改为酰氯、酰胺即可。例如:
第二十七页,共53页。
⑵ 酸酐
由相应的酸来命名
两分子酸相同:
O CH3 C
O CH3 C
O
乙酸酐
O CH3 CH2 C
O CH3 CH2 C
O
丙酸酐
O C
O
C O
苯甲酸酐
两分子酸不同:
O CH3 C
O
CH3 CH2 C O
乙(酸)丙(酸)酐
第二十八页,共53页。
3、苯甲酸 安息香酸,苯甲酸钠作为防腐剂. 4、乙二酸 草酸,酸性最强的二元酸.具有很强的配位能力.在定量分析中
第十七页,共53页。
4、 羧酸的受热分解-脱羧反应
羧酸分子脱去CO2的反应叫脱羧反应,根据羧酸结构不同可以得 到不同产物
(1) 一元羧酸
R – COONa NaOH-CaO
共熔
R - H + Na2CO3
羧酸的α位上有强吸电子基团时,容易脱羧
CCl3 – COOH
△
CHCl3 + CO2↑
R'
浓H2SO4
R
O C
O
△
R' + H2O
CH2COOH 浓H2SO4
OH
CH2
CO O
H3O+
CH2COOH OH
第十六页,共53页。
3、 还原
用LiAlH4可以将羧酸还原为醇,该还原剂不影响化合物中的
不饱和键.
O R C OH
LiAlH4
R CH2 OH 伯伯醇醇
H2C CH CH2 COOH LiAlH4 H2C CH CH2 CH2 OH
⑴ 酰氯、酰胺:将相应的“酸”改为酰氯、酰胺即可。例如:
第二十七页,共53页。
⑵ 酸酐
由相应的酸来命名
两分子酸相同:
O CH3 C
O CH3 C
O
乙酸酐
O CH3 CH2 C
O CH3 CH2 C
O
丙酸酐
O C
O
C O
苯甲酸酐
两分子酸不同:
O CH3 C
O
CH3 CH2 C O
乙(酸)丙(酸)酐
第二十八页,共53页。
3、苯甲酸 安息香酸,苯甲酸钠作为防腐剂. 4、乙二酸 草酸,酸性最强的二元酸.具有很强的配位能力.在定量分析中
羧酸及衍生物

O COOH O COOH prostaglandin A2 OH juvenile hormone
H HOOC
H
chrysanthemic acid (pyrethrin)
二、物理性质(physical properities)
沸 点:
CH3CH2CH2OH CH 3CO OH
2OH
HCOO H
+ H2O
COOH 230℃ COOH
丁二 酸 酐 二 丁 CO 酸 酐 O
KMnO4 H2SO4
O
COOH COOH
P2O5
O
O + H2OFra bibliotek⑷ 酰卤 (acyl halide)的生成:
O R C O OH + Cl S Cl 亚硫酰氯 氯化亚砜 O
R
C
Cl + HCl + SO2
卤化试剂:PCl3, PCl5, SOCl2, PBr3
COOH
A-CH2-COOH
加热 ,碱
CH
ACH3 + CO2
在结构上,两个吸电子基连在同一个碳上的 化合物,热力学上是不稳定的,受热易脱羧。
HOOCCH2COOH
CH3COOH + CO2
当-碳上连有吸电子基团时,羧酸受热易发生脱 羧反应。
O O CH3 C C O H
-CO2
O CH3 C H
合成题:
COOH CH2Br
解:
COOH 1).LiAlH4 2).H3O+
HBr CH2Br
CH2OH
4. 脱羧反应(decarboxylation)
—羧酸失去羧基的反应,即脱去一分子CO2。
H HOOC
H
chrysanthemic acid (pyrethrin)
二、物理性质(physical properities)
沸 点:
CH3CH2CH2OH CH 3CO OH
2OH
HCOO H
+ H2O
COOH 230℃ COOH
丁二 酸 酐 二 丁 CO 酸 酐 O
KMnO4 H2SO4
O
COOH COOH
P2O5
O
O + H2OFra bibliotek⑷ 酰卤 (acyl halide)的生成:
O R C O OH + Cl S Cl 亚硫酰氯 氯化亚砜 O
R
C
Cl + HCl + SO2
卤化试剂:PCl3, PCl5, SOCl2, PBr3
COOH
A-CH2-COOH
加热 ,碱
CH
ACH3 + CO2
在结构上,两个吸电子基连在同一个碳上的 化合物,热力学上是不稳定的,受热易脱羧。
HOOCCH2COOH
CH3COOH + CO2
当-碳上连有吸电子基团时,羧酸受热易发生脱 羧反应。
O O CH3 C C O H
-CO2
O CH3 C H
合成题:
COOH CH2Br
解:
COOH 1).LiAlH4 2).H3O+
HBr CH2Br
CH2OH
4. 脱羧反应(decarboxylation)
—羧酸失去羧基的反应,即脱去一分子CO2。
有机化学(第二版)答案__赵建庄
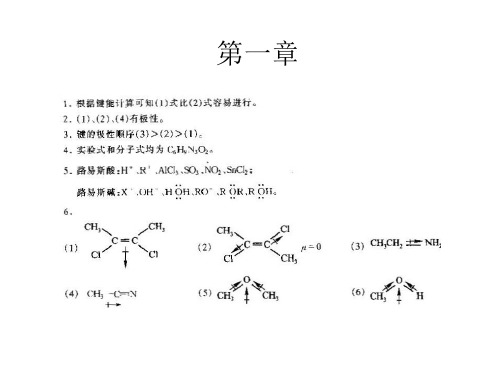
另一组答案为: A.
B. H3C CH2 CH2 CH2Br
C. H3C CH 2 CH CH2
10.
氧化后得到的
对称二酮为:
11.
反应式如下:
12. 透视式
纽曼式
第五章 卤代烃习题参考答案
1. (1) 2-甲基-4-氯戊烷 (3) 4-溴-1-环己烯 (5) 2-氯-4-溴甲苯
(2) 2-氯-2-己烯-4-炔 (4) 苄溴(溴化苄,苯溴甲烷) (6) 3,6-二氯-2-甲萘
H+ -H2O
H3C C CH CH 2 CH3 CH3
+ (1) O3
(2) Zn, H2O H3C CH 2 CHO
O H3C C CH3
丙醛可发生银镜反应,丙酮可发生碘仿反应。
第十章 羧酸、羧酸衍生物和取代酸 参考答案
1. (1) 3-甲基丁酸
(2) 3-乙基-3-丁烯酸
(3) 2,3-环氧丁酸
(4) 1,3-(间)苯二甲酸
(5) 2,4-二氯苯氧乙酸
(6) 反-1,2-环丙二甲酸
(7) 4-甲基-2,4-戊二烯酸
(8) 2-甲基丁酸
(9) 3-(间)甲基苯甲酰溴 (10) 乙酸对甲基苯酯
(11) N-甲基-N-乙基甲酰胺 (12) 乙丙酐
(13) 二乙酸乙二酯
(14) γ –丁内酯
(15) 2-甲基-3-丁酮酸
2.
3. (1)
(2)
(3)
(4)
(5)
4. (1)
(2)
5. (1)
+ CH3I
(2)
O
(3)
(4) 2 H3C C CH3
(5)
(6)
,
有机化学08-羧酸、羧酸衍生物及取代酸

CH 3 CH CH CH 3 CH 3 COOH
C H 3C H C H C O O H
2-丁烯酸(琥珀酸) 丁烯酸( 丁烯酸 琥珀酸)
2,3-二甲基丁酸 二甲基丁酸
③芳香酸和脂环酸,可把芳环和脂环作为取代基来命名。 芳香酸和脂环酸,可把芳环和脂环作为取代基来命名。
CH CHCOOH
COOH OH
(1) 诱导效应是影响羧酸酸性的主要因素: 诱导效应是影响羧酸酸性的主要因素: 吸电子取代基使O—H键极性增强,较易解离出 +,且 键极性增强, 吸电子取代基使 键极性增强 较易解离出H 吸电子效应使-COO-负离子的电荷更加分散,酸性增强; 负离子的电荷更加分散,酸性增强; 吸电子效应使 供电子取代基使酸性减弱。 供电子取代基使酸性减弱。 -I使酸性增强 X-CH2COOH 使酸性增强 X= F Cl Br I H pKa 2.66 2.86 2.90 3.18 4.76 +I使酸性减弱 使酸性减弱 HCOOH CH3COOH pKa 3.75 4.76 NO2 1.68 N+(CH3)3 1.83
COOH COOH
顺-丁烯二酸
邻苯二甲酸
二元酸
HOOCCOOH HOOCCH2COOH HOOC(CH2)2COOH (Z)-HOOCCH=CHCOOH (E)-HOOCCH=CHCOOH
系统命名
乙二酸 丙二酸 丁二酸 顺-丁烯二酸 丁烯二酸 反-丁烯二酸 丁烯二酸
普通命名
草酸 缩苹果酸 琥珀酸 马来酸 富马酸
二、羧酸的结构
O R C O-H
p-π共轭 共轭
C=O碳原子为sp2杂化; C=O碳的p轨道与C=O氧的p轨道平行,相互重叠形成π键; -OH氧p轨道上的孤对电子与C=O的π键形成π34大π键, -OH中氧上电子云密度降低, C=O中碳原子正电性下降。 氧上电子云密度降低, 碳原子正电性下降。
C H 3C H C H C O O H
2-丁烯酸(琥珀酸) 丁烯酸( 丁烯酸 琥珀酸)
2,3-二甲基丁酸 二甲基丁酸
③芳香酸和脂环酸,可把芳环和脂环作为取代基来命名。 芳香酸和脂环酸,可把芳环和脂环作为取代基来命名。
CH CHCOOH
COOH OH
(1) 诱导效应是影响羧酸酸性的主要因素: 诱导效应是影响羧酸酸性的主要因素: 吸电子取代基使O—H键极性增强,较易解离出 +,且 键极性增强, 吸电子取代基使 键极性增强 较易解离出H 吸电子效应使-COO-负离子的电荷更加分散,酸性增强; 负离子的电荷更加分散,酸性增强; 吸电子效应使 供电子取代基使酸性减弱。 供电子取代基使酸性减弱。 -I使酸性增强 X-CH2COOH 使酸性增强 X= F Cl Br I H pKa 2.66 2.86 2.90 3.18 4.76 +I使酸性减弱 使酸性减弱 HCOOH CH3COOH pKa 3.75 4.76 NO2 1.68 N+(CH3)3 1.83
COOH COOH
顺-丁烯二酸
邻苯二甲酸
二元酸
HOOCCOOH HOOCCH2COOH HOOC(CH2)2COOH (Z)-HOOCCH=CHCOOH (E)-HOOCCH=CHCOOH
系统命名
乙二酸 丙二酸 丁二酸 顺-丁烯二酸 丁烯二酸 反-丁烯二酸 丁烯二酸
普通命名
草酸 缩苹果酸 琥珀酸 马来酸 富马酸
二、羧酸的结构
O R C O-H
p-π共轭 共轭
C=O碳原子为sp2杂化; C=O碳的p轨道与C=O氧的p轨道平行,相互重叠形成π键; -OH氧p轨道上的孤对电子与C=O的π键形成π34大π键, -OH中氧上电子云密度降低, C=O中碳原子正电性下降。 氧上电子云密度降低, 碳原子正电性下降。
有机化学10第10章 羧酸及其衍生物

• 取代基的供电子(+I效应)强弱次序:
•注意: 与苯环、1,3-丁二烯和烯烃的-,p-共轭效应比较: 共轭效应是指在共轭体系中原子间的一种相互影响,这种 影响造成分子更加稳定,内能更小,键长趋于平均化。 共 轭效应常与诱导效应同时存在,共同起作用。(苯的定位)
有机化合物酸性的强弱主要受其结构的电子效应、杂 化、氢键、空间效应和溶剂的影响。 1. 羧酸的酸性 (1) 脂肪族羧酸
CH3
KMnO 4 / NaOH
COOH
KMnO 4 / NaOH
C2 H5
CH3
K2Cr2O 7 / H2SO 4
COOH
NO2
NO2
CH(CH3)2
Na2Cr2O 7 / H2SO 4
COOH
COOH (CH2)6CH3
CH3
KMnO 4 / NaOH
COOH
侧链是叔烷 基,很难氧 化,强氧化 剂时环发生 破裂。
• 羧酸的沸点高于质量相近的醇——双分子缔合
O H O CH3 C O H O C CH3
R O H O R H O H O R R H
10.4 羧酸的化学性质
-H取 代反应
H C
O C O
C=O 基亲核加成 O H 键断裂而
呈酸性
R
H
脱羧反应
H
OH被取代反应
羧酸的化学反应包括: (1) O—H键的酸性; (2) —H取代反应 (3) —OH基取代反应; (4) C=O亲核加成 (5) 脱羧反应
第十章 羧酸及其衍生物、取代羧酸
(一)羧酸
10.1 羧酸的结构、分类和命名
——羧酸的分子中都含有羧基官能团
10.1.1 羧酸的结构
有机化学第九章(2024版)

NH3 (过 量) NH4B r
H2NC H2C O O H
= CH2 CHBrCOOH KOH / CH3OH CH2 CHCOOH
CH2 CHBrCOOH
CH2 =CHCOOH
26
甲酸
❖ 俗名蚁酸,其结构特殊,它的羧基与一氢原子相连, 表现出某些醛的性质,具有较强的还原性,能被托
伦试剂、斐林试剂氧化,也容易被一般的氧化剂氧 化生成二氧化碳和水:
F
OH
pKa
2.66
3.83
3)与碳原子相连的基团不饱和性↑,吸电子能力↑。 = C CH > CH CH2 > CH2CH3
= C H CC H2C O O H > C H2 C HC H2C O O H > C H3C H2C H2C O O H
pKa
2.85
4.35
4.82
(C H3)3N+C H2C O O H
CH2NH2
H
反-4-(氨甲基环己烷)甲酸
止血环酸
6
❖ 芳香羧酸的命名,把芳基作为取代基:
COOH
COOH
CH2COOH
苯甲酸 安息香酸
OH 邻羟基苯甲酸 水杨酸
COOH
α-萘乙酸 COOH
COOH 1,2-苯二甲酸
HO
OH
OH 33,,44,,5-5三-三 羟羟 基苯基甲甲酸酸
没食子酸
7
第一节 羧酸
COOH
2
命名
❖ 脂肪族一元羧酸的命名与醛类相似,即选择含羧基 的最长的碳链为主链,按主链的碳原子数称为某酸:
HCOOH 甲酸
CH3COOH
乙酸 醋酸
γ βα
4 3 21
H
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
含有二个羧基的羧酸称为二元酸。
二、羧酸的性质
1. 物理性质:羧酸是极性分子 。 (1)物态
C1~C3 有酸味的无色液体
C4~C9 有腐败酸臭味的油状液体
C10 以上——蜡状固体,没有气味 芳香族羧酸(Ar-COOH)和脂肪族二元羧酸 为结晶的固体
(2) 沸点
液态脂肪酸以二聚体形式存在。 所以羧酸的沸点比相对分子质量相 当的醇高。
基础化学
(下)
羧酸是一种有机机酸,常以盐或酯的形 式广泛存在于自然界中,对人类生活关系密切。
例如:食用的醋,就是2%的醋酸水溶液; 日常用的肥皂,是高级脂肪酸的钠盐;
食用的油以及许多工业用的油都是属于羧酸 的甘油酯
羧酸也是一类非常重要的工业原料, 例如化合成纤维(尼龙、的确良)的重要 原料之一就是羧酸。
反 (1)反应速率慢,需要强酸催化,且加热 应 (浓硫酸,对甲苯磺酸等) 特点:(2)反应的可逆性。(K较小)
增大产率:可减少生成物水(分水装置,带 水剂);或增加反应物,改变醇酸摩尔比。
生成酰胺
O
RC OH + NH3
O R C O NH4+
O
+ RC NH2 H2 O
⑶ 脱羧反应
通式:
+ 或碱
⑴ 羧基中氢原子的反应 ①酸性
能溶与水的羧酸在水溶液中可离解出 氢离子而呈酸性,使蓝色石蕊试纸变红。
O R C OH
O
R C O- + H+
大多数脂肪族一元羧酸的pKa值在4~5范 围内。芳香酸及二元酸的酸性强于一元脂肪族 羧酸;羧酸的酸性弱于无机强酸而强于碳酸 (pKa=6.38)和一般的酚(pKa≈10)。
甲酸 乙酸 丙酸 丁酸 十六酸 十八酸
蚁酸 醋酸 初油酸 酪酸 软脂酸 硬脂酸
二元酸
系统命名
HOOCCOOH
乙二酸
HOOCCH2COOH HOOC(CH2)2COOH (Z)-HOOCCH=CHCOOH
丙二酸 丁二酸 顺丁烯二酸
(E)-HOOCCH=CHCOOH 反丁烯二酸
普通(俗名)命名 草酸 缩苹果酸 琥珀酸 马来酸 富马酸
§17-1 羧 酸
官能团:
O C OH
饱和一元脂肪酸通式:CnH2nO2
分类
按羧基数目分
一元羧酸:OOH
二元羧酸: COOH
COOH
多元羧酸:
COOH HO-C-COOH
COOH
命名
1. 系统命名法:[同“醛”(选主链,编号,命名)
例:
HOCH2CH2CHCH2COOH
Cl
5-羟基-3-氯戊酸
甲酸 乙醇 乙酸 丙醇
分子量
HCOOH
46
CH3CH2OH
46
CH3COOH
60
CH3CH2CH2OH 60
沸点/℃ 100 78.3 118 97.2
(3) 熔点
饱和一元酸的熔点随碳链的增长而升高, 显锯齿状变化,
即含偶数碳原子羧酸的熔点比前后两个 相邻的含奇数碳原子酸的熔点要高。
(4)水溶性
ACH2COOH
ACH3 CO2
O
O
A为-COOH,-CN, CR,-NO2,-CX3, C C6H5-等吸电子基团时,脱羧反应相当容易进行。
⑷烃基中α-H的卤代
X
+ 少量 P
RCH2COOH X2
RCHCOOH
⑸还原
RCOOH LiAlH4 或 B2H6
RCH2OH
三、重要化合物
1.甲酸(HCOOH)
•酯化反应、羧酸衍生物的亲核取代 反应。
•羧酸衍生物在有机合成中的应用和 几个重要的有机人名反应等。
学习要求 1. 了解羧酸及其衍生物的结构,物理性质, 理解羧酸结构对其性质的影响; 2. 掌握羧酸及其衍生物的分类、命名和主 要化学性质; 3. 熟悉常见取代酸的命名及其重要性质; 4. 了解几种重要的羧酸、羧酸衍生物、取 代酸的性质和应用。
0.136nm
O
RC O-
O
R-C
-
O
比醛酮(>C=O)键长(0.123nm)要长 键长平均化
比醇C-O键长(0.143nm)要短
羧酸根比较稳定,所以羧酸的氢 能解离而表现出酸性。
化学性质
• 酸性(p-π共轭,使O-H极性增大)
O R C ..
OH
• -OH的取代反应(酰化) • 还原 • 脱羧
• α-H的卤代
低级酸易溶于水。羧基是亲水基团易 与水形成氢键
O R-C
H -O H
O -H O -H
H H -O
H
高级羧酸随分子量增大( R↑) 而在水中的溶 解度减小。
2. 化学性质
羧酸和羧酸根的结构比较 两个碳氧键等长,完全离域。
两个碳氧 键不等长 ,部分离 域。
H0.125nm
Rα- C
C
O
..
SP2
H OH
O RC OH
RCOX
酰卤
RCOOCOR 酸酐 RCOOR 酯 RCONH2 酰胺
生成酸酐
O
O
R C OH + HO C R1
O
O
R C O C R1 + H2O
生成酰氯
PCl5 SOCl2
O
RC Cl + POCl3 + H Cl O
RC Cl + SO2 + H Cl
二氯亚砜(亚硫酰氯)
成酯反应
羧酸的通式:R-COOH 或 Ar-COOH
第17章 羧酸 羧酸衍生物 取代酸
§17-1 羧 酸 一、羧酸的分类和命名
二、羧酸的性质
三、个别化合物
§17-2 羧酸衍生物 一、分类和命名 二、羧酸衍生物的性质
§17-3 取代酸 一、羟基酸 二、羰基酸
本章重点 •羧酸及其衍生物和取代酸的分子结 构与性质。
甲酸可用作还原剂、消毒剂和防腐剂等
2.乙酸 俗称醋酸,普通食醋含4%~8%的乙酸。 乙酸是染料、香料、制药、塑料等工业 不可缺少的工业原料。
3.丁烯二酸
H
H
CC
HOOC
COOH
顺丁烯二酸
H
COOH
CC
HOOC
H
反丁烯二酸
4.苯甲酸
俗名安息香酸 其钠盐用作食物和某些药物的防腐剂
羧酸的俗名(根据酸的来源命名) 根据它们的天然来源而有其俗名。
甲酸最初是从一种蚂蚁中得到,故称蚁酸 乙酸存在于食醋中,因而又称醋酸
一元酸
系统命名
普通(俗名)命名
HCOOH CH3COOH CH3CH2COOH CH3CH2CH2COOH CH3(CH2)14COOH CH3(CH2)16COOH
R COOH + NaHCO3
R COONa + CO2 + H2O
羧酸的碱金属盐具有一般无机盐的性质, 加入强酸又可以使羧酸重新游离出来。
R COONa + HCl
应用:利用羧酸的酸性可以分离羧酸和不具酸性 的有机化合物,也可以用于羧酸的鉴别和精制。
CH3COOH + NaOH CH3COONa + H2O CH3COOH + NaHCO3 CH3COONa + CO2 + H2O
BrCH2CH
CCH2CH2COOH C2H5
4-乙基-6-溴-4-己烯酸
COOH
环己基甲酸
2. 普通命名法 选主链:含羧基在内的最长碳链 编号:从羧基邻位碳原子开始,依次为 α,β,γ,δ(德尔塔) ,ε(艾普西龙)…ω
CH3CH2CHCH2COOH CH3
β-甲基戊酸
γ –环己基丁酸
CH2CH2CH2COOH
