第二节分子的立体构型第一课时
分子的立体构型(价层电子对互斥理论)

0 0 0 1
正四面体 直线
平面三角形 三角锥形 V形 V形
4
3
2 1
平面三角形
课堂练习
1.下列物质中,分子的立体结构与水分子 相似的是 (B ) A.CO2 B.H2S C.PCl3 D.SiCl4 2.下列分子的立体结构,其中属于直线型 分子的是 ( BC ) A.H2O B.CO2 C.C2H2 D.P4
6
1
2
八面体
平面正方形
XeF4
3、价层电子对互斥模型判断分子空间构型规律
(1) 一类是中心原子上的价电子都用于形成共价键, 如 CO2、 CH2O、 CH4等分子中的碳原子,它们的立 体结构可用中心原子周围的原子数 n来预测,概括如 下:
ABn 立体结构 n=2 直线形 n=3 平面三角形 n=4 正四面体形 n=5 三角双锥形 n=6 正八面体形
中心原子有孤对电子LP≠0 :分子的空间构型 不同于VSEPR模型。 VP LP 3 4
VSEPR模型 分子的 空间构型
例 SnCl2 NH3 H 2O IF5
1 1
2
平面三角形 四面体 四面体 八面体
V形 三角锥 V形 四方锥
6
1
2
八面体
平面正方形
XeF4
应用反馈:
化学式 HCN 中心原子 孤对电子数 中心原子结 合的原子数 空间构型 直线形 V形 V形 平面三角形 三角锥形 正四面体 四面体 正四面体
小结:
1、了解共价分子的多样性和复杂性
2、认识价层电子对互斥模型及计算分子或 离子的孤对电子数
3、能用VSEPR模型预测简单分子或离子 的立体结构
课堂练习
3.若ABn型分子的中心原子A上没有未用于形 成共价键的孤对电子,运用价层电子对互斥模 型,下列说法正确的(C ) A.若n=2,则分子的立体构型为V形 B.若n=3,则分子的立体构型为三角锥形 C.若n=4,则分子的立体构型为正四面体形 D.以上说法都不正确
高中化学 选修3 第二章 分子结构与性质第2节分子的立体构型第1课时价层电子对互斥理论学生使用

选修3 第一章原子结构与性质第2节分子的立体构型第1课时价层电子对互斥理论学习目标:1.认识共价分子结构的多样性和复杂性。
2.理解价层电子对互斥理论的含义。
3.能根据有关理论判断简单分子或离子的构型。
教学难点:1、理解价层电子对互斥理论的含义2、能根据有关理论判断简单分子或离子的构型教学重点:1、理解价层电子对互斥理论的含义2、能根据有关理论判断简单分子或离子的构型教学过程:知识回顾:1.分析下列化学式中画有横线的元素,选出符合要求的物质并填空。
A.NH3B.H2O C.HCl D.CH4E.C2H6F.N2(1)所有的价电子都参与形成共价键的是______;(2)只有一个价电子参与形成共价键的是______;(3)最外层有未参与成键的电子对的是______;(4)既有σ键,又有π键的是______;(5)既有极性键又有非极性键的是__________;(6)分子构型为正四面体的是____________。
【解析】A.NH3中N原子与3个H原子形成3个σ键,还有一对不成键电子;B.H2O中O原子与2个H原子形成2个σ键,还有两对不成键电子;C.HCl中Cl原子与1个H原子形成1个σ键,还有三对不成键电子;D.CH4中C原子与4个H原子形成4个σ键,所有价电子都参与成键,其分子构型为正四面体形;E.C2H6中C原子分别与3个H原子及另1个C原子形成4个σ键,所有价电子都参与成键;C—H为极性键,C—C为非极性键;F.N2中N原子与另1个N原子形成1个σ键,2个π键,还有一对不成键电子。
答案(1)DE (2)C (3)ABCF (4)F (5)E (6)D2.常见分子的立体构型通常有两种表示方法,一是比例模型,二是球棍模型。
请你用短线将下列几种分子的比例模型、球棍模型连接起来。
【解析】 本题主要考查常见分子的立体构型。
H 2O 分子为三原子分子呈V 形,应选E—c ;NH 3分子为四原子分子呈三角锥形,应选B—d ; CCl 4分子为五原子分子呈正四面体形,应选C—a ; CO 2分子为三原子分子呈直线形,应选A—b 。
人教版化学《分子的立体构型》课件完美版

人教版化学选修三第二章第二节分子 的立体 构型3课 时(共7 4张PPT )
同为三原子分子,CO2 和 H2O 分子的空间结构却不 同,什么原因?分析中心原子的价电子是否全部参加成 键?
同为四原子分子,CH2O与 NH3 分子的的空间结构 也不同,什么原因?
人教版化学选修三第二章第二节分子 的立体 构型3课 时(共7 4张PPT )
物
原子数
对
子对 子对数
: : :: : : : :
H2O H :O : H
2
2
2
4
NH3 H :N :H
3
HH
CH4 H :C :H
4
H
CO2 :O::C::O: 2
3
14
4
0
4
2
0
2
价层电子对数 =δ键个数+中心原子上的孤对电子对个数
δ键电子对数 = 与中心原子结合的原子数
人教版化学选修三第二章第二节分子 的立体 构型3课 时(共7 4张PPT )
人教版化学选修三第二章第二节分子 的立体 构型3课 时(共7 4张PPT )
人教版化学选修三第二章第二节分子 的立体 构型3课 时(共7 4张PPT )
孤电子对的计算
=½ (a-xb)
分子或 中心原 a
x
b
离子 子
H2O
O
6
2
1
SO2
S
6
2
2
NH4+
N
5-1=4
4
1
CO32- C
4+2=6 3
2
人教版化学选修三第二章第二节分子 的立体 构型3课 时(共7 4张PPT )
中心原子 上的孤电 子对数
人教版化学选修三第二章第二节分子的立体构型PPT课件

2
无孤电子对 CH2O
3
CH4
4
分子 类型
AB2 AB3 AB4
空间构型 直线形
平面三角形 正四面体
有孤电子对 H2O
2
AB2
V形
NH3
3
AB3 三角锥形
人教版化学选修三第二章第二节分子 的立体 构型
人教版化学选修三第二章第二节分子 的立体 构型 人教版化学选修三第二章第二节分子 的立体 构型
人教版化学选修三第二章第二节分子 的立体 构型
::
..
CH2O
H. . . . H C O. .
.. ..
CH4
H H:C :H
H
O=C=O H-C-H
H H-C-H
H
直线形
V 形 三角锥形 平面三角形 正四面体
人教版化学选修三第二章第二节分子 的立体 构型
人教版化学选修三第二章第二节分子 的立体 构型
分析CO2 、 H2O、NH3 、CH2O、CH4电子 式的中心原子价电子层电子的成键情况。
3、五原子分子立体结构 最常见的是正四面体
CH4
正四面体
人教版化学选修三第二章第二节分子 的立体 构型
一、形形色色的分子
4、其它
人教版化学选修三第二章第二节分子 的立体 构型
P4
正四面体 60°
C2H2
直线形 180°
人教版化学选修三第二章第二节分子 的立体 构型
C60
人教版化学选修三第二章第二节分子 的立体 构型
C20
C40
C70
人教版化学选修三第二章第二节分子 的立体 构型 人教版化学选修三第二章第二节分子 的立体 构型
人教版化学选修三第二章第二节分子 的立体 构型
《分子的立体结构》完整(第一课时)ppt课件

_直线 形和 V 形,大多数四原子分子采取 平面三角 形和 _
_三_角锥 形两种立体结构,五原子分子的立体结构中最常见的是 正四面体 形。
2 、下列分子或离子中,不含有孤对电子的是 __D _
A、H2O、 B、H3O+、
C、NH3、
D、NH4+
分子或 σ键电子 孤电子对 VSEPR模型及 分子的立体
离子 对数
数
名称
构型及名称
CO2
2
0
直线形
O
C
O
直线形
H2O NH3 CH4
2
2
正四面体
V形 O
H
H
O
OC
3
1
正四面体
H
N 三O角锥形 H
H
H
4
0
正四面体
整理版课件
正四面体
C
H
12H
H
2. 孤对电子对数的计算
价层电子对数 = σ键个数 + 孤对电子对数
3 、下列分子①BCl3、②CCl4、③H2S、④CS2中,其键角由小到大 的顺序为_③_②_① ④
4、以下分子或离子的结构为正四面体,且键角为109°28′ 的是_ __C_
①CH4 ②NH4+ ③CH3Cl ④P4 ⑤SO42A、①②③ B、①②④ C、①②⑤ D、①④⑤
整理版课件
20
感谢亲观看此幻灯片,此课件部分内容来源于网络, 如有侵权请及时联系我们删除,谢谢配合!
第二节 分子的立体构型
第一课时 ——价层互斥理论
整理版课件
1
列举一些以下类型的分子,注明其立体构型和键角。
人教版高中化学选修3 物质结构与性质 第二章 第二节 分子的立体构型(第1课时)

2014年7月20日星期日
21
价层电子对互斥理论
ABn 型分子的VSEPR模型和立体结构
电子对数 目 电子对的空 间构型 成键电子 对数 孤电子 对数 电子对的 排列方式 分子的 空间构型 实 例
2
直线
2
0
直 线形
BeCl2 CO2
3 3 三角型 2
0
三角形
BF3 SO3
1
V形
SnBr2 PbCl2
2014年7月20日星期日 17
价层电子对互斥理论
化学式 HCN SO2 NH2- BF3 H 3O + SiCl4 CHCl3 NH4+ SO42-
2014年7月20日星期日
价层电子对数 结合的原子数 孤对电子对数
2 3 4 3 4 4 4 4 4
2 2
0 1
2 3 3 4 4 4 4
2
0 1 0 0 0 0
1 0 0 0
2 2 2 3 3
4 4 4
直线形 V形 V形 平面三角形 三角锥形 正四面体 四面体 正四面体
26
2014年7月20日星期日
价层电子对互斥理论
1、下列物质中分子立体结构与水分子相似的是 A.CO2 B.H2S B C.PCl3 D.SiCl4 2、下列分子立体结构其中属于直线型分子的是 A.H2O B.CO2 BC C.C2H2 D.P4 3、下列分子立体结构其中属正八面体型分子的 A.H3O + B.CO32— D C.PCl5 D.SF6
新课标人教版高中化学课件系列
选修3 物质结构与性质 第二章 分子结构与性质
第二节 分子的立体构型 第1课时
2014年7月20日星期日
1
人教版高中化学选修三教案-分子的立体构型第一课时

第二节分子的立体构型力最小,分子体系能量最低。
3、 价层电子对互斥模型:(1) 、中心原子上的价电子都用于形成共价键:分子中的价电子对相互排 斥的结果 (2) 、中心原子上有孤对电子:孤对电子也要占据中心原子周围的空间, 并参与互相排斥,使分子的空间结构发生变化。
4、 价层电子对互斥理论的应用 (1) 确定中心原子A 价层电子对数目 (2) 价电子对数计算方法 (3) 确定价层电子对的空间构型 (4) 分子空间构型确定教学过程教学方法、手段、师生活动[复习]共价键的三个参数。
[过渡]我们知道许多分子都具有一定的空间结构,如:……, 是什么原因导致了分子的空间结构不同,与共价键的三个参数 有什么关系?我们开始研究分子的立体结构。
[板书]第二节分子的立体结构一、形形色色的分子:讲]大多数分子是由两个以上原子构成的,于是就有 的原子的空间关系问题,这就是所谓“分子的立体结构 如,三原子分子的立体结构有直线形和 V 形两种。
如 呈直线形,而40 分子呈V 形,两个川一。
键的键角为:投影][板书]1、三原子分子立体结构:有直线形 CQ 、CS 2等,V 形 如HO SQ 等。
[讲]大多数四原子分子采取平面三角形和三角锥形两种立体教学步骤、内容了分子中旷。
例 I CQ 分子了 105°。
[板书]3、五原子分子立体结构:正四面体形如甲烷、,键角约120°; (CH 20)1'[阅读]科学视野一分子的立体结构是怎样测定的?肉眼不能看到分子,那么,科学家是怎样知道分子的形状 的呢?早年的科学家主要靠对物质的宏观性质进行系统总结得 出规律后进行推测,如今,科学家已经创造了许许多多测定分 子结构的现代仪器,红外光谱就是其中的一种。
结构。
例如,甲醛(CH0)分子呈平面三角形 氨分子呈三角锥形,键角 ©7。
丿0 分子中的原子不是固定不动的, 而是不断地振动着的。
所[投影]恥-m投影]109° 28。
22分子的立体结构教案第一课时人教选修3.doc
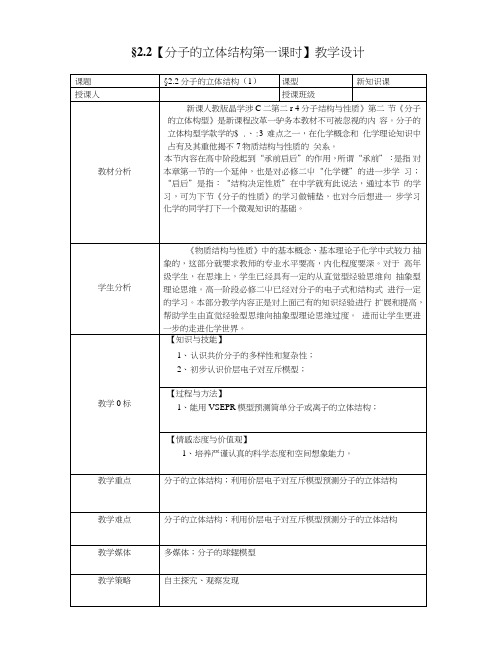
§2.2【分子的立体结构第一课时】教学设计教学流程衫形色、\色的另任务2.1:价层电子对互斥理论定义括动1.1.1板块2:价层电子对互斥理论任务l.h S习分于的结构式和电子式的书写任务1.2:对比分子结构式与分子的立体结构模型任务2.2:价层电子对概念及计算任务2.3:确定分子立体构型活动1.1.2:X活动1.2.1I活动1.2.2学生写出co2H2O NH3 CH2O CH4的电子式和结构式学生讨论交流,教师指导改正展示co2H2O NH3 CH2O CH4分子的球棍模型播放幻灯片,教师总结多原子分子立体构型特点活动2.1.1:教师给出定义活动2.2.1:价层电子对概念活动2.2.2: ci键电子对的确定活动2.2.3:分子、离子里的屮心原子上孤电子对数计算’活动2.3.1:教师讲解如何确定分子立体构型(分两类)活动2.3.2:播放幻灯片,师生共用完成表格填写任务3.1:课堂小结任务3.2:强化训练活动3.1.1:学生归纳总结本节课所学内容,教师补充活动3.1.2:教师出题,学生完成,强化训练及时反馈分子的立体构型案例(1)任务23:确定分子立体构型X一一与中心原子结合的原子数b—一与屮心原子结合的原子最多能接受的电子书(絚为1,其他原子等于“8-该原子的价电子数”)【练习】以S、P为例,确定它们价电子数以N、CL为例,确定他们最多接受电子数【练习】以一氧化碳和水为例:【讲解】分子符合以上公式,对于离子是否也符合呢?答案是肯定的【板书】4、在离子中,XB的计算方法不变,阳离子:a—一中心原子的价电子数-离子的电荷数阴离子:a—一屮心原子的价电子数+离子的电荷数(绝对值)【练习】铵根离子、碳酸根离子为例【讲述】在确定了o键电子对数和巾心原子电子对数后,二者相加就确定了分子中的中心原子上的价层电子对数,由价层电子对互斥,得到含有孤电子对的价层电子对(VSEPR)模型。
然后,略去VSEPR 模型屮的屮心原子上的孤电子对,便可得到分子的立体模型。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
中心原子A价层电子对(包括成键σ键电子对和未成键的 孤对电子对)之间存在排斥力,将使分子中的原子处于尽 可能远的相对位置上,以使彼此之间斥力最小,分子体系 能量最低,最稳定。
价层电子对=成键的σ电子对+孤电子对 σ键电子对数=分子式ABn中的n 孤电子对=1/2(a-xb) a:中心原子的价电子数 x:中心原子结合的原子数 b:与中心原子结合的原子最多接受的电子数
1.下列物质中分子立体结构与水分子相似的是
A.CO2
B.H2S
B
C.PCl3
D.SiCl4
2.下列分子立体结构其中属于直线型分子的是
A.H2O
B.CO2
BC
C.C2H2
D.P4
3.下列分子立体结构其中属正八面体型分子的
A.H3O + C.PCl5
B.CO32— D.SF6
D
本节重点:
会利用VSEPR理论得出 孤电子对数 价层电子对互斥模型(VSEPR模型) 分子立体构型
第二章 分子的结构与性质
第二节 分子的立体结构
复习导入 引入新课
思考
CO2 和H2O同为三原子分子,CO2呈直线 型而H2O呈V型,为什么?
CH2O和NH3同为四原子分子,CH2O呈平面 三角型而NH3三角锥形型,为什么?
一、价层电子对互斥理论 (VSEPR模型)
——预测分子或离子的立体构型 对ABn型分子或离子,B围绕A成键,则A为
(H为1,其他原子为“8-该原子的最外层电子数)
阳离子:a为中心原子的价电子数-离子的电荷数 阴离子:a为中心原子的价电子数+离子的电荷数
确定VSEPR构型
价层电子 对数目
2
3
价层电子 直 平面 对构型 线 三角型
4
四面 体
5
三角 双锥
6
正八 面体
注意:在价层电子对构型的基础上,去掉孤电 子对,便可得到分子的立体构型。
写出CO2、H2O、NH3、CH2O、CH4等分子的电子式、 结构式及分子的空间构型:
分子 电子式
结构式
分子的空间构 型
CO2 H2O NH3
::
:: : :
:O::C::O: H :O : H H :N :H H
O=C=O
直线形
H-O-H
V形
-
H-N-H H
三角 锥形
..
=
CH2O
H. . . . H C O. .
4
1
三角
5
双锥
3
2
变形
四面体
SF4
T—型
BrF3
2
3
直线型
XeF2
确定分子或离子的立体构型有多种 方法:
一是依据价层电子对互斥理论进行推论,记忆
二是依据元素周期律进行类比记忆,如CO2与 CS2,CCl4与SiF4,NH3与PH3等的立体结构相似 三是依据等电子原理进行推理,记忆,如NH4+ 与CH4,CO32-与NO3-等等电子的立体构型相同
子对数 模型 子对数 对 数
4
0
4
四面体 3
1
电子对的 排列方式
分子的 立体构型
实例
四面体
CH4 CCl4 NH4+ SO42—
三角锥
NH3
PCl3 SO32- H3O+
2
2
V形
H2O
电子对 VSEPR 成键电 孤电子
数目 模型 子对数 对 数
电子对的 排列方式
分子的 立体构型
实例
5
0
三角双锥
PCl5
O H-C-H
平面 三角形
.. ..
:: --
CH4
H H:C :H
H
H H-C-H
H
正 四面体
微粒
价层电 VSEPR 孤电子 子对数 模型 对数
分子或离子构型
SO2
3
1
BF3
3
0
价层电 VSEPR 成键电 孤电子 子对数 模型 子对数 对 数
2
直线
2
0
3
0
3
三角型
2
1
电子对的 排列方式
分子的 立体构型
实例
直线
BeCl2 CO2
平面三角 BF3
形
SO3
V形
SnBr2 PbCl2
价层电 VSEPR 成键电 孤电子
