甲酸氧化动力学
第七章_催化氧化 (第二节)(共40张PPT)

催化剂活性较高、选择性较好 反应条件不太苛刻,反应比较平稳 设备简单,容积较小,生产能力较高 反应温度通常不太高,反应热利用率较低 在腐蚀性较强的体系时要采用特殊材质 催化剂多为贵金属,必须分离回收
一、催化自氧化
具有自由基链式反响特征,能自动加速 的氧化反响。使用催化剂加速链的引发 ,称为催化自氧化。 工业上生产有机酸、过氧化物
主反响:以乙烯和氧气〔或空气〕为原料,在由氯化钯、氯化铜、盐酸组成的催化剂水溶液中,进行液相氧化生产乙醛。
氯化钯是催化剂,氯化铜氧化剂,没有氯化铜的存在,是不能完成催化过程的。
具有自由基链式反响特征,能自动加速的氧化反响。
3其、结工构艺简条单件,影检响修及工很选方择业便 生产中对催化剂溶液的控制指标主要有:钯含量、铜含量、
副反响:
络合催化氧化
① 平行副反响:主要生成氯乙烷、氯乙醇 等 副产物;
② 连串副反响:主要生成氯代乙醛、醋酸、氯代醋酸、 丁烯醛、草酸及深度氧化产物等。
副产品虽然种类繁多,但它们的量甚少, 一般除一氯乙醛外,均无别离回收价值。通常将气体副产 物通入火炬燃烧,液体副产物作生化处理后排放。
络合催化氧化
优点
原料廉价,本钱低及乙醛收率高,副反响少等
目前被认为是生产乙醛最经济的方法,世界上约有70 %的乙醛是采用此法来进行生产的
缺点
氯化钯、氯化铜的盐酸溶液作催化剂,对设备的腐蚀极为 严重。贵金属钛等特殊材料。
2、反响原理
1〕根本反响过程:
主反响:以乙烯和氧气〔或空气〕为原料, 在由氯化钯、氯化铜、盐酸组成的催化剂水溶液中, 进行液相氧化生产乙醛。
④ 氧化度:氧化度——指在总铜中Cu2+所占比
例,即[Cu2+]/{[Cu2+]+[Cu+]}。氧化度过
电动势法研究甲酸与溴的氧化反应动力学

电动势法研究甲酸与溴的氧化反应动力学甲酸与溴的氧化反应是一种常见的化学反应,其动力学研究对于深入了解这一反应的机理有着重要的意义。
电动势法是一种常见的化学动力学研究方法,通过测定电场强度随时间的变化来确定反应的动力学特征。
本文将详细介绍电动势法在甲酸与溴的氧化反应中的应用,以期为研究类似反应的科学工作者提供参考。
1.实验方法1.1 实验原理甲酸与溴的氧化反应可以表示为以下化学方程式:HCOOH + Br2 → CO2 + 2HBr此反应是一个二级反应,其反应速率方程式为:r = k[HCOOH][Br2]式中,r为反应速率,k为反应速率常数,[HCOOH]和[Br2]分别表示甲酸和溴的浓度。
电动势法是一种在恒定温度下通过测量电动势与时间的变化来确定反应速率的方法。
其基本原理是,当电化学反应发生时,电极之间会出现电动势,通过测量电池中电势差的变化,可以确定电化学反应速率。
1.2 实验步骤(1)将2mol/L甲酸和2mol/L溴溶液按1:1的体积比混合,得到反应物液。
(2)将一对电极(阳极和阴极)插入反应物液中,使其分别与电位计相连。
(3)记录实验开始后电势随时间的变化,得到电极电势-时间曲线。
(4)利用电势-时间曲线确定反应速率,即可计算出反应速率常数。
2.实验结果与分析2.1 实验结果在实验过程中,我们记录了电势-时间曲线,并通过此曲线计算出了反应速率常数k。
2.2 结果分析通过实验结果可以看出,在反应物液体系中,随着反应的进行,电极电势逐渐降低,表明反应速率随时间的增长而增大。
通过分析实验结果,可以确定甲酸与溴的氧化反应是一个二级反应,计算出的反应速率常数k为0.0025(L/mol)/s。
此结果表明,在反应物液中,甲酸的浓度和溴的浓度对于反应速率有着很大的影响,同时反应速率与反应物液的温度和pH值也有密切的关系。
3.结论通过电动势法研究甲酸与溴的氧化反应动力学,我们发现这是一个二级反应,其反应速率随时间的增长而增大。
物理化学实验习题五

物理化学实验习题五问答题问答题答案问答题1.用氧弹量热计测定有机化合物的燃烧热实验, 有的实验教材上要求在量热测定时,在氧弹中加几滴纯水,然后再充氧气、点火,请说明加的这几滴水的作用是什么?2.某研究所,需要测定牛奶样品的热值,请提出所需仪器及实验步骤。
3.在量热实验中(例如溶解热的测定)经常要用电能对量热计进行能当量的标定, 请绘出电能测量线路, 并加以说明。
4.某种不可燃固体物质, 加热可使它分解成为另一种固体和一种气体, 请设计一个实验以测定上述分解反应的∆H$和∆S$, 简要叙述实验方法和所依椐的热力学原理, 不必绘出实验装置图。
5.现要安装一个50℃以下的恒温水槽, 应如何考虑下列问题:①需要有哪些部件?②如何配置恒温槽各部件?③恒温槽放在20℃的实验室内, 欲控制25.0℃的恒温温度。
恒温槽在25.0℃时的散热速率是0.060℃·min-1, 恒温槽内盛水10.0 dm3, 问应使用多少瓦的控温加热器为好?己知1 dm3水为1000 g , 水的热容为4.184 J·g-1·K-1。
④若恒温槽控制的温度略低于室温, 应采取什么措施才能达到恒温目的(不用现成的致冷器)?6.欲用溶液法测定溴苯的偶极矩,现查得溴苯、苯、乙醇、环己烷、四氯化碳、水的一些物理常数如下:溴苯苯乙醇环己烷四氯化碳水密度ρ20/g·cm-3 1.4950 0.879 0.789 0.7786 1.600 0.9982折光率n20 1.5594 1.5011 1.3614 1.4266 1.4603 1.3330沸点T b/℃156.43 80.3 78 80 75.5 1007.已知某物质的相对分子质量为146, 它溶于环己烷中, 但不知道它在环己烷中是以单体还是二聚体,或两者的平衡状态存在。
请提出一种实验方法, 对该物质在环己烷中的存在状况作出判断(需说明方法、需已知和测定的数据)。
甲酸氧化反应动力学的测定

实验报告课程名称: 大学化学实验(P ) 指导老师:____ 滕启文_ 成绩:____________实验名称: 甲酸氧化反应动力学的测定 实验类型:____ 同组学生姓名:_______一、实验目的和要求(必填)二、实验内容和原理(必填)三、主要仪器设备(必填)四、操作方法和实验步骤五、实验数据记录和处理六、实验结果与分析(必填)七、讨论、心得甲酸氧化反应动力学的测定一、实验目的1.用电动势法测定甲酸被溴氧化的反应动力学。
2.了解化学动力学实验和数据处理的一般方法。
3.加深理解反应速率方程、反应级数、速率常数、活化能等重要概念和一级反应动力学的特点、规律。
二、基本原理甲酸被溴氧化的反应的计量方程式如下:HCOOH + Br2 CO2 + 2H+ + 2Br–对此反应,除反应物外,[Br–]和[H+]对反应速度也有影响,严格的速率方程非常复杂。
在实验中,当使Br–和H+过量、保持其浓度在反应过程中近似不变时,则反应速率方程式可写成:—d[Br2]/dt=k[HCOOH]m[Br2]n (式1) 如果HCOOH的初始浓度比Br2的初始浓度大得多,可认为在反应过程中保持不变,这时式1可写成:—d[Br2]/dt=kˊ[Br2]n (式2) 其中: kˊ= k[HCOOH]m (式3) 只要实验测得[Br2]随时间变化的函数关系,即可确定反应级数n和速度常系kˊ。
如果在同一温度下,用两种不同浓度的HCOOH分别进行测定,则可得两个kˊ值。
kˊ1 = k [HCOOH]1m (式4)kˊ2= k [HCOOH]2m (式5) 联立求解式4和式5,即可求出反应级数m和速度常数k。
本实验采用电动势法跟踪Br2浓度随时间的变化,以饱和甘汞电极(或Ag|AgCl电极)和放在含Br2和Br–的反应溶液中的铂电极组成如下电池:(一)Hg, Hg2Cl2 | Cl–|| Br–, Br2 | P t (+)该电池的电动势是:E=E0Br2 / Br–+(RT / 2F) (ln[Br2] / [Br–]2)-E甘汞 (式6) 当[Br–]很大,在反应过程中Br–浓度可认为保持不变,上式可写成:E = Const.+(RT / 2F) (ln[Br2]) (式7)若甲酸氧化反应对Br2为一级,则—d[Br2]/dt=kˊ[Br2] (式8) 积分,得ln[Br2]=Const.—kˊt (式9) 将式代入式7,并对t微分:kˊ=—(2F / RT)(dE/dt) (式10) 因此,以E对t作图,如果得到的是直线,则证实上述反应对Br2为一级,并可以从直线的斜率求得kˊ。
甲酸氧化数据
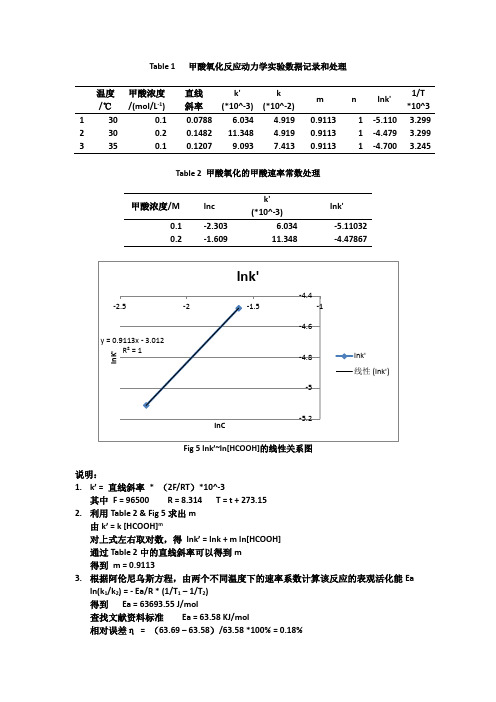
1.k’=直线斜率*(2F/RT)*10^-3
其中F = 96500 R = 8.314 T = t + 273.15
2.利用Table 2 & Fig5求出m
由k’= k [HCOOH]m
对上式左右取对数,得lnk’=lnk+ mln[HCOOH]
通过Table 2中的直线斜率可以得到m
得到m = 0.9113
Fig230℃添加2M的甲酸后电势随时间变化关系图
Fig330℃添加4M的甲酸后电势随时间变化关系图
Fig435℃添加2M的甲酸后电势随时间变化关系图
-4.479
3.299
3
35
0.1
0.1207
9.093
7.413
0.9113
1
-4.700
3.245
Table 2甲酸氧化的甲酸速率常数处理
甲酸浓度/M
lnc
k'
(*10^-3)
lnk'
0.1
-2.303
6.034
-5.11032
0.2
-1.609
11.348
-4.47867
Fig5lnk’~ln[HCOOH]的线性关系图
3.根据阿伦尼乌斯方程,由两个不同温度下的速率系数计算该反应的表观活化能Ea
ln(k1/k2) = - Ea/R * (1/T1–1/T2)
得到Ea =63693.55 J/mol
查找文献资料标准Ea = 63.58 KJ/mol
相对误差η=(63.69–63.58)/63.58 *100% = 0.18%
根据阿伦尼乌斯方程由两个不同温度下的速率系数计算该反应的表观活化能ealnk1k2ear1t11t2得到ea6369355jmol查找文献资料标准ea6358kjmol相对误差636963586358100018y0911x3012r?154525484644424383634323282624222181614121080604020252151lnklnclnklnk线性lnkfig230添加2m的甲酸后电势随时间变化关系图fig330添加4m的甲酸后电势随时间变化关系图fig435添加2m的甲酸后电势随时间变化关系图y0078x1153r?0999051015202530350100200300400500emvts302m302m线性302my0148x3331r?09990102030405060700100200300400500emvts304m304m线性304my0120x2683r?099901020304050600100200300400500emvts352m352m线性352m
甲酸氧化反应动力学测定

课程名称: 实验名称: 中级化学实验 II 指导老师: 王永尧 成绩: _______________ 甲酸氧化反应动力学的测定 实验类型: 同组学生姓名: 尹奇
【实验目的】 1. 用电动势法测定甲酸被溴氧化的反应动力学。 2. 了解化学动力学实验和数据处理的一般方法。 3. 加深理解反应速率方程、反应级数、速率系数、活化能等重要概念和一级反应动力 学的特点、规律。 【实验原理】 甲酸被溴氧化的计量方程如下 HCOOH + Br2 → CO2 + 2H+ + 2Br对该反应,除反应物外,[Br ]和[H+]对反应速率也有影响,严格的速率方程非常复杂。在实 验中,当使 Br-和 H+过量、保持其浓度在反应方程中近似不变时,则反应速率方程式可写成 m n -d[Br2]/dt = k[HCOOH] [Br2] (1) 如果初始的[HCOOH]比[Br2]大得多,可认为在反应过程中[HCOOH]保持不变,这时 n -d[Br2]/dt = k’ [Br2] (2) m 式中,k’ = k[HCOOH] 。 因此, 只要实验测得[Br2]随时间 t 变化的函数关系, 即可确定反应级数 n 和速率系数 k’ 。 如果在同一温度下,用两种不同浓度的 HCOOH 分别进行测定,则可得两个 k’值。 k’1 = k[HCOOH] 1 (3) m k’2 = k[HCOOH] 2 (4) 联立求解式(3)和式(4) ,即可求出反应级数 m 和速率系数 k。 本实验采用电动势法跟踪[Br2]随时间的变化,以饱和甘汞电极(或银|氯化银电极)和 放在含 Br2 和 Br-反应溶液中的铂电极组成如下电池 (-)Hg,Hg2Cl2| KCl- || Br- ,Br2 | Pt(+) 该电池的电动势是
脂肪酸甲酯在甲酸自催化体系中的环氧化和开环反应动力学研究

o f f a t t y a c i d me hy t l e s t e r b y p e r f o r mi c a c i d i n a u t o c a t a l y i t c s y s t e m w a s s t u d i e d .T h e e p o x i d a t i o n r e a c t i o n o r d e s r or f e a c h r e a c t a n t we r e f o u n d t o b e 1 . 4 3 o r d e r wi t l l r e s p e c t o t d o u b l e b o n d s c o n c e n t r a t i o n a n d 1 o r d e r t o he t f o r mi c a c i d
化体 系中的环氧化和开环反应动力学。在环氧化反应 中 , 双键 和过氧 甲酸 的反应级数 分别为 1 . 4 3级和 1级 , 反应活
甲酸还原性的实验研究及热力学分析

甲酸还原性的实验研究及热力学分析摘要甲酸由于其结构的特殊性,因而具有一定的还原性,可被强氧化剂高锰酸钾氧化。
实验研究表明,在托伦反应及斐林反应实验条件下,甲酸既不能被托伦试剂氧化,产生银镜,也不能被斐林试剂氧化,产生氧化亚铜砖红色沉淀。
关键词酸;还原性;托伦反应;斐林反应甲酸与其它有机羧酸相比,其结构的特殊性在于其分子中不存在烃基,是氢原子与羧基直接相连。
在现行的大、中专教材及参考书中,几乎无一例外地认为甲酸分子中既有羧基、又有醛基,因而具有醛的性质,可被弱氧化剂氧化,发生银镜反应和斐林反应,并把银镜反应和斐林反应作为甲酸的鉴别反应安排在有机化学的实验教学中。
在多年的实验教学中发现,学生在做该实验时从未像在做醛的银镜反应哪样得到光亮的银镜,至多是在反应内容物中出现少量黑色颗粒,便认为甲酸已被托伦试剂氧化。
此情况早已引起学者们的注意,不少人对此进行了研究,发表的文章观点不一,多数学者认为通过改变实验条件,如浓度、温度等可使甲酸与托伦试剂反应产生银镜。
2009年孙晓朵等在甲酸还原性研究一文中,通过实验研究及对甲酸的结构分析,提出甲酸既不能发生银镜反应,也不能发生斐林反应。
笔者通过设立对照实验和空白实验对甲酸的还原性再次进行深入的实验研究,同时对甲酸的标准电极电势和银氨配离子的标准电极电势进行了分析比较,研究过程及结果报告如下。
1实验材料及方法1.1仪器及试剂恒温水浴锅、试管、滴管、刻度吸管、水银温度计。
0.3mol·L-1的AgNO3溶液、2mol·L-1的NaOH溶液、2mol·L-1氨水、10%甲酸溶液、10%乙酸溶液、10%甲醛溶液、斐林试剂A、B液、10%甲醛溶液、蒸馏水。
1.2银镜反应实验取4支洁净试管,编号为1,2,3,4,分别加入0.3mol·L-1的AgNO3溶液3ml,再滴加2mol·L-1的NaOH溶液9滴,产生棕色沉淀,再向其中滴加2mol·L-1氨水至沉淀刚好溶解为止。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
演
示
注意事项
思考题
实验目的 实验原理 仪器试剂 实验步骤
演
示
注意事项
思考题
实验目的 实验原理 仪器试剂 实验步骤
演
示
注意事项
思考题
实验目的 实验原理 仪器试剂 实验步骤
演
示
注意事项
思考题
实验目的 实验原理 仪器试剂 实验步骤
演
示
注意事项
思考题
实验目的 实验原理 仪器试剂 实验步骤
实验目的 实验原理 仪器试剂 实验步骤
演
示
注意事项
思考题
实验目的 实验原理 仪器试剂 实验步骤
演
示
注意事项
思考题
实验目的 实验原理 仪器试剂 实验步骤
演
示
注意事项
思考题
实验目的 实验原理 仪器试剂 实验步骤
演
示
注意事项
思考题
实验目的 实验原理 仪器试剂 实验步骤
演
示
注意事项
思考题
实验目的 实验原理 仪器试剂 实验步骤
演
示
注意事项
思考题
实验目的 实验原理 仪器试剂 实验步骤
演
示
注意事项
思考题
实验目的 实验原理 仪器试剂 实验步骤
演
示
注意事项
思考题
实验目的 实验原理 仪器试剂 实验步骤
演
示
注意事项
思考题
实验目的 实验原理 仪器试剂 实验步骤
演
示
注意事项
思考题
具有近红外表面等离子体共振和 催化性能的独立式钯纳米片
西北大学化工学院
生物工程专业 杨敬呈
2010年05月 年 月
摘要
Thin metal film can show quantum size and surface effects, resulting in unique physicaland chemical properties. Metal film contains only a few layers of atoms can beprepared using the deposition substrate, but the thin structure of the independent production remains a major challenge. Here, we report the facile synthesis of less than 10 atomic layers thick hexagonal palladium nanoparticles of independent films, andcarbon monoxide as a limited body surface. The nanocrystalline film is blue, showing a good definition, but tunable surface plasmon resonance peak in the near infraredregion. This combination makes a light and heat stability and biocompatibility ofpalladium nano-film is full of a generation of cancer treatment provided for thereasonable selection of hope. Nanofilm also showed the electrical activity of oxidation of formic acid, greater than the commercial Pd black catalyst of 2.5 times.
演
示
注意事项
思考题
实验目的 实验原理 仪器试剂 实验步骤
演
示
注意事项
思考题
实验目的 实验原理 仪器试剂 实验步骤
演
示
注意事项
思考题
实验目的 实验原理 仪器试剂 实验步骤
演
示
注意事项
思考题
实验目的 实验原理 仪器试剂 实验步骤
演
示
注意事项
思考题
实验目的 实验原理 仪器试剂 实验步骤
演
示
注意事项
