烷烃的异构化反应.
大学化学烷烃的性质
CH3 CH3CCH3
·
CH3CCH3
+ ·H
Δ H = 376 kJ· -1 mol
H 可说明自由基的稳定性: 30R•>20R•>10R•>CH3•
生成自由基, 所需能量越低, 即自由基所 含能量越低, 故越稳定, 越容易形成。
Hammond假说: 活化能高低决定于相应的、与过 渡态稳定性一致的活性中间体的稳定性。即较 稳定的中间体, 其形成时所需活化能也相应较 低. 反应越快, 产物含量越高.
E
过渡态I 过渡态II EaI CH3CH2CH3 +Cl EaII CH3CH2CH3 +Cl
CH2CH2
H
CH3CH2CH2·+ HCl + ·H
CH3CHCH3 H CH3CHCH3 + HCl + ·H
·
在许多有游离基生成的反应中, 游离基的稳定性 支配着反应的取向和活性。
3) 不同X的反应活泼性和选择性:
CH3CH3 + Cl2 420 oC 78% hv 93% Cl +HCl CH3CH2Cl + HCl
+ Cl2
卤代反应历程
反应物转变为产物所经过的途径或过程叫做反应历程 或反应机理。 反应机理是在综合实验事实后提出的理论假说。如果 一个假说能完满地解释观察到的实验事实和新发现的现象, 同时根据这个假说所作的推断被实验所证实, 它与其它有关 反应的机理又没有矛盾, 这个假说则称为反应机理。 通过反应历程可以告诉我们: ① 反应分几步进行? ② 反应的活性中心在哪里? ③ 分子内部如何调整? (包括键的变形、电子云分布
1)环烷烃的自由基取代反应, 常见的是卤代反 应, 反应的活性和环的大小无关。
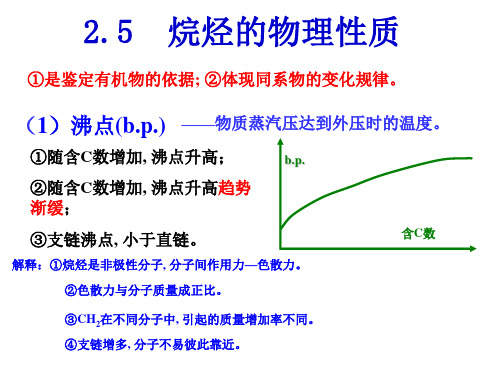
烷烃的化学性质

产率: 45%
55%
异丁烷也有两种氢,即伯氢和叔氢,它的一氯代产物也有两种:
Cl
CH3CHCH3 Cl2 , hv CH3CHCH2Cl + CH3CCH3
CH3
CH3
CH3
产率: 64%
36%
(1) 不同类型氢的活性
为了恒量不同类型氢的相对活性,通过产量可以计算出每类氢的 活性--每类氢中,单位氢原子对产物的贡献。
2. 甲烷氯代反应的历程
实验证明,甲烷氯代反应是自由基取代历程。自由基取代反应一般 要经历三个阶段:即链引发、链传递、链终止。
(1)链引发 在光照或高温下,氯分子吸收能量会发生均裂,生成高活性的氯原子。
Cl:Cl hv 或高温 2Cl· 氯原子吸收了能量,又不满八隅体,有强烈的成键倾向,是一个高
活性的基团。在有机化学中,把这种带有未配对电子的高活性原 子或原子团叫做自由基。上述高活性的氯原子称做氯自由基。产 生自由基的过程就称为链引发。 Cl-Cl 键的离解能为 243 KJ/mol C-H 键的离解能为 435 KJ/mol C-C键的离解能为 346KJ/mol
4. 不同类型氢的活性及 烷基自由基的稳定性
在烷烃卤代中,任何一个氢原子都有被取代的可能。对于CH4和 CH3CH3,都只有一个种氢,所以,一卤代产物只有一种,即: CH3Cl,CH3CH2Cl。
但丙烷有两种氢,即伯氢和仲氢,它的一氯代产物就可能有两种:
CH3CH2CH3
Cl2 , hv
Cl CH3CH2CH2Cl + CH3CHCH3
但是,烷烃的稳定性也是相对的,在较苛刻或特殊的 条件下,也显示出一定的活性。
烷烃的化学性质
烷烃的化学反应主要有两类:一类是C-H键断裂的反应。即H 原子被其它原子或原子团所取代的反应叫取代反应。如果是 被卤素原子取代,则叫卤代反应。
第二章_烷烃

CH3 CH3 600℃
C2H4 + H2
CH4 + C + H2
CH4 >1200℃ C + 2H2
CH3 CH2 CH2 CH3 500℃
CH4 + C3H6
CH3CH3 + C2H4 C4H8 + H2
• 将有害的烃类化合物转化为低毒性的醇类化合物
• 将核苷酸转化为脱氧核苷酸
• 无用的自由基对细胞毒害很大
自由基清除剂 (radical scavengers)
(对苯二酚)
(半醌)
生物体内存在的自由基清除剂
➢氧化反应
CH4 + 2O2 燃烧 CO2 + 2H2O + 891 kJ mol-1 适当条件下可部分氧化为醇、醛、酮、羧酸等含氧化合物。
如果位次和相同,则从取代基较不优先的一 端开始
• 列出取代基
根据优先基团后列出的原则 (英文按字母顺 序),在母体名称前依次列出取代基的位置、 数目、名称
3-甲基-5-乙基辛烷
7-甲基-3,3,6-三乙基癸烷
根据下面化合物的名称,画出结构式
a. 2,3-二甲基己烷 b. 2,4,5-三甲基-4-异丙基庚烷 c. 4,4-二乙基癸烷
• 反应性和选择性
• 不同卤素的反应性
F2 > Cl2 > Br2 > I2
• 不同卤素的选择性
自由基形成的相对速率
• 反应性-选择性原则
反应性越强,选择性越低
➢
➢
如果甲基环己烷与Cl2和Br2发生卤代反应, 哪个反应可以得到更多的1-卤-1-甲基环己 烷?
溴代反应
生物体中的自由基反应
不溶于水,能溶于某些低极性有机溶剂 (苯、氯仿、四氯化碳等)
烷烃课时教案

教案烷烃课时教案一、教学目标:1.知识与技能:(1)了解烷烃的定义、分类和命名方法;(2)掌握烷烃的物理性质和化学性质;(3)了解烷烃的用途和实际应用。
2.过程与方法:(1)通过观察实验现象,培养学生的观察能力和实验操作能力;(2)通过讨论和分析,提高学生的思维能力和解决问题的能力;(3)通过实际应用,培养学生的实践能力和创新能力。
3.情感态度与价值观:(1)培养学生对化学学科的兴趣和热情;(2)培养学生良好的科学态度和合作精神;(3)增强学生的环保意识和责任感。
1.烷烃的定义、分类和命名方法;2.烷烃的物理性质和化学性质;3.烷烃的用途和实际应用。
三、教学重点与难点:1.教学重点:(1)烷烃的定义、分类和命名方法;(2)烷烃的物理性质和化学性质;(3)烷烃的用途和实际应用。
2.教学难点:(1)烷烃的命名方法;(2)烷烃的化学性质。
四、教学方法:1.讲授法:讲解烷烃的定义、分类和命名方法;2.实验法:观察烷烃的物理性质和化学性质;3.讨论法:分析烷烃的用途和实际应用。
1.导入新课:通过生活实例,引出烷烃的概念;2.讲解烷烃的定义、分类和命名方法;3.实验观察烷烃的物理性质和化学性质;4.讨论烷烃的用途和实际应用;5.总结本节课的主要内容;6.布置课后作业。
六、教学评价:1.课堂表现:观察学生在课堂上的参与程度、积极性和合作精神;2.作业完成情况:检查学生对烷烃知识的掌握程度;3.实验报告:评估学生的实验操作能力和观察能力;4.期末考试:检验学生对烷烃知识点的掌握程度。
七、教学反思:本节课结束后,教师应认真反思教学效果,分析学生的掌握程度,针对存在的问题进行改进,以提高教学质量。
同时,教师应关注学生的兴趣和需求,不断调整教学内容和方法,激发学生的学习兴趣,培养学生的实践能力和创新能力。
注:本教案仅供参考,具体教学过程中可根据实际情况进行调整。
重点关注的细节:烷烃的化学性质补充和说明:1.烷烃的稳定性烷烃是一类非常稳定的化合物,其分子中的碳-碳键和碳-氢键都是单键,具有较强的键能。
C_5_C_6正构烷烃异构化反应的热力学分析

0. 340 0. 276 0. 242 0. 212 0. 1 3 81. 1 79. 0 77. 1 74. 5 72. 1 70. 6
1) Equilibrium conversion
Abstract : Thermodynamic analysis on t he n C5 , n C6 paraffin isomerization reaction was worked out in detail. The t hermodynamic equilibrium parameters , product dist ribution and conversion of The effect s of reaction isomerization at different temperat ures were obtained by calculation. were also discussed. Key words :pentane ;hexane ;isomerization ;t hermodynamic calculation
( 5) ( 6)
式中 x nC0 、 x iC0 、 x i C0 分别代表平衡时正戊烷 、 异戊烷和季戊烷的摩尔分数 ; Kp1 、 Kp2 分别是两个独立反应 5 5 5 的定压平衡常数 ; P 是反应的总压 。 另外还有一个包含所有组分摩尔分数的加和式
x n C0 + x i C0 + x i C0 - 1 = 0 5 5 5 ( 7)
THERMODY NAMIC ANALYSIS ON n C5 , n C6 PARAFFIN ISOMERIZATION
刘铁生 , 何奕工
L IU Tie2sheng , HE Yi2gong
烷烃及其化学性质

30 H : 20 H : 10 H = 22%/1 : 33%/2 : (15%+30%)/9
0 0 0 自由基的稳定性: > CH3 3 C > 2 C > 1 C 卤化反应活化能:30H > 20H > 10H>CH4 当T >300℃,氢的活性差别缩小。T越高,差别越小,最后基本上无差别
北京化工大学有机化学Page 7 of 18
北京化工大学有机化学Page 4 of 18
烷烃氯化反应的机理----自由基取代反应机理
(2) Cl + CH 4 (3) CH 3 + Cl2 CH 3 + HCl CH 3Cl + Cl H = 7.5 KJ/mol H = -112.9 KJ/mol
活化能 过渡态
能 量 (
[Cl H CH3 ]
CH 3 + HCl CH 3Cl + Cl
H = 7.5 KJ/mol H = -112.9 KJ/mol
链终止
(4) Cl (5) Cl (6) CH 3
+ Cl + CH 3 + CH 3
Cl2 CH 3 Cl CH 3 CH 3
H = -242.7 KJ/mol H = -355.6 KJ/mol H = -376.6 KJ/mol
CH4
C H 3C H 2C H 2C H 3 R C H 2C H 2R '
石蜡(C20~C60) 复杂产物,难分离,用作肥皂,表面活性剂等的原料
北京化工大学有机化学Page 16 of 18
烷烃的异构化反应
AlCl3 , HCl
CH3CH2CH2CH3
95-150 0C , 1-2MPa
正构烷烃临氢异构化反应的研究综述

正构烷烃临氢异构化反应的研究综述正构烷烃临氢异构化反应的研究综述摘要:综述了近年来正构烷烃在分⼦筛为载体的双功能催化剂上临氢异构化反应机理的研究进展,介绍了单分⼦机理、双分⼦机理、孔⼝机理及锁匙机理。
同时,综述了近年来临氢异构催化剂的发展,介绍了β分⼦筛、丝光沸⽯、SAPO 系列分⼦筛、固体超强酸等为载体的双功能催化剂。
最后,对反应机理在制备新型催化剂领域的应⽤以及新型复合材料在这⼀领域的应⽤前景做了展望。
关键词:正构烷烃,临氢异构,反应机理,催化剂1 前⾔随着环保法规的要求⽇益严格以及⼈们环保意识的增强,⽯油产品的质量规格⽇益提⾼,⼈们对清洁汽油、柴油和润滑油等产品的需求不断增加,因⽽加氢异构化作为⽣产优质⽯油产品的技术越来越受到⼈们的重视。
在汽油的⽣产中,利⽤加氢异构化技术可以提⾼⾟烷值;在柴油和润滑油的⽣产中,通过加氢异构化可以降低凝点或倾点,改善润滑油的粘温性质,同时保持较⾼的产品收率。
加氢异构化技术还可以改善产品的结构。
现代炼油⼯业为了充分利⽤⽯油资源,对重质油的加⼯越来越多,在重油的加氢裂化⼯艺中,提⾼催化剂的异构化性能可以多产中间馏分油。
因此,对于烷烃的临氢异构化反应进⾏深⼊的研究,了解异构化反应的途径,揭⽰反应规律,可为催化剂的设计提供更好的思路,具有⼗分重要的意义。
2 临氢异构反应机理2.1 单分⼦反应机理正构烷烃在双功能催化剂上进⾏加氢异构化反应,部分通过烷基正碳离⼦中间体进⾏。
其中,异构化反应可通过两条途径来实现[1]:(1)烷基迁移,即A型异构化;(2)质⼦⾓-⾓迁移,即B型异构化,如图1所⽰。
其中A型异构化机理能够改变侧链的位置,但不改变分⼦中伯、仲、叔和季碳的原⼦个数,经历了⼀个烷基正碳离⼦环化过程,⽣成⾓状质⼦化的环丙烷结构的中间体(简称CPCP),随后环丙烷开环;⽽B型异构化机理能够改变⽀链度,随之改变分⼦中伯、仲、叔和季碳的原⼦个数,通常发⽣在CPCP开环之前,质⼦先进⾏⾓-⾓迁移,然后经过取代质⼦化环丁烷(简称CPCB)⽣成⼄基侧链的烃。
烷烃异构化的研究进展

烷烃异构化的研究进展[摘要] 对目前烷烃异构化催化剂进行了概述。
随着世界环境保护意识的提高,降低污染、改善燃料油品性能已成为全球性关注的问题。
近几年,出现了许多新的烷烃异构化生产技术,其中固体超强酸、钨基催化剂及分子筛催化剂的研究进展较快。
重点概述了各类催化剂的性能及优缺点。
对烷烃异构化催化剂的发展进行了展望。
[关键词] 异构化催化剂进展烷烃烷烃异构化是将低辛烷值的直链烷烃转化为高辛烷值的支链烷烃,其反应为可逆平衡反应,其中异构烷烃的总键能低于正构烷烃,因此异构化过程的△H 为负值,平衡常数KP 随温度的升高而降低,降低温度有利于生成多支链异构烷烃,产物的辛烷值也较高[1]。
从动力学看,尽管烷烃异构化的反应速率相对较快,可以说基本上处于平衡,但就提高其转化速度而言,异构化反应仍需在相当高的温度下进行,但温度升高,副反应(裂化)随之加剧,这就产生了异构化目的产物与转化速度的矛盾。
要维持低温反应而获得较多高辛烷值的异构化产物,同时又有较大的处理量(高转化速度),必须借助催化剂抑制副反应,使反应向有利于异构化反应的方向进行。
因此,烷烃异构化催化剂的研究在油品性能改进方面就显得尤为重要。
1、传统烷烃异构化催化剂简介烷烃异构化催化剂按反应温度的不同可分为:高温型,低温型和中温型催化剂[1]。
1.1 高温型催化剂早期开发的高温型催化剂有Pt/SiO2-Al2O3 等,其操作温度均为400℃。
这类催化剂具有较强的抗毒物能力,但由于高温对异构产物热力学平衡浓度不利,而对加氢裂解反应有利,其结果是单收率和产品辛烷值较低,因此这类催化剂实际上已被淘汰。
对这方面的报道主要集中在反应机理的研究。
1.2 中温型催化剂中温型催化剂一般为含沸石的双功能催化剂(如Pt/氢型丝光沸石)。
目前,国外采用的Pt/HM 催化剂,如UOP 公司的I-7 和Hysomer 异构化催化剂等中温型催化剂,操作温度为210℃~280℃,可以再生。
