小鼠肿瘤模型
建立小鼠肿瘤模型的研究进展

建立小鼠肿瘤模型的研究进展摘要:建立一种理想的肿瘤动物模型对研究肿瘤的发病、治疗和预防有重大的意义。
其中小鼠肿瘤模型具有生长周期快、易获得、易操作等优点被基础实验研究所广泛采用,如何选择和建立一个合适的小鼠肿瘤模型对肿瘤的整个研究有着举足轻重的作用。
关键字:肿瘤,动物模型,小鼠肿瘤,是一种严重威胁人类健康的多发病和常见病。
对肿瘤的研究一般都是在人类疾病动物模型的基础上展开的。
建立一个完全反映人类疾病的动物模型比较困难,但可依据不同的实验目的选择相应的动物实验模型。
1.实验动物的选择可用作肿瘤模型的动物有很多,小鼠肿瘤模型作为其中一种常用模型主要因为有以下几个优点。
(1)易获得,常用的肿瘤模型小鼠通常采用SPF级小鼠,SPF级小鼠一般医学院校及研究所都能买到。
(2)生长周期短,一般小鼠肿瘤模型两周左右就能长大,能大大缩短实验周期。
(3)易操作,小鼠的动物实验操作一般简便,因此可适当增加组内样本数量,使实验数据更具说服力。
2.理想的建立肿瘤模型应具备的条件(1)肿瘤生长的过程应与人类肿瘤生长过程相似,做到尽可能复制出与人类肿瘤相同的模型。
(2)制作模型的方法简单易行。
(3)动物模型的重复性要好,要能满足实验的多次重复试验结果稳定性好。
(4)采用的建模方法对实验人员和环境无危害或危害较小。
3.肿瘤来源的选择现在世界上保有近500种的动物移植瘤,但常用于筛药的不到40种,多数为小鼠肿瘤,其次是大鼠和仓鼠移植瘤,包括小鼠L1210淋巴白血病,P1534淋巴白血病,艾氏腹水瘤,Friehd病毒白血病,肉瘤180,白血病P388,Lewis肺癌,腺癌755,白血病615,Walker-256,吉田肉瘤,肉瘤45,Liol淋巴瘤,Dunning 白血病,Wagner癌肉瘤,白血病L5170Y,P1798淋巴肉瘤,LPC-1浆细胞瘤,淋巴瘤8,B16或Cloadman黑色素瘤,Ridaway骨肉瘤,Gardner 淋巴肉瘤,肉瘤37,P315白血病,Mur hy-sturm淋巴肉瘤,Jensen肉瘤,Geurin氏癌,仓鼠十二指肠腺癌和人体肉瘤HSL第1代杂交鼠移植。
小鼠肿瘤模型的建立方法及评价手段

小鼠肿瘤模型的建立方法及评价手段动物模型的建立是进行医学科研工作的重要研究手段之一。
肿瘤是机体自身与外界施加因素之间对立平衡,外界因素的干扰逐渐被机体所转化和接纳,从而形成肿瘤。
因此,任何影响正常机体内外环境和施加因素的条件均可改变肿瘤形成的起始、进展和结局。
本文就几种肿瘤动物模型的建立过程,对不同模型特点和选择进行评价。
标签:肿瘤;动物模型;评价方法人类疾病的发展过程十分复杂,为深入探讨疾病的发生机制以人体作为实验对象存在很多的局限性,而且很多的实验方法在道义上也受到限制。
人类疾病动物模型是在医学科学研究中建立的具有人类疾病模拟性表现的动物疾病材料。
借助于动物模型来间接研究一些疾病的发病全过程,从而更方便、更有效、更全面的认识人类疾病的发生发展规律,同时也避免了人体实验造成的伤害。
目前已展现出大量建立肿瘤动物模型的方法,本文做一综述。
1 小鼠肿瘤动物模型的类型及建立方法1.1 自发性小鼠肿瘤模型自发性肿瘤是指实验动物在自然情况下,未经任何有意识的人工处理而发生的肿瘤。
其发病特征和人类肿瘤很相似,所以对人类肿瘤的研究有很高的价值,而且,自发肿瘤的产生可提供前瞻性和回顾性研究。
若自发性肿瘤没有人为因素的干扰,则更接近于人体肿瘤的真实状态。
然而,与人类疾病完全相同的动物自发性疾病模型并不多,且样本数量有限,而且,在自然状态下,细胞癌变的概率较低,故很难得到条件满足、数量足够的动物模型,所以该法在研究中很少使用。
1.2 诱发性小鼠肿瘤模型人为地运用各种致癌因素作用于实验动物的特定组织或器官,从而产生相应肿瘤,这就是诱发性动物肿瘤模型。
给药途径和诱导剂的不同,导致最后生成的肿瘤的类型有差异,其成瘤率也不一样。
化学诱导的肿瘤属实验动物的原发肿瘤,其发病机制及肿瘤生长环境接近于人体原发肿瘤,建立方法相对简单,实验重复性好,因此目前运用较为广泛。
但该方法诱导周期仍较长,成瘤率与移植法相比也有一定差距[1-2]。
这些肿瘤免疫小鼠模型,别说你不知道

这些肿瘤免疫小鼠模型,别说你不知道订阅号APExBIO要说当今社会哪种癌症治疗手段最火热,癌症免疫疗法(Cancer Immunotherapy)当之无愧。
科学家们热衷于从免疫系统着手消灭肿瘤细胞。
自美国詹姆斯·艾利森(James P. Allison)和日本免疫学家本庶佑(Tasuku Honjo)因其开创性的癌症治疗方法获得2018年诺贝尔医学奖后,更是为癌症的免疫治疗增添了热度。
虽说免疫检查点抑制剂、癌症疫苗和细胞治疗等方面取得的成就为患者带来了希望,然而建立可以模拟人类疾病的免疫活性小鼠模型仍是一个重大挑战。
免疫疗法的临床前研究需要具有完整功能免疫系统的体内模型。
当前的临床前免疫治疗小鼠模型包括同源肿瘤模型、基因工程小鼠模型和人源化肿瘤模型,本文将浅谈这几种模型。
一、同源肿瘤模型▲同源肿瘤模型(Syngeneic tumor models)。
利用在体外生长和扩增的鼠肿瘤细胞系,将其注射(通常皮下或原位)到免疫活性(Immune-competent)宿主中。
这是最早出现和最常使用的临床前模型。
同源肿瘤模型是将永生化的小鼠肿瘤细胞系接种到近交品系小鼠中形成的同种移植模型。
肿瘤细胞系可以是自发性的、致癌物诱导的或转基因的。
受体小鼠拥有完整的鼠源免疫系统,具有完全的免疫活性(immuno-competent),且该免疫系统与同种移植肿瘤组织相容。
▲常见的同源肿瘤小鼠模型整理(包括鼠肿瘤细胞系、癌症类型、鼠宿主和使用的药物)同源模型易于建立,且有良好的免疫应答。
可以用免疫检查点抑制剂(例如抗PDL-1,抗PD-1,抗-CTLA-4)等药物来评估荷瘤小鼠中肿瘤免疫疗法的效果。
同源细胞系可以在实验室中轻松培养和大量扩增,这种模型价格低廉,操作起来相当简单且重复性强。
同系模型的另一个优点是宿主的免疫系统是正常的,这可能最大化模拟肿瘤微环境的真实生活情况。
缺点是移植的小鼠组织可能无法完全代表临床情况下人类肿瘤的复杂性。
肿瘤实验动物模型

肿瘤实验动物模型
无论从大体形态及组织学分析,均与人类 的腺癌相似,而且也大都发生于胃窦部, 而且可以培养为用于移植的自发瘤,在实 验室可作为“癌库”,瘤体可维持很长时 间,为活体或离体实验提供必要的材料
胰腺癌动物模型
实验目的:采用某些亚硝胺物质在大鼠中诱发胰 腺癌 实验动物 :Wistar大鼠,体重100g以上 实验方法 :按照500mg/kg BHP,或700mg/kg BAP,或10mg/kg B0P的剂量,每星期皮下注射 一次,在短短的8~10个星期之内,便能几乎100 %地诱发胰腺癌。用于溶解BHP和BOP的是0.9% 生理盐水,而用于BAP的则是橄揽油。侧腹部是 较合适的注射部位
肝癌动物模型
实验目的 :化学诱导法和人肝癌的原位移植制作 肝癌动物模型 实验动物:Wistar大鼠 实验方法:用1.23μmol的乙硫氨酸给大鼠灌胃。4 小时后即可见肝细胞内有脂肪沉着,以后随着时 间的推移而加剧。在24~48小时达到高峰,此时 肝内的脂肪含量约为正常的20倍。本法引起的肝 脏病变主要为脂肪变性,很少或没有肝细胞的坏 死。若以0.5%的浓度连续喂养动物2个月,可引 起胆管增殖及结节性肝硬化;若持续给药8~9个 月,有些动物可发生肝癌
实验参考结果
原位移植瘤的生长特点:建立的人肝癌裸鼠原位移植瘤呈 园形、椭园形成呈分叶状,少数移植瘤有完整的包膜形成, 多数移植瘤与周围组织粘连,无完整的包膜形成,瘤体周 围血管丰富 原位移植瘤保留了原人体原发瘤的形态学特点和功能。人 肝癌移植瘤具有典型的人肝癌细胞的形态学特征。形态上 其细胞形状、组织结构、细胞类型和分化程度均保持一致。 超微结构观察移植瘤细胞间可见毛细胆管和丰富的血窦。 功能上保持分泌人甲胎蛋白CEA的功能长期不丧失 原位移植瘤的侵袭和转移的特征:人肝癌不仅在裸鼠肝内 生长成瘤,而且侵袭和移植。较皮下移植模型更客观地模 拟了人肝癌的侵袭和移植规律
肿瘤正位小鼠模型建立

人舌癌颈淋巴结转移模型[1]Animals: male BALB/c-nu/nu nude mice(5 weeks old; weight, 17 to 20 g; 49 mice in 4 batches), 种植肿瘤后,喂软食物及提高食物蛋白含量。
Cells:1.所有样品来自同一患者(左舌部分化良好鳞状细胞癌伴左侧颈淋巴结转移)转移淋巴结组织。
2.新鲜淋巴结转移灶置于含10%血清和1%青霉素-链霉素双抗的RPMI-1640培养基中,仔细移除肿瘤囊外结缔组织,将肿瘤组织切成1*1*1mm3小块(刚过106个,保证99%的细胞能存活)。
3.从获得组织到种植要在2h之内。
Surgical procedures:2%氯胺酮腹腔麻醉;小鼠舌部1%碘棉球消毒;切口2mm深、2mm长于舌部middle third right margin;肿瘤样品(1 mm3)种植于舌部肌肉;缝合;均由一个人操作,操作时间7-10min/只;密切观察。
后续工作:每只老鼠切下2-3个淋巴结;每个淋巴结切成两半,一半用于HE染色,一半继续注入小鼠舌部;肿瘤生长时间为4w/批;总共种植4次。
种植肿瘤生长转移观察:种植肿瘤后4w,断颈,称重,解剖;舌、淋巴结、肺组织浸于10%福尔马林;石蜡包埋;3-4ul切片厚度;HE染色;组织学观察,观察3-5个区域,有一切片观察到转移肿瘤细胞则可认为此淋巴结有转移。
免疫组化染色:为了确定转移淋巴结肿瘤细胞来自人,用mouse monoclonal IgG2a cytokeratin (SC-6258; Santa Cruz Biotechnology, Santa Cruz, CA)1:100稀释,其中阳性对照用患者原始肿瘤细胞,阴性对照使用同样肿瘤细胞但不使用一抗。
小鼠状况:种植后前两周状态良好,之后进食困难,采用处理后食物喂养,第四周时,小鼠体重没有显著性减少(P>0.05),没有恶病质死亡小鼠。
小鼠肺癌模型
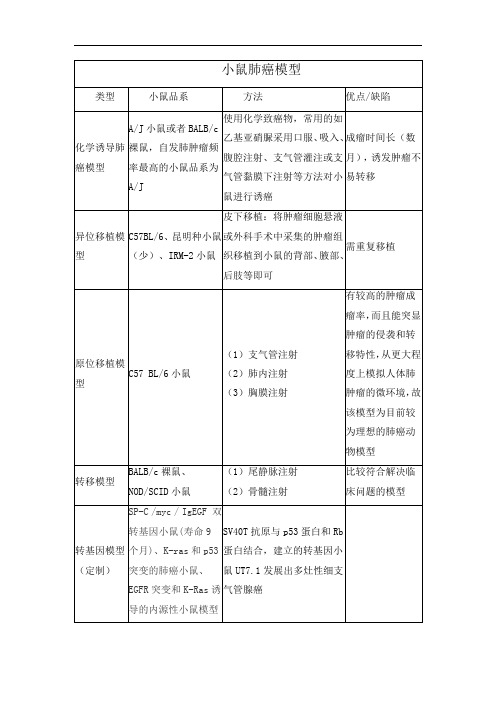
(1)尾静脉注射
(2)骨髓注射
比较符合解决临床问题的模型
转基因模型(定制)
SP-C /myc / IgEGF双转基因小鼠(寿命9个月)、K-ras和p53突变的肺癌小鼠、EGFR突变和K-Ras诱导的内源性小鼠模型
SV40T抗原与p53蛋白和Rb蛋白结合,建立的转基因小鼠UT7.1发展出多灶性细支气管腺癌
皮下移植:将肿瘤细胞悬液或外科手术中采集的肿瘤组织移植到小鼠的背部、57 BL/6小鼠
(1)支气管注射
(2)肺内注射
(3)胸膜注射
有较高的肿瘤成瘤率,而且能突显肿瘤的侵袭和转移特性,从更大程度上模拟人体肺肿瘤的微环境,故该模型为目前较为理想的肺癌动物模型
转移模型
小鼠肺癌模型
类型
小鼠品系
方法
优点/缺陷
化学诱导肺癌模型
A/J小鼠或者BALB/c裸鼠,自发肺肿瘤频率最高的小鼠品系为A/J
使用化学致癌物,常用的如乙基亚硝脲采用口服、吸入、腹腔注射、支气管灌注或支气管黏膜下注射等方法对小鼠进行诱癌
成瘤时间长(数月),诱发肿瘤不易转移
异位移植模型
C57BL/6、昆明种小鼠(少)、IRM-2小鼠
肿瘤小鼠造模方法

肿瘤小鼠造模方法肿瘤小鼠模型是研究肿瘤发展、治疗和预防的重要工具。
通过模拟人类肿瘤的形成和发展过程,可以更好地了解肿瘤的病理生理特征,并为肿瘤的早期诊断和治疗提供有益的信息。
下面我们将介绍几种常用的肿瘤小鼠造模方法。
1. 异种移植模型异种移植模型是最常用的肿瘤小鼠模型。
它通过将人类肿瘤细胞或肿瘤组织移植到小鼠体内形成肿瘤。
该方法可以用于研究肿瘤的生长、转移、侵袭和药物敏感性等方面。
在异种移植模型中,首先需要获取人类肿瘤细胞或肿瘤组织样本。
常用的来源包括人类肿瘤细胞株、肿瘤切片、肿瘤移植瘤等。
然后,将这些样本注射到小鼠体内,通常是通过皮下注射、腹腔注射或静脉注射的方式。
注射后,观察肿瘤的生长情况,定期测量肿瘤体积,并进行影像学检测以评估肿瘤的进展和治疗效果。
2. 转基因小鼠模型转基因小鼠模型是通过改变小鼠基因组中的特定基因,使其表达或缺失某种特定基因,从而模拟人类特定基因异常引起的肿瘤。
这种模型常用于研究特定基因对肿瘤发生和发展的影响。
转基因小鼠模型的制备通常分为两个步骤:基因敲除和基因敲入。
基因敲除是指将目标基因从小鼠基因组中彻底删除,而基因敲入是指将目标基因导入小鼠基因组中,使其表达或缺失。
基因敲除通常采用胚胎干细胞技术。
首先,通过体外培养的方法获得小鼠胚胎干细胞,然后,通过基因编辑技术,将目标基因从胚胎干细胞基因组中删除。
最后,将这些基因敲除的胚胎干细胞注入到小鼠的早期胚胎中,使其发育成为具有目标基因敲除的小鼠。
基因敲入通常采用质粒转染、病毒载体转染或基因修复等方法。
通过以上方法,将目标基因导入小鼠的基因组中,使其表达或缺失。
这种模型的制备过程比较复杂,需要专业的实验条件和技术支持。
3. 化学诱导模型化学诱导模型是通过给予小鼠特定的诱癌物,如化学物质或药物,来诱发肿瘤的形成。
这种模型可以模拟某些环境因素或生理机制与肿瘤发生的关系。
在化学诱导模型中,首先选择合适的诱癌物,如DMBA(二甲基苯并[a]芘)、DEN(二乙胺)等。
(完整)小鼠肿瘤模型

肿瘤模型我们一般常用的就是小鼠模型和人肿瘤裸小鼠移植瘤模型。
其中用得最多的是皮下模型,另外还有腹水(或者尾静脉注射)以及原位模型,其他的模型很少用,就不提他们了。
小鼠模型分三大类:第一类是以S180、EAC、H22等为代表的,他们的宿主小鼠多选用KM,可产生腹水,也可在皮下成瘤。
多以腹水传代,实验时抽取腹水,经过一定稀释后皮下接种构建模型,接踵后第二天开始给药,给药7到10天,接种10天后结束试验,剥取肿瘤称瘤重.1。
关于构建瘤种可以用体外细胞株培养后,用PBS悬浮至1~3×106/0。
1ml/mouse,i.p接种即可,最好用6号左右的针头,就是常用的2ml一次性注射的针头.2. 关于腹水传代观察到第一代的种鼠肚子较大后(一般约8~9天左右),可以传代,传代时取1ml注射器,用2ml注射器的针头,种鼠腹部消毒后直接将针头插入抽取腹水即可,注意不要把针头插得很深,尽量浅一点,还可以把老鼠拎起来,利用重力,让腹水集中在某处便于抽取,一般抽个0.5ml就可以了,不用离心,直接用PBS3~6倍稀释后,接种到新的老鼠腹腔,腹水颜色为白色或者略有发黄都是正常的,但是血性腹水说明不好,需要注意调整,第二代以后,尽量6~7天的时候传代,不要等的时间太久,否则腹水容易血性。
三代后可用于试验。
3. 关于接种进行试验这个时候抽取的腹水需要量比较多,一般需要处死种鼠后,小心地用消毒眼科剪刀镊子剥开腹部皮肤,注意不要弄破肌肉,然后,用镊子(最好是哪种前面有倒勾的镊子,学名好像是唇型镊)拎起腹部的肌肉,用剪刀剪开一个小口,然后用玻璃滴管或者去掉针头的注射器吸取腹水。
然后进过一定的稀释后,接种到小鼠的腋下.关于稀释量,各个实验室的情况都不一样,最好摸索一下,开始的时候可以适当的计数,但是要用台盼兰染色后计活细胞数。
接种部位在小鼠腋下,但是不要深入到腋窝里面,会给以后的操作带来麻烦。
接种时的进针处离接种处远一点,让针头在皮下多走一段,不容易污染。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
肿瘤模型我们一般常用的就是小鼠模型和人肿瘤裸小鼠移植瘤模型。
其中用得最多的是皮下模型,另外还有腹水(或者尾静脉注射)以及原位模型,其他的模型很少用,就不提他们了。
小鼠模型分三大类:第一类是以S180、EAC、H22 等为代表的,他们的宿主小鼠多选用KM可产生腹水,也可在皮下成瘤。
多以腹水传代,实验时抽取腹水,经过一定稀释后皮下接种构建模型,接踵后第二天开始给药,给药7到10天,接种10天后结束试验,剥取肿瘤称瘤重。
1.关于构建瘤种可以用体外细胞株培养后,用PBS悬浮至1~3X 106/mouse,接种即可,最好用6号左右的针头,就是常用的2ml 一次性注射的针头。
2.关于腹水传代观察到第一代的种鼠肚子较大后(一般约8~9 天左右),可以传代,传代时取1ml注射器,用2ml注射器的针头,种鼠腹部消毒后直接将针头插入抽取腹水即可,注意不要把针头插得很深,尽量浅一点,还可以把老鼠拎起来,利用重力,让腹水集中在某处便于抽取,一般抽个就可以了,不用离心,直接用P BS3~6倍稀释后,接种到新的老鼠腹腔,腹水颜色为白色或者略有发黄都是正常的,但是血性腹水说明不好,需要注意调整,第二代以后,尽量6~7 天的时候传代,不要等的时间太久,否则腹水容易血性。
三代后可用于试验。
3.关于接种进行试验这个时候抽取的腹水需要量比较多,一般需要处死种鼠后,小心地用消毒眼科剪刀镊子剥开腹部皮肤,注意不要弄破肌肉,然后,用镊子(最好是哪种前面有倒勾的镊子,学名好像是唇型镊)拎起腹部的肌肉,用剪刀剪开一个小口,然后用玻璃滴管或者去掉针头的注射器吸取腹水。
然后进过一定的稀释后,接种到小鼠的腋下。
关于稀释量,各个实验室的情况都不一样,最好摸索一下,开始的时候可以适当的计数,但是要用台盼兰染色后计活细胞数。
接种部位在小鼠腋下,但是不要深入到腋窝里面,会给以后的操作带来麻烦。
接种时的进针处离接种处远一点,让针头在皮下多走一段,不容易污染。
有的人接种的时候喜欢针头向上用力,紧贴着表皮往里走,然后注射的时候感觉阻力较大,打出来的皮丘又紧又圆,这样的接种,会使肿瘤与皮肤严重粘连,不利于最后肿瘤的剥取。
也不要紧靠肌肉,肿瘤会与肌肉严重粘连。
应该在两者之间,进针的感觉轻松自如,针头很自由,虽然打出来的肿瘤不会很圆很漂亮,但是相对好剥取一些。
4.关于观测指标主要是按时称体重,试验结束后剥取肿瘤称瘤重。
因为出瘤已经是接种后的第6 天左右了,第10 天就结束时间,瘤体积的数据意义就不大。
小鼠肿瘤很难剥,这是没有办法的,只能耐心,没有太好的办法,剥多了以后,手上会掌握一些巧力,有一些帮助,但是我们还是很头痛小鼠肿瘤试验结束。
肿瘤组织周围经常会有一些血窦的形成,弄破后会有血和黄色的液体流出,正常的,但是剥瘤子的时候不要把它弄破,会严重影响瘤重。
按照SFDA勺规定,平均瘤重小于1g, 或者单个瘤重小于200mg认为肿瘤生长不良,试验作废。
小鼠模型第二类是以lewis 肺癌、B16 为代表勺,他们勺宿主多为C57。
不产生腹水,只能皮下生长。
多用插块法或者匀浆法传代和接种做试验。
有一种做法也是接种后第二天开始给药,是接种三天后还有一种做法给药,接种后两周结束试验,剥取肿瘤称重。
1.关于瘤种构建体外细胞株,培养后PBS悬浮至1~3X 106/site,接种至小鼠腋下,即可。
2.关于传代与接种剥取肿瘤,在PBS中取出肿瘤表面包膜和中心的坏死部分,剪刀剪成小块,小块大小以套管针勺针口为标准。
用镊子将小块从针头处塞进18~20号的套管针,接种至小鼠腋下,用套管针中间的实体针将瘤块推出即可。
还可以在上述肿瘤组织剪成小块后,用玻璃匀浆器匀浆后,200目筛网过滤,收集滤液,活细胞计数,PBS稀释后用注射器接种,稀释量也需要各个实验室自己摸索。
也是三代后可用于试验。
3.关于观测指标可以在出瘤后测量瘤体积,但是主要还是考察瘤重。
小鼠模型第三类是以P388、L1210 为代表的白血病模型。
宿主为DBA2也有人用C57与DBA2的F1代传代,DBA2用于试验,但是我们两种宿主都传过代,没有发现有什么区别。
他们能形成腹水,一般不用于皮下接种试验,平时多用腹水传代,实验时多用腹腔接种或尾静脉接种考察生存时间。
也是接种后第二天开始给药这个就不细说了,很多可以参考第一类,主要几点就是,他们的腹水都是血性的。
另外,腹水量也不多,有的时候可以先注射一到两毫升的PBS后,再抽取。
肿瘤模型构建小鼠模型分三大类第一类是以S180EACH22等为代表的,他们的宿主小鼠多选用KM 可产生腹水,也可在皮下成瘤。
多以腹水传代,实验时抽取腹水,经过一定稀释后皮下接种构建模型,接种后第二天开始给药(这里与指导原则相悖,指导原则要求肿瘤长至100-300立方毫米时才给药),给药7到10天,接种10天后结束试验,剥取肿瘤称瘤重。
1. 构建瘤种可以用体外细胞株培养后,用PBS悬浮至1~3X 106/mouse,接种即可,最好用6号左右的针头,就是常用的2ml 一次性注射的针头。
细胞悬液接种时要选活力好的细胞,就是对数期。
细胞生长至瓶底70~80%满的时候认为是对数生长期。
2. 腹水传代观察到第一代的种鼠肚子较大后(一般约8~9天左右),可以传代,传代时取1ml注射器,用2ml注射器的针头,种鼠腹部消毒后直接将针头插入抽取腹水即可,注意不要把针头插得很深,尽量浅一点,还可以把老鼠拎起来,利用重力,让腹水集中在某处便于抽取,一般抽个就可以了,不用离心,直接用P BS3~6倍稀释后,接种到新的老鼠腹腔,腹水颜色为白色或者略有发黄都是正常的,但是血性腹水说明不好,需要注意调整。
第二代以后,尽量6~7天的时候传代,不要等的时间太久,否则腹水容易血性。
三代后可用于试验。
腹水瘤接种时,接种量不要太高,1*107/ml,即可,多按1:3用生理盐水稀释,否则有可能腹水血性。
超过7天的腹水再传代,动物的周龄太大(>6周), 传代次数太多也很容易出现血性腹水。
一般小鼠肿瘤模型都控制在30 多代以内(也有说50 多代的)。
出现血性以后可以调整一下:血性腹水可以离心后加的NH4CL容液破红细胞,然后精确控制条件(接种量,传代时间, 动物周龄等)传几代,很多情况下再传一两代后会有无腹水血性的种鼠出现,然后用这只种鼠的腹水继续传代。
腹水难抽有几种情况,要么接种天数不够,腹水不够多,一般要等动物肚子很大了才去抽。
要么就是压力的问题。
有的动物腹水很稠。
这时可撕开小鼠肚子,拿掉针头,直接抽干净,最多的时候可抽到5ml。
3. 接种这个时候抽取的腹水需要量比较多,有时需要处死种鼠后,小心地用消毒眼科剪刀镊子剥开腹部皮肤,注意不要弄破肌肉,然后,用镊子(最好是哪种前面有倒勾的镊子,学名好像是唇型镊)拎起腹部的肌肉,用剪刀剪开一个小口,然后用玻璃滴管或者去掉针头的注射器吸取腹水。
然后进过一定的稀释后,接种到小鼠的腋下。
关于稀释量,各个实验室的情况都不一样,最好摸索一下,开始的时候可以适当的计数,但是要用台盼兰染色后计活细胞数(计数的时候要注意,有一些很细小的细胞是血细胞,不要计数)。
如果接种细胞量偏大会造成肿瘤早期就溃烂,所以不要为了追求肿瘤生长速度而一味的提高接种细胞量。
接种部位在小鼠腋下,但是不要深入到腋窝里面,会给以后的操作带来麻烦。
可以往尾部或背部靠一些,不要往腹部靠,容易使肿瘤被垫料磨烂。
接种部位可以选择腋下或者后肢, 有的文章说是背部接种,但是背部血管不发达,营养不够,一般不建议采用.接种时的进针处离接种处远一点,让针头在皮下多走一段,不容易污染。
有的人接种的时候喜欢针头向上用力,紧贴着表皮往里走,然后注射的时候感觉阻力较大,打出来的皮丘又紧又圆,这样的接种,会使肿瘤与皮肤严重粘连,不利于最后肿瘤的剥取。
也不要紧靠肌肉,肿瘤会与肌肉严重粘连。
应该在两者之间,接种的时候要精确控制接种在皮下,进针深度左右, 针头沿皮肤水平进入, 然后挑起表皮, 注射。
进针的感觉轻松自如,针头很自由,虽然打出来的肿瘤不会很圆很漂亮,但是相对好剥取一些。
防止接种的时候老鼠乱动,正确手法是用拇指和食指捏住老鼠的颈部皮肤,无名指和手掌下部把老鼠的后肢捏住,捏颈部的时候手指尽量多捏一点皮肤,然后右手(你是左手抓动物的话)拉住后肢,尽量往下拉,让老鼠的身体伸展开来,在用无名指固定,中指可以放在老鼠的身体下面,适当的往上顶,使老鼠的腋下一代完全平展,皮肤不用绷得太紧,平展就可以了,另外接种的时候进针点很靠下,针头在皮下走一段再注射,速度不要太快。
注射前针头稍微动一动,能动就说明在皮下,否则可能在皮内或者肌肉内。
一般来说都是有鼓包的但是要是你接种位置太深入腋窝,你是看不到鼓包的。
主要靠针头稍微动一动来判断。
4. 观测指标主要是按时称体重,试验结束后剥取肿瘤称瘤重。
因为出瘤已经是接种后的第6 天左右了,第10 天就结束时间,瘤体积的数据意义就不大。
小鼠肿瘤很难剥,只能耐心,没有太好的办法,剥多了以后,手上会掌握一些巧力,有一些帮助,但是我们还是很头痛小鼠肿瘤试验结束。
肿瘤组织周围经常会有一些血窦的形成,弄破后会有血和黄色的液体流出,正常的,但是剥瘤子的时候不要把它弄破,会严重影响瘤重。
按照SFDA的规定,平均瘤重小于1g,或者单个瘤重小于200mg认为肿瘤生长不良,试验作废。
第二类是以lewis肺癌、B16为代表的,他们的宿主多为C57。
不产生腹水,只能皮下生长。
多用插块法或者匀浆法传代和接种。
有一种做法也是接种后第二天开始给药,还有一种做法是接种三天后给药,接种后两周结束试验,剥取肿瘤称重。
1. 瘤种构建体外细胞株,培养后PBS悬浮至1~3X 106/site,接种至小鼠腋下,即可。
2. 传代与接种体内瘤源用于传代接种,有两种手段(均为无菌操作),套管针插块法对瘤组织损伤小,可能100%成瘤。
匀浆法对瘤组织损伤大,成瘤可能小于100%。
1)插块法:种鼠处死后体表消毒,将肿瘤组织剥离下来后,置于在PBS 或%£菌氯化钠注射液中洗涤干净,然后剪开,去处中心颜色变暗坏死部分,以及外表的包膜(如果比较明显的话),选外围发亮部分。
清洗干净,然后换到干净的PBS中,用剪刀剪成Imm直径左右的小块,最后用镊子将小块从针头处塞进18~20号的接种套管针(最好用的是胸膜活检针20 号,但是现在已经买不到了,可以用硬脊膜外穿刺针18 号磨平针头后代替),在老鼠的皮肤上剪一小口,接种于动物腋下或者其他部位。
塞的组织块的量以接种针头的口径为准,不能太紧也不能太松,以孔径为标尺,尽量保持差不多大小的接种量。
如出现出针挂组织的问题,关键在于针头的磨制,在针后部的小突起于小缺口吻合后,实体针弯曲方向应该与套管针磨制的斜面一致,接种时,实体针要推到底,也就是后面的小突起与小缺口契合,然后针头“舔住”肌肉层转一圈再退针,还有就是瘤块一定要完全塞入针头内,外面不能有漏出来的。
