水是常用的溶剂
常用有机溶剂极性顺序
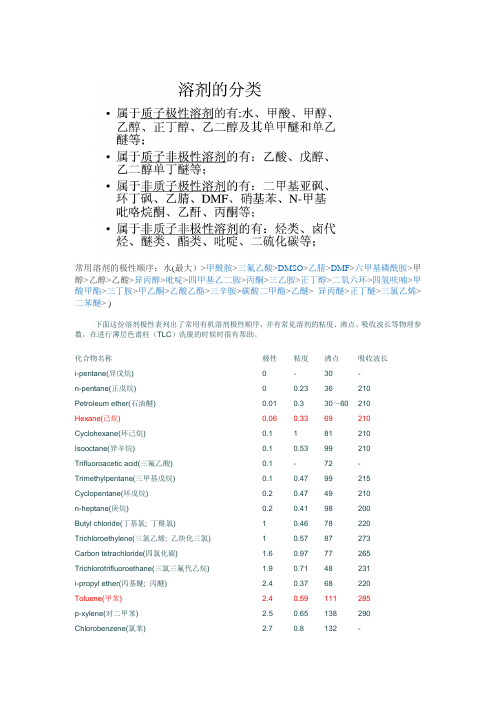
常用溶剂的极性顺序:水(最大)>甲酰胺>三氟乙酸>DMSO>乙腈>DMF>六甲基磷酰胺>甲醇>乙醇>乙酸>异丙醇>吡啶>四甲基乙二胺>丙酮>三乙胺>正丁醇>二氧六环>四氢呋喃>甲酸甲酯>三丁胺>甲乙酮>乙酸乙酯>三辛胺>碳酸二甲酯>乙醚> 异丙醚>正丁醚>三氯乙烯>二苯醚>)下面这份溶剂极性表列出了常用有机溶剂极性顺序,并有常见溶剂的粘度、沸点、吸收波长等物理参数,在进行薄层色谱柱(TLC)洗脱的时候时很有帮助。
化合物名称极性粘度沸点吸收波长i-pentane(异戊烷) 0 - 30 -n-pentane(正戊烷) 0 0.23 36 210Petroleum ether(石油醚) 0.01 0.3 30~60 210Hexane(己烷) 0.06 0.33 69 210 Cyclohexane(环己烷) 0.1 1 81 210Isooctane(异辛烷) 0.1 0.53 99 210 Trifluoroacetic acid(三氟乙酸) 0.1 - 72 - Trimethylpentane(三甲基戊烷) 0.1 0.47 99 215 Cyclopentane(环戊烷) 0.2 0.47 49 210n-heptane(庚烷) 0.2 0.41 98 200Butyl chloride(丁基氯; 丁酰氯) 1 0.46 78 220 Trichloroethylene(三氯乙烯; 乙炔化三氯) 1 0.57 87 273Carbon tetrachloride(四氯化碳) 1.6 0.97 77 265 Trichlorotrifluoroethane(三氯三氟代乙烷) 1.9 0.71 48 231i-propyl ether(丙基醚; 丙醚) 2.4 0.37 68 220Toluene(甲苯) 2.4 0.59 111 285p-xylene(对二甲苯) 2.5 0.65 138 290 Chlorobenzene(氯苯) 2.7 0.8 132 -o-dichlorobenzene(邻二氯苯) 2.7 1.33 180 295Ethyl ether(二乙醚; 醚) 2.9 0.23 35 220Benzene(苯) 3 0.65 80 280Isobutyl alcohol(异丁醇) 3 4.7 108 220Methylene chloride(二氯甲烷) 3.4 0.44 240 245Ethylene dichloride(二氯化乙烯) 3.5 0.78 84 228n-butanol(正丁醇) 3.7 2.95 117 210n-butyl acetate(醋酸丁酯;乙酸丁酯) 4 - 126 254n-propanol(丙醇) 4 2.27 98 210Methyl isobutyl ketone(甲基异丁酮) 4.2 - 119 330 Tetrahydrofuran(四氢呋喃) 4.2 0.55 66 220Ethyl acetate(乙酸乙酯) 4.30 0.45 77 260i-propanol(异丙醇) 4.3 2.37 82 210Chloroform(氯仿) 4.4 0.57 61 245Methyl ethyl ketone(甲基乙基酮) 4.5 0.43 80 330Dioxane(二恶烷; 二氧六环; 二氧杂环己烷) 4.8 1.54 102 220Pyridine(吡啶) 5.3 0.97 115 305Acetone(丙酮) 5.4 0.32 57 330 Nitromethane(硝基甲烷) 6 0.67 101 330Acetic acid(乙酸) 6.2 1.28 118 230Acetonitrile(乙腈) 6.2 0.37 82 210Aniline(苯胺) 6.3 4.4 184 -Dimethyl formamide(二甲基甲酰胺) 6.4 0.92 153 270Methanol(甲醇) 6.6 0.6 65 210Ethylene glycol(乙二醇) 6.9 19.9 197 210Dimethyl sulfoxide(二甲亚砜DMSO) 7.2 2.24 189 268Water(水)10.2 1 100 268 下图是混合有机溶剂极性顺序(由小到大,括号内表示的是混合比例)一:溶剂极性参数表,方便以下比较展开剂。
溶质和溶剂的定义

溶质和溶剂的定义溶质和溶剂是溶液中两个重要的组成部分。
溶质是指能够在溶剂中溶解的物质,而溶剂则是指能够溶解其他物质的介质。
溶质和溶剂的相互作用是溶解过程的基础,也是溶液性质的决定因素之一。
首先我们来了解一下溶质。
溶质可以是固体、液体或气体,它们分散在溶剂中形成溶液。
固体溶质通常是由离子、分子或原子组成的晶体,例如食盐、糖和金属。
液体溶质通常是有机物,如酒精和醋酸。
气体溶质则是通过溶解在液体溶剂中形成的溶液,例如二氧化碳溶解在水中形成的碳酸水。
溶质的溶解度是指单位溶剂中溶质的最大溶解量,它受溶质和溶剂之间相互作用力的影响。
接下来我们来了解一下溶剂。
溶剂是指能够溶解其他物质的介质,通常是液体,例如水、醇类和醚类。
溶剂的选择对溶解过程有着重要的影响,不同的溶剂对不同的溶质有着不同的溶解度。
水是一种常用的溶剂,由于其极性较强,能够溶解许多极性分子和离子。
而非极性溶剂如石油醚和正己烷主要适用于溶解非极性分子。
溶剂的选择还可以根据溶解度、反应性、毒性等因素来进行。
溶质和溶剂之间的相互作用是溶解过程的基础。
在溶解过程中,溶质分子与溶剂分子之间发生相互作用,溶质分子从固体、液体或气体状态转变为分散在溶剂中的溶质分子。
溶质和溶剂之间的相互作用可以通过吸附、解离和溶剂化等方式实现。
溶质分子与溶剂分子之间的相互作用力决定了溶解度和溶液的物理化学性质。
溶质和溶剂的相互作用力可以通过溶质分子与溶剂分子之间的相互作用力来解释。
在溶质溶解过程中,如果溶质与溶剂之间的相互作用力较强,溶质分子更容易与溶剂分子相互吸引和相互作用,溶解过程更容易进行。
相反,如果溶质与溶剂之间的相互作用力较弱,溶质分子更难与溶剂分子相互作用和吸引,溶解过程更困难。
溶质和溶剂的相互作用力还可以通过溶解过程中的热效应来解释。
在溶解过程中,溶质和溶剂之间的相互作用会引起能量的变化。
当溶质溶解于溶剂中时,如果溶液中的总能量较原来的状态更低,则说明溶质和溶剂之间的相互作用力是有利于溶解的。
常用溶剂的沸点

常用溶剂的沸点
常用溶剂是科研和工业生产中常常用到的,其中沸点是一个很重要的物理性质指标。
下面将对常用溶剂的沸点进行中文介绍。
1. 水(H2O)
水是最常见的溶剂之一,其沸点为100°C,即在常压下水的温度达到100°C时会沸腾。
3. 乙醚(C2H5OC2H5)
4. 氯仿(CHCl3)
7. 氮(N2)
氮是一种气体,其沸点为-195.8°C,即在常压下温度达到-195.8°C时会凝结成液态。
8. 甲苯(C7H8)
10. 氯化钠(NaCl)
总之,了解常用溶剂的沸点可帮助我们更好地选择合适的溶剂进行实验或生产,避免因沸点过低或过高而导致实验或生产失败,也可更好地控制反应条件,提高实验或生产效率和成功率。
_2020-2021学年华东师大版科学七年级下册1.3水是常见的溶剂课堂同步练习

1.3水是常见的溶剂一、单选题1.下列有关溶液的说法正确的是( )A. 均一、稳定的液体都是溶液B. 饱和溶液一定是浓溶液,不饱和溶液一定是稀溶液C. 20℃时,10g 水中最多可以溶解3.6g 食盐,所以食盐属于易溶物质D. 25℃时,向100g 质量分数为10%的氯化钠溶液中加入10g 蔗糖粉末,完全溶解后,溶液中氯化钠的质量分数将不变2.下列是关于调节功能的叙述,其中不正确的是( )A. 海洋水可以调节昼夜温差B. 生长素可以调节人的生长C. 温度可以调节许多物质的溶解性大小D. 滑动变阻器可以调节电路的电流大小3. 下列暴露在空气中质量明显增加,溶于水温度明显降低的物质分别是()①氧化钙②硝酸铵③浓盐酸④氯化钠.A. ②③B. ①②C. ①④D. ④②4.20℃时氯化钠的溶解度是36g,则氯化钠属于()A. 易溶物质B. 可溶物质C. 微溶物质D. 难溶物质5.如图是恒温下模拟海水晒盐过程的示意图,从甲到丙可以肯定是饱和溶液的是( )A. 甲B. 乙C. 丙D. 无法判断6.我们日常生活中接触到的溶液中,溶质是单质的是()A. 碘酒B. 汽水C. 食用醋D. 生理盐水7.把少量下列物质分别加入水中,充分搅拌后,不能形成溶液的是()A. 食盐B. 蔗糖C. 酒精D. 花生油8.下表是同学们做溶液形成的实验记录。
以下说法不正确的是( )A. 衣服上不慎沾上碘酒,可用汽油擦洗B. 同一物质在不同溶剂中的溶解性不同C. 水、汽油、酒精都可以作溶剂D. 溶液都是均一、稳定、无色的混合物9.厨房常用的下列物质与水混合,不能形成溶液的是()A. 食盐B. 植物油C. 白糖D. 白酒10.悬浊液、乳浊液和溶液都应是()A. 均一、稳定的B. 澄清、透明的C. 久置不会分层D. 混合物11.将下列物质分别放入足量水中,能形成无色溶液的是()A. 硝酸钾B. 硫酸铜C. 粉笔灰D. 食用油12.现代生活中的饮品各式各样,下列几种常见的饮料中,属于溶液的是( )A. 果汁B. 牛奶C. 矿泉水D. 豆浆二、填空题13.某5克物质(不含结晶水)溶于10克水中,得12克溶液,则溶液中溶质为________克.14.如图是一个概念图,概念图在整理知识时是十分有用的,请在图中空白处填上恰当内容。
色谱专用溶剂

色谱专用溶剂
色谱专用溶剂主要用于色谱分析中,作为流动相,帮助分离样品中的各个组分。
以下是一些常见的色谱专用溶剂及其应用:
1. 水:在高效液相色谱(HPLC)中,水是最常用的溶剂,尤其在生物化学和环境分析中。
它可以与许多有机化合物混溶,有助于样品的分离。
2. 甲醇:在气相色谱(GC)和液相色谱(HPLC)中,甲醇是一种常用的强溶剂,尤其适合分离极性化合物。
3. 乙腈:在液相色谱中,乙腈是一种常用的中等强度溶剂,适合分离多种有机化合物。
4. 丙酮:在气相色谱中,丙酮是一种常用的溶剂,特别适合分离含氮和含硫的化合物。
5. 二甲基甲酰胺:在液相色谱中,二甲基甲酰胺是一种常用的强溶剂,尤其适合分离多肽和蛋白质。
6. 醋酸:在液相色谱中,醋酸常被用作添加剂,调节流动相的pH值,影响样品的离子状态,从而实现更好的分离效果。
以上就是一些常见的色谱专用溶剂及其应用。
需要注意的是,选择合适的溶剂需要考虑到样品的性质、分析的目标以及色谱仪的性能等因素。
水是常用的溶剂PPT课件(初中科学)

/ /
溶 200 解 度 190
g/101080g水
硝 酸
170
铵
160
150
140
130
120
110
100 90 80 70 60 50
硝 酸 钠
硝 酸 钾
氯化铵
氯化钾
熟石灰的溶解度曲线:
溶 0.20 解 0.20 度
g/1000.g105水.15
0.10 0.10
0.05 0.05
0 10 0 10
在100mL水中 加入1g氢氧化 钙固体
稀
饱和溶液 20 ℃氢氧化钙
在100mL水中 加入150g硝酸 铵固体
浓
20 ℃硝酸铵 不饱和溶液
饱和溶液不一定是浓溶液 不饱和溶液不一定是稀溶液。
用溶解度来表示物质的溶解能力,即:在一定 的温度下,某固体物质在100 克水中到达饱和状态时 所溶解的质量(克),叫做该物质在水里的溶解度。
1.3水是常用的溶剂
在我们周围存在的澄清透明的天然水几乎都不是纯净的水。
纯净物:只由一种物质组成的物质。 混合物:由两种或两种以上物质组 成的物质。
氧气是纯净物,空气是混合物;
蒸馏水是纯净物,矿泉水是混合物;
海水、河水等是混合物
水是一种良好的溶剂
它能溶解各种固态、液态和蔼态的物质。
一种或几种物质分散到另一种物质 里,形成均一的、稳定的混合物。
浑浊,有小油滴悬浮 在水中。不均一 浑浊,有小油滴悬浮 在水中。不均一
静置一段时间后现象 不稳定,有泥土沉淀 不稳定,有固体沉淀 不稳定,油水分层 不稳定,油水分层
悬浊液
乳浊液
固体小颗粒悬浮在液体里的混合物 液体小液滴悬浮在液体里的混合物
常用有机溶剂极性及混合溶剂极性顺序

常用溶剂的极性顺序:水(最大) > 甲酰胺> 乙腈> 甲醇> 乙醇> 丙醇> 丙酮> 二氧六环> 四氢呋喃> 甲乙酮> 正丁醇> 乙酸乙酯> 乙醚> 异丙醚> 二氯甲烷>氯仿>溴乙烷>苯>四氯化碳> 二硫化碳>环己烷>己烷>庚烷>煤油(最小)混合有机溶剂极性顺序(从小到大,括号内为有机溶剂的混合比例)常用溶剂极性在结晶和重结晶纯化化学试剂的操作中,溶剂的选择是关系到纯化质量和回收率的关键问题。
选择适宜的溶剂时应注意以下几个问题:1. 选择的溶剂应不与欲纯化的化学试剂发生化学反应。
例如脂肪族卤代烃类化合物不宜用作碱性化合物结晶和重结晶的溶剂;醇类化合物不宜用作酯类化合物结晶和重结晶的溶剂,也不宜用作氨基酸盐酸盐结晶和重结晶的溶剂。
2. 选择的溶剂对欲纯化的化学试剂在热时应具有较大的溶解能力,而在较低温度时对欲纯化的化学试剂的溶解能力大大减小。
3. 选择的溶剂对欲纯化的化学试剂中可能存在的杂质或是溶解度甚大,在欲纯化的化学试剂结晶和重结晶时留在母液中,在结晶和重结晶时不随晶体一同析出;或是溶解度甚小,在欲纯化的化学试剂加热溶解时,很少在热溶剂溶解,在热过滤时被除去。
4. 选择的溶剂沸点不宜太高,以免该溶剂在结晶和重结晶时附着在晶体表面不容易除尽。
用于结晶和重结晶的常用溶剂有:水、甲醇、乙醇、异丙醇、丙酮、乙酸乙酯、氯仿、冰醋酸、二氧六环、四氯化碳、苯、石油醚等。
此外,甲苯、硝基甲烷、乙醚、二甲基甲酰胺、二甲亚砜等也常使用。
二甲基甲酰胺和二甲亚砜的溶解能力大,当找不到其它适用的溶剂时,可以试用。
但往往不易从溶剂中析出结晶,且沸点较高,晶体上吸附的溶剂不易除去,是其缺点。
乙醚虽是常用的溶剂,但是若有其它适用的溶剂时,最好不用乙醚,因为一方面由于乙醚易燃、易爆,使用时危险性特别大,应特别小心;另一方面由于乙醚易沿壁爬行挥发而使欲纯化的化学试剂在瓶壁上析出,以致影响结晶的纯度。
8.2 水以外的溶剂 生活中常见的溶液

2、可以溶解指甲油的溶剂
指甲油可以溶解在丙酮、乙酸乙酯中, 指甲油不可以溶解在水、煤油中。
结论
水是常用的溶剂,但它不能溶解所
有的物质。 碘和指甲油等都不溶于水,但却可 溶于其他溶剂中。
活动8.3
找出清除油渍的最佳溶剂
当衣服上沾有 油渍时,你会 用什么方法清 除这些油渍呢?
能使油渍扩散的是酒精和汽油,汽油是清除油渍 的最佳溶剂。
生活中常见的溶液
活动8.4
对生活中的一些溶液分类
生活中的分类方法
类别
溶液 A、D、G、H B、E C、F
食用
按用途分类
医用
清洗用
科学家对溶液的分类
按溶液的酸碱性分类: 1. 酸性(acid)溶液 2. 中性(neutral)溶液 3. 碱性(alkaline)溶液
8.2 水以外的溶剂 &生活中常见的溶液
水以外的溶剂
复习:什么是溶剂? 能够溶解溶质的液体叫作溶剂
讨论:除了水是最常用的溶剂外,生活 中有没有用到其他液体作为溶剂的呢?
水是最常用的溶剂,但不是唯一的溶剂。事 实上,还有很多其他液体可以作为溶剂。
活动8.2
1、可以溶解碘的溶剂
碘可以溶解在酒精、丙酮中, 碘不可以溶解在水、石蜡油中。
干洗的原理:利用水以外的溶剂来清洗衣物 上的污渍,由于溶剂中几乎不含任何水分,所 以称之为干洗。
拓展阅读:所谓“干洗”是指衣物洗涤之前是干的, 干洗后从干洗机取出的衣物也是干的,但在干洗过程 中,衣物在干洗机滚筒内是用化学溶剂浸泡、洗涤、 脱干,再经过烘干,把衣物上含有的化学溶剂回收, 并将衣物干燥就完成了全部干洗过程。干洗是近百年 才出现的洗涤方法。经过干洗后的服装不变形、不退 色、不损伤面料。还有消毒、灭菌的特殊功效。四氯 乙烯是世界各国洗衣店公认的标准干洗剂。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
40
30 20 10 0 10 20 30 40 50
硼酸
60
70
80
温度/℃
溶 200 解 度 190
180 170 160 150 140 130 120 110 100 90 80 70 60 50
g
硝 酸 铵
固体的溶解度曲线:
练习: 68 3、在___℃时硝酸钾和硝酸钠的溶解
134g 度相同,都约为______。 小于 4、在40℃时,硝酸钾的溶解度____ (填大于、小于)硝酸钠的溶解度。 5、在80℃时氯化钠、氯化钾、氯化 铵、硼酸的溶解度由大到小的顺序是 氯化铵、氯化钾、氯化钠、硼酸 _____________________________。
浊液
黄河水中含有 很多泥沙,水的颜 色发黄,黄河由此 得名。黄河水素有 “一碗水,半碗泥” 的说法。这是一种 典型的悬浊液。
活动
编号 实验 内容
观察在水中加入不易溶解物质后的现象 1 泥土 水 2 熟石灰 水 3 食用油 水 4 煤油 水
振荡
静置
不溶解 不溶解 不溶解 不溶解 分层 分层 分层 分层
注意点: (1)理解这个概念,抓住四个词:一定的 温度、100克溶剂(一般为水)、达到 饱和、溶解的质量(单位为克) (2)溶解度值越大,表明该温度下,物 质的溶解能力越强.
如何比较 氯化钠、硝酸钾的溶解性大小?
(1)为什么要求水温相同?用一杯冷水和一 杯热水分别溶解氯化钠和硝酸钾,行不行? (2)为什么要求水的体积相同?用一杯水和 一盆水分别溶解,行不行? (3)为什么要达到饱和状态?100克水能溶解 1克氯化钠也能溶解1克硝酸钾,能否说明氯化 钠、硝酸钾的溶解性相同?
2、 不饱和溶液:
在一定温度下,在一定量的溶剂里, 还能继续溶解某种溶质的溶液,称为这种 溶质的不饱和溶液。
【思考、讨论】 怎样判断一种溶液是不是饱和溶液?
1. 如果溶液中有少量未溶的溶质,则是饱 和溶液; 2、温度稍有降低,如果就会有一些溶质析 出,表明原溶液是饱和的。 3、如果溶剂稍有蒸发,溶质就会有析出, 表明原溶液是饱和的。 4、 加少量的溶质,溶质能继续溶解的是 不饱和溶液,不能溶解的是饱和溶液。
判断是非:
(1)20℃时,10克食盐溶解在100克水中,所以 20℃时食盐的溶解度是10克。 (2)100克水中溶解了36克食盐刚好达到饱和, 所以食盐的溶解度是36克。 (3)在20℃时,100克水里最多溶解33.3克氯化 铵,则20℃氯化铵的溶解度是33.3。 (4)在20℃时,100克硝酸钾饱和溶液里含硝酸 钾24克,则20℃硝酸钾的溶解度是24克。 (5)在30℃时,100克水中加入40克氯化钾后达 到饱和溶液,则30℃时氯化钾的溶解度是40克。
在20ml水中大约能溶解7g食盐.
在20ml水中大约能溶解38g蔗糖.
蔗 糖
食蔗 盐糖 的的 溶溶 解解 能能 力力 强比
一般地,不同溶质在同一种溶剂里的溶解能力不同; 同种溶质在不同溶剂里的溶解能力也是不同的。
可见:一种物质溶解在另一种物质里的能 力大小主要是由溶质和溶剂的性质决定的
饱和溶液和不饱和溶液
溶 200 解 度 190
180
/
2、溶解度的表示方法: (1)列表法:
温 度
g
170
160 150 140 130
. .
硝 酸 钾
硝酸钾在不同温度时的溶解度:
/
℃ 溶 解 度 /g
0
10
20
30
40
50
60
70
80
90
100
120 110
.
20.9
45.8
85.5
138
202 169
100
13.3
溶剂(液体)
水、酒精等。
思考
鱼可以在水中呼吸,说明水中溶解了什么
物质?它是溶质吗?
小结
组成
溶质 溶剂
特征
溶液
均一
稳定
活动
取用固体块状药品一般用镊子。 取用固体小颗粒状药品一般用药匙。 取用固体粉末状药品一般用纸槽。
课堂练习
均一 稳定 1.溶液是一种_________ 、_________的混合物。 2.溶液是由溶质和溶剂组成,指出下列溶液的溶质和溶剂: 酒精 水 (1)“茅台”白酒:溶质是_______,溶剂是_________。 食盐 (2)生理盐水:溶质是_________,溶剂是_________。 水 酒精 (3)碘酒:溶质是__________,溶剂是_________。 碘 (4)高锰酸钾溶液:溶质是_________,溶剂是________。 水 高锰酸钾 3.下列物质属于混合物的是 ( D ) A.食盐 B.蒸馏水 C.酒精 D.天然水
1.“20℃时,硝酸钾的溶解度是31.6克”.
这句话的含义是 20℃时,在100克水中达到 饱和状态时,溶解硝酸钾的质量是31.6克。 此时,饱和溶液 131.6 克, 溶质 31.6 克, 溶剂 100 克, 2.20℃时,100克水中最多能溶解0.165克氢 氧化钙,则20℃时氢氧化钙的溶解度是 0.165克
溶液、悬浊液、 悬浊液 悬浊液 乳浊液 乳浊液 乳浊液
二、悬浊液和乳浊液
1、悬浊液:固体小颗粒分散于液体里所形
成的混合物 2、乳浊液:液体小液滴分散另一种液体里
所形成的混合物
溶液、悬浊液、乳浊液的区别:
名称特征 溶 液 悬浊液 乳浊液
形成过程 固、液、气体 溶解在液体中 稳定性 长期放置 稳定 均一、稳定的
80 90 100
40
30 20 10 0 10 20 30 40 50
氯化钠
硼酸
60 70
温度/℃
溶 200 解 度 190
180 170 160 150 140 130 120 110 100 90 80 70 60 50
熟石灰的溶解度曲线:
硝 酸 铵
溶 0.20 解 度
/ g
/ g
0.15 0.10
溶液 溶质在溶剂中溶解后得到的混合物
你认为在溶液中这三者的质量存在什 么样的关系吗? 2、溶质质量 + 溶剂质量 = 溶液质量
泉水中溶入了矿物质、氧气、 二氧化碳,那么,其中的溶质 是什么?溶剂是什么?
溶质(固体、液体、气体)
固体:蔗糖、高锰酸钾、盐、碘等。 液体:酒精、煤油等。 气体:二氧化碳、氧气等。
【思考】在一定的条件下,溶质是否
可以无限地溶解在一定量的溶剂里呢? 【实验演示】蔗糖的溶解 现象:得到蔗糖的溶液,到一定时候蔗糖不 再溶解。
这说明了什么?
结论:说明在一定的条件下,溶质不能 无限地溶解在溶剂里。 (一定量的溶剂中,一定的温度下)
1、 饱和溶液:
在一定温度下,在一定量的溶剂里, 不能继续溶解某种溶质的溶液,称为这种 溶质的饱和溶液。
1、横坐标60,纵坐标110 的A 点表示什么意义? 2、40℃时氯化铵的溶解度为 44g ______, 70℃时氯化铵的溶解 60g 度为______。 70℃时氯化钾的 47g 溶解度为____。
3、B点表示什么意思?
表示在该点所示的温度 (68 ℃ )时,硝酸钠和硝 酸钾两种物质的溶解度相 等(134克)。
31.6
63.9
110
246
90 80
(2)溶解度曲线
70 60
以温度为横坐标,溶解度为纵 坐标,形象地表示出物质的溶 解度随温度变化情况的曲线。 不同的物质溶解度受温度的 影响是不同的。
50 40 30
20 10
.
0
. .
10 20
.
30
.
.
40
50
60
70
80
温度/℃
90
100
溶 200 解 度 190
『思考与讨论』
当两种液体相互溶解时,可以怎样确定溶质和溶剂? 用水做溶剂的溶液,叫做水溶液。通常不 指明溶剂的溶液,一般指的是水溶液。水溶液 通常不论液体的含量多少,都把水看作溶剂, 另一种物质看作溶质。 当其他两种液体相互溶解是通常把溶液里 含量较多的一种叫做溶剂,把含量较少的一种 叫做溶质。
其他常用的溶剂
活动
1、在两个试管中各加入5ml水和5ml汽油,然后分别滴入2滴 食物油,振荡后,观察到的现象? 2、在两个试管中各加入5ml水和5ml酒精,然后分别加入1小块 碘晶体,振荡后,观察到的现象?
实验表明:水是一种良好的溶剂,能溶解很多 种物质,但不是万能的溶剂。溶质对溶剂是有 选择性的。酒精能溶解碘,配成消毒用的碘酒; 汽油能溶解油脂,人们常用汽油擦除油污。
溶解度
『回顾』不同溶质在同种溶剂中的溶解 能力是不一样。 『讨论』怎样定量比较物质的溶解能力呢? 定标准; 标准里应该含有哪些物理量呢?从哪些 方面考虑? 从影响物质溶解能力的因素考虑。 定溶剂的量、定温度、定状态
1、用溶解度来表示物质的溶解能力,即: 在一定的温度下,在100 克溶剂里达到饱和 状态时所溶解某物质的质量(克)为该物 质在这种溶剂里的溶解度。
80 90 100
40
30 20 10 0 10 20 30 40 50
氯化钠
硼酸
60 70
温度/℃
溶 200 解 度 190
180 170 160 150 140 130 120 110 100 90 80 70 60 50
固体的溶解度曲线:
硝 酸 铵
/ g
练习:
B. A.
硝 酸 钠
硝 酸 钾 氯化铵 氯化钾 氯化钠
课堂练习
4、下列叙述中正确的是……………… ( D ) A 凡是无色透明的液体都是溶液 B 溶液的体积等于溶质和溶剂体积之和 C 溶液是均一、稳定、无色透明的混合物 D 只要条件不变,糖水中的糖不会分离出来 5、下列物质属于溶液的是………………( B ) A纯牛奶 B白醋 C粒粒橙 D冰水
