第20章(5)-四个量子数
四个量子数及其取值范围

四个量子数及其取值范围量子数是描述原子或分子量子态的参数,它们的取值范围决定了电子在原子中的能级和轨道结构。
在量子力学中,有四个重要的量子数,分别是主量子数、角量子数、磁量子数和自旋量子数。
本文将依次介绍这四个量子数及其取值范围。
一、主量子数(n)主量子数决定了电子所处的能级,也即电子离原子核的距离。
主量子数的取值范围为正整数,从1开始递增。
当n为1时,表示电子在最内层能级;当n为2时,表示电子在第二层能级;以此类推。
主量子数越大,电子离原子核越远,能级也越高。
二、角量子数(l)角量子数决定了电子在原子中的轨道形状。
角量子数的取值范围与主量子数有关,即0 ≤ l ≤ n-1。
角量子数为0时,表示s轨道,形状是球对称的;角量子数为1时,表示p轨道,形状是两个相互垂直的球面;角量子数为2时,表示d轨道,形状是复杂的双球面等等。
三、磁量子数(ml)磁量子数决定了电子在原子中轨道的方向。
磁量子数的取值范围与角量子数有关,即-l ≤ ml ≤ l。
对于每个角量子数l,磁量子数ml 的取值个数为2l+1。
例如,对于角量子数l为1的p轨道,磁量子数ml的取值范围为-1、0、1,共有3个取值。
四、自旋量子数(ms)自旋量子数描述了电子的自旋状态。
自旋量子数的取值范围为±1/2,分别表示电子的自旋向上和向下。
自旋量子数是量子力学中唯一一个可以观测到的量子数。
主量子数、角量子数、磁量子数和自旋量子数是描述原子或分子量子态的四个重要参数。
它们的取值范围决定了电子在原子中的能级、轨道形状、轨道方向和自旋状态。
这些量子数的不同取值组合产生了多样的原子结构,为我们理解和研究原子的性质提供了重要的理论基础。
通过研究量子数的取值范围,我们可以了解电子在原子中的分布规律和能级结构。
这对于理解化学反应、原子结构及物质性质等方面都具有重要意义。
同时,量子数的研究也为制定新材料、开发新技术提供了理论指导。
随着量子力学的发展,量子数的概念不仅适用于原子和分子,也适用于更复杂的体系。
【高中化学】高中化学知识点:四个量子数

【高中化学】高中化学知识点:四个量子数四个量子数:
(1)主量子数n:描述原子中电子出现几率最大区域离核的远近(电子层数);决定电子能量高低。
值域:n=123456……
电子层符号klmnop……
对于氢原子其能量多寡依赖于n
但对于多电子原子,电子的能量除受电子层影响,还因原子轨道形状不同而异,(即受角量子数影响)
(2)角量子数l:它同意了原子轨道或电子云的形状或则表示电子亚层(同一n层中相同分层)意义:在多电子原子中,角量子数与主量子数一起同意电子的能量。
之所以表示l 为角量子数,是因为它与电子运动的角动量m有关。
如m=0时,说明原子中电子运动情况同角度无关,即原子轨道或电子云形状是球形对称的。
角量子数,l只能取一定数值。
(3)磁量子数m:同意波函数(原子轨道)或电子云在空间的弯曲方向,同意角动量在空间的取值方向上的分量大小。
(4)自旋量子数ms:ms=±1/2,表示同一轨道中电子的二种自旋状态
ms表示磁矩量子数值域:ms=±1/2,即为仅有两种运动状态。
(↑↓)
用分辨力较强的光谱仪观察氢原子光谱,发现,大多数谱线是由靠得很近的两条谱线组成的。
这是因为同一空间运动状态,即同一轨道中,可能有两种电子运动状态,即电子还有自身旋转运动,(类似于地球绕太阳转,自转)其自旋角动量沿外磁场方向的分量为
综合所述,若叙述核电子的运动状态,须要四个量子数,即n、l、m、ms。
注意:n、l、m可描述核外电子的一种空间运动状态,即一个原子轨道。
每个原子轨道中能容纳两个自旋相反的电子。
电子自旋 四个量子数
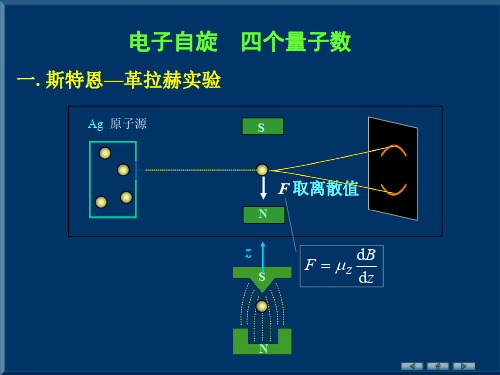
一. 斯特恩—革拉赫实验
Ag 原子源
S
F 取离散值
N
z
S
F
Z
dB dz
N
S
F
N
分 立
F 取
F
z
dB dz
μZ 取
的
分
分
沉
立
立
积
的
的
线
值
值
μ 空
e
L
空
2me 角 间
间
动量
N
F
Z
dB dz
基态 Ag ( 47 ) 原子最外层价电子副量子数 l =0
z ml B 其中 ml = 0, ±1, ± 2, …, ± l
Z 取(2l+1 )个值, 则 F 可取(2l+1 )个值,
原子沉积线条数应为奇数(2l+1 ),而不应是实验中的两条。
实验观察到的磁矩 Z 是由价电子自旋产生的,且 Z 取 2 个值
二. 电子自旋 (1925年乌伦贝克等) • 电子自旋角动量大小 S s(s 1) s —自旋量子数 • S 在外磁场方向的投影 SZ ms 自旋磁量子数 ms 取值个数为 2s +1 = 2 有 s = 1/2 ,ms = ±1/2
z
2
S
S
3 4
S
2
斯特恩-革拉赫实验 — 第一次直接观察到原子磁矩取向量子化
法兰克福大学纪念斯特恩-革拉赫实验的铭牌
三. 四个量子数(表征电子的运动状态) 1.主量子数 n ( 1 , 2 , 3, ……)
大体上决定了电子能量
原子轨道及四个量子数

原子轨道及四个量子数原子轨道及四个量子数【一】原子轨道:原子中单个电子的空间运动状态函数,叫做原子轨道。
原子轨道的含义与玻尔轨道的含义完全不同,也不是经典意义上的固定轨迹,原子轨道由三个量子数(n/l/m)确定。
【二】四个量子数【1】主量子数(电子层数)nn 1 2 3 4 5 6 7 符号 K L M N O P Q从左向右,离原子核越来越远,一般地说,原子轨道能量越来越高。
对单电子原子来说,原子轨道的能量只取决于主量子数。
【2】角量子数(电子亚层数)l(是小写的L)n=1 l=0(s)n=2 l=0(s);1(p)n=3 l=0(s);1(p);2(d)n=4 l=0(s);1(p);2(d);3(f)n=5 l=0(s);1(p);2(d);3(f)n=6 l=0(s);1(p);2(d)n=7 l=0(s);1(p)l=0(s),有一个原子轨道;l=1(p),有三个原子轨道;l=2(d),有五个原子轨道;l=3(f),有七个原子轨道。
〖※〗能级:原子轨道能量的数值,对氢原子来说只有n决定,对其它原子来说有n和l决定。
能级大小约为E = n + 0.7 l。
【3】磁量子数(磁场存在时,轨道的空间伸展方向)ml=0 m = 0l=1 m = ,1 0 ,1m = ,2 ,1 0 ,1 ,2 l=2l=3 m = ,3 ,2 ,1 0 ,1 ,2 ,3【4】自旋量子数msms = ,1/2(?) ,1/2(?)处于同一原子轨道上的电子自旋运动状态只有两种,分别用符号?和?来表示。
即同一原子轨道上最多容纳自旋方向相反的两个电子。
附:n值所对应的能级、原子轨道和最多容纳电子数。
量子数符能级原子原子轨道最多原子轨道数号种类轨道总数容纳电子数 n1 K s 1s 1 1 2s 2s 1 2 L 4 8 p 2p 3s 3s 13 M p 3p 3 9 18d 3d 5s 4s 1p 4p 3 4 N 16 32 d 4d 5f 4f 7s 5s 1p 5p 3 5 O 16 32 d 5d 5f 5f 7… … … … … … …。
氢原子基态的四个量子数

氢原子基态的四个量子数
氢原子是能在自然界中容易观察到的最小的原子,关于它包含的量子数,物理学家做了研究,表明氢原子基态的四个量子数是n,l,m 和s,n表示原子的能量档次,l表示原子的角动量的大小,m表示角动量的方向,而s则表示原子的自旋状态。
n是氢原子基态的量子数之一,表示原子能量档次,它用字母n 表示,又叫作Principle Quantum Number(主量子数)。
它决定了氢原子能出现的最高能量状态,也决定了氢原子状态的总能量。
实际上,n的值决定了原子几层电子结构有多稳定,因此可以推断,n越大说明原子结构稳定性越好,从而说明原子总能量越高。
l是氢原子基态的量子数之二,也叫作角动量粒子数,用字母l 表示,又叫作Angular Momentum Quantum Number(角动量量子数)。
它反映了电子角动量的大小,决定原子电子自旋和轨道所占空间,从而决定了原子形状和大小,也影响了原子能级排列。
从l的值可以看出,角动量越大(当l=3时),说明空间的大小也越大,轨道的扩展更加明显,因此能级排列也就越混乱。
m是氢原子基态的量子数之三,也叫作角动量分量,用字母m表示,又叫作Magnetic Quantum Number(磁量子数)。
- 1 -。
描述单个电子的四个量子数,其物理意义是什么?

1.描述单个电子的四个量子数,其物理意义是什么?量子数是量子力学中表述原子核外电子运动的一组整数或半整数。
因为核外电子运动状态的变化不是连续的,而是量子化的,所以量子数的取值也不是连续的,而只能取一组整数或半整数。
量子数包括主量子数n 、角量子数l 、磁量子数m 和自旋量子数s 四种,前三种是在数学解析薛定谔方程过程中引出的,而最后一种则是为了表述电子的自旋运动提出的。
(1). 主量子数n① 它决定了能量En 的大小和量子:eV nZ n Z me E n 6.13822222204⋅-=⋅-= ε ② 简并度:21012n l g n l =+=∑-=③ 决定了原子状态波函数的总节面数为n-1个.(2). 角量子数l222)1()2)(1( +=+=l l h l l M π 即: )1(||+=l l M l=0,1,2, ……, n-1① 角量子数l 决定了角动量的大小.② 决定了磁矩的大小:B ee l l m eh l l h l l m eμππμ)1(4)1(2)1(2||+=⋅+=⋅+= ③ 在多电子原子中也决定了轨道的能量。
(3).磁量子数m⋅=π2h m M Z m=0,±1,±2,……±l ① m 决定了电子的轨道角动量在Z 轴方向得分量z M 的量子化,角动量在磁场中可有(2l+1)种取向,即角动量方向量子化。
② 也决定了轨道磁矩在磁场方向的分量Z μ的量子化。
B Z m μμ-=③ 有外加磁场时决定体系的能量。
2.描述原子整体状态的四个量子数是什么?其光谱项及光谱支项符号是什么? 可以用表征原子内各种相互作用的四个量子数L,S,J 和MJ 来标记原子的状态。
原子的状态可用L,S,J 和MJ 来标记,光谱学上常写成符号L s 12+,L s 12+称为光谱项,J s L 12+为光谱支项,用S,P,D,F,G,H 分别代表,3,2,1,0=L 等状态。
H原子的四个量子数

H原子的四个量子数
原子质量数为1的氢原子有4个量子数:原子核电荷量子数n、轨道角量子数l、轨道角动量量子数ml、总正负量子数ms。
原子核电荷量子数n是描述原子的最重要的一个量子数,它代表的是原子的能量水平和最大的电荷数,也叫外层电子配置的第一量子数,n在氢原子中取值为1,表示原子的能量最低水平位于一能级,最大的电荷数也只有一个电子。
轨道角量子数l又称为角动量量子数,它是描述原子在第n能级内各轨道中电子态势型与此能级性质之间的关系,当n=1时,l只可取0,表明原子在一能级中,其单电子只可分布在1s轨道中,也就是氢原子只有1s轨道。
最后是总正负量子数ms,它是描述原子轨道中电子状态势型的非旋转对称性,即电子有正转和负转两种可能。
在氢原子中,只有一个电子,n=l=ml=0,ms的取值范围为-
1/2到+1/2,且在实际上只取正值,即ms=+1/2。
量子物理四个量子数

(1) n 4;
1 (2) n 4 m ;
s2
(3) n 4 m 3 l
(1) n=4, Zn 2n2 32
(2)n 4
ms
1 2
;
总电子数为 16.
缺少
1 ms 2 的16个电子.
(3)n 4 ml 3
l 3 总电子数为 2.
原子中电子的状态要用四个量子数描述且受泡利不相容
2. 能量最小原理 原子处于正常状态时,每个电子都趋向占据可能的最低能级 主量子数 n 决定 能级高低 影响 角量子数 l
1s 2s 2p 3s 3p 3d 4s
1氢 H 1 2 氦 He 2
3 锂 Li 2 1 4 铍 Be 2 2
D = n + 0.7 l
5硼 B 2 2 1
6碳 C 2 2 2
量子数 (n, l, ml , mS ) 的可能取值为:
(A) (3,1,1, 1 ), (B) (1, 0,1, 1 ),
2
2
(C) (2, 1, 2, 1 ), 2
(D) (3, 2, 0, 1 ). 2
l2
ml 0, 1, 2.
1 ms 2
(D)
求下列量子态中可填充的最大电子数
N
➢ 小结 分
立 的 沉 积 线
F取 分 立
F
z
dB dz
的
值
μZ 取分 立的 值
μ空 间 量 子 化
e
L
2me
角 动 量
空 间 量 子 化
基态 Ag 原子的磁矩等于最外层价电子的磁矩,其 Z 取(2l+1 )个
值,则 F 可取(2l+1 )个值,原子沉积线条数应为奇数(2l+1 ), 而不应是两条.
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
出现对称的 两条细线? 奇怪!
l 0
电子的自旋
怎样解释这一奇怪的现象呢?
美国物理学家克罗尼格(R.L.Kroning) 提出电子绕自身的轴自旋的模型,并作了一 番计算.并急忙去找泡利,但遭到泡利的强 烈反对,并对他说:“你的想法很聪明,但大 自然并不喜它”.因泡利早就想到过这一模 型,并计算出电子速度要超过光速。所以必 须放弃。
分壳层
角量子数( l)
S 0
p 1
d
2
h
5
角动量(L)
0
2
6 12 20 30
3、磁量子数 ml
角动量在空间取向不是任意的,以外磁场为Z轴方向,则角动量在Z轴上的分量:
LZ ml
ml 0. 1. 2. 3 l 称为“磁量子数” 或“轨道磁量子数”
LZ 0,,2
N 4 Nn 2 8 18 32 各支壳层最多可容纳的电子数: (2l 1) 2 p d 支壳层符号 s f 3 0 1 2 角量子数 l 2 10 14 6 Nl
例碳原子:原子系数为6,核外有6个电子
O 5 50பைடு நூலகம்
g 4 18
P 6 72
h 5 22
第一壳层最多只能容纳两个电子。余下4个电子填充第 二壳层,第二壳层的s态仅级容纳两个电子,余下电子 2 填充在2p能级: 2 2
32 能有的电子数为___________个.
6. 主量子数n = 2的量子态中,角量子数l的可能取值为 ____________;自旋量子数ms=1/2的量子态中,能够填充的 0,1 4 最大电子数为__________,并写出。
S
半年后,荷兰物理学家埃斯费斯特的两个学生乌仑贝克 和高斯密特(G.E.Uhlenbeck and S.A.Goudsmit)在不知上 述情形下,也提出了同样的想法,并写了一篇论文,请埃 斯费斯特推荐给“自然”杂志。并将论文寄出。接着又去找 洛仑兹,洛仑兹热情地接待了他们。但一周后,洛仑兹交 给他们一叠稿纸。并告诉他们,如果电子自旋,其表面速 度将超过光速,但论文已寄出,他们后悔不已。
l
※泡利不相容原理(Pauli
exclusion principle)
在原子系统内,不可能有两个或两个以上的电子具有 相同的状态,亦不可能具有相同的四个量子数。
由各量子数可能取值的范围可求出电子的可能状态数:
各支壳层最 多可容纳的 电子数
n,l,ml 相同,但ms不同的可能状态有2个 n, l 相同,但ml 、ms不同的可能状态有
[B ]
2、在氢原子的K壳层中,电子可能具有的量子数(n,l,ml,ms)是 1 1 (A) (1,0,0, ). (B) (1,0,-1, ). 2 2 1 1 ). [ A] (C) (1,1,0, 2 ). (D) (2,1,0, 2
3、试求d分壳层最多能容纳的电子数,并写出这些电子的ml和ms值. 解: d分壳层就是角量子数l=2的分壳层 d分壳层最多能容纳的电子数为
幸运的是论文得以发表。论文发表后,海森伯表示赞许,后经 爱因斯坦等人的努力,物理界普遍接受了自旋的概念,但泡利 始终反对。
他认为“一种新的邪说被引进了物理学”。 应当说泡利并没有错,两年后狄拉克建立了相对论量子 力学,自然地得到了电子具有内禀角动量的重要结论。 关于电子自旋问题,量子力学中得到一结论: (4).电子自旋角动量S的大小:
Ly
y
Lx
x
决定电子绕核运动的角动量 角动量量子数
注意:角动量量子化是通过解Schrödinger 得出的,并非人为 假设.
即能量为En的原子,角动量有几种可能的值。也可以 说,同一主壳层的电子又处在不同的分壳层上。
l 0.1.2(n 1) L
l (l 1)
f
3 g 4
量子力学中通常用小写字母s.p.d.f.g.表示这些状态.
实验验证 1921年,施忒恩(O.Stern)和盖拉赫W.Gerlach) 发现一些处于S 态(l=0)的原子射线束,在非均匀磁 场中一束分为两束。 z
S 原子炉
准直屏
N
磁
铁
电子的自旋量子数 mS
L l (l 1)
实验结果:
无外磁场
LZ ml
有外磁场
l 0.
l 1
L l (l 1) 0
Ψ Ψ(r , , )
求解定态薛定谔方程
电子的状态要用 n、l、ml 、ms四个量子数表示,相应的 波函数 n,l .ml ,ms 对确定能级En电子有2 n2 种可能状态
100 1
基态 n =1 2n
2=
2
2
100
1 2
第一激发态 n =2
2n2 = 8 —— 2lm
?
ml 0,1,2
1 mS 2
2(2l 1) 10个
4、主量子数n = 4的量子态中,角量子数l的可能取值为
0,1,2,3 0, 1, 2, 3 ____________;磁量子数ml的可能取值为_________________.
5、根据泡利不相容原理,在主量子数n = 4的电子壳层上最多可
例:判别4s与3d能级的高低。
对4s能级
对3d能级 电子先填充4s能级,再填3d能级
(n 0.7l ) 4 0.7 0 4 (n 0.7l ) 3 0.7 2 4.4 4
各壳层最多可容纳的电子数
壳层符号
2n
M 3
18
2
K 1 2
L 2
8
N
O 5
50
P 6 72
1s 2s 2 p
※
能量最小原理
当原子处在正常状态时电子尽可能地会占据未 被填充的最低能级。
由此可见:主量子数越小,能级越低,越被首先填满。
注意:1)对多电子原子,能量或能级也与副量子数有关。因此 判别能级高低不能只看主量子数n。我国学者研究出一个判别式:
(n 0.7l ) 的值越大者,能级越高。
1、原子的壳层结构
取决于原子中电子的四个量子数 —— n,l,ml , ms 主壳层---具有相同主量子数n的电子构成一个壳层 主量子数 n 壳层符号 1 K 2 L 3 M
4
N
5 O
6 P
同一壳层(Shell)中的电子离核的距离大致相同 支壳层(Subshell)--按角(副)量子数 l 的不同而分的壳层。
K、L、M、N、O、P、Q……主壳层
2、角动量量子数 l
电子饶核旋转,“轨道”角动量是量子化的
·· · ·· ···· ··· ·· ·· · ·· · ·· · ·· · ·· ·· ·· · ··· · · ·· · · ···· ··· ·
Lz
z
L l (l 1)
l 0.1.2(n 1)
1 mS 2
B
因此在量子力学中,对原子的电子的 状态通常是用四个量子数来确定的。
1 2
S
主量子数
决定电子的能量。
角量子数
决定电子绕核运动的角动量
磁量子数 决定电子绕核运动的 角动量矢量在外磁场中的空间取向, 自旋磁量子数 的的空间取向, 决定自旋角动量在外磁场中 。
二、各种原子中电子的排布
n相同,但l,ml 、ms不同的可能状态有
n 1
个 组成支壳层
个 组成壳层
各壳层最多可 容纳的电子数
2 2[2( n 1) 1] N n 2( 2l 1) n 2n 2 2 l 0
三、常用支壳层电子组态表明原子结构
各壳层最多可容纳的电子数: 壳层符号 K L M 1 3 主量子数 n 2
20.8 原子中的电子
—、四个量子数
*
以氢原子为例解定态薛定谔方程 e2 势能函数 V 4 0 r 定态薛定谔方程
2 2 2 2m ( 2 2 2 )Ψ 2 E V Ψ 0 x y z 球坐标的定态薛定谔方程
1 2 1 (r ) 2 (sin ) 2 r r r r sin 1 2 2m e2 2 2 2 (E ) 0 2 r sin 4 0 r
: 主量子数 n
N
4
32
各支壳层最多可容纳的电子数: (2l 1) 2 p g d 支壳层符号 s f
角量子数
h
l
0
2
1
6
2
10
3
14
4
18
5
22
Nl
例1:氯原子有17个电子, 例2:钾原子有19个电子, 写出基态原子组态。 写出基态原子组态。
n 1 2 l 0 0 1
2(2l+1)
2 2 6
角量子数 支壳层符号
l
0 s
1 p
2 d
3 f
4 g
5 h
注意:对多电子的原子系统而言:能量主要由主量子n数决 定,但也与副量子数 l 有关,故一个支壳层代表了一 种能量组态,因此用主量子数与副量子数来表示一个 支壳层。如1s、2s、2p·····
壳层表: 4 3 0 1 2 5 p g s h n d f 壳层 1s K 1 L 2 2s 2p M 3s 3p 3d 3 N 4 4s 4p 4d 4f O 5s 5p 5d 5f 5g 5 6s 6p 6d 6f 6g 6h P 6 各壳层的电子又是如何排列呢?分析表明 基态原子中的核外电子排列满足如下两个 原理:
S s(s 1)
S称自旋量子数,取值仅有一个值“1 / 2”
1 1 3 即 S 2 ( 2 1) 2
(5)电子自旋角动量在空间的取向是量子
化的,S在外磁场方向的投影:
S Z mS
