极化曲线求自腐蚀电流密度
铁的极化曲线物化实验报告
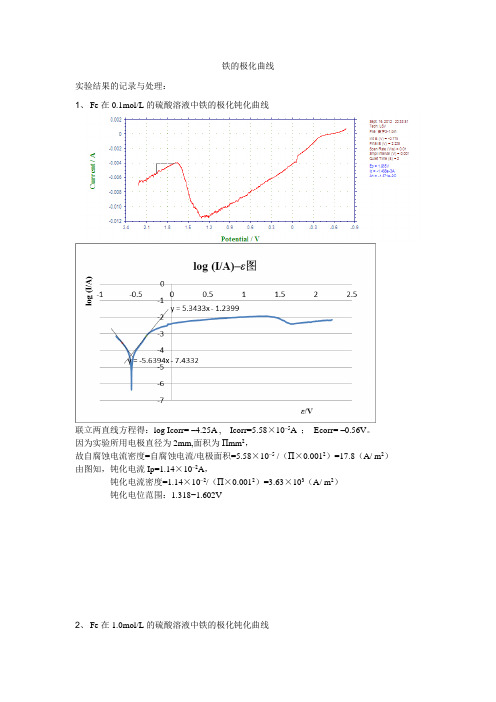
铁的极化曲线实验结果的记录与处理:1、Fe在0.1mol/L的硫酸溶液中铁的极化钝化曲线联立两直线方程得:log Icorr= ‒4.25A , Icorr=5.58×10‒5A ;Ecorr= ‒0.56V。
因为实验所用电极直径为2mm,面积为Πmm2,故自腐蚀电流密度=自腐蚀电流/电极面积=5.58×10‒5 /(Π×0.0012)=17.8(A/ m2)由图知,钝化电流Ip=1.14×10‒2A,钝化电流密度=1.14×10‒2/(Π×0.0012)=3.63×103(A/ m2)钝化电位范围:1.318−1.602V2、Fe在1.0mol/L的硫酸溶液中铁的极化钝化曲线联立两直线方程得:log Icorr= ‒4.25A , Icorr=5.58×10‒5A ;Ecorr= ‒0.56V。
因为实验所用电极直径为2mm,面积为Πmm2,故自腐蚀电流密度=自腐蚀电流/电极面积=5.58×10‒5 /(Π×0.0012)=17.8(A/ m2)由图知,钝化电流Ip=1.14×10‒2A,钝化电流密度=1.14×10‒2/(Π×0.0012)=3.63×103(A/ m2)钝化电位范围:1.318−1.602V3、Fe在1.0mol/L的HCl溶液中铁的极化钝化曲线联立两直线方程得:log Icorr= ‒4.25A , Icorr=5.58×10‒5A ;Ecorr= ‒0.56V。
因为实验所用电极直径为2mm,面积为Πmm2,故自腐蚀电流密度=自腐蚀电流/电极面积=5.58×10‒5 /(Π×0.0012)=17.8(A/ m2)由图知,钝化电流Ip=1.14×10‒2A,钝化电流密度=1.14×10‒2/(Π×0.0012)=3.63×103(A/ m2)钝化电位范围:1.318−1.602V4、Fe在含1%的乌洛托品的1.0mol/L的HCl溶液中铁的极化钝化曲线联立两直线方程得:log Icorr= ‒4.25A , Icorr=5.58×10‒5A ;Ecorr= ‒0.56V。
极化曲线求自腐蚀电流密度

极化曲线求自腐蚀电流密度
自腐蚀电流密度可以通过测量极化曲线来获得,具体方法如下:
1. 准备工作:准备好待测的金属样品,并将其作为工作电极放在电解质溶液中。
2. 极化曲线测量:在测量中,需要通过改变工作电极的电势来获得极化曲线。
可以使用电位扫描法或电流密度扫描法进行测量。
- 电位扫描法:在这种方法中,将工作电极的电势从一个起始
点线性变化到一个终止点,并记录在每个电位下测得的电流密度值。
根据所测得的数据绘制极化曲线,横坐标为电势,纵坐标为电流密度。
- 电流密度扫描法:在这种方法中,将工作电极的电流密度从
一个起始点线性变化到一个终止点,并记录在每个电流密度下测得的电势值。
根据所测得的数据绘制极化曲线,横坐标为电流密度,纵坐标为电势。
3. 求自腐蚀电流密度:自腐蚀电流密度通常对应于极化曲线的原点,即在工作电极无外加电势的情况下的电流密度值。
4. 分析结果:根据所测得的极化曲线,可以进一步分析金属的腐蚀行为。
如果极化曲线在原点处呈现水平线,则说明金属处于自腐蚀状态,该水平线对应的电流密度即为自腐蚀电流密度。
需要注意的是,测量极化曲线时要注意电解质溶液的温度、测量仪器的准确性等因素,以获得可靠的结果。
极化曲线实验报告

腐蚀金属电极稳态极化曲线测量和数据处理一、实验目的:1、掌握恒电位测定极化曲线的原理和方法2、巩固金属极化理论,确定金属实施阳极保护的可能性。
初步了解阳极保护参数及其确定方法。
3、了解恒电位仪器及相关电化学仪器的使用。
4、测定铁在酸性介质中的极化曲线,求算自腐蚀电位、自腐蚀电流、掌握线性扫描伏安法和TAFEL方法测定极化曲线。
实验原理铁在酸溶液中,将不断被溶解,同时产生H2,即:Fe + 2H+ = Fe2+ + H2 (a)Fe/HCl体系是-个二重电极,即在Fe/H+界面上同时进行两个电极反应:Fe Fe2+ + 2e (b)2H+ + 2e H2 (c)反应(b)、(c)称为共轭反应。
正是由于反应(c)存在,反应(b)才能不断进行,这就是铁在酸性介质中腐蚀的主要原因。
当电极不与外电路接通时,其净电流I总为零。
在稳定状态下,铁溶解的阳极电流I(Fe)和H+还原出H2的阴极电流I(H),它们在数值上相等但符号相反,即:(1)IFe的大小反映Fe在H+中的溶解速率,而维持I(Fe),I(H)相等时的电势称为Fe/H+体系的自腐蚀电势εcor。
图12-1 Fe的极化曲线图12-1是Fe在H+中的阳极极化和阴极极化曲线图。
当对电极进行阳极极化(即加更大正电势)时,反应(c)被抑制,反应(b)加快。
此时,电化学过程以Fe的溶解为主要倾向。
通过测定对应的极化电势和极化电流,就可得到Fe/H+体系的阳极极化曲线rba。
由于反应(c)是由迁越步骤所控制,所以符合塔菲尔(Tafel)半对数关系,即:(2)直线的斜率为bFe。
当对电极进行阴极极化,即加更负的电势时,反应(b)被抑制,电化学过程以反应(c)为主要倾向。
同理,可获得阴极极化曲线rdc。
由于H+在Fe电极上还原出H2的过程也是由迁越步骤所控制,故阴极极化曲线也符合塔菲尔关系,即:(3)当把阳极极化曲线abr的直线部分ab和阴极极化曲线cdr的直线部分cd 外延,理论上应交于一点(z),z点的纵坐标就是,腐蚀电流Icor的对数,而z 点的横坐标则表示自腐蚀电势εcor的大小。
实验二 铁的极化曲线的测定

实验二铁的极化曲线的测定实验二铁的极化曲线的测定一、实验目的1、掌握恒电位法测定电极极化曲线的原理和实验技术。
通过测定Fe在H2SO4、HCl溶液中的阴极极化、阳极极化曲线,求得Fe的自腐蚀电位,自腐蚀电流和钝化电势、钝化电流等参数。
2、了解Cl-离子,缓蚀剂等因素对铁电极极化的影响。
3、讨论极化曲线在金属腐蚀与防护中的应用。
二、实验原理1、铁的极化曲线:金属的电化学腐蚀是金属与介质接触时发生的自溶解过程。
例如Fe →Fe2++2e (1)2H++2e →H2(2) Fe将不断被溶解,同时产生H2。
Fe电极和H2电极及H2SO4溶液构成了腐蚀原电池,其腐蚀反应为:Fe+2H+→ Fe2++H2(3)这就是Fe在酸性溶液中腐蚀的原因。
当电极不与外电路接通时,其净电流为零。
即I corr=I Fe=-I H≠0。
图1中ra为阴极极化曲线。
当对电极进行阴极极化,即加比Ecorr更负的电势,反应(1) 被抑制,反应(2)加速,电化学过程以H2析出为主,这种效应称为“阴极保护”。
塔菲尔(Tafel)半对数关系,即:图1中ab为阳极极化曲线。
当对电极进行阳极极化时,即加比Ecorr更正的电势,则反应(2) 被抑制,反应(1) 加速,电化学过程以Fe溶解为主。
符合公式:2、铁的钝化曲线:abc段是Fe的正常溶解,生成Fe2+,称为活化区。
cd段称为活化钝化过渡区。
de段的电流称为维钝电流,此段电极处于比较稳定的钝化区, Fe2+离子与溶液中的离子形成FeSO4沉淀层,阻滞了阳极反应,由于H+不易达到FeSO4层内部,使Fe表面的pH增大,Fe2O3、Fe3O4开始在Fe表面生成,形成了致密的氧化膜,极大地阻滞了Fe的溶解,因而出现钝化现象。
ef段称为过钝化区。
图3中W表示研究电极、C表示辅助电极、r表示参比电极。
参比电极和研究电极组成原电池,可确定研究电极的电位。
辅助电极与研究电极组成电解池,使研究电极处于极化状态。
极化曲线测量金属的腐蚀速度

极化曲线测量金属的腐蚀速度极化曲线测量金属的腐蚀速度一、目的和要求1. 掌握恒电位法测定电极极化曲线的原理和实验技术。
通过测定Fe 在NaCl 溶液中的极化曲线,求算Fe 的自腐蚀电位,自腐蚀电流。
2. 讨论极化曲线在金属腐蚀与防护中的应用。
二、基本原理当金属浸于腐蚀介质时,如果金属的平衡电极电位低于介质中去极化剂(如H +或氧分子)的平衡电极电位,则金属和介质构成一个腐蚀体系,称为共轭体系。
此时,金属发生阳极溶解,去极化剂发生还原。
以金属锌在盐酸体系中为例:阳极反应: Zn-2e=Zn 2+阴极反应: H ++2e=H 2阳极反应的电流密度以 i a 表示,阴极反应的速度以 i k 表示,当体系达到稳定时,即金属处于自腐蚀状态时,i a =i k =i corr (i corr 为腐蚀电流),体系不会有净的电流积累,体系处于一稳定电位c ?。
根据法拉第定律,体系通过的电流和电极上发生反应的物质的量存在严格的一一对应关系,故可阴阳极反应的电流密度代表阴阳极反应的腐蚀速度。
金属自腐蚀状态的腐蚀电流密度即代表了金属的腐蚀速度。
因此求得金属腐蚀电流即代表了金属的腐蚀速度。
金属处于自腐蚀状态时,外测电流为零。
极化电位与极化电流或极化电流密度之间的关系曲线称为极化曲线。
极化曲线在金属腐蚀研究中有重要的意义。
测量腐蚀体系的阴阳极极化曲线可以揭示腐蚀的控制因素及缓蚀剂的作用机理。
在腐蚀点位附近积弱极化区的举行集会测量可以可以快速求得腐蚀速度。
还可以通过极化曲线的测量获得阴极保护和阳极保护的主要参数。
在活化极化控制下,金属腐蚀速度的一般方程式为:其中 I 为外测电流密度,i a 为金属阳极溶解的速度,i k 为去极化剂还原的速度,βa 、βk 分别为金属阳极溶解的自然对数塔菲尔斜率和去极化剂还原的自然对数塔菲尔斜率。
若以十为底的对数,则表示为b a 、b k 。
这就是腐蚀金属电极的极化曲线方程式,令 ?E 称为腐蚀金属电极的极化值,?E =0时,I =0;?E>0时,是阳极极化,I>0,体系通过阳极电流。
极化曲线等的实验原理 2

极化曲线
是一种快速测定金属腐蚀速度和腐蚀倾向的方法,极化曲线的自腐蚀电位表明了材料的腐蚀趋势,电位越负说明腐蚀趋势越大,而自腐蚀电流密度icorr表明了腐蚀速度的快慢, icorr越大,说明腐蚀速度越快。
icorr是阴极极化曲线和阳极化曲线的塔菲尔区的切线交点对应的电流密度值。
操作参数:采用动电位极化曲线法评价耐蚀性能,测量溶液是3.5%NaCl,在自腐蚀电位±300mV进扫描,扫描速率为50mV/s。
显微硬度评价膜层性能
测定之前,先要将待测磨料制成反光磨片试样,置于显微硬度计的载物台上,通过加负荷装置对四棱锥形的金刚石压头加压负荷的大小可根据待测材料的硬度不同而增减。
金刚石压头压入试样后,在试样表面上会产生一个凹坑。
把显微镜十字丝对准凹坑,用目镜测微器测量凹坑对角线的长度。
根据所加负荷及凹坑对角线长度就可计算出所测物质的显微硬度值。
HV = 常数×试验力/压痕表面积≈0.1891 F/d2。
其最大的优点在于其硬度值与试验力的大小无关,只要是硬度均匀的材料,任意试验力性能不受影响;缺点在于试样要求高,技术要求高,多数停留在实验室使用,致使试验效率低。
仪器操作参数:试验力1.961N(200g),测量系统放大倍数400倍(测量)、100倍(观察),加载时间10s,电源交流电220V。
实验原理
阳极氧化,
它是一种比较传统的表面处理技术,就是把金属或合金放在合适的电解液中作为阳极进行通电、处理,使得金属或合金表面生成一种氧化薄膜的电化学氧化方法。
动电位极化曲线 计算腐蚀速率

主题:动电位极化曲线计算腐蚀速率目录1. 动电位极化曲线的概念及原理2. 腐蚀速率的计算方法3. 实际案例分析4. 结论与展望1. 动电位极化曲线的概念及原理动电位极化曲线是一种常用的腐蚀分析方法,它通过测定金属在一定电位范围内的极化曲线,来研究金属的腐蚀行为。
在动电位极化曲线中,横轴表示电位,纵轴表示电流密度。
通过测定金属在极化曲线上的拐点,可以得到金属的腐蚀电位和腐蚀电流密度,进而计算腐蚀速率。
动电位极化曲线的测定可以在自然环境下进行,也可以在实验室中通过电化学方法进行。
通过对动电位极化曲线的分析,可以了解金属在具体环境中的腐蚀行为,为腐蚀预防提供重要参考。
2. 腐蚀速率的计算方法腐蚀速率是描述金属在一定环境条件下腐蚀程度的重要指标。
根据动电位极化曲线的测定结果,可以采用以下方法来计算金属的腐蚀速率。
(1)泊松方程法泊松方程法是一种常用的计算腐蚀速率的方法。
它通过测定金属在不同电位下的动电位极化曲线,并利用泊松方程建立腐蚀速率和电流密度之间的关系,来计算腐蚀速率。
(2)球形极化曲线法球形极化曲线法是一种基于动电位极化曲线的计算腐蚀速率的方法。
它利用金属在球形电极下的动电位极化曲线,通过对曲线的分析,来计算金属的腐蚀速率。
(3)Tafel斜率法Tafel斜率法是一种通过测定金属在不同电位下的动电位极化曲线,利用Tafel斜率和Tafel方程来计算腐蚀速率的方法。
通过对Tafel斜率和Tafel方程的运用,可以较准确地计算金属的腐蚀速率。
3. 实际案例分析以某海洋评台上使用的钢结构为例进行分析,该钢结构在海水中进行了腐蚀测试,得到了相应的动电位极化曲线。
通过对曲线的测定和分析,得到了钢结构在海水中的腐蚀电位和腐蚀电流密度。
根据腐蚀电位和腐蚀电流密度,可以利用上述方法计算钢结构在海水中的腐蚀速率。
通过实际数据的分析和计算,可以较准确地了解钢结构在海水中的腐蚀状况,为相关腐蚀防护措施的制定提供重要参考。
电化学实验2 铁的极化曲线测定数据处理

铁的极化曲线测定数据处理
图一 Fe 在 0.1MH2SO4 中极化曲线
图二 Fe 在 0.1MH2SO4 中极化曲线 Fe 在不同浓度 H2SO4 中 硫酸浓度 0.1M 1.0M 自腐蚀电流 -3.336A -2.481A 自腐蚀电位 -0.555V -0.551V 钝化电流 -1.478A 钝化电位范围 0.5423V-1.2961V
2
/#×".$)# 1×2#34/
= 3.139g ∙ m:1 ∙ h:) ;υ1 = 3600×
/#×1.3$/ 1×2#34/
= 2.920g ∙ m:1 ∙ h:)
结论:Fe 在低浓度(0.1M )H2SO4 中未钝化,在较高浓度(1M )H2SO4 中钝化; 腐蚀速率加入乌洛托品后下降,说明乌洛托品有缓释作用。
图?fe在01mh2so4中极化曲线图?fe在01mh2so4中极化曲线fe在不同浓度h2so4中硫酸浓度自腐蚀电流自腐蚀电位钝化电流钝化电位范围01m3336a0555v10m2481a0551v1478a05423v12961v2?fe在hcl及缓蚀剂中
电化学实验 2
一、 Fe 在不同浓度 H2SO4 中:
图三 Fe 在 1M 的 HCl 中极化曲线
图四 Fe 在 1M 的 HCl 中+1%乌洛托品极化曲线 已知:υ=
"#$$%& '(
(*)
由图知:Fe 在 1M 的 HCl 中,自腐蚀电流 i1=-3.016A; Fe 在 1M 的 HCl 中+1%乌洛托品中,自腐蚀电流 i2=-2.805A 所以:将 i1、i2 代入公式(*)得: υ) = 3600×
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
极化曲线求自腐蚀电流密度
1. 引言
自腐蚀电流密度是表征金属在自腐蚀环境中的腐蚀性能的重要参数。
通过测量极化曲线,可以获得金属在自腐蚀条件下的电流密度,进而评估其腐蚀倾向和腐蚀速率。
本文将介绍极化曲线的概念和测量方法,并详细探讨如何通过极化曲线求得自腐蚀电流密度。
2. 极化曲线的概念
极化曲线是描述金属在电化学腐蚀条件下的电流密度与电位之间关系的曲线。
它是通过在不同电位下测量金属电流密度的变化来得到的。
一般来说,极化曲线可以分为两个区域:阳极极化区和阴极极化区。
在阳极极化区,金属电流密度随着电位的增加而增加;在阴极极化区,金属电流密度随着电位的增加而减小。
3. 极化曲线的测量方法
测量极化曲线的方法有很多种,其中最常用的是三电极法和双电极法。
以下将详细介绍这两种方法的原理和步骤。
3.1 三电极法
三电极法是通过在被测金属表面插入一个参比电极和一个工作电极,通过控制参比电极和工作电极之间的电位差来测量金属的电流密度。
具体步骤如下:
1.准备工作电极、参比电极和电解质溶液。
2.将工作电极和参比电极插入电解质溶液中,使其与溶液充分接触。
3.通过外部电源控制参比电极和工作电极之间的电位差,并测量工作电极的电
流响应。
4.通过改变电位差,测量不同电位下的电流密度。
5.根据测量数据绘制极化曲线。
3.2 双电极法
双电极法是通过在被测金属表面插入一个工作电极和一个参比电极,通过改变工作电极的电位来测量金属的电流密度。
具体步骤如下:
1.准备工作电极、参比电极和电解质溶液。
2.将工作电极和参比电极插入电解质溶液中,使其与溶液充分接触。
3.通过外部电源控制工作电极的电位,并测量工作电极的电流响应。
4.通过改变工作电极的电位,测量不同电位下的电流密度。
5.根据测量数据绘制极化曲线。
4. 极化曲线求自腐蚀电流密度的方法
通过测量得到的极化曲线,可以通过以下方法求得金属的自腐蚀电流密度。
4.1 Tafel斜率法
Tafel斜率法是通过极化曲线的斜率来求得自腐蚀电流密度的方法。
具体步骤如下:
1.在极化曲线的阳极极化区和阴极极化区分别选取一段直线段。
2.通过线性拟合得到阳极极化区和阴极极化区的斜率。
3.根据斜率计算自腐蚀电流密度。
4.2 Tafel外推法
Tafel外推法是通过极化曲线的外推来求得自腐蚀电流密度的方法。
具体步骤如下:
1.在极化曲线的阳极极化区和阴极极化区分别选取一段直线段。
2.通过线性拟合得到阳极极化区和阴极极化区的直线方程。
3.根据直线方程外推得到自腐蚀电流密度。
4.3 腐蚀动力学模型法
腐蚀动力学模型法是通过根据极化曲线拟合得到的腐蚀动力学模型来求得自腐蚀电流密度的方法。
具体步骤如下:
1.根据测量得到的极化曲线,选择适当的腐蚀动力学模型。
2.根据模型参数拟合得到的极化曲线与实际测量的极化曲线进行比较。
3.根据拟合结果求得自腐蚀电流密度。
5. 结论
通过测量极化曲线,并通过Tafel斜率法、Tafel外推法或腐蚀动力学模型法,可以求得金属的自腐蚀电流密度。
这一参数可以用于评估金属在自腐蚀条件下的腐蚀性能,为腐蚀控制和材料选择提供依据。
