最新通过GLP认证机构名单
动物实验室的nmpa glp 证书

动物实验室的NMPA GLP证书是指药物非临床研究质量管理规范(Good Laboratory Practice,简称GLP)认证证书。
这个证书是由中国国家药品监督管理局(National Medical Products Administration,简称NMPA)颁发的,证明实验室在药物非临床安全性评价研究中遵守了GLP规范。
GLP规范是一套国际公认的实验室质量管理体系标准,旨在确保实验数据的质量、可靠性和完整性。
获得NMPA GLP证书的实验室意味着其具备了进行药物安全性评价等非临床研究的资格和能力。
此外,对于通过GLP认证的药物非临床安全性评价研究机构,NMPA会发放新版的药物GLP 认证证书,该证书的有效期通常为5年。
这表明实验室在认证有效期内需要维持符合GLP 标准的管理和操作流程,以确保其研究质量得到持续的保证。
总的来说,GLP认证对于实验室来说是一个重要的质量保证,它不仅有助于提升实验室的国际认可度,还能够增强其在国内药品注册审批过程中的竞争力。
因此,许多实验室都会积极追求获得这一认证,以展示其科研水平和管理能力。
我国农药GLP

我国GLP现状中国继2005 年首次作为临时观察员参加第19 届OECD/GLP 工作组会议后,于2008 年作为临时观察员第二次组团参加该工作组会议。
中国代表团向大会报告了近年来中国在GLP 监控领域的工作进展,并表示中国将积极申请成为OECD/GLP “非成员数据互认协议”签署方。
由于我国不是OECD 成员国,目前尚未建立工业化学品GLP 监控体系,也没有加入OECD/GLP 工作组或加入其非成员数据互认协议,目前我们国家还没有哪一种GLP 认证是被国际认可的,数据还不能够得到国际承认,我国处于提交加入OECD -GLP 体系的申请阶段。
化学品监管涉及农业部、国家环保总局、卫生部和国家食品药品监管局等部门,并需以国家名义递交申请方可有效。
目前相关部门正在积极协调,希望尽早向OECD 提交申请书,进一步推进我国实现包括药物安全评价资料在内的化学品资料国互认的进程。
农药、兽药GLP我国是农药生产、使用和出口大国,促进我国农药GLP 管理体系和农药GLP 实验室的建设,是农药管理和形势发展的需要。
我国农药GLP 工作,但近几年在GPL 体系建立、尤其是GLP 国际互认方面开展了一些卓有成效的工作。
先后制定与GLP 有关的法律、法规和标准:NY/T 718 -2003《农药毒理学安全性评价良好实验室规范》NY/T 1386 -2007 农药理化分析良好实验室规范准则。
2003 年颁布实施《农药毒理学安全性评价良好实验室规范》,2006 年11 月农业部公告第739 号《农药良好实验室考核管理办法》;2008 年6 月农业部发布《关于开展农药良好实验室规范符合性考核工作的通知》;2008 年8 月农业部办公厅发布《关于印发《农药良好实验室考核专家管理办法》和《农药良好实验室规范符合性考核评价表》的通知》农办农[2008]129 号。
虽然农业部也参照OECD 的GLP 准则,相继制定和出台了GLP 的规章和技术标准,2008 年6 月也发布通知,但尚未有机构通过检查认定。
赛赋医药安评中心:打造一站式医药CRO平台,获得GLP资质9项认证

赛赋医药安评中⼼:打造⼀站式医药CRO平台,获得GLP资质9项认证动脉⽹近⽇获悉,国科赛赋河北医药技术有限公司(赛赋医药安评中⼼)获得了国家药品监督管理局(NMPA)颁发的药物⾮临床研究质量规范(GLP)9项全项药物安全性评价试验资质证书。
赛赋医药本次获得GLP资质认证,标志着该公司的⼀站式医药CRO服务平台进⼀步健全。
2003年6⽉4⽇,我国正式发布了GLP规范,第⼀次对全国药物临床前安全评价实验室进⾏了试点检查,检查试验项⽬包括在实验室条件下,⽤实验系统进⾏的各种毒性试验,例如单次给药的毒性试验、反复给药的毒性试验、⽣殖毒性试验、遗传毒性试验、致癌试验、局部毒性试验、免疫原性试验、依赖性试验、毒代动⼒学试验及与评价药物安全性有关的其它试验。
药物临床前安全评价作为新药研发中最重要的⼀环,通过GLP认证的实验室才有资格进⾏药物的各种毒性试验,GLP实验室也成为医药CRO企业间拉开差距的竞争点之⼀。
截⾄⽬前,我国约有近70家实验室通过了GLP认证,但约⼀半的GLP实验室只获得了7项及7项以内的试验资质批件。
再加之GLP实验室对设备仪器、场地、⼈员等的要求⾮常⾼,由此带来的运营开⽀⼗分庞⼤,普通企业难以承受,所以我国⼤多数GLP实验室都具有很强的政府背景,如中检所、军科院或上海药物所的安评中⼼等。
赛赋医药安评中⼼作为⼀个⾮政府背景的第三⽅GLP实验室,并且能够获得9项安评项⽬的试验资质批件,其背后的实⼒有⽬共睹。
此次获得GLP资质的国科赛赋河北医药技术有限公司是赛赋医药集团专注进⾏药物临床前安全性评价的全资⼦公司,也是赛赋医药集团打造的⼀站式服务平台的核⼼组成部分之⼀。
该中⼼依托于中国科学院药物创新研究院、国家北京新药评价中⼼等国家级药物研发单位,于2017年成⽴,2018年7⽉试运⾏,按照国际最先进的分区控制理念,建设了近万平⽶的功能实验室及实验动物饲养设施。
赛赋医药安评中⼼主要从事GLP条件下的药物(⽣物技术药物、化学药物和中药)、医疗器械的⾮临床安全性评价研究,以及遵从GLP的药理、药效和药代研究。
我国GLP认证机构市场概况(2021年)
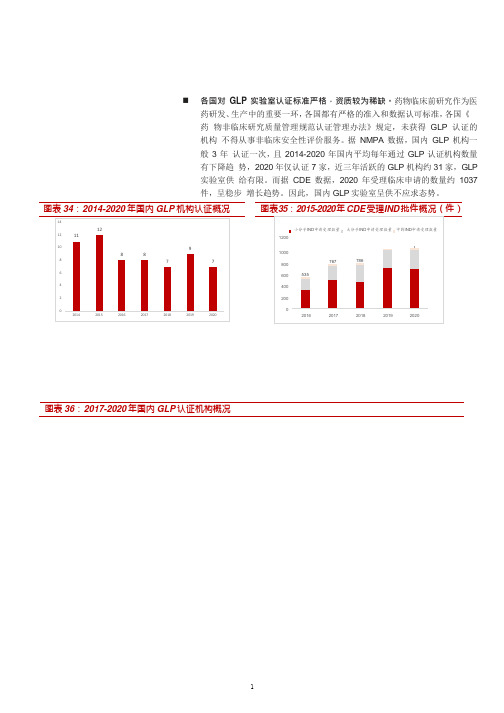
注:标红为上市公司
地址 四川 北京 上海 苏州 昆明 上海 沈阳 苏州 太仓 北京
GLP检查通过日期 2017/4/21 2017/4/28 2017/9/15 2017/9/22 2018/5/14 2018/5/22 2018/7/6 2019/3/8 2019/3/15 2019/5/24
临床前评价业务外包率较高。据《新药 I 期临床试验申请技术指南》要 求,需提供药理、毒理、非临床药代动力学数据,而《药物非临床研究 质量管理规范》要求毒理试验应至少采用两种哺乳动物,建议一种啮齿 一种非啮齿,如若未采用非啮齿类,应阐明其合理性,因此大动物对于 临床前评价研究需求度较高。对于药企,在犬、猪及非人灵长类动物的 饲养及 GLP 级实验室的构建与资质获取上时间与经济成本较高,因此该 业务通常外包给专业的 CRO 机构比率较高,据 Pharmamaprojects 统 计,2016 年药理毒理评估外包率平均约 70%,在各项研究中排名第一。
1 康龙化成(北京)生物技术有限公司
2 益诺思生物技术海门有限公司
3 合肥诺明药物安全研究有限公司
4 北京市药品检验所(药物安全评价中心)
5 中国辐射防护研究院(药物安全性评价中心)
6 昭衍(苏州)新药研究中评价中心)
注:截止 2021 年 3 月 3 日
认证年份 2017 2017 2017 2017 2017 2017 2017 2017 2018 2018 2018 2018 2018 2018 2018 2019 2019 2019 2019 2019 2019 2019 2019 2019 2020 2020 2020 2020 2020 2020 2020
图表 34:2014-2020 年国内 GLP 机构认证概况
GLp实验室可行性分析-final

1. 美国FDA,1976年11月颁布了GLP法规草案,1978年12月22日颁布《Good Laboratory Practice》,1979年6月22日正式生效。
2.国际经济合作与发展组织(OECD),1981年制定了GLP原则,1997年完成修订。
任命
检查 结果的报告及改善建议
4)构成GLP实验室要素的全体保证
六、研发中心GLP实验室认证国家的选择
比利时为OECD成员国之一,也为欧洲共同体成员国之一,通过比利时GLP监管当局的认证,其检查结果 (符合性声明及检查报告)及这些实验室的数据被多个国家或地区注册部门包括欧盟成员国接受;
只要遵从OECD (化学品测试) 指导原则及GLP原则,OECD成员国内产生的化学物质测试数据被其它成员国接受;
1.GLP实验室技术领域的拓展和扩大 :
2.为公司带来经济效益:
3.产生的社会效益 :
药品和工业化学品为第一期技术领域,完成整个GLP实验室体系建设并通过国际认证; 拓展在兽药、食品添加剂、农药等技术领域并进行国际认证; 形成一系列对内为公司服务、对外开放的国际化GLP实验室。
直接经济效益:每个试验收入约为12-15万左右。 间接经济效益:医药和中间体产品在国外登记注册的市场拓展。
整改,进一步完善体系建设
提出认证申请
运行2个项目
接受认证检查
提交整改方案
提交整改报告
获得GLP证书
Phase I
Phase II
Phase III
Phase Ⅳ
半个月
3个月
3个月
3个月
3~5个月后
1个月
2个月
国内GLP实验室清单(优选借鉴)
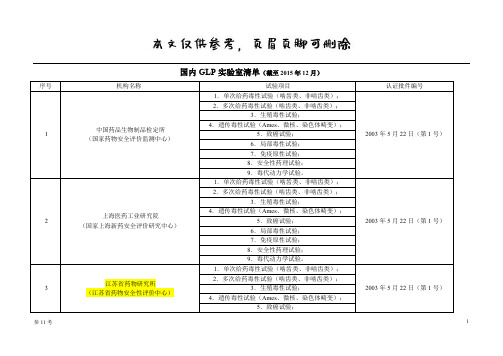
序号
机构名称
试验项目
认证批件编号
1
中国药品生物制品检定所
(国家药物安全评价监测中心)
1.单次给药毒性试验(啮齿类、非啮齿类);
2003年5月22日(第1号)
2.多次给药毒性试验(啮齿类、非啮齿类);
3.生殖毒性试验;
4.遗传毒性试验(Ames、微核、染色体畸变);
7.免疫原性试验;
8.安全性药理试验。
6
中国科学院上海药物研究所
(药物安全评价研究中心)
1.单次给药毒性试验(啮齿类、非啮齿类);
2004年8月3日(第3号)
2.多次给药毒性试验(啮齿类、非啮齿类);
3.生殖毒性试验;
4.遗传毒性试验(Ames、微核、染色体畸变);
5.致癌试验;
6.局部毒性试验;
7.免疫原性试验;
3.生殖毒性试验;
4.遗传毒性试验(Ames、微核、染色体畸变);
5.致癌试验;
6.局部毒性试验;
7.免疫原性试验;
8.安全性药理试验。
11
北京协和建昊医药技术开发有限责任公司
(中国医学科学院中国协和医科大学新药安全评价研究中心)
1.单次给药毒性试验(啮齿类、非啮齿类);
2004年12月23日(第7号)
8.安全性药理试验;
9.毒代动力学试验。
7
广州市医药工业研究所
(新药安全评价研究重点实验室)
1.单次给药毒性试验(啮齿类、非啮齿类);
2004年9月6日(第4号)
2.多次给药毒性试验(啮齿类、非啮齿类);
3.局部毒性试验;
4.免疫原性试验;
5.安全性药理试验。
20110307GLP简介

2000年11月卫生部发布《化学品毒性鉴定管理规范》(包括 化学品毒性鉴定实验室条件及工作准则,即GLP);2001年6月 发布《化学品毒性鉴定机构资质认证工作程序》和《化学品毒 性鉴定机构资质认证标准》。
2003年国家食品药品监督管理局成立 ,5 月,我国首批通过 试认证的4 家GLP 实验室出炉。它们分别是:国家药物安全监 测中心、国家上海新药安全评价研究中心、国家沈阳新药安全 评价中心和江苏省新药安全性评价研究中心。 6 月对1999 年发 布的《药品非临床研究质量管理规范(试行) 》进行了完善和细化, 并审议通过。
2004年8月,国家食品药品监管局公布了《药物研究监 督管理办法(试行)》规定:“未通过GLP认证的机构所开展 的药物非临床安全性评价研究、未获得药物临床试验机构资 格认定所开展的药物临床研究,其研究资料不能作为药品注 册的有效申报资料。”也就是说,药物的安全性评价研究将 逐步强制实施GLP。
2005 年1 月1 日起《药物研究与监督管理办法》将分 步实施、逐步完善,创新药、中药注射剂、生物制品等产品 类别被首批确定强制实施GLP。 至此, 一条从研发、生产到销售的GLP-GCP-GMPGSP 药品安全链条真正完整地串联起来;而GLP 的强制推 行,同时也从源头上为长期以来政府全力推进保证群众安全 有效用药工作提供了有力的保障。 目前,我国通过国家食品药品监督管局GLP认证机构及 通过项目 2010326共39家
GLP简介
CNCA
CMA GLP
中国国家认证认可监督管理委员会 (CNCA) 是国务院决定组建并授权,履行行政管理职能,统一管 理、监督和综合协调全国认证认可工作的主管机构。 国家食品药品监督管理局State Food and Drog Administration
国家药监局批准通过GLP认证的机构名单

17
山东省医药工业研究所(药物安全性评价中心)
1.单次给药毒性试验(啮齿类、非啮齿类);2.多次给药毒性试验(啮齿类、非啮齿类);.局部毒性试验;3.免疫原性试验;4
.安全性药理试验5
2006年3月20日(第12号)
18
云南省药物研究所(药物安全性评价中心)
非啮齿类)1.单次给药毒性试验(啮齿类、;非啮齿类)2.多次给药毒性试验(啮齿类、
通过GLP认证的机构名单(国食药监安[2006]587号,2006.11.20)
序号
机构名称
试验项目
公告时间
1
中国药品生物制品(国家药物安检定所全评价监测中心)
1.单次给药毒性试验(啮齿类、非啮齿类);
2.多次给药毒性试验(啮齿类、非啮齿类);
3.生殖毒性试验;
4.遗传毒性试验(Ames、微核、染色体畸变);.致癌试验;5.局部毒性试验;6
.免疫原性试验;7
.安全性药理试验;8
9.毒代动力学试验。
号)1(第日22月5年2003
2
上海医药工业研究院(国家上海新药安全评价研究中心)
;非啮齿类)单次给药毒性试验(啮齿类、1.
;(啮齿类、非啮齿类)2.多次给药毒性试验
.生殖毒性试验;3
、微核、染色体畸4.遗传毒性试验(Ames变);.致癌试验;5.局部毒性试验;6
6
中国科学院上海药物研究所(药物安全评价研究中心)
;非啮齿类).1单次给药毒性试验(啮齿类、
;(啮齿类、非啮齿类)多次给药毒性试验2.
.生殖毒性试验;3
、微核、染色体畸Ames4.遗传毒性试验(变);.致癌试验;5.局部毒性试验;6
.免疫原性试验;7
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1.单次给药毒性试验(啮齿类、 非啮齿类); 2.反复给药毒性试验(啮齿 类、非啮齿类); 3.生殖毒性试验; 4.遗传毒性试验(Ames、微核、 染色体畸变); 5.致癌试验; 6.局部毒性试验; 7.免疫原性试验; 8.安全性药理试验; 9.依赖性试验; 10.毒代动力学试验。 1.单次给药毒性试验(啮齿类、 非啮齿类); 2.反复给药毒性试验(啮齿类、 非啮齿类)。 1.单次给药毒性试验(啮齿类、 非啮齿类); 2.反 复给药毒性试验(啮齿类、非啮 齿类); 3.生 殖毒性试验; 4.遗 传毒性试验(Ames、微核、染色 体畸变); 5.致 癌试验; 6.局 部毒性试验; 7.免 疫原性试验; 8.安 全性药理试验。 1.单次给药毒性试验(啮齿类); 2.多次给药毒性试验(啮齿类)。 1.单次给药毒性试验(啮齿类、非 啮齿类); 2.多次给药毒性试验(啮齿类、非 啮齿类); 3.局部毒性试验; 4.免疫原性试验; 5.安全性药理。
成都华西海圻医药科技有限 60 公司(国家成都中药安全性
评价中心)
2012.6
61
浙江大学(浙江大学药物安 全评价研究中心)
2012.6
中国食品药品检定研究院 62 (国家药物安全评价监测中
心)
2012.6
63
湖南省实验动物中心(湖南 省药物安全评价研究中心)
2012.6
中国人民解放军疾病预防控 64 制所(毒理学评价研究中
集团安全评价研究中心)
2011.12
中国医学科学院医学实验动 51 物研究所(新药安全评价研
究中心)
52
鲁南制药集团股份有限公司 (新药安评中心)
2011.12 2011.12
53
江苏鼎泰药物研究有限公司 (鼎泰国际毒理研究中心)
2011.12
54
中国辐射防护研究院(药物 安全评价中心)
2011.12
1.单次、多次给药毒性试验(啮 齿类、非啮齿类); 2.生殖毒性试验; 3.遗传毒性试验(Ames、微核、 染色体畸变); 4.致癌试验; 5.局部毒性试验; 6.免疫原性试验; 7.安全性药理试验; 8.毒代动力学试验。 1.单次给药毒性试验(啮齿类、 非啮齿类); 2.多次给药毒性试验(啮齿类、 非啮齿类); 3.生殖毒性试验; 4.遗传毒性试验; 5.局部毒性试验; 6.安全性药理试验。
1.单次给药毒性试验(啮齿类、非 啮齿类); 2.多次给药毒性试验(啮齿类、非 啮齿类); 3.生殖毒性试验; 4.遗传毒性试验(Ames、微核、 染色体畸变); 5.局部毒性试验; 6.免疫原性试验; 7.安全性药理试验。 1.单次给药毒性试验(啮齿类); 2.多次给药毒性试验(啮齿类); 3.局部毒性试验。 1.单次给药毒性试验(啮齿类、非 啮齿类); 2.多次给药毒性试验(啮齿类、非 啮齿类);} 3.生殖毒性试验; 4.遗传毒性试验(Ames、微核、 染色体畸变);5.致癌试验; 6.局部毒性试验; 7.免疫原性试验; 8.安全性药理试验; 9.毒代动力学试验。 1.单次给药毒性试验(啮齿类、非 啮齿类); 2.多次给药毒性试验(啮齿类、非 啮齿类); 3.局部毒性试验; 4.免疫原性试验; 5.安全性药理试验; 6.毒代动力学试验。 1.单次给药毒性试验(啮齿类、 非啮齿类); 2.多次给药毒性试验 1.单次和多次给药毒性试验(啮 齿类) 2.单次和多次给药毒性试验(非 啮齿类,不包括灵长类) 3.生殖毒性试验 4.遗传毒性试验(Ames、微核、 染色体畸变) 5.局部毒性试验 1.单次和多次给药毒性试验(非 啮齿类) 2.安全性药理试验 1.单次和多次给药毒性试验(啮 齿类) 2.单次和多次给药毒性试验(非 啮齿类,不包括灵长类) 3.局部毒性试验 4.安全性药理试验 5.毒代动力学试验
海南海医药物安全性评价有
81
限责任公司(海南医学院海 南省药物安全性评价研究中
心)
2014.1 2014.12 2014.12
82
上海市食品药品检验所(药 物安全评价中心)
2014.12
北京协和建昊医药技术开发
83
有限责任公司(中国医学科 学院北京协和医学院新药安
全评价研究中心)
2014.12
84
2004.3
6
中国科学院上海药物研究所 (药物安全评价研究中心)
2004.8
广州市医药工业研究所 7 (新药安全评价研究重点
实验室)
2004.9
浙江省医学科学院(新药 8 安全评价研究重点实验
室)
2004.9
9
国家成都中药安全性评价中 心
2004.12
10
吉林天药科技药物安全评 价有限公司
2004.12
2005.7
15 北京昭衍新药研究中心
2005.7
16
中国辐射防护研究院(药物 安全性评价中心)
17
山东省医药工业研究所(药 物安全性评价中心)
2006.3 2006.3
18
云南省药物研究所(药物安 全性评价中心)
新疆维吾尔自治区维吾尔医 19 研究所(药物安全性评价中
心)
四川抗菌素工业研究所有限 20 公司 (国药控股安全性评价
广州中医药大学科技产业园 26 有限公司(新南方药物安全
性评价中心)
2007.12
27
辽宁省食品药品检验所(药 物安全评价中心)
28
北京市药品检验所(药物安 全评价中心)
29
青岛市药品检验所(新药安 全评价中心)
30
山东大学(新药评价中心药 物安全性评价实验室 )
2007.12 2008.8 2008.8 2008.12
昭衍(苏州)新药研究中心 有限公司
85
河北省中西医结合医药研究 院
86
中国人民解放军第二军医大所(新药安全评价研
究中心)
88
浙江省医学科学院安全性评 价研究中心
89
鲁南制药集团股份有限公司 (新药安评中心)
90
福建医科大学(福建省新药 安全性评价中心)
心)
65
美迪西普亚医药科技(上 海)有限公司
山东欣博药物研究有限公司 66 (山东欣博药物安全评价研
究中心)
67
江西省药物研究所(安全评 价中心)
68
苏州药明康德新药开发有限 公司
69
山东省食品药品检验所(药 物安全评价中心)
2012.6 2012.6 2012.6 2012.11 2012.11 2012.11
北京协和建昊医药技术开发
11
有限责任公司(中国医学科 学院中国协和医科大学新药
安全评价研究中心)
2004.12
湖北省医药工业研究院有限 12 公司(湖北省药物安全性评
价中心)
2005.1
军事医学科学院毒物药物研 13 究所(国家北京药物安全评
价中心)
2005.2
14
山东大学(新药评价中心药 物安全性评价实验室)
上海市计划生育科学研究所 70 (中国生育调节药物毒理检
测中心)
71
科文斯医药研发(上海)有 限公司
2012.11 2012.11
中国科学院上海药物研究所 72 (药物安全性评价研究中
心)
2014.1
73
苏州西山中科药物研究开发 有限公司
2014.1
74
昭衍(苏州)新药研究中心 有限公司
2014.1
1、单次给药毒性试验(啮齿类、 非啮齿类); 2、多次给药毒性试验(啮齿类、 非啮齿类); 3、生殖毒性试验; 4、遗传毒性试验(Ames、微核、 染色体畸变); 5、致癌试验; 6、局部毒性试验; 7、免疫原性试验; 8、安全性药理; 9、毒代动力学试验。 1.单次给药毒性试验(啮齿类、 非啮齿类); 2.反复给药毒性试验(啮齿类、 非啮齿类); 3.局部毒性试验; 4.免疫原性试验; 5.安全性药理。 1.单次给药毒性试验(啮齿类、 非啮齿类); 2.反复给药毒性试验(啮齿 类); 3.生殖毒性试验; 4.遗传毒性试验(Ames、微核、 染色体畸变); 5.局部毒性试验; 6.免疫原性试验; 1、单次给药毒性试验(啮齿类、 非啮齿类); 2、多次给药毒性试验(啮齿类、 非啮齿类); 3、生殖毒性试验; 4、遗传毒性试验(Ames、微核、 染色体畸变); 5、致癌试验; 6、局部毒性试验; 7、免疫原性试验; 8、安全性药理; 9、毒代动力学试验。
研究中心)
2006.3 2006.3 2006.3
21
上海中医药大学(药物安全 评价研究中心)
22
第二军医大学(药物安全性 评价中心)
23
湖北省预防医学科学院(食 品药品安全性评价研究所)
24
中国医学科学院实验动物研 究所
25
天津药物研究院(天津市新 药安全评价研究中心)
2006.7 2006.11 2007.3 2007.3 2007.3
46
云南省药物研究所(药物安 全性评价中心)
2010.9
47
苏州药明康德新药开发有限 公司
2011.12
北京协和建昊医药技术开发
48
有限责任公司(中国医学科 学院北京协和医学院新药安
全评价研究中心)
2011.12
49
广州医药工业研究院(药物 非临床评价研究中心)
2011.12
中国医药集团总公司四川抗 50 菌素工业研究所(中国医药
36
郑州大学(郑州大学药物安 全性评价研究中心)
37
上海市食品药品检验所(药 物安全评价中心)
38
四川省天然药物研究所(安 全性评价中心)
2009.8 2010.3 2010.3
39
天津药物研究院(天津市新 药安全评价研究中心)
2010.3
40
山东省医药工业研究所(药 物安全性评价中心)
