沉淀溶解平衡讨论的对象是难溶性强电解质。
第四章难溶强电解

example
18℃时,PbI2的溶解度为0.558g·L-1,求PbI2的溶度积
解: PbI2的相对分子质量为461,则PbI2的溶解度为 S 0.558 1.21103(mol • L1) 461
PbI2为AB2型微溶电解质,则 KspӨ(PbI2)=4(S/cӨ)3=4×(1.21×10-3)3 =7.09×10-9
解: Ksp=[Fe3+][OH-]3 已知溶液中的Fe3+浓度为0.01 moL·L-1, 则使Fe(OH)3开始沉淀所需OH-的最低浓度为
[OH ] 3 Ksp [Fe3 ] 3 1.11036 0.01 4.81012(mol • L-1 )
pOH=-lg4.8×10-12=11.32
的相对浓度。
17
溶度积规则
(l) Qc=KspӨ,无沉淀析出。
(2) Qc < Ksp Ө ,表示溶液是不饱和溶液,无沉淀 析出。 (3) Qc > Ksp Ө ,表示溶液为过饱和溶液,有沉淀
析出,直至溶液达饱和为止。
18
沉淀反应的利用和控制
l.沉淀的生成 2.沉淀的溶解
19
沉淀的生成
l.加入沉淀剂 增大离子浓度,使溶液中Qi大于Ksp
pH=14.00-pOH=14.00-10.32=3.68
计算结果表明,要使Fe(OH)3沉淀完全,溶液的pH值
必须大于3.68。
24
沉淀的溶解
1.生成弱电解质使沉淀溶解
生成水、弱酸、弱碱、配离子或其它难 解离的分子(另一种沉淀)
2.发生氧化还原反应使沉淀溶解
25
生成弱电解质使沉淀溶解
(1)金属氢氧化物沉淀的溶解
14
酸碱效应
10-沉淀-溶解平衡

3CuS(s) 8HNO3 (aq)
3Cu(NO3 )2 (aq) 3S(s) 2NO(g) 4H2O(l)
(三) 生成配位个体
在含有难溶强电解质沉淀的饱和溶液中加入某 种电解质,与难溶强电解质的阳离子或阴离子生成 配位个体,使难溶强电解质的阳离子浓度或阴离子 浓度降低,致使 IP < Ksp ,沉淀 - 溶解平衡向沉 淀溶解方向移动,导致难溶电解质沉淀溶解。 AgCl 沉淀溶于氨水的反应式为: AgCl(s) Ag+ (aq) Cl (aq)
(三)溶度积规则 离子积(ion product):
离子浓度幂的乘积称为离子积 IP。 它表示的是在任意情况下的离子浓度幂的乘积。 对某一难溶强电解质溶液 当IP = Ksp ,表示溶液是饱和的。此时溶液达成沉 淀溶解平衡,宏观上既无沉淀溶解,也无沉淀析出。
当IP < Ksp ,表示溶液是不饱和的。此时溶液无 沉淀析出。若再加入难溶强电解质,则会继续溶解。 当IP > Ksp ,表示溶液是过饱和的。此时溶液会 有沉淀析出,直至溶液饱和为止。
ห้องสมุดไป่ตู้S3
Ksp 3 1.121012 6.54105 mol/ L 4 4
对于相同类型的难溶强电解质,它的标 准溶度积常数越大,它的溶解度也就越大。 但对于不同类型的难溶强电解质,不能直接 利用标准溶度积常数来比较溶解度的大小, 必须通过计算进行比较。
例 6-3 25℃时,Ksp(AgCl) =1.8×10-10, Ksp(AgI) =8.5×10-17 ,Ksp(Ag2CrO4 ) ==1.1×10-12。试分别计算 AgCl 、 AgI和 Ag2CrO4 在水中的溶解度,并比较它们的 溶解度的大小。 解:AgCl和AgI 为 1-1 型难溶电解质,其溶解度为:
wj6难溶强电解质的沉淀-溶解平衡2012

标准溶度积常数的理解
K sp 表明构成难溶强电解质的各离子平衡浓 度的相互关系 特点:一定温度下,为一常数 意义: K sp 的大小反映了物质在水中的溶解能 力。同类型物质, K sp 越大,其溶解能力越强 K sp 反映的方程式,难溶电解质在反应物的 位置,即方程式的左边
常见难溶强电解质的溶度积
3CuS+8HNO3 (稀)
Cu +S
2
2
3Cu(NO3 )2+3S+2NO+4H 2O
三、难溶强电解质沉淀的溶解 3.生成配位个体
如:AgCl 沉淀溶于氨水的反应式为 :
AgCl(s)
沉淀 溶解
2NH3 (aq)
Ag (aq) Cl (aq)
+
[Ag(NH3 )2 ] (aq)
微溶物:0.01~0.1克(或: 0. 10 g/L<s< 1 g/L)
可溶物:> 0.1 克(或:s>1.0 g/L)
将难溶强电解质放入水中,就发生溶解和沉淀两 个过程:
沉淀溶解平衡
难溶强电解质Mv+Av-饱和溶液中存在如下动态平衡:
Mv Av (s)
理解:
vM (aq) vA (aq)
Mv Av (s)
vM (aq) vA (aq)
z z
可知: K
J Ksp K sp
sp
溶液未饱和,固体继续溶解 溶液饱和,达沉淀溶解平衡 溶液过饱和,析出沉淀
溶度积规则(solubility product principle)
二、难溶强电解质沉淀的生成
课堂练习
写出 AgCl 、 BaSO4 、 CaF2 、 Cu2S 溶度 积表达式。
二、标准溶度积常数与溶解度的关系
讲座二十八、沉淀溶解平衡(2012年7月13日,2中,王振山

解:
Mg2+ + 2OH-
Mg(OH)2 (S)
10×0.1 反应前: = 1mmol 反应后: 0
10×0.2 = 2mmol,适量 0
溶液中含有 Mg2+、 OH-?
30
Mg(OH)2 (S)
初始: 平衡:
Mg2+ + 2OH0 c(Mg2+) =S 0 c(OH-) =2S
c(Mg2+)· c2(OH-)=KSPθ
θ sp
的物理意义:
①、不同难溶电解质,都有自己的 ②、 无关;
K
K
θ 与温度有关,与未溶固体的多少 sp
12
θ ; sp
③、它表示达到沉淀-溶解平衡的条件
c(A ) c(B ) K θ பைடு நூலகம் θ c c
θ sp n m m n
④、反映了难溶电解质的溶解能力。
讲座二十八
(2012年7月13日,2中,王振山)
1
~溶解度和溶度积~
一、沉淀溶解平衡
1、溶解度 从相平衡的角度理解溶解度更确切。在一 定温度和压力下,固、液两相达到溶解平 衡状态时,把饱和溶液里的物质浓度称为 “溶解度”,常用S(mol/L)表示。
2
⑴、 在一定温度下,达到溶解平衡时, 一定量的溶剂中含有溶质的质量,叫 (1) 溶解度 做溶解度,通常以符号 S 表示。
KSPθ=S· (2S)2=4S3
11
S3
3
K
θ sp
4
3
1.8 10 4
4.5 10
12
1.65 10 m ol /L
31
4
例3、求AgCl在纯H2O中的溶解度, 已知Kspө=1.8×10-10。若在1mol· dm-3 的盐酸中,AgCl的溶解度又是多少? 解:在纯H2O中,
化学-难溶电解质的溶解平衡讲义-解析版
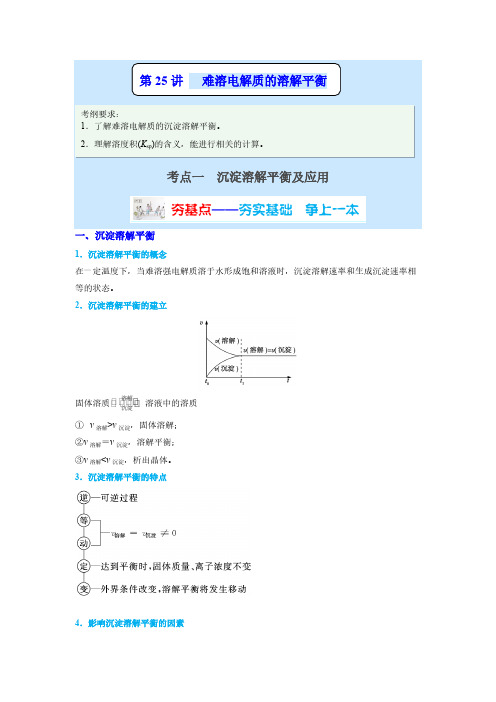
4.影响沉淀溶解平衡的因素(1)内因难溶电解质本身的性质,这是决定因素。
(2)外因①浓度:加水稀释,平衡向沉淀溶解的方向移动;②温度:绝大多数难溶盐的溶解是吸热过程,升高温度,平衡向沉淀溶解的方向移动;③同离子效应:向平衡体系中加入难溶物溶解产生的离子,平衡向生成沉淀的方向移动;④其他:向平衡体系中加入可与体系中某些离子反应生成更难溶或更难电离或气体的离子时,平衡向沉淀溶解的方向移动。
二、沉淀溶解平衡的应用1.沉淀的生成当溶液中离子积(Q c )大于溶度积(K sp )时有沉淀生成。
①调节pH 法:如除去NH 4Cl 溶液中的FeCl 3杂质,可加入氨水调节pH 至4左右,离子方程式为Fe 3++3NH 3·H 2O===Fe(OH)3↓+3NH 。
+4②沉淀剂法:如用H 2S 沉淀Cu 2+,离子方程式为Cu 2++H 2S===CuS↓+2H +。
2.沉淀的溶解当溶液中离子积(Q c )小于溶度积(K sp )时,沉淀可以溶解。
①酸溶解:用离子方程式表示CaCO 3溶于盐酸:CaCO 3+2H +===Ca 2++CO 2↑+H 2O 。
②碱溶解法如Al 2O 3溶于NaOH 溶液,离子方程式为:Al 2O 3+2OH -===2AlO +H 2O -2③盐溶解:用离子方程式表示Mg(OH)2溶于NH 4Cl 溶液:Mg(OH)2+2NH===Mg 2++2NH 3·H 2O 。
+4④配位溶解:用离子方程式表示AgCl 溶于氨水:AgCl +2NH 3·H 2O===[Ag(NH 3)2]++Cl -+2H 2O 。
⑤氧化还原溶解:如不溶于盐酸的硫化物Ag 2S 溶于稀HNO 3。
3.沉淀的转化通常,一种沉淀可以转化为更难溶的沉淀,两种难溶物的溶解能力差别越大,这种转化的趋势就越大。
①实质:沉淀溶解平衡的移动。
②实例:AgNO 3溶液AgCl AgBr ,则K sp (AgCl)>K sp (AgBr)。
《难溶电解质的沉淀溶解平衡》 讲义

《难溶电解质的沉淀溶解平衡》讲义一、什么是难溶电解质的沉淀溶解平衡在一定温度下,当难溶电解质溶于水形成饱和溶液时,溶解速率和沉淀速率相等的状态,就叫做沉淀溶解平衡。
比如说,把一定量的氯化银固体放入水中,氯化银会在水中溶解,同时溶解的银离子和氯离子又会结合生成氯化银沉淀。
开始时,溶解速率较大,沉淀速率较小。
随着时间的推移,溶解的氯化银逐渐增多,溶液中的银离子和氯离子浓度也逐渐增大,沉淀速率就会随之加快。
最终,溶解速率和沉淀速率相等,达到了一种动态平衡。
这就好像是一个拔河比赛,溶解和沉淀两边的力量相等,谁也无法战胜谁。
二、沉淀溶解平衡的特征1、动态平衡沉淀溶解平衡是一种动态平衡,溶解和沉淀这两个过程仍在不断进行,只是速率相等,看起来好像没有变化。
2、等速溶解速率和沉淀速率相等,这是平衡状态的重要标志。
3、定态平衡时,溶液中各离子的浓度保持不变,但不是绝对不变,而是在一定范围内波动。
4、同条件沉淀溶解平衡的建立与温度、浓度等条件有关。
在相同条件下,无论溶液中固体的量有多少,平衡状态下离子的浓度都是一定的。
三、沉淀溶解平衡的表达式以 AgCl 为例,其沉淀溶解平衡的表达式为:AgCl(s) ⇌ Ag+(aq) + Cl(aq)这里的“s”表示固体,“aq”表示在水溶液中。
四、影响沉淀溶解平衡的因素1、内因难溶电解质本身的性质是决定沉淀溶解平衡的主要内因。
不同的难溶电解质在相同条件下溶解度不同,溶解度越小,越难溶解。
2、外因(1)温度大多数难溶电解质的溶解过程是吸热的,升高温度,平衡向溶解的方向移动,溶解度增大;少数难溶电解质的溶解过程是放热的,升高温度,平衡向生成沉淀的方向移动,溶解度减小。
(2)浓度加水稀释,平衡向溶解的方向移动,但溶解度不变。
(3)同离子效应向平衡体系中加入相同的离子,平衡向生成沉淀的方向移动。
例如,在 AgCl 的饱和溶液中加入氯离子,会使平衡向左移动,生成更多的AgCl 沉淀。
(4)化学反应若加入能与体系中某些离子发生反应的物质,平衡会向溶解的方向移动。
备课讲义7- 沉淀平衡

化
无结晶中心,即晶核的存在,沉淀亦不能生成,而将形成过饱和溶液,故观察不到沉淀物。 若向过饱和溶液中加入晶种 (非常微小的晶体, 甚至于灰尘微粒) , 或用玻璃棒磨擦容器壁, 立刻析晶,甚至引起暴沸现象。 3)沉淀的量: 前两种情况中,并没有生成沉淀。 实际上即使有沉淀生成, 若其量过小, −5 −3 也可能观察不到。正常的视力,当沉淀的量达到 10 g⋅dm 时,可以看出溶液浑浊。
再求 [H+],即当 H2S 达到饱和、且 [S2−] = 1.1×10−20 mol⋅dm−3 时的 [H+]。 H2S ⇔ 2 H+ + S2− t 平衡 0.1 [H+] 1.1×10−20 K = Ka1⋅Ka2 = [H ] =
[H ] ∙[S ] [H S] ]
解得: pH = 1.04
2. 溶度积规则
Qi > Ksp 时,平衡左移,生成沉淀;Qi < Ksp 时,平衡右移,沉淀溶解;Qi = Ksp 时, 平衡。上述结论有时称之为溶度积原理。
例 3 [Ag+] 为多少时,可以使溶液中的 CrO42− 沉淀完全? 解:沉淀完全是一个概念,一般认为溶液中某离子被沉淀剂消耗至 1.0×10−5 mol⋅dm−3 时, 即为沉淀完全。 (定量分析要求 10−6 mol⋅dm−3) Ksp = [Ag+]2⋅[CrO42−] = 1.0×10−5⋅[Ag+]2 = 9.6×10−12 解得: [Ag+] = 9.8×10−4 即当 [Ag+] 达到 9.8×10−4 mol⋅dm−3 时,CrO42−已被沉淀完全。可以用图示的方法在坐标系 中表示出沉淀生成的区域。 由例 1 和 例 2 已得出两组数据: [CrO42−] = 1.0×10−3 [CrO42−] = 1.0×10−4 [CrO42−] = 1.0×10−5
第22讲难溶电解质的沉淀溶解平衡

知识精讲
一、沉淀溶解平衡的基本概念
3. 沉淀溶解平衡方程式 MmAn(s) ⇌ mMn+(aq) + nAm-(aq)
沉淀溶解平衡方程式中各物质 要标明聚集状态 → “s” “aq”
如AgCl沉淀溶解平衡:AgCl(s) ⇌ Ag+(aq) + Cl-(aq)
请写出Ag2S、Ca(OH)2的溶解平衡方程式
如Fe(OH)3(s) ⇌ Fe3+ (aq) + 3OH- (aq) Ksp= c(Fe3+)·c3(OH-) 2.影响因素 ① 溶度积Ksp值的大小只与难溶电解质本身的性质和温度有关。 ② 溶解平衡一般是吸热的,温度升高,平衡正移,Ksp增大,但Ca(OH)2相反。
知识精讲
三、溶度积(Ksp) 3. 意义
第22讲 难溶电解质的沉淀溶解平衡
课前引入
初中所学,关于物质的溶解性是如何分类的?
往饱和 NaCl 溶液中加入浓盐酸,会有什么现象?
课前引入
NaCl 饱和溶液中,存在溶解平衡:NaCl(s) ⇌ Na+(aq)+Cl-(aq) 加浓盐酸,Cl- 的浓度增大,平衡逆向移动,NaCl析出
NaCl 饱和溶液存在溶解平衡,那难溶的电 解质在水中是否也存在溶解平衡呢?
D
对点训练
题型四:沉淀溶解平衡图像
【例5】(2021·江苏昆山·高二月考)不同温度(T1和T2)时,硫酸钡在水中的 沉淀溶解平衡曲线如图所示,已知硫酸钡在水中溶解时吸收热量。下列说法 正确的是
A.T1>T2 B.加入BaCl2固体,可使溶液由a点变到c点 C.c点时,在T1、T2两个温度下均没有固体析出 D.图中c点对应的是T1时硫酸钡的过饱和溶液
知识精讲
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
·
25
解: AgCl —— Ag+ + Cl-
t平
s
s
Ksp = [ Ag+ ][ Cl- ] = s2 = 1.8 10-10
所以 s = 1.3 10-5
·
26
在 0.1 mol•dm-3的盐酸中, [ Cl- ] = 0.1mol•dm-3
AgCl —— Ag+ +
Cl-
t平
s′ 0.1 + s′ 0.1
在 100 g 水中溶解的质量 远大于 0.01 g。
·
4
Hg2SO4,PbCl2,CaSO4 等 但是由于这些物质的式量很大, 所以其饱和溶液的体积摩尔浓度相当 小,故这些化合物仍作为难溶性化合 物在本章中讨论。
·
5
9. 1. 1 溶度积常数
AgCl 在 H2O 中有如下平衡 AgCl(s) Ag+(aq)+ Cl-(aq)
·
11
AgCl
Ag+ + Cl-
Qi > Ksp 时,平衡左移,将生成沉淀 Qi < Ksp 时,平衡右移,沉淀将溶解 Qi = Ksp 时,达到沉淀溶解平衡
上述结论有时称之为溶度积原理。
·
12
9. 1. 2 溶度积常数与溶解度的关系 溶解度用 s 表示,其意义是实
现沉淀溶解平衡时,溶解掉的某物 质的体积摩尔浓度。
K = [ Ag+ ] [ Cl-]
式中 K 是标准平衡常数,各 浓度是相对浓度。
·
6
K = [ Ag+ ] [ Cl-] 由于方程式左侧是固体物质, 不写入平衡常数的表达式。 故 K 的表达式是乘积形式。 所以沉淀溶解平衡的平衡常数 K 称为溶度积常数,写作 Ksp。
·
7
关于平衡常数的规定和平衡常 数的性质,对于 Ksp 均适用。
·
29
例 9. 3 告诉我们,在这种情况 下,溶解度 s 发生变化,但是溶度积 常数不变。
可见溶度积常数的意义更重要。
·
30
比较例 9. 3 和例 9. 2 的结果, 观察 AgCl 和 Ag2CrO4 的 Ksp和 s 的数值大小关系:
2 Ag+ + CrO42- 2 mol 1 mol
本例中,每有
溶解,则有 和
1 mol Ag2CrO4 2 mol Ag+ 1 mol CrO42- 生成。
·
20
Ag2CrO4 溶解度为 s
2 Ag+ + CrO42-
2s
s
因此平衡时 [ CrO42-] 等于 Ag2CrO4 的溶解度 s;
而 [ Ag+ ] 等于 Ag2CrO4 的 溶解度 s 的 2 倍。
CaCO3 t平
Ca2+ + CO32-
s
s
Ksp = [ Ca2+ ] [ CO32- ]
·
16
Ksp = [ Ca2+ ] [ CO32- ] = s2 = 2.8 10- 9
所以 CaCO3在水中的溶解度 s = 5.3 10-5 mol•dm-3
·
17
Ksp 与 s 之间的数量关系,取决 于离子的平衡浓度与 s 之间的数量关 系。
例如在本例中 [ Ca2+ ] 和 [ CO32- ] 均等于 s。
·
18
例 9. 2 298 K 时,Ag2CrO4 的溶解度 s 为 6.5 10-5 mol•dm-3, 求 Ag2CrO4 的溶度积常数 Ksp。
分析:关键的问题,是找出溶解 度 s 与离子浓度的数量关系。
·
19
Ag2CrO4 1 mol
应该指出,严格讲 Ksp 是平衡 时的活度之积。
Ksp = a Ag+ • aCl-
·
8
Ksp = [ Ag+ ] [ Cl- ] Ksp = a Ag+ • aCl-
因为难溶物的饱和溶液的浓度 肯定非常小,所以用浓度代替活度 是合理的。
·
9
比较 Ksp 和 Q 的大小,可以判 断反应进行的方向。
Ksp = [ Ag+ ] [ Cl- ]
·
27
AgCl —— Ag+ +
Cl-
t平
s′ 0.1 + s′ 0.1
Ksp = [ Ag+ ] [ Cl- ]
= 0.1s′ = 1.8 10-10
所以 s′= 1.8 10-9
·
28
纯水中 s = 1.3 10-5 盐酸中 s′= 1.8 10-9 在 0.1 mol•dm-3 的盐酸中, AgCl 的溶解度明显变小。 这是同离子效应的影响。
(1)写出化学方程式; (2)用溶解度 s 表示出平衡浓度 (3)写出 Ksp 的表达式; (4)代入数据后,求值或解方程
其中(2)是关键步骤
·
24
例 9. 3 已知 Ksp(AgCl )= 1.8 10-10, 求 AgCl 在纯 H2O 中的溶解度 s;
若在 0.1 mol·dm-3 的盐酸中, AgCl 的溶解度 s′又是多少?
AgCl
Ag+ + Cl-
某时刻有 Qi = [ Ag+ ] [ Cl-], 这里的反应商也是乘积形式。
故称 Qi 为离子积。
·
10
Ksp = [ Ag+ ] [ Cl- ] Ksp 表达式中的 [ Ag+ ] 和 [ Cl- ] 是平衡浓度。
Qi = [ Ag+ ] [ Cl- ] Qi 表达式中的 [ Ag+ ] 和 [ Cl- ] 不是平衡浓度。
溶解度的单位是 mol•dm-3
·
13
s 和 Ksp 从不同侧面描述了物 质的同一种性质 —— 溶解性。
尽管二者之间有根本的区别, 但其间会有必然的数量关系。
·
14
例 9. 1 已知 CaCO3 的 Ksp = 2.8 10- 9
求 CaCO3 在水中的溶解度 s。
·
15
解:设 CaCO3 在水中的溶解度 为 s,则两种离子的平衡浓度皆为 s。
第九章 沉淀溶解平衡和 络合解离平衡
9. 1 沉淀溶解平衡
沉淀溶解平衡讨论的对象 是难溶性强电解质。
·
1
难溶性物质,一般是指 在 100 g 水中溶解质量少于 0.01 g 的物质。
·
2
但在本章中讨论的是沉淀 溶解平衡,必须从物质饱和溶 液的平衡浓度来体现物质的溶 解度。
·
3
有些电解质,如 Hg2SO4, PbCl2 和 CaSO4 等,
·
21
解:
Ag2CrO4
2 Ag+ + CrO42-
t平
2s
s
Ksp = [ Ag+ ]2 • [ CrO42- ]
= ( 2 s)2 • s
= 4 s3
·
22
将已知的溶解度数据代入溶 度积表达式
Ksp = 4 s3 = 4 (6.5 10-5 )3 = 1.1 10-12
·
23
通过例 9. 1 和例 9. 2,总结 解题的一般步骤:
