第三章 化学反应动力学基础
第三章 化学反应速率、方向和限度

①逆过程G与正过程的G数值相等,符号相反。
②如果一个反应是多个反应的和,总反应的rG等 于各反应G之总和。
二、判断一个反应进行的方向时,如果:
rG<0反应自发进行
rG>0反应不自发进行
rG=0平衡状态
当rG<0时(产物的G<反应物的G)该反应就自动向生 成产物的方向进行,在反应中反应物不断减小而产物不
由上面的rG(T)=rH(298K)-TrS(298K) 公式可得下列结果:
类型 H
S
G
反应的自发性
1 2 3 4
+ +
+ +
永远是永远是+ 受温度影响 受温度影响
永远自发 永远非自发 温度低时自发 温度高时自发
例:求标准状态下CaCO3(s)===CaO(s)+CO2(g)
的分解温度?
Kc=[CrO42-]2[H+]2/[Cr2O72-]
对于气体反应,写平衡常数关系式,除可以用平衡时的 浓度表示外,也可以用平衡时各气体的分压表示。如: N2+3H2=2NH3 可写出两个平衡常数关系式
Kc=[NH3]2/([N2][H2]3)
Kp=p2(NH3)/[p(N2)p3(H2)]
3.1
的因素以及反应的机理。
化学平衡
化学动力学 是研究化学反应的速度、影响反应速度 热力学 研究物理或化学变化中能量的相互转化和热 的影响因素(如温度)对转化的影响。特别是研究在
指定条件下一个变化自动进行的可能性(自发性),
从而确定变化的方向和范围。但热力学不能解决变化 的速度问题。 化学热力学 研究化学变化中能量的相互转化和热的 影响因素(如温度)对转化的影响。
第三章 化学反应动力学的计算

(3.15) 式中函数,是变元的函数。若函数族在区间上是确定且可微的,当时, 满足关系式:
则称是微分方程组(3.15)的解。 在真实的化学反应体系中,总能满足上述要求,因此一定存在数值 解,具体的解是用计算机寻找满足初始条件的数值解。 给定的初值 是已知常数。 为了书写方便,一阶微分方程组(3.15)式使用微向量表示,即 初值。 现以 (3.16) 为例说明微分方程组的R-K算法。初始条件: R-K公式为:
9.93522×10-3 1.40291×10-5 5.07574×10-5
9.87084×10-3 1.46652×10-5 1.14494×10-4
9.80689×10-5 1.46078×10-5
0.1×10-7 0.333×10-6 0.356×10-6
0 0.47×10-7 0.44×10-7
开式子: Eular法只取了前二项而忽略了高次项,所以产生了误差。
3. Runge-Kutta方法 .1 常微分方程的Runge-Kutta方法 Runge-Kutta方法是建立在泰勒公式基础上的一种方法。通常采用 的是四
阶R-K公式,即考虑了泰勒公式中四次项,而Eular公式只取了一次 项。故R-K公式比Eular公式有了很大的改进。R-K方法在求解范围大、 精度要求主的情况下是一种比较好的方法,并且计算工作量不算太大, 所以在化学化工中应用颇多。 四阶的R-K公式为:
有已斜率的小线段,即可得方向场的略图(图3-2)
从方向场各点的略图可以推出微分方程的原函数图形。例如画出微
分方程的方向场略图,其解为:在平面上(除原点外)的若干个点,画
化学反应动力学(全套课件582P)

§1-1 绪论
一、化学反应动力学的地位和作用 1 物理化学八个主要分支: 量子化学 催化化学 结构化学 胶体与界面化学 化学动力学 电化学 化学热力学( 统计热力学) 光化学 化学动力学是物理化学的主要分支之一。它与量 子化学、结构化学、化学热力学( 统计热力学 ) 构成了物理化学的主要理论基础,为化学这一中 心科学提供了一系列的原理和方法。
二、化学反应动力学的特点 与平衡态热力学比较,化学反应动力学的特点:
1、考虑时间这个因素(反应速率) 2、涉及化学变化所经由的中间步骤(反应机理)
例如: 在298K及101.3kP下, H2 (g) +1/2O2(g) = H2O(l) Δ rGθ m = -287.19 kJ mol-1
根据热力学第二定律,该反应发生的可能性非常大。
3、态态反应 关于“态” 平动状态: 平动能或平动速度。 转动状态: 转动量子数 J。 振动状态: 振动量子数 V。 电子状态: 如 O2 :X3∑g-,1Δ g, 1∑g+
X3∑g-:
*+1
*-1
*+1
*-11Δg:源自*+1*-1
*+1
*-1
*+1
*-1
1∑ +, g
*+1
但在上述条件下,实际观察不到H2和O2的任何变化。 如果在反应混合物里加入火化或催化剂(如铂黑),或 者把它们加热到800℃以上,则上述反应能在瞬时完成, 以致于发生爆炸。
三、化学反应动力学的基本任务
1、 研究反应进行的条件——温度、压力、浓 度、介质以及催化剂等对化学反应速率的 影响。 2、揭示化学反应的历程(也叫作机理)。 3、研究物质的结构和反应能力之间的关系。
普通化学——化学动力学基础PPT课件

(产物取正,生成物取负)
显然,两种方法定义的数值不一样,它们之间的关系为: r ri 1 dci vi vi dt
式中,vi为反应系数,符号一律取正)
||
||
5
3.1.2 反应动力学方程
1 积分形式的动力学方程
描述反应体系中某组分浓度与时间的关系的函数称为积分形式的动 力学方程:
ci = g(t)
||
||
10
3.2 简单级数的反应的动力学方程
常见的简单级数的反应有零级反应、一级反应和二级反 应,三级反应的例子不多。 零级反应(准)——气、固相催化反应,酶催化反应 一级反应——同位素衰变反应,部分取代反应 二级反应——水解反应,部分取代反应
||
||
11
3.2.1 一级反应
一级反应:A → P dc kc dt
t
图3.2 一级反应
||
||
13
一级反应计算示例
例3.1 从考古发现的某古书卷中取出的小块纸片,测得 其中 14C/12C 的比值为现在活的植物体内 14C/12C 的比值 的0.795 倍。试估算该古书卷的年代。
解: 已知 1 4 7 1 4 7 - 0 1 e - , t 12 5730a
可用式(2.34)求得此一级反应速率常数k
第三章 化学动力学基础
第三章 化学动力学基础
化学热力学为我们提供了判断反应能否自发进行的依据。 但是一个热力学自发的反应不一定能够进行,例如:
H2(g)+O2(g) = H2O(g) 298.15K时标准摩尔反应吉布斯函数变为–457kJ·mol-1,但 在此温度下,不点燃或无撞击的情况下几天甚至几月都 观察不到水分子的产生。
2 微分形式的动力学方程
化学反应动力学基础N

3.5910 4 3.6010
3.62 10 4 3.6110
4
3.61104 3.68104
N2O5的分解速率与N2O5浓度的比值是恒定的,
即反应速率 r 与 c(N2O5) 成正比。
即:
r kc( N2O5 )
对于一般的化学反应:
aA bB yY zZ
到达一定的温度,速率反而下降。如多相催化 反应和酶催化反应。 (4)速率在随温度升到某一高度时下降,再升高温 度,速率又迅速增加,可能发生了副反应。 (5)温度升高,速率反而下降。这种类型很少, 如一氧化氮氧化成二氧化氮。
T
T
T
T
T
一、 范特霍夫规则
1884年 Van' t Hoff 提出:
kT 10K 2~4 kT
c-t图
r-c图
40℃,CCl4中N2O5分解反应的r:c( N2O5 )
t /s
0 300 600 900 1200
r : c N 2 O5 / s1
t /s
1800 2400 3000 4200 5400
r : c N 2 O5 / s
1
3.6510
4
4
3.64104 3.6210 3.6910
2
1 k kA 0
仅适用于只有一种反应物的纯U-238就
有0.257mg的Pb-206。试计算此岩石的年
龄。已知U-238的半率期为4.5109年。
解:假设分析时U-238的量为1mg ,岩石中原来铀
的总量应为1mg加上衰变为Pb-206的量。
238 m(U 238 ) 1.000 mg 0.257 mg 1.297 mg 206
北理无机化学第3章-化学动力学基础

基元反应
§3.2 浓度对反应速率的影响
NO2(g)+CO(g) NO(g)+CO2(g)
v=kc(NO2)c(CO)
反应级数 n = 2
基元反应 2NO(g)+O2(g)2NO2(g)
v=kc(NO)2c(O2)
反应级数 n = 3
第三章 化学动力学基础
3.注意
§3.2 浓度对反应速率的影响
或
lg{k}
Ea 2.303RT
lg{k0}
k: 反应速率常数,由反应的性质和温度决定;
Ea:实验活化能,单位为kJ·mol-1,是表示反应特性 的常数;
k0:指数前因子,频率因子,对指定反应为一常数。
第三章 化学动力学基础
§3.3 温度对反应速率的影响
3.3.2 Arrhenius 方程式的应用
vB ΔcB Δt
vC
ΔcC
t
vD ΔcD Δt
浓度的单位:mol·L-1 时间的单位:s(h、min)
第三章 化学动力学基础
例:
起始浓度/(mol·L-1)
§3.1 反应速率的意义
N2 + 3H2 → 2NH3
13
0
2秒后浓度/(mol·L-1)
0.8 2.4 0.4
同一反应,可用不同物质的浓度的变化表示反应速率,其 值可能不同。
vN2
-
(0.8-1) 2
0.1mol
L-1
S-1
vH2
-
(2.4- 3) 2
0.3 mol
L-1
S-1
vNH3
(0.42
0)
0.2 mol
L-1
S-1
第三章 化学动力学基础
第三章 化学反应动力学的计算
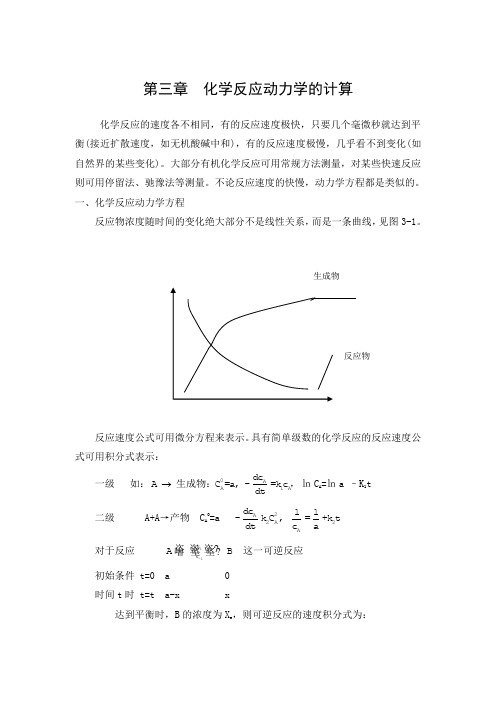
第三章 化学反应动力学的计算化学反应的速度各不相同,有的反应速度极快,只要几个毫微秒就达到平衡(接近扩散速度,如无机酸碱中和),有的反应速度极慢,几乎看不到变化(如自然界的某些变化)。
大部分有机化学反应可用常规方法测量,对某些快速反应则可用停留法、驰豫法等测量。
不论反应速度的快慢,动力学方程都是类似的。
一、化学反应动力学方程反应物浓度随时间的变化绝大部分不是线性关系,而是一条曲线,见图3-1。
反应速度公式可用微分方程来表示。
具有简单级数的化学反应的反应速度公式可用积分式表示:一级 如:0AA1Adc A C =a, -=k c dt 生成物:,㏑C A =㏑a –K 1t 二级 A+A →产物 C A 0=a 2A 2A 2A d c 11-k C , =+k t d t c a对于反应 1-1k k A B 这一可逆反应初始条件 t=0 a 0 时间t 时 t=t a-x x达到平衡时,B 的浓度为X e ,则可逆反应的速度积分式为: 级数:1-1 1-10k A A e e 1A -1B k 0e 0C =a dc x xA B=-k C +k C : =kt dt a x -xC =0ln 1-21-10Ak0A e e e B 1A -1B C k e e 0CC =a dc x ax +x(a-x )A B+C C =0=-k C +k C C : =kt dt 2a-x a(x -x)C =0ln 二、常微分方程的解化学反应动力学方程是用微分方程表示的,对于简单的反应,可直接求得微分方程的解。
微分方程:()(1)(,,,......)......(1)n n y f x y y y -'=在区间a<x<b 的解,是指()y x ϕ=,这样一个函数,在所述区间内存在导数()(),(),......()n x x x ϕϕϕ'''。
且对于区间a<x<b 内的每一个x ,等式(1)都成立。
化学反应动力学-第三章-基元反应动力学

论相比较, Ea却是和温度有关的,即 Ea = f (T)
一般来说,当Ec较大且在低温下反应时,Ea=Ec; 当Ec较小且在高温下反应时,只有采用 ln( k 2 ) 1 1 作图才能得较为理想的直线。
上一内容 下一内容
T
T
返回
五、概率因子 碰撞理论假定分子为刚性硬球,主要考虑了硬
假设A、B双分子的反应是:
A + B A B 产物
只有处于活化状态的(A……B)才能进一步反
应,利用Maxwell的速率分布定律、玻尔兹曼
分布律及统计力学,可得出反应的活化能:
E N0 a
上一内容 下一内容
返回
四、碰撞理论的反应速率公式与讨论 依据分子碰撞理论的两个基本假定,反应速率 公式有二:
以上这些问题在分子碰撞理论中将予解释。
上一内容
下一内容
返回
二、分子碰撞理论和碰撞频率 (一)分子碰撞模型 ⑴分子碰撞的弹性刚球模型: 假定分子是刚性的实心球体,分子占有一定体 积,不考虑分子作用力,分子不能压缩。刚球为 光滑表面,碰撞无摩擦阻力,碰撞时切面方向和 对相对速度不产生任何影响,分子的碰撞是弹 性碰撞。
e
E0 / RT
用此式可求出具有能量ε(≥ 0 )的分子分数。式 0 E0 / N(N0为 中kB为玻尔兹曼常数,显然 0 Avogadro常数)。这表明反应速率常数与能量大 0 于 (即 E0 / N 0 )的分子数成正比。 可见,只有具有能量大于 0 的反应物分子才能进 行反应。可见,温度的影响表现在活化能因子 - E0 / RT 上,即活化分子的百分数上,由于T是在 e 指数项上,故其影响显著。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
过渡状态理论(活化络合物理论) 过渡状态理论(活化络合物理论)
1930年艾林和佩尔采运用了量子力学方法提出 年艾林和佩尔采运用了量子力学方法提出: 年艾林和佩尔采运用了量子力学方法提出
碰撞理论把分子看成刚性球体, 碰撞理论把分子看成刚性球体,认为反 应是由于分子间发生突然的、 应是由于分子间发生突然的、不连续碰撞的 结果,这种形象过于简单化。 结果,这种形象过于简单化。过渡状态理论 纠正了这种形象, 纠正了这种形象,认为当具有足够能量的分 子彼此以适当的空间取向相互靠近到一定程 度时, 度时,会引起分子或原子内部结构连续性变 化,使原来以化学键结合的原子间的距离变 而没有结合的原子间的距离变短, 长,而没有结合的原子间的距离变短,形成 了过渡状态的构型,称为活化络合物 活化络合物。 了过渡状态的构型,称为活化络合物。
第二节 反应速率理论
有效碰撞理论
1918年 lewis 以气体分子运动论为基础提出: 年 以气体分子运动论为基础提出: 1. 反应进行的必要条件是反应物分子间的相互磁撞 反应速率∝碰撞次数∝反应物浓度 反应速率∝碰撞次数∝ 2. 有效磁撞,只有具有较高能量的分子在取向合适的前提 有效磁撞,
下,能够克服碰撞分子间电子的相互斥力,完成化学键的改 能够克服碰撞分子间电子的相互斥力, 使反应完成。 组,使反应完成。
李远哲
药物代谢动力学研究内容 药物代谢动力学研究内容
• 药物体内过程 : 机体对药物的处置 吸收(absorption) 分布 (distribution) 代谢(metabolism) 排泄 (excretion) • 体内药物浓度(血药浓度)动力学规律
非血管途径给药的药非血管途径给药的药-时曲线
反应物浓度越大, 反应速率越大。 反应物浓度越大, 反应速率越大。
白磷在纯氧中燃烧
白磷在空气中燃烧
例: 2NO(g ) + 2H 2 (g ) 1073K → N 2 (g ) + 2H 2 O(g )
反应的有关实验数据如下:
c(H 2 ) /(mol ⋅ L−1 ) c(NO) /(mol ⋅ L-1 ) r /(mol⋅ L−1 ⋅ s−1) 试验编号
预测制剂中化学活性物质的稳定性 指导设计安全、稳定及有效的制剂处方 提出有关制剂正确的工艺技术及合适的 贮存条件 制订合理的用药方案 引入动力学的研究方法之后,药物研究才 引入动力学的研究方法之后, 真正摆脱经验阶段而进入科学阶段
第一节
化学反应速率
反应速率 ∆t时间内反应物浓度和生成物浓度的变化值 时间内反应物浓度和生成物浓度的变化值 如: t1时的浓度 t2时的浓度 则 aA + bB → cC + dD c(A)1 c(B)1 c(A)2 c(B)2 ∆t = t2 - t1 ∆c(A) υ(A) = - ∆t c(C)1 c(D)1 c(C)2 c(D)2 ∆c = c2 - c1 ∆c(D) υ(D) = ∆t
第三章 化学动力学基础
Very fast reaction 反 应 速 率
Slow reaction
化学反应,有的进行得很快, 化学反应 , 有的进行得很快 , 例如爆炸反 强酸和强碱的中和反应等, 应 、 强酸和强碱的中和反应等 , 几乎在顷刻 之间完成, 有的则进行得很慢, 之间完成 , 有的则进行得很慢 , 例如岩石的 风化、 钟乳石的生长、 镭的衰变等, 风化 、 钟乳石的生长 、 镭的衰变等 , 历时千 百万年才有显著的变化。 百万年才有显著的变化。 有的反应,用热力学预见是可以发生的, 有的反应 , 用热力学预见是可以发生的 , 但却因为反应速度太慢而事实上并不发生, 但却因为反应速度太慢而事实上并不发生 , 如金刚石在常温常压下转化为石墨, 如金刚石在常温常压下转化为石墨 , 在常温 下氢气和氧气反应生成水等, 这是由于, 下氢气和氧气反应生成水等 , 这是由于 , 化 学热力学只讨论反应的可能性、 趋势与程度, 学热力学只讨论反应的可能性 、 趋势与程度 , 却不讨论反应的速度。 却不讨论反应的速度。
二、瞬时速率——某瞬间的反应速率 瞬时速率 某瞬间的反应速率
∆cB dcB υ = lim = ∆t → 0 ∆ t dt
均相反应和非均相反应 均相反应
N2 + H2 = 2NH3 反应物和生成物均为气态,为均相体 系。反应速度仅与反应物浓度有关。
非均相反应
Zn + 2HCl = ZnCl2 + H2 非均相体系,反应速度与反应物浓度、 界面上的吸附、扩散等因素有关。
化学动力学意义
通过化学动力学的研究, 通过化学动力学的研究 , 可以知道如 何控制反应条件, 提高主反应的速率, 何控制反应条件 , 提高主反应的速率 , 增加产品产量, 抑制副反应的速率, 增加产品产量 , 抑制副反应的速率 , 减少原料消耗, 减少副产物, 减少原料消耗 , 减少副产物 , 提高纯 提高产品质量。 度 , 提高产品质量 。 化学动力学也研 究如何避免危险品的爆炸、 究如何避免危险品的爆炸 、 材料的腐 产品的变质与老化等问题。 蚀 、 产品的变质与老化等问题 。 所以 化学动力学的研究有理论与实践上的 重大意义。 重大意义。
在反应物与产物间存在过渡状态: 在反应物与产物间存在过渡状态: A B A A B C B C A C A B C
Activated complex
B
C
过渡态理论
A…B…C … … A…B…C … …
A+BC AB+C A+BC
AB+C
A+BC
[A…B…C] AB+C
第三节 浓度对反应速率的影响
• 利用激光 、 交叉分子束等新实验手段 , 研究某 利用激光、 交叉分子束等新实验手段, 一量子态的反应物变化到某一确定量子态的产 物的速率及反应历程( 态反应的层次) 物的速率及反应历程(态-态反应的层次); • 从分子水平上研究微观反应动力学 , 使得化学 从分子水平上研究微观反应动力学, 动力学取得了新的进展。 动力学取得了新的进展。
反应物分子具有足够的能量 碰撞的方向要合适
分 子 数 目
非活化分子
活化分子
E平
EC
分子具有的能量
活化能Ea = EC- E平
分子碰撞部位示意图
O C O C
O N O O O N
碰撞理论
※有效碰撞:能发生反应的碰撞 有效碰撞: 有效碰撞 ※活化分子:具有足够高的动能发生有效 活化分子: 活化分子 碰撞发生反应的分子 ※活化能:活化分子所具有的最低能量与 活化能: 活化能 反应物分子的平均能量之差 ※其他条件相同时,活化能越低的化学反 其他条件相同时, 其他条件相同时 反应速率越高。 应,反应速率越高。
飞秒化学(Femtochemistry) 飞秒化学(Femtochemistry)
20世纪70年代,基于快速激光脉冲的飞秒光谱技术发展, 使时间标度达到了飞秒数量级,用飞秒激光技术来研究 超快过程和过渡态使飞秒化学随之发展起来。从20世纪 80年代开始,艾哈迈德-泽维尔(Ahmed H. Zewail埃及出 生 美籍) 因用飞秒化学研究化学反应的过渡态而获得了 1999年度的诺贝尔化学奖。 “Zewail教授在飞秒化学领域所做出的贡献使 我们可以断言,化学家研究反应历程的努力 已接近终点,任何化学反应的速率都不可能 比飞秒量级更快。化学将有可能对各类化学 反应的历程做出合乎实际的推断” -诺贝尔化学奖公报
2)20世纪前叶:反应速率理论的创立 ) 世纪前叶 世纪前叶: a. 碰撞理论: 碰撞理论: 把反应看作两个反应球体碰撞的结果; 把反应看作两个反应球体碰撞的结果; b. 过渡态理论: 过渡态理论: 产生中间活化络合物的历程。 产生中间活化络合物的历程。
3)1950年代后, 新的实验手段的利用 ,微 ) 年代后, 年代后 新的实验手段的利用, 观反应动力学( 分子反应动态学) 观反应动力学 ( 分子反应动态学 ) 得到 发展。 发展。
单位: 单位 mol·L-1·s-1; mol·L-1·min-1; mol·L-1·h-1
如: 反应 C0/(mol·L-1) C100S/(mol·L-1)
2N2O5 = 4NO2 + O2 2.10 1.95 0 0 0.30 0.075
∆c(N2O5) 1.95-2.10 =1.5×10-3mol·L-1·s-1 × υ(N2O5)= =∆t 100 ∆c(NO2) 0.30-0 υ(NO2)= = =3.0× =3.0×10-3mol·L-1·s-1 ∆t 100 ∆c(O2) 0.0750-0 υ(O2) = = =7.5×10-4mol·L-1·s-1 × ∆t 100
1 2 3 4 5
该反应的速率方程: r = k [c(NO )] c ( H 2 ) 该反应的速率方程:
2
0.0060 0.0060 0.0060 0.0030 0.0015
0.0010 0.0020 0.0040 0.0040 0.0040
7.9 × 10 −7
3.2 × 10 −6
1.3 × 10 −5
6.4 × 10 3.2 × 10 −6
−6
动力学与热力学联系
热力学上不能发生的过程, 热力学上不能发生的过程,在现实中一定不 能发生,研究其动力学没有意义。 能发生,研究其动力学没有意义。 热力学研究无限缓慢的可逆过程, 热力学研究无限缓慢的可逆过程,故不考虑 时间因素, 时间因素,所以热力学上可以发生的过程只是 现实可能发生的过程,不是必然发生的。 现实可能发生的过程,不是必然发生的。 变化的可能性变化的可能性-化学热 力学: 力学: 解决变化的方向、 解决变化的方向、限度 及变化过程的能量转化 变化的现实性变化的现实性-化学动 力学: 力学: 解决变化的速率及分 析变化的具体过程。 析变化的具体过程。
化学动力学发展
