高一化学合金铁合金知识点人教版
3.2 金属材料--【新教材】人教版(2019)高中化学必修一基础知识讲义

第二节金属材料(一)铁合金一、合金1、定义:合金是由两种或两种以上的金属(或金属与非金属)熔合而成的具有金属特性的物质2、成分:一种金属为主,另一种或几种是金属或非金属3、制作过程:熔合4、特性:(1)合金的硬度一般比各成分金属的大(2)合金的熔点一般比各成分金属的低(3)合金的物理、化学及机械性能一般优于各成分金属注:1、合金是混合物2、稀土元素被称为“冶金工业的维生素”5、结构变化:纯金属中,所有原子大小、形状都相同,排列规整;加入其它元素的原子后,改变了金属原子有规则的层状排列,使原子层之间的相对滑动变得困难,导致合金的硬度变大。
二、铁合金(1)铁碳合金1、分类:含碳量为0.03%-2%,为钢;含碳量为2%-4.3%,为生铁。
2、性能及用途:生铁硬度大、抗压、性脆、可以铸造成型,是制造机座、管道的重要材料;钢有良好的延展性,机械性能良好,可以锻轧和铸造,广泛用于制造机械和交通工具等(2)钢钢是用量最大、用途最广的合金。
根据化学成分,钢分为两大类:碳素钢和合金钢1、碳素钢:铁与碳的合金2、合金钢:也叫特种钢,在碳素钢中适量加入一种或几种合金元素,使钢的组织结构发生变化,从而具有特殊性能例:不锈钢是最常见的一种合金钢,它的合金元素主要是铬和镍。
不锈钢特点:比较稳定,不易生锈,有很强的抗腐蚀能力;不锈钢用途:医疗器材、厨房用具、餐具、地铁列车车体(二)铝和铝合金一、铝的性质1、物理性质:铝是地壳中含量最多的金属。
银白色,有金属光泽的固体,熔点较低,硬度较小,是电和热的良导体。
常温下在空气中常被氧化成致密的氧化膜(Al2O3熔点2050℃),这层膜起到保护内部金属Al(熔点660℃)的作用,所以活泼的Al可以在空气中稳定存在。
2、化学性质:(1)与非金属反应:①与氧气反应:4Al+3O2点燃2Al2O3②与氯气反应:2Al+3Cl2点燃2AlCl3(2)与酸反应:2Al+6HCl=2AlCl3+3H2↑ 2Al+6H+=2Al3++3H2↑(3)与碱反应:2Al+2NaOH+2H2O=2NaAlO2+3H2↑ 2Al+2OH―+2H2O=2AlO2-+3H2↑实质:先与水反应,生成的氢氧化铝再与强碱溶液反应(4)与某些氧化物反应(即铝热反应):2Al+Fe2O3高温2Fe+ Al2O33、铝合金的用途①铝合金:向铝中加入少量法合金元素,如Cu、Mg、Si、Mn、Zn及稀土元素等,可制成铝合金。
金属材料(第2课时 常见的合金及应用)-高一化学课件(人教2019必修第一册)

√B.b点时溶液中发生的反应为Fe+Cu2+===Cu+Fe2+
C.c点时加入的铁粉与Cu2+反应
√D.原溶液中Fe2(SO4)3和CuSO4的物质的量之比为1∶2
11.硫酸铁铵[NH4Fe(SO4)2·xH2O]是一种重要铁盐。为充分利用资源,
6.将m g镁铝合金投入500 mL 2 mol·L-1的盐酸中,固体完全溶解, 收集到气体5.6 L(标准状况下)。向反应所得溶液中加入4 mol·L-1的氢 氧化钠溶液,沉淀质量的最大值为13.60 g,则m的值为( A ) A.5.10 B.8.50 C.9.35 D.11.48
7.将一定质量的Al、Mg混合物加入足量的盐酸中,充分反应后得 到标准状况下的氢气8.96 L;如果将等质量的该混合物加入足量的 NaOH溶液中,充分反应后得到标准状况下的氢气6.72 L。 (1)混合物与NaOH溶液反应的离子方程式为 ___2_A_l_+__2_O__H__-_+__2_H__2_O_=__=_=__2__A_l_O_2_-__+__3_H_2_↑_________。 (2)求混合物中各成分的质量。
A.①② B.①③ C.①④ D.②④
(3)镁、铝合金与盐酸完全反应后,加入过量的氢氧化钠溶液,最后的结 果是 C 。 A.没有沉淀物生成 B.只有氢氧化铝沉淀生成 C.只有氢氧化镁沉淀生成 D.有氢氧化铝和氢氧化镁沉淀生成
10.现代建筑的门窗架常用电解加工成的古铜色硬铝制造。取硬铝样品 进行如下实验(每一步试剂均过量),由此可以推知硬铝的组成可能为
第三章 第二节 金属材料
第2课时 常见的合金及应用 Nhomakorabea一、铁合金
一 铁合金 1.合金:合金属于混合物,合金的机械性能一般 优于 各成分金属;合金的 硬度一般 高于 它的各成分金属。 2.铁合金 生铁和钢是含碳量不同的两种铁碳合金。 (1)生铁:含碳量为2%~4.3% 的铁碳合金称为生铁。生铁硬度 大 、抗压, 性脆、可以铸造成型,是制造机座、管道的重要材料。
3.2金属材料铁合金新型合金课件高一上学期化学人教版

合金的形成条件:一种金属的熔点不高于另一种金属的沸点。
四、课堂检测
1.我国“蛟龙”号载人潜水器已成功下潜至海中7 062.68米处。“蛟龙”
号载人潜水器的外壳是耐超高压的钛合金,下面有关合金的说法正确的是
(
D)
A.钛合金是一种新型金属单质
B.钛合金熔点比钛金属高
C.钛合金的硬度与钛单质相同 D.青铜、合金钢和硬铝都是合金
2.下列关于新型合金材料说法不正确的是(
D
)
A.镧镍合金能大量吸收H2形成金属氢化物,可作储氢材料
B.钛合金生物相容性好,强度大,可作人造骨骼
C.形状记忆合金可在使合金发生形变的作用力消失后恢复原状
高强度的铝合金。
一、合金
01
微观 结构
合金的结构、性质和应用。
决定
决定
02
宏观 性质
03
用途
原子 大小和排列
硬度 熔点 ……
二、常见的合金
1.铜合金
青铜:主要含铜和锡----我国使用最早的合金 黄铜:主要含铜和锌 白铜:主要含铜和镍 2.铁合金
铁的合金 铁
C% 机械性能
生
钢
2%-4.3%
0.03%-2%
储氢合金
钛合金
新型合金
耐热合金
形状记忆合金
······
二、新型合金
新型合金:储氢合金
储氢合金是一类能够大量吸收H2,并与H2结合成金属氢化物的材料。
储氢量大,容易形成,稍稍加热又容易分解,室温下吸、放氢的速率快。 新型储氢合金材料的研究和开发为氢气作为能源的实际应新型合金
人教版高中化学必修第1册 3.2.1 第1课时 合金

________的物质。
2.合金的特性
大
(1)合金的硬度一般比各成分金属的____。
低
(2)合金的熔点一般比各成分金属的____。
(3)合金的_____、_____及________一般优于各成分金属。
物理
化学
机械性能
种类 、 含 量 和
(4) 合 金 的 性 能 可 以 通 过 所 添 加 的 合 金 元 素 的 ______
3.00
7.86
硬度(金刚
石为10)
7.4
4.5
导电性
(银为100)
2.3
17
已知该合金耐腐蚀,强度大。从以上性能看,该合金不适合作( A )
A.导线
B.门窗框
C.炉具
D.飞机外壳
解析:从表格中总结,该合金具有密度小、机械性能好的特点,所以适合作飞
机外壳、门窗框。由于熔点较高,所以适合作炉具。但是导电性不好,所以不适
等。稀土金属除广泛应用在冶金、石油化工、材料工业、医药及农业
领域外,还逐渐深入到许多现代科技领域。
[即学即练]
1.判断正误,正确的打“√”,错误的打“×”
(1)合金中不可能含有非金属元素。( × )
(2)合金中的金属元素以化合物的形式存在。( × )
(3)合金中各元素的含量一定,所以合金是纯净物。( × )
合金元素
铬(Cr)
锰(Mn)
钼(Mo)
钨(W)
钴(Co)
镍(Ni)
硅(Si)
主要作用
增强耐磨性和抗氧化性;增强高温强度;提高高碳钢的耐
磨性等
防止硫引起的脆性;增强钢的强度和韧性等
降低脆性;增强高温强度;提高红热时的硬度和耐磨性等
新教材 高中化学人教版必修一同步知识专项讲练 含解析 铁合金

必过18 铁合金知识点一合金1.概念:由两种或两种以上的金属与金属(或非金属)熔合而成的具有金属特性的物质。
2.性能特征:合金具有许多优良的物理、化学或机械性能,在许多方面不同于各成分金属。
(1)合金的硬度及机械性能一般大于成分金属。
(2)合金的熔点多数低于成分金属。
3.影响性能的因素由于所添加合金元素的种类、含量和形成合金的条件不同,则使合金的组成结构不同,进而使合金具有的性能不同。
知识点二铁合金1.生铁和钢的比较生铁钢含碳量2%~4.3% 0.03%~2%性能特征硬度大、抗压、性脆、可铸造成型有良好的延展性、机械性能好、可以锻轧和铸造主要应用制造机座、管道等制造机械和交通工具等其中不锈钢是一种重要的合金钢,合金元素主要是铬和镍,在大气中比较稳定,不易生锈,抗蚀能力强,常用于制造医疗器械、厨房用具和餐具,以及地铁列车的车体等。
一、选择题1.下列物质不属于合金的是()A.青铜器B.不锈钢C.合金钢D.金刚石【答案】D【解析】合金是由金属与金属或金属与非金属熔合而成具有金属特性的混合物,青铜器、不锈钢、合金钢均属于合金,金刚石是碳的单质,不属于合金,故选D。
2.(2021·云南省华宁县第一中学)铁的下列性质中不属于纯铁的物理性质是()A.质软B.银白色C.能导电D.易生锈【答案】D【解析】物理性质通常包括:颜色、状态、气味、密度、硬度、熔沸点、导电性、导热性、溶解性等,所以铁质软、银白色、能导电,均为物理性质,而易生锈是指易被氧化,为化学性质;故选D。
3.(2021·山西高一期末)人类最早使用的合金是()A.铜合金B.铁合金C.铝合金D.镁合金【答案】A【解析】由于铜的活动性比较弱,以单质形成存在的比较多,所以人类历史上使用最早的合金是铜合金。
故A符合题意,B、C、D不符合题意。
故选A。
4.(2021·全国高一课时练习)下列适合制作不锈钢用具的铁合金是()A.低碳钢B.中碳钢C.高碳钢D.合金钢【答案】D【解析】不锈钢由于其抗腐蚀性好,在生产和生活中有许多用途,若含有碳元素,易形成电化学腐蚀,低碳钢、中碳钢、高碳钢都含有碳,属于不适宜于制作不锈钢用具的钢,不锈钢中含有的主要金属是镍和铬铁,是这三种元素为主制成的合金钢,D符合题意。
人教版高中化学必修第一册精品课件 第3章 铁 金属材料 第2节 第1课时 常见的合金及应用

木条放在试管口有 爆鸣
声
立即产生 气泡
,铝片逐渐
溶解,将点燃的木条放在试管
口有 爆鸣 声
实验结论
铝、氧化铝均能与NaOH溶液反应
Al2O3+2NaOH+3H2O ══ 2Na[Al(OH)4]
、
化学方程式 2Al+2NaOH+6H O ══ 2Na[Al(OH) ]+3H ↑
2
4
2
④两性氧化物
含着许多化学知识。下列说法错误的是( D )
A.“金(即铜)柔锡柔,合两柔则刚”,体现了合金硬度的特性
B.“千淘万漉虽辛苦,吹尽狂沙始到金”能体现出金的化学性质不活泼
C.“两编千片白雪茧,六百二斗青铜钱”中的“青铜钱”属于铜的合金
D.“司南之杓,投之于地,其柢指南”,司南的“杓”中含有Fe2O3
解析 “合两柔则刚”体现了合金的特性,A正确;“千淘万漉虽辛苦,吹尽狂沙
能,B错误;合金是金属与金属或非金属熔合而成的具有金属特性的物质,C
错误;不锈钢中的主要元素是铁,D错误。
归纳总结 1.合金的形成条件
(1)金属与金属形成合金时:熔化时的温度需达到成分金属中熔点最高的金属的
熔点,但又不能超出成分金属中沸点最低的金属的沸点。
(2)金属与非金属形成合金时:部分不活泼非金属与金属可形成合金,活泼非金属
材料说法正确的是( A )
A.铜比铝先成功冶炼的原因是铝比铜活泼,更难获得铝单质
B.组成合金的元素种类相同,得到的合金性能就相同
C.合金中至少含有两种金属
D.不锈钢中的主要元素是镍、铬、碳
解析 活泼的金属冶炼难度大,铜比铝先成功冶炼的原因是铝比铜活泼,更
难获得铝单质,A正确;组成合金的元素种类、含量等都会影响合金的性
人教版高中化学必修第1册 第三章 第二节 第1课时 铁合金 铝和铝合金 新型合金

铝和铝合金
1、铝的物理性质 银白色金属、密度小、质软,熔点低、
良好的导电导热性和延展性。 2、铝在地壳中的含量
地壳中含量最高的金属元素 3、铝的化学性质
铝是一种活泼金属,易失去电子,常温下被 空气中的氧气氧化
钢
高碳钢(含碳0.6%~2% )
0.03%~2% 合金钢: 也叫特种钢在碳素钢中加入铬、锰、钨、
镍、钼、钴等一种或几种元素,组织结构发生
变化,从而使钢具有各种特殊性能
钢
组成元 素
低碳钢
碳素钢 中碳钢
Fe和C
高碳钢
合金钢
Fe、C、Cr、Mn、W、 Ni、Mo、Co、Si
含碳量 低于0.3%
0.3%-0.6%
高于0.6%
性能
韧性、焊接性好, 强度高、韧性及
但强度低
加工性好
硬而脆,热处 理后弹性好
种类多,性能差别大
用途
用于制造钢板、 用于制造钢轨、 用于制造器械、 钢丝、钢管等 车轮、建材等 弹簧、刀具等
不锈钢
合金元素:主要是 铬 (Cr)和镍 (Ni ) 性能:在大气中比较稳定,不容易生锈,具有很强的抗腐蚀能力。
实验2
反应的化学方程式:
实验 、
原理 Al2O3+2NaOH=2NaAlO2+H2O 2Al+2NaOH+2H2O=2NaAlO2+3H2↑
化学方程式: 2Al+2NaOH+2H2O=2NaAlO2+3H2↑
实验1 实验 装置
实验 离子方程式: 原理
实验2 、离子方程式:
新课标高中化学人教版必修第一册第二册知识解析〖铁合金〗
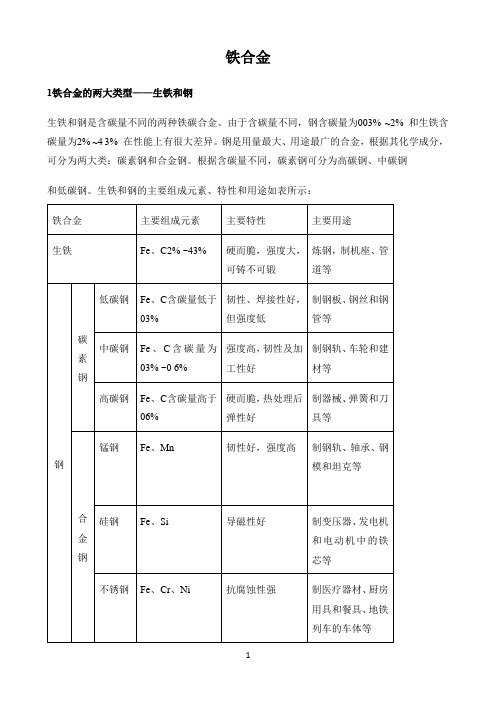
铁合金
1铁合金的两大类型——生铁和钢
生铁和钢是含碳量不同的两种铁碳合金。
由于含碳量不同,钢含碳量为003% ~2% 和生铁含碳量为2% ~4 3% 在性能上有很大差异。
钢是用量最大、用途最广的合金,根据其化学成分,可分为两大类:碳素钢和合金钢。
根据含碳量不同,碳素钢可分为高碳钢、中碳钢
和低碳钢。
生铁和钢的主要组成元素、特性和用途如表所示:
2钢中合金元素的主要作用
【例1】碳素钢的分类依据是
A硬度B含碳量C用途D机械性能
【解析】根据含碳量的不同,可把碳素钢分为低碳钢、中碳钢和高碳钢。
【答案】B
【例2】下列说法正确的是
A高碳钢的含碳量大于2%
B生铁既可铸造也可锻造
C生铁和钢都属于铁合金
D生铁是用途最广的合金
【解析】高碳钢属于钢中的碳素钢,钢的含碳量均低于2% ,A项错误;生铁可铸不可锻,B 项错误;铁合金通常包括生铁和钢两大类,C项正确;钢是用途最广的合金,D项错误。
【答案】C
【例3】日常生活中的容器主要是不锈钢制品,这是利用该合金的
A导电性B导热性C抗腐蚀性D易回收利用
【解析】生活中使用不锈钢制品,主要利用其抗腐蚀性。
【答案】C。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高一化学合金铁合金知识点人教版铁合金是以铁为主体,加入少量的合金元素制成的合金材料。
铁合金在工业生产中具有重要的应用,主要是因为其优异的物理
性能和化学性能。
下面将介绍高一化学中关于铁合金知识点,包
括合金的分类、合金元素的作用以及铁合金的应用等内容。
一、铁合金的分类
铁合金根据合金元素的不同,可以分为碳钢、铸铁和合金钢。
1. 碳钢:主要合金元素是碳,含碳量在0.03%~
2.0%之间。
碳
钢具有良好的切削性和强度,常用于制造机械零部件和工具。
2. 铸铁:主要合金元素是碳和硅,含碳量在2.0%~4.5%之间。
铸铁具有良好的流动性和耐磨性,常用于制造铸件、机械零部件
和汽车零件等。
3. 合金钢:除了碳外,还含有其他合金元素,如铬、镍、钼等。
合金钢具有更高的强度和耐腐蚀性能,广泛应用于制造汽车、航
空器、建筑材料等。
二、合金元素的作用
合金元素对铁合金的性质有着重要的影响,下面以常用的合金元素为例进行介绍。
1. 碳:在铁合金中,碳是最常见的合金元素之一。
适量的碳可以提高铁合金的硬度和强度,但过量的碳会导致铁合金变脆。
碳在铁合金中形成的固溶体称为渗碳体,它是提高铁合金硬度的重要因素。
2. 硅:硅是铁合金中常见的合金元素,可以提高铁合金的耐腐蚀性和热稳定性。
在铸铁中加入适量的硅可以提高铁合金的液态流动性,有利于铸件的成型。
3. 锰:锰主要用于制造锰铁合金,可以提高铁合金的硬度和抗磨性能。
锰铁合金在钢铁工业中有着重要的应用。
4. 铬:铬主要用于制造不锈钢。
加入适量的铬可以提高铁合金的耐腐蚀性、耐高温性和耐磨性。
5. 镍:镍可以提高铁合金的延展性和韧性,常用于制造合金钢和不锈钢。
三、铁合金的应用
铁合金在工业生产中应用广泛,下面将介绍一些常见的应用领域。
1. 钢铁工业:铁合金是钢铁工业的重要原料。
合金钢在航空、航天、汽车制造等领域有着广泛的应用。
铸铁常用于制造机械零部件和汽车部件。
2. 电子行业:铁合金在电子行业中也有着重要的应用。
合金钢常用于制造电子设备的机械结构,合金材料常用于制造电子元器件。
3. 建筑材料:合金钢常用于制造建筑结构材料,如钢筋、钢板等。
4. 航空航天工业:航空航天工业对铁合金的需求量很大,合金钢和高温合金是航空航天工业中重要的材料。
总结:
铁合金作为一种重要的材料,具有广泛的应用领域,对于推动工业发展起着重要的作用。
高一化学中学习铁合金知识,有助于学生了解材料科学的基础知识,培养科学思维和创新能力。
通过深入学习铁合金知识,可以更好地理解和应用相关的知识,为今后的学习和职业发展打下良好的基础。
