人教版化学选3第二章 第二节 分子的立体结构
人教版高中化学选修三课件:第二章 第二节 第一课时 价层电子对互斥理论(26张PPT)

•1、所有高尚教育的课程表里都不能没有各种形式的跳舞:用脚跳舞,用思想跳舞,用言语跳舞,不用说,还需用笔跳舞。 •2、一切真理要由学生自己获得,或由他们重新发现,至少由他们重建。 •3、教育始于母亲膝下,孩童耳听一言一语,均影响其性格的形成。 •4、好的教师是让学生发现真理,而不只是传授知识。 •5、数学教学要“淡化形式,注重实质.
实例
2
0
2
3
0
3
2
1
直线形
直线形
HgCl2、 BeCl2、
CO2
三角形
平面三角形 V形
BF3、 BCl3 SnBr2、 PbCl2
σ键电 孤电子 价层电 电子对的 VSEP 分子或离子 实例
子对数 对数 子对数 排列方式 R模型 的立体构型
4
0
3
1
4
四面 体形
正四面体形 三角锥形
CH4、 CCl4 NH3、 NF3
VSEPR模型 的立体构型 体构型名称
NH3
_三__角__锥__形
HCN
_直__线__形
H3O+
_三__角__锥__形
SO2
_V_形
[特别提醒] VSEPR模型与分子的立体构型不一定一致,分子的 立体构型指的是成键电子对的立体构型,不包括孤电子 对(未用于形成共价键的电子对)。两者是否一致取决于 中心原子上有无孤电子对,当中心原子上无孤电子对 时,两者的构型一致;当中心原子上有孤电子对时,两 者的构型不一致。
2
2
V形
H2O
1.用价层电子对互斥理论判断SO3的分子构型为 ( )
A.正四面体形 B.V形
C.三角锥形
D.平面三角形
解析:SO3中S原子的价层电子对数为3,其全部用于形
人教版选修3高中化学 第2章第2节 分子的立体构型(第2课时)

锥形
sp 杂化和 sp2 杂化这两种形式中,原子还有未参与杂化的 p 轨道,可用于形成 π 键,而杂化轨道只能用于形成 σ 键或 者用来容纳未参与成键的孤电子对。
指出下列分子中,中心原子可能采取的杂化轨道类 型,并预测分子的立体构型。 (1)BeCl2:__________ (2)PCl3:__________ (3)BCl3:____________ (4)CS2:__________ (5)SCl2:____________
4.如图是甲醛分子的模型。根据该图和所学化学键知识回 答下列问题:
甲醛分子的比例模型 甲醛分子的球棍模型 (1)甲醛分子中碳原子的杂化方式是________________, 作出该判断的主要理由是_____________________。 (2) 下 列 是 对 甲 醛 分 子 中 碳 氧 键 的 判 断 , 其 中 正 确 的 是 ________(填序号)。 ①单键 ②双键 ③σ 键 ④π 键 ⑤σ 键和 π 键
(3)sp3 杂化 sp3 杂化轨道是由一个__s____轨道和三个_____p____轨道杂 化 而 得 , 杂 化 轨 道 间 的 夹 角 为 __1_0_9_°__2_8_′_ , 立 体 构 型 为 _正__四__面__体___形,如 CH4 分子。
(1)在形成多原子分子时,中心原子价电子层上的某些能量 相近的原子轨道发生混杂,重新组合成一组新的轨道的过 程,叫做轨道的杂化。双原子分子中,不存在杂化过程。 (2)只有能量相近的轨道才能杂化(ns,np)。
• 1、“手和脑在一块干是创造教育的开始,手脑双全是创造教育的目的。” • 2、一切真理要由学生自己获得,或由他们重新发现,至少由他们重建。 • 3、反思自我时展示了勇气,自我反思是一切思想的源泉。 • 4、好的教师是让学生发现真理,而不只是传授知识。 • 5、数学教学要“淡化形式,注重实质.
人教版化学选修三2.2《分子的立体构型(第2课时)分子的空间结构和价层电子对互斥理论》教学设计

第二章第二节分子的立体构造第 2 课时分子的空间构造与价层电子对互斥理论【学习目标】 1、能应用价层电子对互斥理论判断分子的空间构型。
【学习要点】σ键电子对、孤电子对和价层电子对的计算,VSEPR 模型【学习难点】分子立体构型的推测课前预习案一、价层电子对互斥理论(阅读课本 P37-38 达成填空)1、价层电子对互斥理论以为,分子的“立体构型”是的结果。
2、价层电子对是指;价层电子对 =+;( 1)σ键电子对数:可由确立。
比如,H2O的中心原子是______,构造式是 __________,有个σ键,故σ键电子对数是______;(2)中心原子上的孤对电子对数:依据公式 _______________________确立,此中 a 为,关于主族元向来说,价电子数等于;x 为;b 为;氢为 _____,其余原子等于。
阳离子: a 为中心原子的价电子数减去 _______________;阴离子:a为中心原子的价电子数加上(绝对值)。
2-的孤对电子数 =1/2(6+2-2*3 )=13比如: SO【预习检测】1、运用你对分子的已有的认识,达成以下表格,写出C、 H、N、O 的电子式,依据共价键的饱和性议论C、H、N、 O、F 的成键状况。
原子H C N O F 电子式可形成的共用电子对数讲堂研究案研究一:价层电子对空间构型(即VSEPR 模型)价层电子对互斥理论的基本内容:对AB n型的分子或离子,中心原子A 价层电子对(包含成键σ键电子对和未成键的孤对电子对)之间因为存在排挤力,将使分子的几何构型老是采纳电子对互相排挤最小的那种构型,以使相互之间斥力最小,分子系统能量最低、最稳固。
问题 1:请你依据价层电子对互斥理论的基本内容,总结出价层电子对的空间构型(即 VSEPR 模型)(利用牙签与橡皮泥模拟)空间构型价电子对数量234VSEPR 模型形形形问题 2:依据价层电子对互斥理论,计算出以下分子的中心原子含有的σ键电子对数、孤对电子数及价层电子数。
化学选修3第二章第二节分子的立体构型
3个sp2杂化轨 4个sp3杂化轨 道 道
1200 1090 28’
1800
空 间 构 型
实 例
直 线形
平面三角形
四面体形 CH4 , H2O
BeCl2 CO2 C2H2 BF3 , C2H4
杂化轨道只用于形成σ键或者用来容纳孤对电子,剩 余的p轨道可以形成π键
1、氨气分子空间构型是三角锥形,而甲烷是正四面体形,这是 因为( C ) A.两种分子的中心原子杂化轨道类型不同,NH3为sp2杂化, 而CH4是sp3杂化 B.NH3分子中N原子形成3个杂化轨道,CH4分子中C原子形 成4个杂化轨道 C.NH3分子中有未成键的孤电子对,它对成键电子的排斥 作用较强 D.氨气分子中氮原子电负性强于甲烷分子中的碳原子 2、用价层电子对互斥理论预测H2S和BF3的立体结构,两个 结论都正确的是( D )
sp2杂化轨道的形成过程
120° z z z z
y x x
y x
y x
y
sp2杂化轨道由1个s轨道和2个p轨道杂化而得到三个sp2杂化轨道。 三个杂化轨道在空间分布是在同一平面上,互成120º 例如:C2H4
C2H4(sp2杂化)
sp杂化轨道的形成过程
z
z
180°
z
z
y x x
y x
y x
y
sp杂化轨道由1个s轨道和1个p轨道杂化而得到两个sp杂化轨道。 两个杂化轨道在空间分布呈直线型,互成180º 例如:C2H2
4、下列分子或离子中,不含有孤对电子的是( D ) A、H2O B、H3O+ C、NH3 D、NH4+
5、以下分子或离子的结构为正四面体,且键角为 109°28′ 的是( B ) ①CH4 ②NH4+ ③CH3Cl ④P4 ⑤SO42A、①②③ B、①②④ C、①②⑤ D、①④⑤
高二化学选修3第二章第二节分子的立体构型 杂化轨道理论

为了解决这一矛盾,鲍林提出了杂化轨道理论,
三、杂化轨道理论
1、理论要点
① 同一原子中能量相近的不同种原子轨道在成 键过程中重新组合,形成一系列能量相等的新轨 道的过程叫杂化。形成的新轨道叫杂化轨道,用 于形成σ键或容纳孤对电子 ② 杂化轨道数目等于各参与杂化的原子轨道数目 之和 ③ 杂化轨道成键能力强,有利于成键 ④ 杂化轨道成键时,满足化学键间最小排斥原 理,不同的杂化方式,键角大小不同 ⑤ 杂化轨道又分为等性杂化和不等性杂化两种
④ 其它杂化方式
dsp2杂化、sp3d杂化、sp3d2杂化、d2sp3杂化
例如:sp3d2杂化:SF6 构型:四棱双锥 正八面体
此类杂化一般是金属作为中心原子 用于形成配位化合物
小结:杂化轨道的类型与分子的空间构型 • 杂化轨道类型 sp
参加杂化的轨道 s+p 杂化轨道数 2
sp2
s+(2)p 3
+
构型 120° 正三角型
BF3的空间构型 为平面三角形
F
2p
F
激发 2s
B
B: 2s22p1
2s
2p
F
sp2杂化
sp2
③ sp3杂化
2p
2s
以C原子为例
2s 2p
激发
C
杂化
C
sp 杂 化
3
基态 激发态
1个s轨道和3个p轨道杂化形成4个sp3杂化轨道
构型 109°28′ 正四面体型 4个sp3杂化轨道可形成4个σ键 价层电子对数为4的中心原子 采用sp3杂化方式
CH4的空间构型为正四面体
C:2s22p2
2s
2p
激发 2s
2p
sp 杂化
高中化学选修3(第二章第二节).ppt

大π 键
C6 H6
C6H6的大π键
价层电子对数为3的中心 原子采用sp2杂化方式
sp3杂化轨道的形成过程
z z y y x x x x y y z 109°28′ z
sp3杂化:1个s 轨道与3个p 轨道进行的杂化, 形成4个sp3 杂化轨道。 每个sp3杂化轨道的形状也为一头大,一头小, 含有 1/4 s 轨道和 3/4 p 轨道的成分 每两个轨道间的夹角为109.5°, 空间构型为正四面体型
(2)杂化前后原子轨道数目不变:参加杂化的轨道数 目等于形成的杂化轨道数目;但杂化轨道改变了原子 轨道的形状方向,在成键时更有利于轨道间的重叠;
sp杂化轨道的形成过程
z z 180° z z
y x
y
y x x
y
x
sp 杂化:1个s 轨道与1个p 轨道进行的杂化,
形成2个sp杂化轨道。可形成2σ键。 剩下的两个未参与杂化的道用于形成π键 。
乙炔的成键
价层电子对数为2的中心 原子采用sp杂化方式
sp2杂化轨道的形成过程
120° z z z z
y x x
y x
y x
y
sp2杂化:1个s 轨道与2个p 轨道进行的杂化,
形成3个sp2 杂化轨道。 每个sp2杂化轨道的形状也为一头大,一头小, 含有 1/3 s 轨道和 2/3 p 轨道的成分
杂化轨道 sp sp2 每个轨道的成分 1/2 s,1/2 p 1/3 s,2/3 p 轨道间夹角( 键角) 180° 120°
sp3
1/4 s,3/4p
109°28′
H2O原子 轨道杂化
22p4 O 原子: 2 s 有2个 不等性杂化:参与杂化的各原子轨道进行成分上的 单电子,可形成2个共价键, 键角应当是90°, Why? 不均匀混合。某个杂化轨道有孤电子对
高中化学教学课例《化学人教版选修32.2分子的立体构型》课程思政核心素养教学设计及总结反思

态。
尊重、理解、关注、赏识”的新型师生关系,课堂教学
才能在和谐愉悦课堂氛围实现有效,甚至是高效。
引入:PPT 展示常见分子和离子的球棍模型。
提问:什么是分子的立体模型?原子数相同的分子 教学过程
为什么构型不同?(抛出问题,让学生产生认知冲突,
产生求知的欲望和探究的兴趣。)
提示:上节课所讲分子的构型和键参数有关。但并 非决定性因素。尝试根据球棍模型或比例模型,写出上 述分子和离子的电子式、结构式。
引出:价层电子对互斥理论(VSEPR):分子的立 体构型是“价层电子对”相互排斥的结果。
(抛出重点。) 公式:价层电子对=孤电子对+σ 键电子对;孤电 子对=(a-xb)÷2。 (注意:阴阳离子的算法。对于阳离子:a 为中心 原子的最外层电子数减去离子的电荷数;对于阴离子: a 为中心原子的最外层电子数加上离子的电荷数) (解决重点。) (PPT+板书)列表格,举例子,详解析,做练习。 (在这个环节,将突破本节课的重点,解决难点,
趣,感受化学世界的奇妙。
本节知识属于化学理论教学和已有知识关联度较
少,通过设计引导希望尽可能取得较好的教学效果。虽
然学生已初步了解分子和离子的电子式、结构式,以及 学生学习能
性质和结构的关系,但学生对分子和离子的空间立体构 力分析
型还没有形成正确的深入理解,另一方面学生的空间想
象思维略弱,相关知识的准确度把握不够,在教学过程
进一步为后面学习晶体及其在生活中的应用埋下铺垫。 教材分析
所以本节内容至关重要。
重点:分子的立体构型;价层电子对互斥理论;孤
电子对数的计算;VSEPR 模型和分子模型的差别。
难点:价层电子对互斥理论;VSEPR 模型和分子模
人教版高中化学选修3 物质结构与性质 第二章 第二节 分子的立体构型(第1课时)

2014年7月20日星期日
21
价层电子对互斥理论
ABn 型分子的VSEPR模型和立体结构
电子对数 目 电子对的空 间构型 成键电子 对数 孤电子 对数 电子对的 排列方式 分子的 空间构型 实 例
2
直线
2
0
直 线形
BeCl2 CO2
3 3 三角型 2
0
三角形
BF3 SO3
1
V形
SnBr2 PbCl2
2014年7月20日星期日 17
价层电子对互斥理论
化学式 HCN SO2 NH2- BF3 H 3O + SiCl4 CHCl3 NH4+ SO42-
2014年7月20日星期日
价层电子对数 结合的原子数 孤对电子对数
2 3 4 3 4 4 4 4 4
2 2
0 1
2 3 3 4 4 4 4
2
0 1 0 0 0 0
1 0 0 0
2 2 2 3 3
4 4 4
直线形 V形 V形 平面三角形 三角锥形 正四面体 四面体 正四面体
26
2014年7月20日星期日
价层电子对互斥理论
1、下列物质中分子立体结构与水分子相似的是 A.CO2 B.H2S B C.PCl3 D.SiCl4 2、下列分子立体结构其中属于直线型分子的是 A.H2O B.CO2 BC C.C2H2 D.P4 3、下列分子立体结构其中属正八面体型分子的 A.H3O + B.CO32— D C.PCl5 D.SF6
新课标人教版高中化学课件系列
选修3 物质结构与性质 第二章 分子结构与性质
第二节 分子的立体构型 第1课时
2014年7月20日星期日
1
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
对ABn型分子,B围绕A成键,则A为中心原子,n 值为中心原子结合的原子数。
-
平面 正 三角形 四面体
3)填写孤对电子与分子的空间构型关系,中心原子 结合的原子数(n值)与分子的空间构型关系。
中心无孤对电子
代表物
中心原子含孤对电 子对数
0 0 0 2 1
:O::C::O:
H .. .. H C O .. H H : C :H H .. . . ..
V
分子
表 的立 格 一 四原子分子
平面三角 形,如HCHO、BF3
体结
三角锥
形,如NH3
构
五原子分子——— 最常见的是正四面体 形,如CH
4
★☆★通过填表,你能发现什么问题?
探究:同为三原子分子,CO2 和 H2O 分子的空间
结构却不同,同为四原子分子,CH2O与 NH3 分子 的空间结构也不同,什么原因?
: : : : : :
H 2O
NH3
中心存在孤对电子 3 107°
2
105°
V形
三角锥形
二、价层电子对互斥模型
(VSEPR模型)
1、内容:中心原子价电子层电子对(包括__ 成键( σ键) _ 电子对和 未成键 的孤对电子对) 的互相 排斥 作用,使分子的几何构型总是采 取电子对相互 排斥最小 的那种构型,即分子 尽可能采取对称的空间构型。
无孤对电子 CH2O CH4 H2O NH3
AB3 平面三角形 AB4 AB2 AB3 正四面体 V形 三角锥形
有孤对电子
应用反馈:
化学式 HCN 中心原子 孤对电子数 中心原子结 合的原子数 空间构型 直线形
三角锥形
SO32NH2- BF3 H3O+ SiCl4 CHCl3 NH4+
0 1 2 0
第二章 分子结构与性质
第二节分子的立体结构 (第一课时)
复习回顾
σ键 共价键
成键方式 “头碰头”,呈轴对称
π键
键能 键参数
成键方式 “肩并肩”,呈镜像对称
键长
衡量化学键稳定性
键角 描述分子的立体结构的重要因素
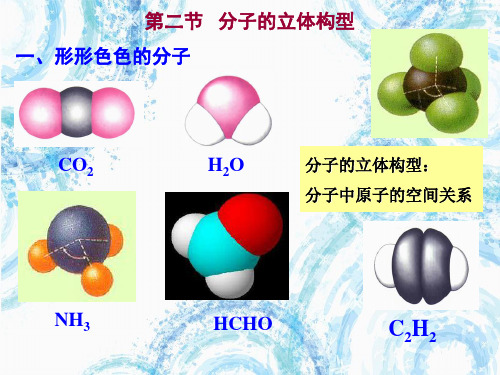
一、形形色色的分子
1、双原子分子(直线型)
O2
2、三原子分子立体结构(有直线形和V形)
HCl
三角锥形
NH
确定孤电子对的方法: 中心原子上的 孤对电子对=1/2(a-xb) a :中心原子的价电子数 x :与中心原子结合的原子数 b :8-与中心原子结合的原子的价电子数
见教材38页表2-4
小结:
中心原子
价层电子对互斥模型
中心原子 分子 代表物 结合的原子数 类型 CO2 2 3 4 2 3 AB2 空间构型 直线形
H .. .. : : H N H : : H O H :O::C::O: H C O .. H
: : : : : : .. . . .. O=C=O H-O-H H-N-H H
结构式
O
H-C-H
H H : C :H H H H-C-H H : :
- -
=
分子的空间构 型
直线形 倒V 形
三角 锥 形
更多资源
课堂练习
3.若ABn型分子的中心原子A上没有未用于形 成共价键的孤对电子,运用价层电子对互斥模 型,下列说法正确的(C ) A.若n=2,则分子的立体构型为V形 B.若n=3,则分子的立体构型为三角锥形 C.若n=4,则分子的立体构型为正四面体形 D.以上说法都不正确
1)写出H、C、N、O原子的电子式:表格二 原子
H C N O
电子式
H·
· C· · ·
· · N: ·
· · O: · ·
可形成 共用电子对数
1
4
3
2
2)写出CO2、H2O、NH3、CH2O、CH4等分子的电 子式、结构式及分子的空间构型:表格三
分子 CO2 H2O NH3 CH2O CH4
电子式
H2O
CO2
3、四原子分子立体结构(直线形、平面三 角形、三角锥形、正四面体) (平面三角形,三角锥形)
C2H2
CH2O
COCl2
NH3
P4
4、五原子分子立体结构
最常见的是正四面体
CH4
5、其它:
CH3CH2OH
CH3COOH
C6H6
C8H8
CH3OH
直线
三原子分子
形,如CO2 形,如H20
2、价电子对数和电子对立体构型(VSEPR模型) 的关系
2 对电子 •• A •• 4 对电子 •• •• •• A • •
A
直线形
3 对电子
平面三角形
只有一种角度,120° 四面体形
••只有一种角度,109°28′
5 对电子
三角双锥
6 对电子
正八面体
3、价层电子对互斥模型的应用
(1)、一类是中心原子上的价电子都用于形 成共价键,如 CO2 、 CH2O 、 CH4 等分子中的 碳原子,它们的立体结构可用中心原子周围的 原子数n来预测,概括如下: ABn 立体结构 范例 n=2 直线形 CO2、 CS2 n=3 平面三角形 CH2O、BF3 n=4 正四面体形 CH4、 CCl4 n=5 三角双锥形 PCl5 n=6 正八面体形 SCl6
分子 电子式 结构式
中心原子 有无孤对电子 :
CO2
:O::C::O: O=C=O :
CH2O
: H : C :H O = H-C-H :O: :
CH4
H H : C :H H H H-C-H H : :
无
直线形
无
平面 三角形
无
空间结构
正 四面体
- -
(2)、另一类是中心原子上有孤对电子(未用于形成共 价键的电子对)的分子。
1 0 0 0
2 3 2 3 3
4 4 4
V形 平面三角形 三角锥形 正四面体 四面体 正四面体
课堂练习
1.下列物质中,分子的立体结构与水分子 相似的是 (B ) A.CO2 B.H2S C.PCl3 D.SiCl4 2.下列分子的立体结构,其中属于直线型 分子的是 ( BC ) A.H2O B.CO2 C.C2H2 D.P4
总结:由于分子中的成键电子 CO 对及中心原子上的孤对电子 2 180° 对相互排斥,结果趋向尽可 120° CH O 3 能彼此远离,以减小斥力, 109°28′ CH 4 从而影响了分子的空间构型
2 2 4
中心原子结合的 原子数(n值)键角分子的空间构 型:
H :O:H
H : N :H H
:
直线形 平面三角形 正四面体
原因: AB 立体结构 范例 n 中心原子上的孤对电子也要占据中心原子周围的 空间,并参与互相排斥。例如, H2O和NHH n=2 V形 3的中心原 2O 子分别有2对和l对孤对电子,跟中心原子周围的σ键 加起来都是4,它们相互排斥,形成四面体,因而 3 H2O分子呈V形,NH3分子呈三角锥形。
n=3
