化学物质的量知识点
高中化学必修一1.2物质的量-知识点
小初高个性化辅导,助你提升学习力! 1 高中化学必修一1.2物质的量-知识点
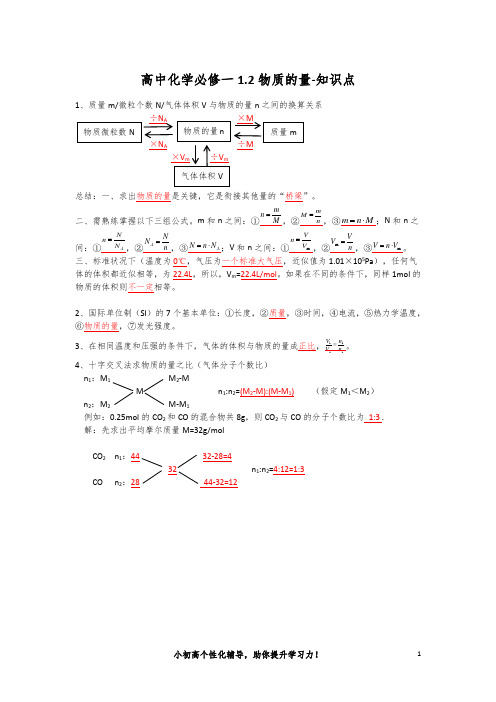
1、质量m/微粒个数N/气体体积V 与物质的量n 之间的换算关系
×N A ÷M
总结:一、求出物质的量是关键,它是衔接其他量的“桥梁”。
二、需熟练掌握以下三组公式。
m 和n 之间:①
M m n =,②n m M =,③M n m ⋅=;N 和n 之间:①A N N n =,②n N N A =,③A N n N ⋅=;V 和n 之间:①m V V n =,②n V V =m ,③m V n V ⋅=。
三、标准状况下(温度为0℃,气压为一个标准大气压,近似值为1.01×105Pa ),任何气体的体积都近似相等,为22.4L ,所以,V m =22.4L/mol 。
如果在不同的条件下,同样1mol 的物质的体积则不一定相等。
2、国际单位制(SI )的7个基本单位:①长度,②质量,③时间,④电流,⑤热力学温度,⑥物质的量,⑦发光强度。
3、在相同温度和压强的条件下,气体的体积与物质的量成正比,21
21n n V V =。
4、十字交叉法求物质的量之比(气体分子个数比)
n 1:M 1 M 2-M
M n 1:n 2=(M 2-M):(M-M 1) (假定M 1<M 2)
n 2:M 2 M-M 1
例如:0.25mol 的CO 2和CO 的混合物共8g ,则CO 2与CO 的分子个数比为 1:3 .
解:先求出平均摩尔质量M=32g/mol
CO 2 n 1 32-28=4
n 1:n 2=4:12=1:3
CO n 2:28 44-32=12。
高一化学物质的量知识点

高一化学物质的量知识点一、化学物质的量的概念化学物质的量是用来表示物质数量的物理量,通常用摩尔(mol)来表示。
化学物质的量与物质的质量之间存在着一定的关系,化学物质的量的单位摩尔是国际通用的。
二、摩尔质量摩尔质量是指一个物质中含有的质量与该物质的摩尔数之间的比值。
摩尔质量的单位为克/摩尔(g/mol)。
计算摩尔质量的方法是将该物质的相对原子质量(或相对分子质量)的数值与单位g/mol相乘。
三、摩尔体积摩尔体积是指在一定条件下(通常是常温常压下),一个物质的摩尔数所占据的体积。
摩尔体积的单位为升/摩尔(L/mol)。
四、摩尔浓度摩尔浓度是指溶液中溶质的摩尔数与溶液体积的比值。
摩尔浓度的单位为摩尔/升(mol/L)。
计算摩尔浓度的方法是将溶质的摩尔数除以溶液的体积。
五、摩尔分数摩尔分数是指在混合物中,某一组分的摩尔数与所有组分的摩尔数之比。
摩尔分数没有单位,通常用小数表示。
计算摩尔分数的方法是将某一组分的摩尔数除以所有组分的摩尔数之和。
六、化学方程式中的物质的量关系在化学方程式中,各个物质之间的摩尔比可以根据化学方程式的系数得到。
化学方程式中的系数表示各个物质的物质的量比例。
七、气体的物质的量与体积的关系根据理想气体状态方程PV=nRT(P为压强,V为体积,n为物质的量,R为气体常数,T为温度),在一定条件下,气体的物质的量与体积成正比。
当温度和压强一定时,气体的物质的量增加,体积也会增加。
八、物质的量在化学反应中的应用化学反应中,反应物与生成物之间的物质的量是按照化学方程式的摩尔比关系进行反应的。
根据化学方程式中的系数,可以计算出反应物与生成物的物质的量之间的关系,从而进行计量。
九、摩尔计算在化学实验和计算中,常常需要根据物质的质量、体积或摩尔浓度等信息计算出物质的物质的量。
根据摩尔质量、摩尔体积、摩尔浓度等的定义和计算方法,可以进行摩尔计算。
总结:化学物质的量是用来表示物质数量的物理量,摩尔是化学物质的量的单位。
高三化学物质的量知识点

高三化学物质的量知识点化学是自然科学的一个重要分支,研究物质的性质、组成以及变化规律等。
其中,物质的量是化学中一个重要的概念。
本文将介绍一些高三化学中关于物质的量的知识点。
1. 物质的量的概念物质的量是描述物质数量的一个基本概念,用符号n表示,单位是摩尔(mol)。
一个摩尔的物质的量等于该物质中包含的粒子(原子、离子、分子等)的数量,其中包含的粒子数量被称为阿伏伽德罗常数,约为6.022×10²³。
2. 摩尔质量摩尔质量是指一个物质摩尔的质量,用符号M表示,单位是克/摩尔(g/mol)。
摩尔质量可以通过原子质量或分子质量进行计算。
原子质量是一个元素原子质量的摩尔质量,分子质量是一个分子的摩尔质量。
3. 摩尔体积摩尔体积是指一个物质摩尔的体积,用符号V表示,单位是升/摩尔(L/mol)。
摩尔体积可以通过气体的体积和气体的物质的量来计算。
在标准状况下,一个摩尔的任何气体的体积约为22.4升。
4. 摩尔比摩尔比是指不同物质摩尔的比值。
它可以表示化学方程式中物质的量的比例关系。
例如,对于化学方程式2H₂+ O₂→ 2H₂O,它表示了氢气和氧气的摩尔比为2:1。
5. 反应物的量和生成物的量的关系在化学反应中,反应物的量和生成物的量之间存在一定的关系。
这种关系可以通过化学方程式和摩尔比来推导和计算。
根据化学方程式中的摩尔比,可以确定反应物和生成物的物质的量之间的关系。
6. 摩尔浓度摩尔浓度是指溶液中溶质的物质的量与溶液的体积之比,用符号C表示,单位是摩尔/升(mol/L)。
摩尔浓度可以通过溶质的物质的量和溶液的体积来计算。
它是描述溶液浓度的重要参数。
7. 摩尔反应热摩尔反应热是指在化学反应中单位摩尔反应物转化为产物时释放或吸收的能量,用符号ΔH表示,单位是焦耳/摩尔(J/mol)。
摩尔反应热可以通过实验测量得到,它反映了化学反应的放热或吸热性质。
总结:通过对高三化学物质的量知识点的介绍,我们了解到物质的量是描述物质数量的重要概念,摩尔质量、摩尔体积、摩尔比、摩尔浓度和摩尔反应热等是与物质的量相关的重要参数。
物质的量知识点总结

物质的量知识点总结在咱们学习化学的过程中啊,“物质的量”这个概念就像是一把神奇的钥匙,能帮咱们打开很多化学世界的秘密大门。
今天咱们就来好好唠唠这“物质的量”。
先来说说啥是物质的量。
想象一下,咱们去超市买鸡蛋,不会说“我要几个几个原子的鸡蛋”,而是说“我要几斤鸡蛋”。
在化学里,物质的量就相当于“几斤”这样的表述,用来衡量微观粒子的多少。
物质的量的单位是摩尔(mol)。
一摩尔任何粒子所含的粒子数都约等于 602×10²³个,这个数就叫阿伏加德罗常数。
比如说,1mol 氧气分子,就含有约 602×10²³个氧气分子。
再说说为啥要有物质的量这个概念。
我记得有一次在实验室做实验,老师让我们配置一定浓度的溶液。
如果没有物质的量,我们就得一个一个地去数原子或者分子,那得数到啥时候啊!有了物质的量,我们就能轻松地计算出需要多少溶质,方便又准确。
物质的量(n)、粒子数(N)和阿伏加德罗常数(NA)之间有这样的关系:n = N/NA。
打个比方,假如你知道有一堆苹果,总共有100 个(这就是粒子数 N),而一个袋子能装 10 个苹果(这相当于阿伏加德罗常数 NA),那需要几个袋子(这就是物质的量 n)呢?很明显,100÷10 = 10,所以需要 10 个袋子。
物质的量还和质量(m)有关系。
通过摩尔质量(M),它们之间的关系是 n = m/M。
摩尔质量在数值上等于该粒子的相对原子质量或者相对分子质量,单位是 g/mol。
比如说,氧气(O₂)的相对分子质量是 32,那氧气的摩尔质量就是 32g/mol。
如果有 32g 氧气,那物质的量就是 32÷32 = 1mol。
还有气体摩尔体积,这也是个重要的知识点。
在标准状况下(0℃,101kPa),1mol 任何气体所占的体积都约为 224L。
这就好比一堆同样大小的气球,每个气球里装的气体分子数量相同,那么总体积也就固定啦。
化学总结物质的量知识点

化学总结物质的量知识点一、物质的量的基本概念1.1 物质的量的概念物质的量是描述物质数量的物理量,用符号n表示,其单位是摩尔(mol)。
1摩尔物质的数量等于6.022×10^23个粒子,这个数值被称为阿伏伽德罗常数,记作N_A,通常用来表示粒子的数量。
1.2 摩尔质量摩尔质量是1摩尔物质的质量,记作M。
对于元素来说,它等于该元素的相对原子质量;对于化合物来说,它等于化合物的相对分子质量。
1.3 摩尔体积摩尔体积是1摩尔气体在标准状态下的体积,记作V_M。
对于理想气体来说,其摩尔体积为22.4升/mol。
1.4 摩尔浓度摩尔浓度是指溶液中物质的摩尔数与溶液体积的比值,记作c,单位是mol/L。
二、物质的量的表示2.1 物质的量的计算物质的量与粒子数、质量和体积之间有一定的关系,可以通过以下公式进行计算:n = N/N_An = M/Mn = V/V_M其中,n表示物质的量,N表示粒子数,M表示质量,V表示体积,N_A表示阿伏伽德罗常数,V_M表示摩尔体积。
2.2 物质的量在化学方程式中的应用在化学方程式中,反应物和生成物的物质的量比例是通过平衡系数来表示的,这种比例关系称为摩尔比。
根据平衡系数,可以确定反应物和生成物之间的摩尔比,方便计算物质的量的变化。
2.3 用摩尔表示物质的量在进行计算时,通常使用摩尔来表示物质的量,这样可以简化计算过程,方便进行化学反应和物质变化的研究。
三、摩尔计算3.1 摩尔质量的计算摩尔质量可以通过元素或化合物的化学式中各元素的相对原子质量进行计算,然后将各元素的相对原子质量相加即可得到。
3.2 摩尔浓度的计算摩尔浓度可以通过溶液中物质的摩尔数和溶液的体积进行计算,根据摩尔浓度的定义公式进行计算即可。
3.3 摩尔体积的计算摩尔体积可以通过理想气体定律及标准状态下的体积得到,根据摩尔体积的定义公式进行计算即可。
3.4 反应物的量与生成物的量的计算通过化学方程式中的平衡系数,可以确定反应物和生成物之间的摩尔比,从而可以计算出反应物的量和生成物的量。
高考化学物质的量相关计算公式知识点

高考化学物质的量相关计算公式知识点物质的量相关计算公式1.物质的量=微粒数/阿伏伽德罗常数(n=N/NA)2.物质的量=物质的质量/物质的摩尔质量(n=m/M)3.物质的量=气体的体积/气体的摩尔体积(n=V/Vm)4.c=1000mL/Lρ(密度) w / M5:物质的量(mol)=物质的质量(g)/物质的摩尔质量(g/mol)6.c(浓溶液)·V(浓溶液)=c(稀溶液)·V(稀溶液) 用浓溶液配制稀溶液时使用在稀释溶液时,溶液的体积发生了变化,但溶液中溶质的物质的量不变,即在溶液稀释前后,溶液的物质的量相等。
7.c混·V混=c1·V1+c2·V2+……+cn·Vn(有多少种溶液混合n就为几)8.同温同压时 V1/V2=n1/n2=N1/N2 正比同温同体积 P1/P2=N1/N2=n1/n2 正比同压同物质的量 V1/V2=T1/T2 正比同温同物质的量 V1/V2=P2/P1 反比同体积同物质的量 P1/P2=T1/T2 正比同温同压同体积 m1/m2=Mr1/Mr2=M1/M2 正比同温同压同质量 V1/V2=p1/p2=M2/M1 反比同温同体积同质量 p1/p2=Mr1/Mr2=M2/M1 反比同温同压密度1/密度2=Mr1/Mr2=M1/M2 正比9.n、V、Vm、N、NA、m、M、c的关系n=m/M=N/NA=V/Vm=cVPS:V----体积 p------压强T-----温度 n ------物质的量N ----分子数 Mr----相对分子质量M------摩尔质量 m-----质量c------物质的量浓度9.关于物质的量浓度与质量分数的转化(推导和演化)C=ρ·ω·1000/M其中,C:物质的量浓度(单位mol/L)ω:溶液的密度,(形式为质量分数,1) ρ:密度,(单位g/mL)M:物质的摩尔质量,(单位g/mol)c=n/Vn(溶质的物质的量)=ωxm(溶液质量)/Mm(溶液质量)=ρ· Vm(溶液溶质的质量)=ω(质量分数)·ρ(密度)·V故,n(溶质的物质的量)=ω·ρ·V / Mc= n/V=(ω·ρ· V /M) / V=ω·ρ· V /M V=ω·ρ/M若密度ρ单位为1000kg/m^3(国际单位)=1 g/cm^3.有关溶液稀释和浓缩的计算V1ρ1×ω1= V2ρ2×ω2 (溶质的质量守恒)C1V1=C2V2 (溶质的物质的量守恒)有关两种不同浓度溶液混合的计算C3V3 =C1V1+C2V2 (混合前后溶质的物质的量总和不变)高中化学必备知识点有哪些“元素化合物”知识模块1.碱金属元素原子半径越大,熔点越高,单质的活泼性越大错误,熔点随着原子半径增大而递减2.硫与白磷皆易溶于二硫化碳、四氯化碳等有机溶剂,有机酸则较难溶于水3.在硫酸铜饱和溶液中加入足量浓硫酸产生蓝色固体正确,浓硫酸吸水后有胆矾析出4.能与冷水反应放出气体单质的只有是活泼的金属单质或活泼的非金属单质错误,比如2Na2O2+2H2O→O2↑+4NaOH5.将空气液化,然后逐渐升温,先制得氧气,余下氮气错误,N2的沸点低于O2,会先得到N2,留下液氧6.把生铁冶炼成碳素钢要解决的主要问题是除去生铁中除Fe以外各种元素,把生铁提纯错误,是降低生铁中C的百分比而不是提纯7.虽然自然界含钾的物质均易溶于水,但土壤中K%不高,故需施钾肥满足植物生长需要错误,自然界钾元素含量不低,但以复杂硅酸盐形式存在难溶于水8.制取漂白粉、配制波尔多液以及改良酸性土壤时,都要用到熟石灰正确,制取漂白粉为熟石灰和Cl2反应,波尔多液为熟石灰和硫酸铜的混合物9.二氧化硅是酸性氧化物,它不溶于酸溶液错误,SiO2能溶于氢氟酸10.铁屑溶于过量盐酸,再加入氯水或溴水或碘水或硝酸锌,皆会产生Fe3+错误,加入碘水会得到FeI2,因为Fe3+的氧化性虽然不如Cl2,Br2,但是强于I2,在溶液中FeI3是不存在的11.常温下,浓硝酸可以用铝罐贮存,说明铝与浓硝酸不反应错误,钝化是化学性质,实质上是生成了致密的Al2O3氧化膜保护着铝罐12.NaAlO2、Na2SiO3、Na2CO3、Ca(ClO)2、NaOH、C17H35COONa、C6H5ONa 等饱和溶液中通入CO2出现白色沉淀,继续通入CO2至过量,白色沉淀仍不消失错误,Ca(ClO)2中继续通入CO2至过量,白色沉淀消失,最后得到的是Ca(HCO3)213.大气中大量二氧化硫****于煤和石油的燃烧以及金属矿石的冶炼正确14.某澄清溶液由NH4Cl、AgNO3、NaOH三种物质混合而成,若加入足量硝酸必产生白色沉淀正确,NH4Cl、AgNO3、NaOH混合后发生反应生成[Ag(NH3)2]+加入足量硝酸后生成AgCl和NH4NO315.为了充分利用原料,硫酸工业中的尾气必须经净化、回收处理错误,是为了防止大气污染16.用1molAl与足量NaOH溶液反应,共有3mol电子发生转移正确17.硫化钠既不能与烧碱溶液反应,也不能与氢硫酸反应错误,硫化钠可以和氢硫酸反应: Na2S+H2S=2NaHS18.在含有较高浓度的Fe3+的溶液中,SCN-、I-、AlO-、S2-、CO32-、HCO3-等不能大量共存正确,Fe3+可以于SCN-配合,与I-和S2-发生氧化还原反应,与CO32-,HCO3-和AlO2-发生双水解反应19.活性炭、二氧化硫、氯水等都能使品红褪色,但反应本质有所不同正确,活性炭是吸附品红,为物理变化,SO2是生成不稳定的化合物且可逆,氯水是发生氧化还原反应且不可逆20.乙酸乙酯、三溴苯酚、乙酸钠、液溴、玻璃、重晶石、重钙等都能与烧碱反应错误,重晶石(主要成分BaSO4)不与烧碱反应21.在FeBr2溶液中通入一定量Cl2可得FeBr3、FeCl2、Br2错误,Fe2+和Br2不共存22.由于Fe3+和S2-可以发生氧化还原反应,所以Fe2S3不存在错误,在PH=4左右的Fe3+溶液中加入Na2S可得到Fe2S3,溶度积极小23.在次氯酸钠溶液中通入少量二氧化硫可得亚硫酸钠与次氯酸错误,次氯酸可以氧化亚硫酸钠,会得到NaCl和H2SO424.有5.6g铁与足量酸反应转移电子数目为0.2NA错误,如果和硝酸等强氧化性酸反应转移0.3NA25.含有最高价元素的化合物不一定具有强氧化性正确,如较稀的HClO4,H2SO4等26.单质的还原性越弱,则其阳离子的氧化性越强错误,比如Cu的还原性弱于铁的,而Cu2+的氧化性同样弱于Fe3+27.CuCO3可由Cu2+溶液中加入CO32-制得错误,无法制的纯净的CuCO3,Cu2+溶液中加入CO32-会马上有Cu2(OH)2CO3生成28.单质X能从盐的溶液中置换出单质Y,则单质X与Y的物质属性可以是:(1)金属和金属;(2)非金属和非金属;(3)金属和非金属;(4)非金属和金属;错误,(4)非金属和金属不可能发生这个反应29.H2S、HI、FeCl2、浓H2SO4、Na2SO3、苯酚等溶液在空气中久置因发生氧化还原反应而变质错误,H2SO4是因为吸水且放出SO3而变质30.浓硝酸、浓硫酸在常温下都能与铜、铁等发生反应错误,浓硫酸常温与铜不反应"基本概念基础理论"知识模块1.与水反应可生成酸的氧化物都是酸性氧化物错误,是"只生成酸的氧化物"才能定义为酸性氧化物2.分子中键能越大,分子化学性质越稳定。
中考化学物质的量知识点汇总
中考化学物质的量知识点汇总在中考化学中,物质的量是一个非常重要的概念,它将微观粒子的数量与宏观可测量的物理量联系起来,为化学计算和定量分析提供了有力的工具。
下面我们就来详细汇总一下这部分的知识点。
一、物质的量的定义物质的量是表示含有一定数目粒子的集合体的物理量,符号为“n”。
它的单位是摩尔(mol)。
我们可以这样来理解,物质的量就好比是一个“大箱子”,把一定数目的微观粒子装在一起,这个“大箱子”就是物质的量。
二、阿伏加德罗常数1 摩尔任何粒子所含的粒子数均为阿伏加德罗常数个,通常用符号“NA”表示,其数值约为 602×10²³。
打个比方,如果把 602×10²³个乒乓球堆在一起,这一堆乒乓球的“物质的量”就是 1 摩尔。
三、物质的量(n)、阿伏加德罗常数(NA)与粒子数(N)的关系它们三者之间的关系可以用公式表示:n = N / NA这就好比,如果知道了一堆粒子的总数(N),又知道 1 摩尔粒子的个数(NA),那么就能算出这堆粒子的物质的量(n)。
例如,有 1204×10²⁴个氧原子,那么氧原子的物质的量就是:n = 1204×10²⁴÷ 602×10²³= 2 mol四、摩尔质量1、定义:单位物质的量的物质所具有的质量叫做摩尔质量,符号为“M”,单位是 g/mol。
2、数值:以 g/mol 为单位时,摩尔质量在数值上等于该粒子的相对原子质量或相对分子质量。
比如,氧气(O₂)的相对分子质量约为 32,那么氧气的摩尔质量就是 32 g/mol 。
3、物质的量(n)、质量(m)和摩尔质量(M)的关系公式:n = m / M假如我们知道了一种物质的质量(m)和它的摩尔质量(M),就能算出这种物质的物质的量(n)。
例如,有 16 g 氧气,氧气的摩尔质量是 32 g/mol ,那么氧气的物质的量为:n = 16 g ÷ 32 g/mol = 05 mol五、气体摩尔体积1、定义:单位物质的量的气体所占的体积叫做气体摩尔体积,符号为“Vm”,单位是 L/mol 。
物质的量必考知识点总结
物质的量必考知识点总结1.物质的量的定义物质的量是一个宏观的物理量,表示物质中包含的粒子数目。
在国际单位制中,物质的量的单位是摩尔(mol),1摩尔物质包含约6.02x10^23个粒子,这个数值被称为阿伏伽德罗常数。
摩尔是一个基本单位,可以用来表示任何一种物质的量。
2.摩尔质量摩尔质量是物质的质量与其摩尔数的比值。
它的单位是克/摩尔(g/mol)。
摩尔质量可以通过元素的相对原子质量或者分子的相对分子质量来计算。
例如,氧气(O2)的摩尔质量为32g/mol,这个数值表示在摩尔的单位下,氧气分子的质量是32克。
3.物质的量与质量的转换物质的量和质量是两种不同的物理量,它们之间的转换可以通过摩尔质量来实现。
按照定义,1摩尔物质的质量等于该物质的摩尔质量。
因此,我们可以用下面的公式来计算物质的量和质量之间的关系:n = m/M其中,n表示摩尔数,m表示质量,M表示摩尔质量。
这个公式可以用来在物质的质量和摩尔数之间进行转换。
4.物质的量与体积的关系对于气体来说,物质的量和体积之间存在一定的关系。
在相同的条件下,相同物质的物质的量与体积成正比。
这个关系可以用下面的公式表示:V = n*VT其中,V表示体积,n表示摩尔数,V表示摩尔的体积,T表示温度。
这个公式也被称为理想气体方程。
5.摩尔浓度摩尔浓度是溶液中溶质的摩尔数与溶液体积的比值。
它的单位是摩尔/升(mol/L)。
摩尔浓度可以用来表示溶液中的物质的量。
我们可以通过摩尔浓度来计算溶液中溶质的质量。
摩尔浓度是溶液中溶质的浓度大小的一个重要标志。
6.物质的量与化学反应在化学反应中,物质的量是一个重要的参数。
化学反应通常是以物质的量来进行计量的。
反应物的物质的量与产物的物质的量之间存在一定的关系,这个关系可以通过化学平衡方程式来表示。
在化学方程中,物质的数量是平衡反应的基础,可以用来计算反应物和产物的量比。
以上就是有关物质的量的一些必考知识点的总结。
物质的量是化学学科的一个基本概念,它涉及到化学计量和化学反应的许多重要概念和计算。
化学物质的量知识点总结
化学物质的量知识点总结化学,即使是考试也只占一小部分。
但无论如何,我们都应该学好它。
下面是关于化学物质的量知识点总结,希望可以帮助大家!1、质量守恒定律(mass conservation law):在化学反应中,反应前后原子的种类和数目没有改变,原子的质量也没有改变。
2、溶液中的离子:在溶液中,带电的微粒(如离子)不仅原来所带的电荷数目不变,而且还带着等量的其他正负电荷。
3、物质的量:物质的量用符号Q表示,单位是摩尔,简称摩,符号是mol。
物质的量浓度等于物质的量的浓度乘以物质的量。
浓度是物质的量的单位。
4、摩尔质量:物质的质量以克为单位时,物质的摩尔质量为M=ρQ/n,其中:ρ是物质的密度; m是物质的质量; n是阿佛加德罗常数; Q是物质的量。
一摩尔任何物质所含微粒数的多少,叫做该物质的摩尔数。
所含微粒数与摩尔质量的乘积叫做这种物质的摩尔质量。
5、阿伏伽德罗常数:一摩尔任何物质所含微粒的物质的量n,与这种物质所带的电荷量q的比值叫做这种物质的阿伏伽德罗常数。
它是一个常数,通常用下面的近似式表示: s=c/n6、酸碱度:能在水溶液中电离出的阳离子全部是氢离子的化合物叫做酸;全部是氢氧根离子的化合物叫做碱。
7、酸碱指示剂:在溶液中能显示出酸碱性质的物质。
如食醋里含有氢离子,在紫色石蕊试液中就显红色。
8、酸碱中和反应:一种酸(或碱)和一种盐(或碱)中和生成另一种盐(或碱),而使酸碱质量都减少的反应。
酸碱中和反应的化学方程式为:H2SO4+NaOH=H2NaCl+H2O。
中和反应前后,各元素的原子的种类和个数没有发生改变,只是原子的结合方式和核电荷数改变了。
在反应前后,同种元素的原子由于电子的得失,在数目上有增有减。
9、 pH:溶液中氢离子活度的负对数。
如1份碳酸钠溶液中含有1个氢离子,因此pH=1。
10、离子反应:凡是两种离子参加的反应叫做离子反应。
离子反应必须具备的三个条件是:反应物中必须有离子,离子必须参加反应,生成物中必须有离子。
物质的量知识点总结
物质的量知识点总结在化学的世界里,“物质的量”是一个极其重要的概念,它就像一座桥梁,将微观的粒子世界与宏观的可测量世界紧密地连接起来。
下面就让我们一起深入了解一下物质的量的相关知识。
一、物质的量的定义物质的量是表示含有一定数目粒子的集合体的物理量。
简单来说,它是把微观粒子,如原子、分子、离子等,与可称量的物质联系起来的一个桥梁。
我们用符号“n”来表示物质的量。
二、单位——摩尔(mol)摩尔是物质的量的单位,就像长度的单位是米、质量的单位是千克一样。
1 摩尔任何粒子所含的粒子数与 0012 kg 碳 12 中所含的碳原子数相同,这个数被称为阿伏伽德罗常数,约为 602×10²³。
三、阿伏伽德罗常数阿伏伽德罗常数是一个非常重要的数值,它的符号是Nₐ,通常取值约 602×10²³ mol⁻¹。
这意味着 1 摩尔任何物质所含的粒子数都是约602×10²³个。
例如,1 摩尔氧气分子(O₂)中约含有 602×10²³个氧气分子;1 摩尔钠离子(Na⁺)中约含有 602×10²³个钠离子。
四、物质的量(n)、粒子数(N)与阿伏伽德罗常数(Nₐ)的关系它们三者之间的关系可以用一个公式来表示:n = N /Nₐ 。
也就是说,如果我们知道了某种物质的粒子数 N 和阿伏伽德罗常数Nₐ,就可以计算出这种物质的物质的量 n ;反之,如果知道了物质的量 n 和阿伏伽德罗常数Nₐ,也能算出粒子数 N 。
五、物质的量与质量的关系物质的量(n)、质量(m)和摩尔质量(M)之间存在着这样的关系:n = m / M 。
摩尔质量是指单位物质的量的物质所具有的质量,单位是 g/mol 。
例如,氧气(O₂)的摩尔质量约为 32 g/mol ,这意味着 1 摩尔氧气的质量约为 32 克。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
化学物质的量知识点
化学物质的量知识点
物质的量是化学的一大难点,这属于化学计算的一大重点,这块的知识新概念多,公式多,计算多。
下面我给你分享,欢迎阅读。
一、基本概念
1.物质的量:物质的量是表示物质所含微粒数多少的物理量。
符号:n;单位:mol。
2.摩尔:摩尔是物质的量的单位,每摩尔物质含有阿伏加德罗常数个粒子。
【注意】:在理解概念时,不能按字面理解成物质的质量或物质的数量是多少,它是一个专用名词,而简称摩,符号为mol。
“物质的量”仅由于构成物质的微粒种类很多,用“物质的量”来表示物质时,必须指明微粒的名称,如1mol氢原子、1mol氢分子、1mol氢离子,也可用化学式表示为lmolH、l mol H2、1 mol
H+等。
此外,“物质的量”还可用来表示某些结构微粒的特定组合,如由Na+与Cl-按1:l特定组合构成的NaCI晶体,可表示为1molNaCl。
3、阿伏加德罗常数:12g 12C中所含碳原子数为阿伏加德罗常数其近似值为6.02×1023。
符号:NA;单位:mol—
【思考】阿伏加德罗常数NA与6.02×1023完全相同吗?
答案:不相同;原因是NA是指1 mol 任何粒子的粒子数,即12 g12C 中含有的原子数,是一个真实值,而6.02×1023是一个实验值,是阿伏加德罗常数的近似值。
【说明】:阿伏加德罗常数和原子量标准均为人为规定的,如果它们发生改变,则原子量、分子量、摩尔质量、气体摩尔体积、物质的量浓度等均发生改变;但是,质量、微粒数目、密度、体积等客观因素却不会改变。
【讨论】:假设以24克12C所含有的碳原子数为阿伏加德罗常数。
下列数据肯定不变的是:
①氧气的溶解度②44克CO2的体积③气体摩尔体积④摩尔质量⑤相对分子质量⑥阿伏加德罗常数⑦物质的量⑧气体的密度⑨物质的量浓度⑩质量分数
答案:①、②、⑤、⑧、⑩。
4.摩尔质量:单位物质的量的物质具有的质量叫做该物质的摩尔质量。
符号:M;单位:g/mol
5.气体摩尔体积:在一定条件下,单位物质的量的气体所占的体积叫做气体摩尔体积。
符号:Vm;单位:L/mol。
①标准状况下的气体摩尔体积:22.4L/mol。
②决定物质体积的因素:粒子数目、粒子大小、粒子间距。
【思考】标准状况下,1 mol气体的体积是22.4 L,如果当1 mol气体的体积是22.4 L时,一定是标准状况吗?
答案:不一定;因气体的体积与温度、压强和气体的分子数有关,标准状况下,22.4 L气体的物质的量为1 mol。
6.物质的量浓度:
以单位体积的溶液中所含溶质B的物质的量来表示的溶液的浓度叫做溶质B的物质的量浓度。
符号:cB;单位:mol·L-。
【注意】:
①要用溶液的体积,单位是升,而不是溶剂的体积。
②溶质一定要用“物质的量”来表示。
如给出的已知条件是溶质的质量或气体的体积标准状况下或微粒数,应根据有关公式换算为“物质的量”。
③带有结晶水的物质作为溶质时,其“物质的量”的计算,用带有结晶水物质的质量除以带有结晶水物质的摩尔质量即可。
④同一溶液,无论取出多大体积,其各种浓度物质的量浓度、溶质的质量分数、离子浓度均不变。
二、基本关系
1.物质的量与离子数目:
2.物质的量与质量:
3.物质的量与气体体积:
4.物质的量浓度:
5.混合气体的平均式量:
6.气体密度与式量:M=p×Vm 注意:密度的单位为g·L-1,多用于标
准状况下的计算。
三、基本规律
1.摩尔质量与式量关系规律:
1摩尔任何物质的质量都是以克为单位,在数值上等于其式量。
2.阿伏加德罗定律:
1定律:在相同的温度和压强下,相同体积任何气体都含有相同数目的分子。
【注意】:①使用范围:气体;②使用条件:相同的温度和压强。
2重要推论:
①同温同压下,任何气体的体积之比都等于物质的量之比。
②同温同容下,任何气体的压强之比等于物质的量之比。
③同温同压下,气体的密度之比等于其式量之比。
3.物质反应的计算规律:
①参加反应的各物质的物质的量之比等于其在化学方程式中计量系数之比。
②在同温同压下,参加反应的气体的体积之比等于其在化学方程式中计量系数之比。
化学物质的量练习题
1.下列叙述中,正确的是
A.12g碳所含的原子数就是阿伏加德罗常数
B.阿伏加德罗常数没有单位
C.“物质的量”指物质的质量
D.摩尔是表示物质的量的单位,每摩尔物质含有阿伏加德罗常数个微粒
2.下列说法正确的是
A.1 molH2的质量是1 g
B.1 mol HCl的质量是36.5 g·mol-1
C.Cl2的摩尔质量等于它的相对分子质量
D.硫酸根离子的摩尔质量是96 g·mol-1
3.下列说法错误的是
A.1 mol 氢
B.1 mol O?
C.1 mol 二氧化碳
D.1 mol水
4.下列各组物质中,含原子数最多的是
A.0.4 mol NH3
B.4℃时5.4 mL水
C.10 g氖气
D.6.02×1023个硫酸分子
5.铅笔芯的主要成分是石墨和黏土,这些物质按照不同的比例加以混和、压制,就可以制成铅笔芯。
如果铅笔芯质量的一半成分是石墨,且用铅笔写一个字消耗的质量约为1mg。
那么一个铅笔字含有的碳原子数约为
A.2.5×1019个
B.2.5×1022个
C.5×1019个
D. 5×1022个
6.下列说法错误的是
A.6.02×1023是阿伏加德罗常数的近似值
B.1 mol 12C的质量是12 g
C.含有阿伏加德罗常数个粒子的物质就是1 mol
D.1 mol O2含有
6.02×1023个氧原子
7.下列物质里含氢原子数最多的是
A.1 mol H2
B.0.5molNH3
C.6.02×1023个的CH4分子
D.0.3molH3PO4
8.0.1 mol NaHCO3中含有 ?
A.0.2 mol Na+
B.0.05 mol CO
C.6.02×1023个 O
D.0.1 mol H
9.1g O2和1g O3相比,下列表述正确的是
A.所含分子数相同
B. 所含原子数相同
C.所含原子数不同
D.1g O3中所含分子数较多
10. 2.16 g X2O5中含有0.1 molO,则X的相对原子质量为
A.21.6
B.28
C.14
D.31
11.某气体物质质量为 g,含有6.02×1022个分子,则该气体的相对分子质量为
A. 64
B. 32
C.96
D.32
12.如果1g水中含有n个氢原子,则阿伏加德罗常数是
A.1/n mol-1
B.9n mol-1
C.2n mol-1
D.n mol-1。
