新人教版九年级化学下册_酸和碱的中和反应ppt课件
合集下载
人教版九年级化学课件: 10.2酸和碱的中和反应 (共14张PPT)
谈谈本节课的收获。
作用与用途: 具有制酸、收敛与促进
溃疡愈合的作用。适用于胃溃疡、十二 指肠溃疡、急慢性胃炎、胃酸过多、胃 痉挛所致的胃痛。
3HCl+Al(OH)3====AlCl3+3H2O
二、中和反应在实际中的运用
3.农业上:改良土壤的酸碱性
二、中和反应在实际中的运用
4.工业上: 处理工厂的废水
处理硫酸厂生产中形成的含硫酸的污水。
课堂练习
2、下列反应,要借助酸碱指示剂,才能判断二者发生
反应的是( B )
A、大理石和稀盐酸
B、石灰水和稀盐酸
C、铁锈与稀盐酸
D、镁和稀硫酸
3、下列物质中,属于盐类的是(
A、Fe(OH)2 C、Na2CO3
B、Al2O3 D、H2SO4
C)
二、中和反应的运用
1.在实际生活中的运用
利用熟石灰加工的皮蛋
被蚊虫叮咬后,叮咬处很快会肿成大包, 这是因为蚊虫能在人的皮肤内分泌出蚁酸,从 而使皮肤肿痛。如果涂一些含有碱性肥皂可减 轻痛痒。
化学与生活
吃碱面时,放点醋,味道会更鲜美。
化学与生活
利用熟石灰加工 的皮蛋
二、中和反应在实际中的应用
2.医学上:中和胃酸,制成含碱性药水。
说明书 成份:氢氧化铝、碘甲基蛋氨酸、颠茄。
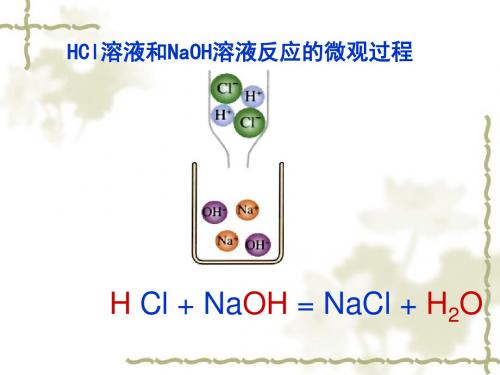
HCl溶液和NaOH溶液反应的微观过程
H Cl + NaOH = NaCl + H2O
HCl + NaOH == NaCl + H2O 2HCl + Ca(OH)2 == CaCl2 + 2H2O H2SO4 + 2NaOH == Na2SO4 + 2H2O H2SO4 + Ca(OH)2== CaSO4 + 2H2O
《酸和碱的中和反应》PPT课件

树”边放的是浓盐酸。
1、提出问题:酸和碱之间会发生 什么反应
2、猜想与假设:酸和碱之间能发生反应, 并有水生成
3、设计实验方案
4、进行实验探究 5、分析结果,得出结论
下面每小组自选药品和仪器,根据自己 的猜想,完成相关的实验。 稀硫酸 石 蕊试液 氢氧化钙容液 酚酞试液 稀 盐酸溶液 烧杯 玻璃杯
2.处理工业废水
酸性或碱性废水必须先进行 处理,达标后才可以排放, 否则会造成水体污染。
思考:化学实验产生的酸性或碱性废液能否直接倒入 下水道中?应如何处理?
新知学习 课堂小结 知能训练 上一页 下一页
3.用于医药卫生
中和蚊虫叮咬时“注 射”的蚁酸可以用含 碱性物质的溶液,如 肥皂水、稀氨水。
新知学习 课堂小结 知能训练 上一页 下一页
盐酸与氢氧化钾: HCl + KOH == KCl + H2O 盐酸与氢氧化钙: 2HCl + Ca(OH)2== CaCl2 + 2H2O 硫酸与氢氧化钾: H2SO4 + 2KOH == K2SO4 + 2H2O 硫酸与氢氧化钠: H2SO4 + 2NaOH == Na2SO4 + 2H2O
新知学习 课堂小结 知能训练 上一页 下一页
思考:熟石灰可以用来 改良酸性土壤,你知道 其中的原理是什么吗?
新知学习 课堂小结 知能训练 上一页 下一页二、中和反应在实际的应用1.改变土壤的酸碱性
利用中和反应原理,向土壤 中加入酸性或碱性物质,将 土壤pH控制在最适宜农作 物生长的范围之内。如撒熟 石灰中和酸性土壤。
新知学习 课堂小结 知能训练 上一页 下一页
胃酸过多导致胃部不适或疼痛时可口服碱性药物, 以降低胃酸的含量。如“胃舒平”(主要成分为 Al(OH)3)或小苏打片(主要成分是NaHCO3)
1、提出问题:酸和碱之间会发生 什么反应
2、猜想与假设:酸和碱之间能发生反应, 并有水生成
3、设计实验方案
4、进行实验探究 5、分析结果,得出结论
下面每小组自选药品和仪器,根据自己 的猜想,完成相关的实验。 稀硫酸 石 蕊试液 氢氧化钙容液 酚酞试液 稀 盐酸溶液 烧杯 玻璃杯
2.处理工业废水
酸性或碱性废水必须先进行 处理,达标后才可以排放, 否则会造成水体污染。
思考:化学实验产生的酸性或碱性废液能否直接倒入 下水道中?应如何处理?
新知学习 课堂小结 知能训练 上一页 下一页
3.用于医药卫生
中和蚊虫叮咬时“注 射”的蚁酸可以用含 碱性物质的溶液,如 肥皂水、稀氨水。
新知学习 课堂小结 知能训练 上一页 下一页
盐酸与氢氧化钾: HCl + KOH == KCl + H2O 盐酸与氢氧化钙: 2HCl + Ca(OH)2== CaCl2 + 2H2O 硫酸与氢氧化钾: H2SO4 + 2KOH == K2SO4 + 2H2O 硫酸与氢氧化钠: H2SO4 + 2NaOH == Na2SO4 + 2H2O
新知学习 课堂小结 知能训练 上一页 下一页
思考:熟石灰可以用来 改良酸性土壤,你知道 其中的原理是什么吗?
新知学习 课堂小结 知能训练 上一页 下一页二、中和反应在实际的应用1.改变土壤的酸碱性
利用中和反应原理,向土壤 中加入酸性或碱性物质,将 土壤pH控制在最适宜农作 物生长的范围之内。如撒熟 石灰中和酸性土壤。
新知学习 课堂小结 知能训练 上一页 下一页
胃酸过多导致胃部不适或疼痛时可口服碱性药物, 以降低胃酸的含量。如“胃舒平”(主要成分为 Al(OH)3)或小苏打片(主要成分是NaHCO3)
10.2 酸和碱的中和反应课件-九年级化学人教版下册

5.“用微观的眼光看世界”是我们学习化学的重要思想方法,回答下列问题: (1)稀硫酸和氢氧化钠溶液发生反应的微观过程如图所示。从微观角度分析该反应 能 发 生 的 原 因 是 酸 中 的 ____氢__离_子_______ 和 碱 中 的 _____氢__氧_根__离_子________ 结 合 生 成 了 ____水_分__子______,反应的化学方程式是__H__2S_O__4_+__2_N_a_O__H_=_=_=_N__a_2_S_O_4_+__2_H_2_O__。 (2) 为了准确控制反应的进度,可先向氢氧化钠溶液中加入几滴无色酚酞溶液,当 二者恰好完全反应时,溶液的颜色变化是_____由_红__色_变__成_无__色___________,此时溶液中的 溶质是___氢__氧_根__离_子______。
• 被黄蜂蜇到,毒液呈碱性,可涂食醋
思考讨论
探究—洗发剂和护发剂的酸碱性
健康的头发
受损伤的头发
学完本课你应该知道
酸 和 碱 的 中 和 反应 应用
中和反应:酸+碱 盐+水
改良酸性或碱性土壤应用
1.下列应用与中和反应原理无关的是( B )
A.服用含Al(OH)3的药物,治疗胃酸过多症 B.用稀硫酸除去铁钉表面的铁锈 C.用NaOH溶液洗涤石油产品中的残余硫酸 D.用熟石灰改良酸性土壤
二 中和反应在实际中的应用
• 1.改变土壤的酸碱性
熟石灰
H2SO4+ Ca(OH)2 = CaSO4 + 2H2O 改良时能否用NaOH? 碱性太强,价格太贵
思考与练习
• 2.处理工厂的废水
用熟石灰处理
• 2.处理工厂的废水
方法1:可用熟石灰 进行中和处理。 方法2:在废硫酸中加入 废铁(硫酸亚铁可用来 做动物的食品添加剂。)
人教版九年级化学下册 10.2 酸和碱的中和反应第1课时课件(共23张PPT)

❖(2)滴入石蕊溶液,若变红,说明过量; ❖(3)加入镁条,若有气泡冒出,43; Cl-
NaOH == Na+ + OH-
氢氧化钠(碱)和稀盐酸(酸)发生的反应
NaOH + HCl === NaCl + H2O
碱酸
盐? 氧化物
金属 酸根
离子 离子
1 、盐:由 金属离子 和 酸根离子 构成的化合物。
HCl + NaOH === NaCl + H2O
酸 + 碱 === 盐 + 水
2HCl + Ca(OH)2 === CaCl2 + 2H2O H2SO4 + 2NaOH === Na2SO4 +2H2O
2 、中和反应:酸和碱作用生成盐和水的反应。
反应实质:H+ + OH- == H2O
请思考?
❖ 回答: ❖酸: HCl、 HNO3、 H2SO4 ❖碱: KOH 、Ca(OH)2、 NH3 ·H2O ❖ 盐:CaCl2、BaSO4、Na2CO3、CaCO3
❖氧化物:SO2 、CuO
中考链接二
1.下列物质属于盐的是( C )
A. CuO B. Cu(OH)2 C. CuSO4 D. HCl 2.填写下表(类别按酸、碱、盐、氧化物填写)
酸性土壤
熟石灰
碱性土壤
碳酸
H2SO4+ Ca(OH)2 = CaSO4 + 2H2O 能否用NaOH? 碱性太强,价格太贵
❖2、处理工厂的废水
VS
含酸废水
熟石灰
玉米地的土壤由于工厂排出的废水而变酸 性,怎么办?
(碱性废水可用酸中和,酸性废水可用碱中和)
胃 乐
NaOH == Na+ + OH-
氢氧化钠(碱)和稀盐酸(酸)发生的反应
NaOH + HCl === NaCl + H2O
碱酸
盐? 氧化物
金属 酸根
离子 离子
1 、盐:由 金属离子 和 酸根离子 构成的化合物。
HCl + NaOH === NaCl + H2O
酸 + 碱 === 盐 + 水
2HCl + Ca(OH)2 === CaCl2 + 2H2O H2SO4 + 2NaOH === Na2SO4 +2H2O
2 、中和反应:酸和碱作用生成盐和水的反应。
反应实质:H+ + OH- == H2O
请思考?
❖ 回答: ❖酸: HCl、 HNO3、 H2SO4 ❖碱: KOH 、Ca(OH)2、 NH3 ·H2O ❖ 盐:CaCl2、BaSO4、Na2CO3、CaCO3
❖氧化物:SO2 、CuO
中考链接二
1.下列物质属于盐的是( C )
A. CuO B. Cu(OH)2 C. CuSO4 D. HCl 2.填写下表(类别按酸、碱、盐、氧化物填写)
酸性土壤
熟石灰
碱性土壤
碳酸
H2SO4+ Ca(OH)2 = CaSO4 + 2H2O 能否用NaOH? 碱性太强,价格太贵
❖2、处理工厂的废水
VS
含酸废水
熟石灰
玉米地的土壤由于工厂排出的废水而变酸 性,怎么办?
(碱性废水可用酸中和,酸性废水可用碱中和)
胃 乐
人教版九年级下册化学第十单元酸和碱 课题2 酸和碱的中和反应 课件(共17张PPT)

酸性
pH<7
中性
pH=7
碱性
pH>7
溶液的酸碱度与pH的关系
实验探究:
1、测定一定浓度的HCl溶液的pH 剪取一小片 pH试纸放 于点滴板上,用玻璃棒蘸取少量稀盐酸 溶液滴在pH试纸上,观察颜色变化,对照标准比 色卡,读出pH。
(测定一定浓度的NaOH溶液的pH 剪取一小片pH 试纸放于点滴板上,用玻璃棒蘸取少量稀盐酸溶液滴 在pH试纸上,观察颜色变化,对照标准比色卡,读出 pH。)
蓝色固体逐渐溶解,溶 液由无色变为蓝色
结论: 难溶性碱液能与酸反应(酸碱中和反应,酸可溶即可)
酸碱中和反应在生活中的用途
医药:治疗胃酸过多、消除蚊虫叮咬后的瘙痒
性质决定用途 工业:处理工厂废水
农业:改良酸(碱)性土壤 (熟石灰、氨水;碳酸水) 问:如何知道土壤的酸碱性?酸碱性强弱程度?
溶液的酸碱度——pH
2、往实验1中的稀盐酸溶液中加入一定量 水稀释,再用同样的操作进行pH测定,读 出pH。
(往实验1中的NaOH溶液中加入一定量 水稀释,再用同样的操作进行pH测定,读 出pH。)
溶液的酸碱度与pH的关系
结论:
酸溶液的浓度越小,酸性越弱,pH越大; 酸溶液的浓度越大,酸性越强,pH越小。
碱溶液的浓度越小,碱性越弱,pH越小; 碱溶液的浓度越大,碱性越强,pH越大。
课题2 酸和碱的中和反应
NaOH + H2SO4 = Na2SO4 + H2O Na+ + OH- + H+ + SO4- = Na+ + SO42- + H2O
酸碱中和的实质:
H+ + OH- = H2O
人教版九年级化学下册10.2酸和碱的中和反应 课件(共26张PPT)

方程式: 3HCl + Al(OH)3= AlCl3 + 3H2O 2HCl + Mg(OH)2= MgCl2 + 2H2O
展示 交流
中和蚁酸
课题2 酸和碱的中和反应
zxxkw
学科网 学 科网
可涂抹一些含有碱性物质(如氨水NH3·H2O和肥皂水)的 药水。
思考:可不可以用NaOH来中和胃酸、蚁酸?为什么? 答:不可以。因为NaOH的碱性太强,具有强的腐蚀性。
2、处理工厂的废水H2SO4 + Ca(OH)2=CaSO4 + 2H2O 3、医药(中和胃酸3HCl + Al(OH)3= AlCl3 + 3H2O )
制成含碱性物质的药水,防蚊虫叮咬
课题2 酸和碱的中和反应
• 考点一:酸碱中和反应的考查。
• 1.下列zxxkw有关中和反学科应网 的说法,不正确的是 ( ) • A.中和反应一定是学 酸科网 和碱的反应 • B.凡是生成盐和水的化学反应都是中和反应 • C.中和反应的实质是H+和OH-结合生成水 • D.中和反应一定生成盐和水
问题
【提出假设】酸碱之间可以发生反应。 探究
【实验验证】 zxxkw
学科网
重新设学计科网 实验方案...
活动与探究中和反应.flv:
操作步骤
在烧杯中加入10mL氢氧化钠溶液,
滴入2滴酚酞溶液,逐滴入稀盐酸,并
不断搅拌 zxxkw
学科网
课题2 酸和碱的中和反应
现象和分析
溶液由红色逐渐 变为无色
学 科网
学科网
D.苏打水或肥皂水(呈碱性)
• 3.酸与碱作用生成盐学和科网 水的反应,叫作中和反应,它在工
九年级化学下册课件-10.2 酸和碱的中和反应-人教版(共22张PPT)

含Al(OH)3 药片
含Mg(OH)2药片
原 Al(OH)3 + 3HCl=AlCl3 +3H2O 理 Mg(OH)2+2HCl =MgCl2 +2H2O
练一练
1、某同学不小心被黄蜂蛰了(黄蜂毒液呈碱性),
为了减轻疼痛,可以涂抹下列哪种物质(B )
A.浓硫酸
B.食醋
C.食盐水
D.苏打水或肥皂水(呈碱性)
CO2 + 2NaOH = Na2CO3 + H2O
二氧化碳等非金属氧化物与碱反应、铁锈等金属氧 化物与酸反应均能生成盐和水,但它们不是中和反应。
Fe2O3 + 6HCl = 2FeCl3 + 3H2O
练一练
以下反应属于中和反应的是 (C)
A、CO2 + 2NaOH = Na2CO3 + H2O B、2NaOH +CuSO4==Cu(OH)2↓ +Na2SO4 C、HNO3 + NaOH= NaNO3 + H2O D、Fe2O3 + 3H2SO4 = Fe2(SO4)3 +3H2O
思考2:为什么酸和碱能够发生反应?
小资料:水在通常 情况下化学性质非 常稳定。 宏观:水在2000℃ 以上才开始分解。 微观:室温下,一 亿个水分子中,只 有一个水分子分子 发生了解离。
3. 中和反应的实质:
H+
Na+
Na+
Cl-
OH-
HCl→ H+ +Cl-
H2O
Cl-
NaOH→ Na++OH-
用熟石灰改良酸性土壤。
2. 中和反应在工业中的应用
人教版化学九年级下册:10.2酸和碱的中和反应课件 (共16张PPT)

3、 下列各组物质,需要借助指示剂才能判断反应 发生的是( D ) A、石灰石与稀HCl C、铁与稀H2SO4 B、 Fe2O3与稀HCl D、 NaOH 与H2SO4
4.一些国家正在试用碳酸水浇灌某些植物,其作用是 (BC) 碳酸 并能分解放出CO
2
A.改良酸性土壤 B.改良碱性土壤 C.促进植物的光合作用 D.在植物上方形成温室
本节课小结: 一、中和反应 中和反应:酸与碱作用生成盐和水的反应
NaOH+HCl===NaCl+H2O Ca(OH)2+2HCl====CaCl2+2H2O
二、中和反应在实际中的应用
1 .改变土壤的酸碱 性 如:用熟石灰改良酸性土壤 2.处理工厂的废水 如:硫酸厂的污水中含有硫酸等杂质,可以用熟石 灰进行中和处理, 3.用于医疗和日常生活
教学目标
1、知道酸与碱发生的中和反应
2、了解中和反应在实际中的应用
2002年5月19日中午12时多, 一辆车牌为“湘E02450”的 油罐车满载着45吨浓度为 98%的浓硫酸 前往茂名,途 经国道阳西县程村镇黄什桥 附近时发生泄漏。当地政府 的领导和一批救援专家迅速 赶到现场处理。 由于硫酸浓度高、腐蚀性极 强,各套处理方案实施的效 果不理想。程村镇政府将5吨 熟石灰送到现 场,对泄漏浓 硫酸进行抢险
⑵碱性废水加酸性物质
如造纸厂的废水
(1)治疗胃酸过多
盐酸 胃酸的主要成分是______ 氢氧化铝 胃药胶囊的主要成分______
你能写出化学方程式吗? Al(OH)3 + 3HCl==AlCl3 +
3H2O
⑵蚊虫能分泌出蚁酸,从而使皮肤肿痛。 如:涂一些含有碱性物质(如肥皂水或 NH3· H2O)等药水,就可以减轻痛庠。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
金属离子:Cu2+、Fe2+、Fe3+、K+等 酸根离子:NO3-、SO42-、CO32-、Cl-、SO32- 等
氯化钾 氯化银 氯化镁 氯化锌
KCl AgCl MgCl2 ZnCl2
硝酸铜 硝酸铝 硝酸铁 硝酸铵
Cu(NO3)2 Al(NO3)3 Fe(NO3)3 NH4NO3 K2CO3 CaCO3 BaCO3
课题二
酸和碱的中和反应
(第一课时)
思考: 为什么被蚊虫叮咬过之后会觉得痛痒? 蚊子的口器中分泌出一种有机酸--蚁酸 有什么办法会消除肿痛? 浓肥皂(碱性)涂抹可迅速止痒
酸和碱混合在一起,会 发生化学反应吗?
物质发生化学变化时,经常会伴随着如颜色改变、 放出气体、生成沉淀、吸热、放热、发光等现象。
酸和碱反应本质:H++OH- =
H2O 笔记
其他酸与其他碱也能发生类似的反应:
NaOH+HCl == NaCl
+ H2O
Ca(OH)2+2HCl== CaCl2 + 2H2O 2NaOH + H2SO4== Na2SO4 + 2H2O 盐
酸根离子
由金属离子和酸根离子构成的化合物(划课本) 盐: 盐 金属离子+ 酸根离子
制作面条时,需加入碱性的 Na2CO3 ,用来防止花蛋加工的主要原料: 食盐、纯碱、生石灰、水等。
1、下列反应中属于中和反应的是( A. CuO+H2 Cu+H2O B. 6HCl+Fe2O3=2FeCl3+3H2O C. 2H2 + O2 2H2O D. NaOH+HNO3=NaNO3+H2O
B)
课题二
酸和碱的中和反应
(第二课时)
三、溶液酸碱度的表示法
1、如何检验溶液的酸碱性? 用酸碱指示剂 石蕊试液 酸红碱蓝 酚酞试液 酸无碱红
2、日常生活中,在我们吃苹果、橘子、葡萄等水果 时,会感到它们的酸的程度是不一样的,那么。如 何比较酸、碱性相对强弱呢?即溶液的酸碱度呢?
常用pH来表示
三、溶液酸碱度的表示法——pH
D
)
2.下列反应中,肯定能生成水的是 A.化合反应 B.中和反应 C.分解反应 D.置换反应
(B )
3. 下列应用一定与中和反应原理无关的是(C ) A.施用熟石灰改良酸性土壤 B.服用含Al(OH)3的药物治疗胃酸过多 C.用熟石灰和硫酸铜配制波尔多液 Ca(OH)2+CuSO4=CaSO4+Cu(OH)2↓ D.用NaOH溶液洗涤石油产品中的残余硫酸 4下列物质中常用来改良土壤酸性的是( A.石灰石 B.熟石灰 C.干冰 D.烧碱
思考:
(1)能不能直接将pH试纸浸入待测溶液中?
不能,会使待测液受到污染。 (2)用pH试纸测溶液的酸碱度前, pH试纸是否要先用 蒸馏水润湿? 不要,用蒸馏水润湿溶液就会被稀释,所测得的 pH 值可能不准确。 4、使用pH试纸时的注意事项: (1)不能把pH试纸浸在待测液体中。 笔记 (2)pH试纸不能用水润湿。
1、酸碱度: 表示溶液酸碱性的强弱程度, 常用pH表示。 通常在0~14之间
2、溶液的酸碱性与pH的关系
pH = 7,溶液显中性 。 pH < 7,溶液显酸性, pH越小,酸性越强。 pH > 7,溶液显碱性,pH越大,碱性越强。
三、溶液酸碱度的表示法——pH
3、测定pH最简便的方法是:使用pH试纸(划课本)
注:pH试纸测出的pH值是整数。
【实验10-9】用pH试纸测定pH的步骤:
在白瓷板或玻璃片上放一小片试纸,用玻璃棒将被 测液滴到pH试纸上,把试纸显示的颜色与标准比 色卡比较,读出测液的pH。(划课本)
pH 稀盐酸 稀硫酸
1 1 14 7
酸性
酸碱性
酸性
氢氧化钠 溶液
氯化钠溶 液
碱性
中性
pH试纸也能检验溶液的酸碱性
H2O
笔记 基本反应类型包括:化合反应、分解反应、 置换反应和复分解反应
中和反应:
酸和碱作用生成盐和水的反应。 (划课本)
小练习:1.完成下列方程式,并判断哪一个是中和反应
CaCO3 + 2HCl ------- CaCl2 + H2O + CO2
CO2 + 2NaOH -------Na2CO3 + H2O KOH + HNO3 ------- KNO3 + H2O(是中和反应)
3 H2SO4 + Fe2O3 -------
Fe2(SO4)3 + 3 H2O
化学与“特异功能”
杀鬼见血 巫师在病人房内烧香念咒作法,手持宝剑在 空中乱舞,用“神仙一把抓”的方法由病人身上 抓出疫鬼,扔在一个剪好的黄裱纸人身上, 然后将宝剑蘸水后砍在纸人上,纸人立刻被 砍出斑斑血迹。鬼被杀了,病也就算治好了。 这里用的黄裱纸是用酚酞染过的,清水 实际是碱水,酚酞遇见碱就会变成血红色, 秘密就在这里。
一、中和反应 实验10-8
5mL
在氢氧化钠溶液中加入盐酸 加入酚酞的作用:判断反应有 无发生。 酸和碱恰好完全反应:溶液恰 好由红色变为无色。
现象:溶液由红色变为无色 结论:酸和碱能反应
笔记
HCl→H+ + Cl-
NaOH→ OH-+ Na+
H2O
氢氧化钠与盐酸反应示意图
NaCl
反应方程式:NaOH + HCl = NaCl + H2O
硫酸锌 ZnSO 4 硫酸铜 CuSO 4 硫酸铵 (NH ) SO 4 2 4
碳酸钾 碳酸钙 碳酸钡
一、中和反应
1、中和反应的概念:酸和碱作用生成盐和水 的反应(划课本)
2、表达式:酸+碱=盐+水 3、中和反应的特点:反应物是酸和碱;生成物是盐和水
4、中和反应的本质:H++OH- =
注意:中和反应不是基本反应类型
二、中和反应在实际中的应用
植物需要在一定酸碱性的土壤中生长,如酸雨或施 肥过多,导致土壤显酸性的,不利于植物的生长,
1.改良土壤的酸碱性
笔记
用熟石灰 碱性太强,价格太贵
(1)改良酸性土壤: 能否用NaOH?
(2)改良碱性土壤:用碳酸水
在酸性土壤中加入熟石灰
2、处理工厂的废水
可用熟石灰进行中和处理 如:处理硫酸厂的污水,
H2SO4+ Ca(OH)2=CaSO4+2H2O
笔记
因为熟石灰价格便宜,处理污水成本低。
3. 用于医药 ⑴ 中和胃酸过多 用含有Al(OH)3的胃药中和胃酸中过多的HCl。
化学方程式: Al(OH)3 + 3HCl=AlCl3 + 3H2O
⑵ 中和蚁酸: 可涂抹一些含有碱性物质的药水。
笔记
思考:可不可以用NaOH来中和胃酸、蚁酸?为什么? 答:不可以。因为NaOH的碱性太强,具有强的腐蚀性。
氯化钾 氯化银 氯化镁 氯化锌
KCl AgCl MgCl2 ZnCl2
硝酸铜 硝酸铝 硝酸铁 硝酸铵
Cu(NO3)2 Al(NO3)3 Fe(NO3)3 NH4NO3 K2CO3 CaCO3 BaCO3
课题二
酸和碱的中和反应
(第一课时)
思考: 为什么被蚊虫叮咬过之后会觉得痛痒? 蚊子的口器中分泌出一种有机酸--蚁酸 有什么办法会消除肿痛? 浓肥皂(碱性)涂抹可迅速止痒
酸和碱混合在一起,会 发生化学反应吗?
物质发生化学变化时,经常会伴随着如颜色改变、 放出气体、生成沉淀、吸热、放热、发光等现象。
酸和碱反应本质:H++OH- =
H2O 笔记
其他酸与其他碱也能发生类似的反应:
NaOH+HCl == NaCl
+ H2O
Ca(OH)2+2HCl== CaCl2 + 2H2O 2NaOH + H2SO4== Na2SO4 + 2H2O 盐
酸根离子
由金属离子和酸根离子构成的化合物(划课本) 盐: 盐 金属离子+ 酸根离子
制作面条时,需加入碱性的 Na2CO3 ,用来防止花蛋加工的主要原料: 食盐、纯碱、生石灰、水等。
1、下列反应中属于中和反应的是( A. CuO+H2 Cu+H2O B. 6HCl+Fe2O3=2FeCl3+3H2O C. 2H2 + O2 2H2O D. NaOH+HNO3=NaNO3+H2O
B)
课题二
酸和碱的中和反应
(第二课时)
三、溶液酸碱度的表示法
1、如何检验溶液的酸碱性? 用酸碱指示剂 石蕊试液 酸红碱蓝 酚酞试液 酸无碱红
2、日常生活中,在我们吃苹果、橘子、葡萄等水果 时,会感到它们的酸的程度是不一样的,那么。如 何比较酸、碱性相对强弱呢?即溶液的酸碱度呢?
常用pH来表示
三、溶液酸碱度的表示法——pH
D
)
2.下列反应中,肯定能生成水的是 A.化合反应 B.中和反应 C.分解反应 D.置换反应
(B )
3. 下列应用一定与中和反应原理无关的是(C ) A.施用熟石灰改良酸性土壤 B.服用含Al(OH)3的药物治疗胃酸过多 C.用熟石灰和硫酸铜配制波尔多液 Ca(OH)2+CuSO4=CaSO4+Cu(OH)2↓ D.用NaOH溶液洗涤石油产品中的残余硫酸 4下列物质中常用来改良土壤酸性的是( A.石灰石 B.熟石灰 C.干冰 D.烧碱
思考:
(1)能不能直接将pH试纸浸入待测溶液中?
不能,会使待测液受到污染。 (2)用pH试纸测溶液的酸碱度前, pH试纸是否要先用 蒸馏水润湿? 不要,用蒸馏水润湿溶液就会被稀释,所测得的 pH 值可能不准确。 4、使用pH试纸时的注意事项: (1)不能把pH试纸浸在待测液体中。 笔记 (2)pH试纸不能用水润湿。
1、酸碱度: 表示溶液酸碱性的强弱程度, 常用pH表示。 通常在0~14之间
2、溶液的酸碱性与pH的关系
pH = 7,溶液显中性 。 pH < 7,溶液显酸性, pH越小,酸性越强。 pH > 7,溶液显碱性,pH越大,碱性越强。
三、溶液酸碱度的表示法——pH
3、测定pH最简便的方法是:使用pH试纸(划课本)
注:pH试纸测出的pH值是整数。
【实验10-9】用pH试纸测定pH的步骤:
在白瓷板或玻璃片上放一小片试纸,用玻璃棒将被 测液滴到pH试纸上,把试纸显示的颜色与标准比 色卡比较,读出测液的pH。(划课本)
pH 稀盐酸 稀硫酸
1 1 14 7
酸性
酸碱性
酸性
氢氧化钠 溶液
氯化钠溶 液
碱性
中性
pH试纸也能检验溶液的酸碱性
H2O
笔记 基本反应类型包括:化合反应、分解反应、 置换反应和复分解反应
中和反应:
酸和碱作用生成盐和水的反应。 (划课本)
小练习:1.完成下列方程式,并判断哪一个是中和反应
CaCO3 + 2HCl ------- CaCl2 + H2O + CO2
CO2 + 2NaOH -------Na2CO3 + H2O KOH + HNO3 ------- KNO3 + H2O(是中和反应)
3 H2SO4 + Fe2O3 -------
Fe2(SO4)3 + 3 H2O
化学与“特异功能”
杀鬼见血 巫师在病人房内烧香念咒作法,手持宝剑在 空中乱舞,用“神仙一把抓”的方法由病人身上 抓出疫鬼,扔在一个剪好的黄裱纸人身上, 然后将宝剑蘸水后砍在纸人上,纸人立刻被 砍出斑斑血迹。鬼被杀了,病也就算治好了。 这里用的黄裱纸是用酚酞染过的,清水 实际是碱水,酚酞遇见碱就会变成血红色, 秘密就在这里。
一、中和反应 实验10-8
5mL
在氢氧化钠溶液中加入盐酸 加入酚酞的作用:判断反应有 无发生。 酸和碱恰好完全反应:溶液恰 好由红色变为无色。
现象:溶液由红色变为无色 结论:酸和碱能反应
笔记
HCl→H+ + Cl-
NaOH→ OH-+ Na+
H2O
氢氧化钠与盐酸反应示意图
NaCl
反应方程式:NaOH + HCl = NaCl + H2O
硫酸锌 ZnSO 4 硫酸铜 CuSO 4 硫酸铵 (NH ) SO 4 2 4
碳酸钾 碳酸钙 碳酸钡
一、中和反应
1、中和反应的概念:酸和碱作用生成盐和水 的反应(划课本)
2、表达式:酸+碱=盐+水 3、中和反应的特点:反应物是酸和碱;生成物是盐和水
4、中和反应的本质:H++OH- =
注意:中和反应不是基本反应类型
二、中和反应在实际中的应用
植物需要在一定酸碱性的土壤中生长,如酸雨或施 肥过多,导致土壤显酸性的,不利于植物的生长,
1.改良土壤的酸碱性
笔记
用熟石灰 碱性太强,价格太贵
(1)改良酸性土壤: 能否用NaOH?
(2)改良碱性土壤:用碳酸水
在酸性土壤中加入熟石灰
2、处理工厂的废水
可用熟石灰进行中和处理 如:处理硫酸厂的污水,
H2SO4+ Ca(OH)2=CaSO4+2H2O
笔记
因为熟石灰价格便宜,处理污水成本低。
3. 用于医药 ⑴ 中和胃酸过多 用含有Al(OH)3的胃药中和胃酸中过多的HCl。
化学方程式: Al(OH)3 + 3HCl=AlCl3 + 3H2O
⑵ 中和蚁酸: 可涂抹一些含有碱性物质的药水。
笔记
思考:可不可以用NaOH来中和胃酸、蚁酸?为什么? 答:不可以。因为NaOH的碱性太强,具有强的腐蚀性。
