有机质谱解析
有机化合物波谱解析第四章 质谱(MS)

电喷雾电离的基本过程 ➢ 电场下的喷雾 ➢ 壳气的作用下 ➢ 电荷的库仑作用 ➢ Rayleigh 极限
Charged Droplets
+ ++
-
+ - -++ -
++
+ +
Evaporation
Rayleigh Limit
Reached
+ +++
+-+--+-- +++
带电雾滴 溶剂的蒸发 带电雾滴的解体 表面张力和库仑斥力的平衡点
• 氩气(Ar)在电离室依靠放电产生氩离子, 高能氩离子经电荷交换得到高能氩原子 流,氩原子打在样品上产生样品离子。 样品置于涂有底物(如甘油)的靶上。 靶材为铜,原子氩打在样品上使其电离 后进入真空,并在电场作用下进入分析 器。
• FAB的优点:
• 电离过程中不必加热气化,因此适合于 分析大分子量、难气化、热稳定性差的 样品。
B + M+
• 加成反应
• BH+ + M
[BHM]+ 或 [BMH]+
ON O N
O
(M.W. 224)
甲糖宁的EI-MS与CI-MS谱比较
化学电离源 分子离子峰
麻黄碱 电子轰击源
• 2.3 场致电离源( Field ionization, FI) • 应用强电场(电压梯度107-108V/cm)诱导样
• 特点:高的灵敏度和专属性
•
可以测定分子量,确定化合物的
分子式。
•
用于推断化合物结构。
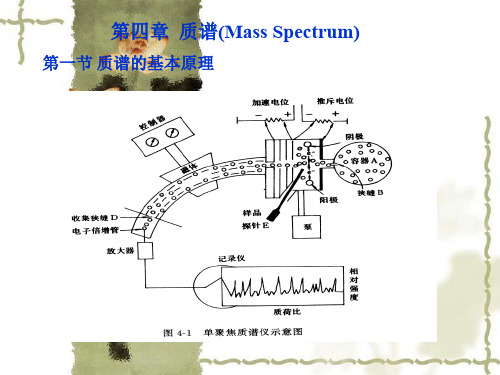
第一节 有机质谱仪的工作原理
有机化学基础知识点有机物的质谱和核磁共振谱

有机化学基础知识点有机物的质谱和核磁共振谱有机化学基础知识点 - 有机物的质谱和核磁共振谱一. 引言在有机化学领域中,质谱和核磁共振谱是两种重要的分析技术,它们可以提供有机物分子结构的丰富信息。
本文将详细介绍有机物的质谱和核磁共振谱的基本原理、仪器设备以及应用。
二. 有机物的质谱原理和方法1. 质谱的基本原理质谱是通过测量有机物分子中离子的质量和相对丰度来分析有机物的技术。
其基本原理为:(1)电离:将有机物分子转化为带电粒子,一般使用电子轰击、电子喷射等方法。
(2)分离:离子根据质量-电荷比在磁场中进行分离。
(3)检测:测量离子的质量和相对丰度。
2. 质谱仪器设备质谱的仪器设备主要由以下几个部分组成:(1)离子源:用于产生离子。
(2)质谱仪:包括质量分析器、检测器等。
(3)数据处理系统:用于采集和分析数据。
3. 质谱的应用质谱在有机化学中有广泛的应用,包括:(1)质谱图谱解析:通过分析质谱图谱,确定有机物的分子式、分子结构等信息。
(2)质谱定性分析:通过比较样品的质谱图谱与数据库中的标准质谱图,鉴定有机物的种类。
(3)质谱定量分析:通过测量质谱图谱中特定离子峰的强度,确定样品中有机物的含量。
三. 有机物的核磁共振(NMR)原理和方法1. 核磁共振的基本原理核磁共振是通过测量有机物分子中核自旋的行为来提供有机物分子结构信息的技术。
其基本原理为:(1)核自旋:原子核具有自旋,每种核素的自旋数是固定的。
(2)共振:核自旋在磁场中被激发,并在不同频率下共振吸收或发射能量。
(3)检测:测量吸收或发射能量的频率和强度。
2. 核磁共振仪器设备核磁共振的仪器设备主要由以下几个部分组成:(1)磁场系统:用于产生强磁场。
(2)射频系统:用于激发和检测核自旋的共振吸收或发射能量。
(3)探头:用于容纳样品和与样品进行相互作用。
3. 核磁共振的应用核磁共振在有机化学中有广泛的应用,包括:(1)1H核磁共振:通过测量样品中氢原子核的共振吸收能量,获得有机物的结构信息。
有机化合物光谱解析第四章质谱
例一、某未知化合物只含有C、H、O,红外光谱在 3100~3700cm-1之间无吸收,质谱见下图。
例二、某酯类化合物的高分辨质谱测出其精确分子量 为116.0833,低分辨质谱图见下。试推测其结构。
各碎片离子的开裂过程
例三、某苯烃胺类生物碱的质谱如下,试推测 其结构。
各碎片离子的开裂过程
五、多电荷离子
较易出现多电荷离子的化合物:具有电子系统的 芳香族化合物、苯环化合物或高度共轭的化合物。
பைடு நூலகம்
第三节 离子开裂类型 离子开裂类型有简单开裂、重排开裂、复杂开裂 和双重开裂。 一、简单开裂 仅在化学键上发生断裂,并脱去一个游离基。
简单开裂的特征是:母离子与子离子在质量的奇 偶性上成相反的关系,即母离子的质量为偶数,则子 离子的质量应为奇数;母离子的质量如为奇数,子离 子的质量就应为偶数。
生成相对稳定的碎片离子的开裂是优势开裂
(1)有 电子 的化合物,较易生成相对稳定 的碎片离子。
(2)有杂原子的化合物,也易生成相对稳定 的碎片离子。
(3)有分支的化合物,容易在取代基最多的 碳原子处开裂,生成较稳定的叔正离子或仲 正离子。
四、亚稳离子(metastable ion)
特征:峰较宽(跨越2~5个质量单位),强度较低,且m/z不是整 数值的离子峰。
环醚类化合物易通过开裂脱去醛 饱和环状烃类易通过重排开裂而脱去烯烃
三、复杂开裂
通常含杂原子的环状化合物能发生复杂开裂,生成稳定的共振离子。 如:
第一步 第二 步 第三步
四、双重重排
双重重排是多个键发生断裂,脱去一个游离基,同时有两个氢发生迁 移的开裂 。容易发生双重重排的化合物有: 1、乙酯以上的酯和碳酸酯
发生双重重排的过程:
如何利用质谱技术快速解析复杂有机物质结构

如何利用质谱技术快速解析复杂有机物质结构在化学领域,复杂有机物质的结构解析一直是一个具有挑战性的问题。
随着科技的不断发展,质谱技术作为一种强大的工具被广泛应用于有机物质结构的研究和鉴定。
本文将介绍如何利用质谱技术帮助快速解析复杂有机物质的结构。
一、质谱的基本原理质谱技术是一种将物质中的分子转化为离子,并通过离子的质量与电荷比来分析具体成分的技术。
质谱仪一般由离子源、质量分析器和检测器组成。
首先,离子源将待测物质转化为离子,通过质量分析器对离子进行分析和分离,最后通过检测器来测量离子的相对丰度。
二、质谱技术在结构解析中的应用1. 分子量的测定分子量是有机物质结构鉴定的基础,而质谱技术可以准确测定分子的相对质量。
通过质谱图中的离子峰位置和相对丰度,可以计算出分子的相对分子量。
这对化学家在鉴定未知化合物或鉴定复杂混合物中的主要成分非常有用。
2. 离子片段分析质谱技术能够将分子转化为离子,并进一步通过产生的离子片段来推断分子的结构。
当离子经过碰撞解离时,会产生特定的离子片段。
通过测量这些离子片段的质荷比,可以推断出分子的结构。
3. 各种质谱技术的组合应用现代质谱仪通常结合了多种质谱技术,如质子质谱(MS)、碰撞诱导解离质谱(CID-MS)、高分辨质谱(HRMS)等,这样可以进一步提高分析的精确性和灵敏度。
例如,质子质谱可以提供关于分子的分子量和离子片段信息,而HRMS则可以提供更加高分辨的离子质量信息。
三、结构鉴定实例以一种未知有机物为例,假设通过质谱技术得到了其分子量和离子片段信息,那么我们可以根据这些信息来推断分子的结构。
首先,可以根据分子量推测有机物可能的功能基团,然后根据离子片段信息确定各个功能基团的位置和种类。
此外,还可以通过与已知化合物库进行对比,找到与实验结果相符的结构。
四、质谱技术的应用前景随着质谱技术的不断发展,它的应用前景也越来越广阔。
例如,质谱成像技术能够在微观尺度上对样品进行分析,为实时、无损、高分辨的成像分析提供了可能。
有机质谱解析 实验报告

试验一色质联机机器数据处理1、练习:样品名称:20-ng.sms第一峰保留时间:7.316名称:2,4-Dimethylphenol CAS:No.105-67-9分子式:C8H10O MW:122Purity:980Fit:982RFit:988Avg:983OHCH3CH3第二峰保留时间:7.613min名称:bis(2-Chloroethyl)ether CAS:No.111-444分子式:C4H8Cl2O MW:142Purity:923Fit:949RFit:947Avg:142OCl Cl第三峰保留时间:7.763名称:2,4-Dichlorophenol CAS:No.120-83-2分子式:C4H4Cl2O MW:162Purity:896Fit:909RFit:973Avg:926OHCl Cl第四峰保留时间:7.979名称:1,2,4-Trichlorobenzene CAS :No.120-82-1分子式:C 6H 3Cl 3MW :180Purity :947Fit :956RFit :983Avg :962Cl ClCl第五峰保留时间:8.073min名称:Napthalene-d8分子式:C 10D 8MW :136Purity :952Fit :962RFit :980Avg :965D DDD D DD D第六峰保留时间:8.127名称:Naphthalene CAS :No.91-20-3分子式:C 10D 8MW :128Purity :984Fit :991RFit :989Avg :988第七峰保留时间:8.476min名称:4-Chloroaniline CAS :No.106-47-8分子式:C 6H 6ClNMW :127Purity :967Fit :969RFit :978Avg :971NH 2Cl第八峰保留时间:8.735min 名称:Hexachlorobutadiene CAS :No.87-68-3分子式:C 4Cl 6MW :258Purity :916Fit :937RFit :962Avg :938Cl ClClCl2、思考题:(1)色质联机数据中可以得到的信息有:总离子流图、质谱图、质量色谱图,以及通过色质联机提供的质谱数据得到分子离子、碎片离子以及同位素离子等;总离子流图是一张色谱图,提供全扫描,每一个点都对应一个质谱图,从而方便物质的确定;质谱图可以准确的定性某一未知物的分子式和大致结构;质量色谱图可以使某一特征离子表征出来,从而针对某一化合物进行质量色谱的定性检测。
有机波谱分析--质谱分析法

43
②逆狄尔斯-阿尔德(Retro-Diels-Alder,RDA)重排 具有环己烯结构类型的有机化合物,可发生RDA
开裂,一般都产生一个共轭二烯游离基正离子及一个 中性烯烃分子碎片。
●脂环化合物的逆狄尔斯-阿尔德重排 ●芳香族化合物的逆狄尔斯-阿尔德重排
β键的断裂称为β断裂。当化合物中含有C=C、苯环、 C=O等基团时,它的β键也易发生断裂。
β键断裂多发生均裂。
苄基断裂
25
c. i-断裂(i –breakage) C-X键既可发生均裂,也会发生异裂,即2个电子发生
单向转移,称为诱导断裂,或称i-断裂
●i-断裂中发生了正电荷的转移,造成了i-断裂困难很大。
26
③ 影响断裂的因素 a. 化学键的相对强度
优先断裂顺序:
27
单键>双键>三键
◆从化学键的键能可以看出: (1)有机物中C-S,C-X键的键能相对较小,最易断裂。 (2)其次易断裂的是C-C、C-O键。
两者键能相差不大,相对而言C-C键优先断裂。 (3)C-C与C-H比较,C-C键的键能更小,故C-C要比
离子,常常为基峰或强峰
◆碳原子相邻的杂原子对正电荷有稳定作用的离子
30
丙苯的质谱图中苄基断裂峰—m/z91
④分子离子的简单裂解的规律
以上都是简单裂解
1) 侧链碳原子处最易断裂而生成稳定的碳正离子。 侧链愈多愈易断裂,侧链上取代基大的基团优先作为自由 基脱去。
2) 饱和环在侧链部位产生α-断裂,生成带正电荷的环 状正离子碎片。
CH3NH2
31
C5H5N
(新)有机化合物谱图解析-质谱图分析(一)

Analyte Ion (M+H)
+ + +
CH5 , C2H5 , C3H5 C4H9 NH4 NH4 F
+ +
(M+H) , (M+ C2H5) , (M+ C3H5)
+ + +
+
(M+H) , (M+ C4H9) (M+H) , (M+ NH4) (M+H)
+
+
+
+ -
CH3O
(M-H)
+
3)应用氮规则 当化合物不含氮或含偶数个氮时,其分子量为偶数; 当化合物含奇数个氮时,其分子量为奇数。
4)分子离子峰的强度和化合物的结构类型密切相关。 (1) 芳香化合物共轭多烯脂环化合物短直链烷烃 某些含硫化合物。通常给出较强的分子离子峰。 (2) 直链的酮、酯、醛、酰胺、醚、卤化物等通常显 示分子离子峰。 (3) 脂肪族且分子量较大的醇、胺、亚硝酸酯、硝酸 酯等化合物及高分支链的化合物通常没有分子离子峰。
-
(M-H)
(M+ C4H9)
+
CI(with isobutane as the reagent gas) and EI mass spectra of C6H5CH2CH2CH2CH2CH3
6.1.6 用低分辨质谱数据推测未知物元素组成
1)利用元素分析数据求元素组成 。 2)利用碳谱、氢谱数据。 3)利用同位素峰簇 有机化合物中的常见元素通常不只含一种同位素,因此 分子离子峰或碎片离子一般都以同位素峰簇的形式存在。 设某一元素有两种同位素,在某化合物中含有m个该元 素的原子,则分子离子同位素峰簇各峰的相对强度为:
有机质谱解析共38页文档

• 1942年,第一台商品质谱仪;
• 1953年,由鲍尔(Paul)和斯坦威德尔(Steinwedel)提出四极 滤质器 ;
• 1953年,由威雷(Wiley)和麦克劳伦斯(Mclarens)设计出飞行 时间质谱仪原型 ;
1954年
英格拉姆(Inghram)和海登(Hayden)报道的
2002年诺贝尔化学奖获得者
日本科学家田中耕一(Koichi Tanaka)1959年出生于日本富山 县首府富山市,1983年获日本 东北大学学士学位,现任职于 京都市岛津制作所,为该公司 研发工程师,分析测量事业部 生命科学商务中心、生命科学 研究所主任。他对化学的贡献 类似于约翰·芬恩,因此也得到 了1/4的奖金。
1.4 我国有机质谱概况与进展
50年代,同位素分析;
有机质谱70年代零星开展;
年代,有机质谱快速发展成立质谱学会; 四个专业组:同位素质谱、无机质谱、有机质谱、质谱 仪器;
有机质谱主要在结构分析、气相离子化学、色质联用技 术等方面发展;
近年来,随着生命科学的发展,有机质谱也跨入生物质 谱的范畴。
1.5 质谱的特点
• 1917年,电喷雾物理现象被发现(并非为了质谱); • 1918年,Dempster 180°磁扇面方向聚焦质谱仪; • 1935年,马陶赫(Marttauch)和赫佐格(R. Herzog)根据他们
的双聚焦理论,研制出双聚焦质谱仪 ; • 1940年,尼尔(Nier)设计出单聚焦磁质谱仪,又于1960年设
Tandem系统,即串联的质谱系统(MS/MS);
1955年
Wiley & Mclarens 飞行时间质谱仪;
1960 ’s
开发GC/MS;
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
有机质谱解析第一章导论第一节引言质谱,即质量的谱图,物质的分子在高真空下,经物理作用或化学反应等途径形成带电粒子,某些带电粒了可进一步断裂。
如用电子轰击有机化合物(M),使其产生离子的过程如下:每一离子的质量及所带电荷的比称为质荷比(m/z ,曾用m/e)。
不同质荷比的离子经质量分离器一一分离后,由检测器测定每一离子的质荷比及相对强度,由此得出的谱图称为质谱质谱分析中常用术语和缩写式如下:游离基阳离子,奇电子离子(例如CH4)(全箭头) 电子对转移(鱼钩)单个电子转移α断裂;及奇电子原子邻接原子的键断裂(不是它们间的键断裂)“A”元素只有一种同位素的元素(氢也归入“A”元素)。
“A+1”元素某种元素,它只含有比最高丰度同位素高1amu 的同位素。
“A+2”元素某种元素,它含有比最高丰度同位素高2 amu的同位素。
A峰元素组成只含有最高丰度同位素的质谱峰。
A+1峰比A峰高一个质量单位的峰。
分子离子(M)失去一个电荷形成的离子,其质荷比相当于该分子的分子量。
碎片离子:分子或分子离子裂解产生的离子。
包括正离子(A+)及游离基离子(A+.)。
同位素离子:元素组成中含有非最高天然丰度同位素的离子。
亚稳离子(m*)离子在质谱仪的无场漂移区中分解而形成的较低质量的离子。
质谱图上反应各离子的质荷比及丰度的峰被称为某离子峰。
基峰:谱图中丰度最高离子的峰绝对丰度:每一离子的丰度占所有离子丰度总和的百分比,记作%∑。
相对丰度:每一离子及丰度最高离子的丰度百分比。
第二章谱图中的离子第一节分子离子分子离子(M+)是质谱图中最有价值的信息,它不但是测定化合物分子量的依据,而且可以推测化合物的分子式,用高分辨质谱可以直接测定化合物的分子式。
一、分子离子的形成分子失去一个电子后形成分子离子。
一般来讲,从分子中失去的电子应该是分子中束缚最弱的电子,如双键或叁键的π电子,杂原子上的非键电子。
失去电子的难易顺序为:杂原子> C = C > C —C > C —H易难分子离子的丰度主要取决于其稳定性和分子电离所需要的能量。
易失去电子的化合物,如环状化合物,双键化合物等,其分子离子稳定,分子离子峰较强;而长碳链烷烃,支链烷烃等正及此相反。
有机化合物在质谱中的分子离子稳定度有如下次序:芳香环> 共轭烯> 烯>环状化合物> 羰基化合物> 醚>酯> 胺> 酸> 醇>高度分支的烃类。
二、分子离子峰的判别。
通常,化合物的分子量用其所含元素的最大丰度质量来计算。
假如一个纯化合物的EI质谱图中有分子离子的话,它应该出现在谱图的最高质荷比区,但是,质谱图上质荷比最高的离子不一定就是分子离子,仍需进一步检验确定,以便排除各种干扰。
为判别分子离子,前人总结了很多经验。
在一个纯化合物质谱(不含本底和离子分子反应等产生的附加峰)中,作为一个分子离子必要的但非充分的条件是:1、它必要是谱图中最高质量的离子分子失去一个电子,形成分子离子,自然它的质量数(质荷比)应为最高。
但是,某些含氧含氮的化合物,如醚,酯,胺、酰胺、氨基酸酯、氰化物等,往往在比母峰多一个质量单位处出现一个峰,称为m+1峰,这是由于分子离子在电离室碰撞过程中捕获一个H而形成的。
同样,有些分子易失去一个氢而生成M-1离子,例如,六氢吡啶的M-1峰比M峰要高得多。
在实际工作中,情况往往很复杂,例如测量误差会对低丰度元素的计算带来较大影响,使推导出的元素组成有一种以上的可能性,这样,还需结合碎片离子及其他数据综合分析。
NHNHM-1+m/z 84此外,由于某些元素的重同位素的存在,质谱图中也会出现某些离子的质荷比高于分子离子的情况。
对同位素离子的说名见下节。
2、分子离子必须是奇电子离子样品分子失去一个电子而被电离成离子,因而分子离子是一个游离基离子,由于带有未成对电子,所以被称为奇电子离子(OE),用符号表示。
例如甲烷的分子离了形成过程如下:CHHHHeCHHH或CH上式中符号只指带未成对电子的离子,并不是指另有一个电子加到所表示的分子上。
3、含氮的有机化合物,分子离子的质荷比符含“氮规则”。
在有机化合物中常见的多数元素,其最大丰度同位素质量和价健之间有一个巧合,即除氮原子外,两者或均为偶数或均为奇数。
由此可以推导出“氮规则”:假若一个化合物含有偶数个氮原子,则分子离子的质量为偶数。
反之,可以推论出:含奇数个氮原子的化合物,分子离子的质量为奇数,其他有机化合物,分子离子的质量一般为偶数。
4、分子离子必须能够通过丢失合理的中性碎片,产生谱图中高质量区的重要离子。
分子离子分解过程中,通常仅有少数几种低质量中性碎片被失去。
例如,饱合烷烃可以失去甲基或一个氢原子,出现质荷比为M-15及M-1的离子,但不可能失去个氢,出现质荷此为M-5的离子。
通常,巧合,低质量中性碎片破失去。
例如,饱合烷烃可以失去甲基或一个氢原子,出现质荷比为M—15及M—1的离子,但不可能失去5个氢,出现质荷比为M—5的离子。
通常,分子离子不可能失去质量为4~14和21~25的中性碎片而产生重要的峰。
下图为一烷烃的图谱,每m/z 57及m/z 43的离子相距14个质量数,而完整的有机化合物分子不可能丢失一个·CH2离子,所以m/z 57不是分子离子峰,而是由m/z 72的离子失去甲基(M—15)形成的。
经过谱图解析,证明这个化合物是季戊烷[CH3—C(CH3)3],由于它不稳定,在电子轰击下易断裂,所以没出现分子离子峰。
M-15(.CH3), M-16(O), M-17(.OH,NH3), M-18(H2O),M-26(CN,HCCH), M-27(CHNH2.CHCH2), M-28(CO,CH2CH2),M-29(CHO,C2H5), M-30(CH2O,NO), M-31(OCH3,CH2OH),M-32(CH3OH,S,O2), M-33(CH3+H2O), M-34(H2S), M-35(CL),M-36(2H2O,HCL), M-41(C3H5),对于不易出现分子离子的化合物,可采用其他辅助分析手段。
1、低能电子:通常EI谱的电子轰击能量为70ev,逐步降低轰击电子的能量,可以减少分子的平均内能使其碎断几率相应减少,由此提高分子离子的相对丰度。
但需要注意的是,降低轰击电子能量,也就降低了所有离子的绝对丰度,使仪器灵敏度随之下降。
能量过低,对辨别分子离子峰同样是不利的。
2、化学电离等软电离技术:在化学电离条件下,样品分子及“反应气”离子在离子源中发生离子—分子反应。
通常,样品分子得到一个氢或失去一个氢,得到质荷比为[M±1]的偶电子离子(OE)+,这些偶电子离了一般具有较低的内能。
因此用EI得不到分子离子的化合物,大多数在CI条件下,可以产生能指明分子量的离子。
除CI外,常用的软电离技术还有FI(场电离)FD(场解吸)及FAB(快原子轰去)等。
3、测定衍生物的质谱:用化方法把一个化合物转变为适当的衍生物来提高化合物的蒸汽压,从而得到低挥发性化合物的衍生物质谱图,如羧酸,在EI谱上,只能得到[M-COOH]的峰,将羧酸进行甲酯化反应后,得到[M-H+CH3]的峰,进而推测化合物的分子量。
第二节同位素离子在自然界,很多元素的组成不是单一的。
这样,由它们组成的化学纯的有机化合物,由于组成它们的元素不是同位素纯的,只能得到一张混合物的质谱图。
其中含有丰度较小的同位素的离子被称为同位素离子。
它的丰度及离子中存在该元素的原子数目及该同位素的天然丰度有关,借助这些知识,可以推测分子离子或碎片离子的元素组成。
一、天然元素中同位素的相对丰度下表中列举了组成有机化合物的常见元素在自然界中存在的同位素及其丰度。
这些化合物被分为三类:“A”,只有一个天然丰度的同位素;“A+1”,有两个同位素的元素,其中第二个同位素比丰度最大的同位素重一个质量单位;“A+2”,这类元素含有比丰度最大同位素重二个质量单位的同位素。
表2-1常见元素的天然同位素丰度①H 1 100 20.015 “A”C 12 100 13 1.1①“A+1” N 14 100 15 0.37 “A+1” O 16 100 17 0.04 18 0.20 “A+2” F 19 100 “A” Si 28 100 29 5.1 30 3.4 “A+2” P 31 100 “A” S 32 100 33 0.80 34 4.4 “A+2” Cl 35 100 37 32.5 “A+2” Br 79 100 81 98.0 “A+2” I 127 100 “A” ②1.1±0.02,取决于来源。
二、重同位素峰丰度的近似计算法。
“A+2”·元素,这类元素包括氧、硅、硫、氯和溴。
除氧以外,其他元素的重同位素丰度都较高,如果有机物含有硅、硫、氯和溴,则分子离子区出现的同位素峰的强度可由二项式的展开式来计算。
......!3/)2)(1(!2/)1()(33221+--+-++=+---b a n n n b a n n b na a b a n n n n n式中a :轻同位素相对丰度 b :重同位素相对丰度n :分子中该元素的原子数目例如:含一个氯原子的化合物CH 3CL ,由CH 335CL (M=50)及CH 337CL (M+2=52)组成,其中35CL 及37CL 的丰度比为3:1,则上式为(3+1)1=3+1CH 335CL 及CH 337CL 的丰度比,即m/m+2=3:1而含三个氯的CHCL 3,同位素峰丰度计算如下:19272731)23)(13(3213)13(313331213)13(31333)13()(323322333+++=⋅--+⋅⋅-+⋅⋅+=+∴⋅-+⋅⋅+=+=+b a同样,可知含一个溴原子的有机化合物,其m/m+2的丰度比为1:1,含二个溴原子时,m:m+2:m+4=1:2:1。
当化合物含有两种或两种以上“A+2”元素时,先根据上式计算每一种元素的丰度比,而后时它们进行排列组合,例如对于含一个氯原子及两个溴原子的化合物,用3:1含一个(氯原子的丰度比),及1:2:1(含两个溪原子的丰度比)组合,可知它的m:m+2:m+4:m+6 =3:7:5:1。
氧原子的A+2同位素相对丰度很低(0.2%),当离子中存在多数个碳原子时,会对m+2峰产生影响,对于含有W 个碳原子及五个氧原子的化合物,其m+2峰的相对丰度的理论便可用下形式计算,%20.0200)11(%22⎥⎦⎤⎢⎣⎡+⋅=+Z W m在实际测量中,由于18O含量低,测量误差往往较大。
以上介绍了已知“A+2”元素原子的个数时,如何计算同位素样的样相对强度。
