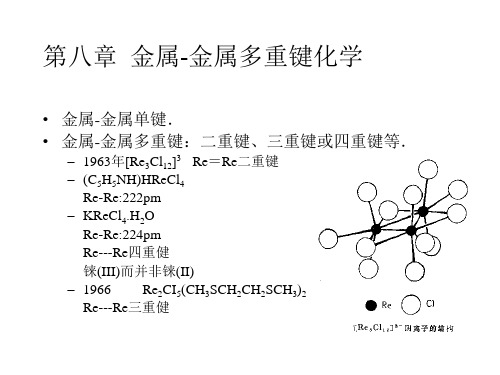
第四章 金属金属多重键
合集下载
《金属和金属键》课件

舶等。
航空航天
金属如钛、铝等在航空 航天领域广泛应用,用 于制造飞机、火箭和卫
星等。
石油化工
金属如镍、铬等在石油 化工领域用于制造催化 剂、反应器和管道等。
电力能源
金属如铜、铝等在电力 能源领域用于制造电线 、电缆和太阳能电池板
等。
金属在生活中的应用
家居用品
金属如铝、铜和不锈钢等在家 庭生活中用于制作炊具、餐具
金属原子失去部分外层电子,形成正离子。
电子填充空位
其他金属原子的外层电子填充到留下的空位中,形成金属键。
金属键的形成条件
金属原子半径较小,电子密度较高,有利于形成稳定的金属键。
金属键的特点
方向性
饱和性
金属键的形成具有方向性,因为金属原子 失去价电子后,留下的空位只能被特定方 向的电子填充。
金属键具有饱和性,因为每个金属原子只 能失去有限的外层电子,形成一定数量的 金属键。
和家居装饰等。
电子产品
金属如金、银和铜等在电子产 品中用于制作电路板、连接器 和外壳等。
交通工具
金属如钢铁、铝和镁等在交通 工具中用于制造汽车、火车和 飞机等。
医疗器械
金属如钛、不锈钢和镍钛合金 等在医疗器械中用于制造人工 关节、牙科植入物和手术器械
等。
金属在科技中的应用
科学研究
金属在化学、物理和生物学等科学研 究中广泛应用,用于制造实验设备和 仪器等。
金属的分类
总结词
金属可以根据其性质、用途和来源进行分类。
详细描述
根据性质,金属可以分为轻金属和重金属、过渡金属和非过渡金属等;根据用 途,金属可以分为结构金属、功能金属等;根据来源,金属可以分为原生金属 、再生金属等。
金属的性质
航空航天
金属如钛、铝等在航空 航天领域广泛应用,用 于制造飞机、火箭和卫
星等。
石油化工
金属如镍、铬等在石油 化工领域用于制造催化 剂、反应器和管道等。
电力能源
金属如铜、铝等在电力 能源领域用于制造电线 、电缆和太阳能电池板
等。
金属在生活中的应用
家居用品
金属如铝、铜和不锈钢等在家 庭生活中用于制作炊具、餐具
金属原子失去部分外层电子,形成正离子。
电子填充空位
其他金属原子的外层电子填充到留下的空位中,形成金属键。
金属键的形成条件
金属原子半径较小,电子密度较高,有利于形成稳定的金属键。
金属键的特点
方向性
饱和性
金属键的形成具有方向性,因为金属原子 失去价电子后,留下的空位只能被特定方 向的电子填充。
金属键具有饱和性,因为每个金属原子只 能失去有限的外层电子,形成一定数量的 金属键。
和家居装饰等。
电子产品
金属如金、银和铜等在电子产 品中用于制作电路板、连接器 和外壳等。
交通工具
金属如钢铁、铝和镁等在交通 工具中用于制造汽车、火车和 飞机等。
医疗器械
金属如钛、不锈钢和镍钛合金 等在医疗器械中用于制造人工 关节、牙科植入物和手术器械
等。
金属在科技中的应用
科学研究
金属在化学、物理和生物学等科学研 究中广泛应用,用于制造实验设备和 仪器等。
金属的分类
总结词
金属可以根据其性质、用途和来源进行分类。
详细描述
根据性质,金属可以分为轻金属和重金属、过渡金属和非过渡金属等;根据用 途,金属可以分为结构金属、功能金属等;根据来源,金属可以分为原生金属 、再生金属等。
金属的性质
第四章 金属金属多重键

用Mo2(OOCCH3)4 为原料还可制备其它钼的四重键化合物: Mo2 (O2CCH3)4 0 C ,浓HCl, KClK4Mo2Cl8 2H2O 红色晶体 用类似的方法,还可制备其它的盐: (enH2)2Mo2Cl8·2H2O, (NH4)2Mo2Br8 等 目前,Mo2(O2CR)4L2型的化合物 虽然已经合成很多种,但测定出 结构的却很少。 例2:Mo2(O2CCF3)4(py)2的结构 注意Mo-N很长(254。8pm)和键轴方向 分子间的距离相近,表明Mo-N键弱
Cr2(O2CR)L2中Cr-Cr键对L敏感,变化范围在220-250pm, 通过 Cr-O轴向连接成无限长链结构
14
15
含
羧
基
配
体
的
金
属
-
金
属
四
重
diglyme: 二甘醇二
键 化
甲基醚
合
Pz: 吡嗪
物
15
(3) 含芳香环体系的配体
16
四重键化合物中的芳香环体系的配体
16
若干Cr(Ⅱ)的含芳香环配体的四重键化合物的合成
17
大多数这类化合物
中
Cr-Cr 距 离 比 羧 基 化 合物的短得多,有
超 短 键 之 称 ( M-M 键长<190 pm)
结构见下页
有 Cr-Cr 超 短 键 的 分 子可能由于空间位 阻的原因,一般无 轴向配体,同时又 不相互缔合,较长 Cr-Cr 四 重 键 除 Cr2(O2CR)4外不存在 Cr2X82-, Cr2X4(PR3)4 等类型的四重键化 合物。
3
Pauling 杂化理论对金属-金属四重键的描述
4
过渡金属原子全部九个价轨道参与形成 一组杂化轨道d5sp3, 可分成三类: 1个属于A型,4个属于B型,4个属于C型, 4个B形成M-L键, 4个C形成M-M键(弧形单键,称为香蕉键) 形成四重金属键 A型键可沿键轴方向与配体键合, 也可以不加利用。
Cr2(O2CR)L2中Cr-Cr键对L敏感,变化范围在220-250pm, 通过 Cr-O轴向连接成无限长链结构
14
15
含
羧
基
配
体
的
金
属
-
金
属
四
重
diglyme: 二甘醇二
键 化
甲基醚
合
Pz: 吡嗪
物
15
(3) 含芳香环体系的配体
16
四重键化合物中的芳香环体系的配体
16
若干Cr(Ⅱ)的含芳香环配体的四重键化合物的合成
17
大多数这类化合物
中
Cr-Cr 距 离 比 羧 基 化 合物的短得多,有
超 短 键 之 称 ( M-M 键长<190 pm)
结构见下页
有 Cr-Cr 超 短 键 的 分 子可能由于空间位 阻的原因,一般无 轴向配体,同时又 不相互缔合,较长 Cr-Cr 四 重 键 除 Cr2(O2CR)4外不存在 Cr2X82-, Cr2X4(PR3)4 等类型的四重键化 合物。
3
Pauling 杂化理论对金属-金属四重键的描述
4
过渡金属原子全部九个价轨道参与形成 一组杂化轨道d5sp3, 可分成三类: 1个属于A型,4个属于B型,4个属于C型, 4个B形成M-L键, 4个C形成M-M键(弧形单键,称为香蕉键) 形成四重金属键 A型键可沿键轴方向与配体键合, 也可以不加利用。
金属有机化学 第4章 过渡金属有机化合物

N M N
side-on bridging
M
40
配合物中的N2可加合质子并被还原为氨或肼.
41
二氧化碳配位化合物
42
异腈配合物
硫代羰基配合物 亚硝酰基配合物
43
不饱和烃配位化合物
含过渡金属M-Cσ键配合物的合成
24
乙酰丙酮基
2,2’-联吡啶
1,2-二(二苯基膦基)乙烷
26
27
烷基过渡金属配合物的分解过程
环配合物的合成
H 2C Ni(PR3)2Cl2 + Li(CH2)4Li (R3P)2Ni H 2C CH2 H2C Ni(cod)2 + bpy + Br(CH2)4Br (bpy)Ni H2C PPh3 H2C (Ph3P)2Pt H2C CH2 CH2 CH2 CH2 CH2
8
常见的有机配体和齿合度
提供给M 的电子数 齿合度 配体 M-L的结构
M CR3
C M C
C M C
1
2
1
2
烷基(H, X)
烯烃(CH2=CH2)
2(4)
2
2
1
炔烃(CHCH)
亚烷基(carbene)
M
CR2
9
3 3,1 4 4 5 6
1 3 , 1 4 4 5, 3, 1 6
• 金属的氧化态:配体L以满壳层离开时,金属所 保留的正电荷数 e.g. M-Cl • 烃基一般表现为负离子,所以把它们看成是负离 子时,贡献为-1, e.g. M-CH3 • 中性配体(CO, H2C=CH2, PR3等)的贡献为零 • 环戊二烯基Cp为一价负离子 • e.g. Cp2Fe, (Ph3P)3RhCl, Fe(CO)5, CH3Mn(CO)5
第五章金属金属多重键化学(精)

δ键是由dxy-dxy形成的,由于dxy的角度分布特征,只有重叠的结构才 能最大程度的重叠(四方棱柱体),但是这样对配体之间的非键性排斥 最大,因而稍微错开一点, 从而整体上有利于成键,虽然重叠程度已不 太大, 但降低了排斥作用。
(a)X-射线晶体结构
(b)覆盖构型重叠最大 (c)交错构型重叠为零
•1966年末, Cotton等又首次发现任化合物Re2Cl5(CH3SCH2CH2SCH3) 中 存在着Re Re三重键; • 含金属—金属多重键的化合物不断脱颖而出,为无机化学这个古老的
领域又增添了新的光彩,开辟新的园地.
4. 1 主要的结构类型
含M—M多重键的化合物有四种类型
一、共边双八面体 M2X10可看成2个MX6八面体共边组成,这类化
Cl
PR3
Cl
对d2金属,M-M为双键σ2π2, 如
R2P
Cl
Cl
PR2 Cl
Nb
Nb
Cl R2P
Cl
Cl
PR2
对d4金属,σ2π2δ2δ*2, M-M也应该为双键;
但d3金属麻烦一些,按d3-d3(σ2π2δ2)来说,应为三重键,但由于δ和 δ*能级之间相差不大,在受到配体轨道相互作用的影响时,能级次序 发生倒转;从实际情况看形成单键(σ2π2δ*2)的可能性有时比三重键 (σ2π2δ2)大一些, 同时由于δ和δ*能级太接近,单线态(δ或δ*)与 三线态(δδ*)之间相差不到100cm-1,自旋态之间的平衡容易观察到。
OPh OPh
PhO P
OPh P
O O
Mo
O O
Mo
ClCH2CH2Cl
λ= 500 nm
OO
O O
PhO
金属金属多重键化学
金属-金属四重键
• 例:K2Re2Cl8· 2H2O
– 首先被认识到的含金属—金属四重键的化合物. – 墨绿色的晶体. – 制备:
• 一定温度下.用次磷酸H3PO2在盐酸溶液中还原高铼酸钟KReO4. • 高压下用氯气还原KReO4
– x射线晶体结构的测定:
• • • • • 存在着[Re2Cl8]2-离子,它具中心对称性,D4h点群. Re—Re距离为224pm Re—Cl键长都在229+/- 3pm Cl—Re—C1键角都在87+/- 20 Re—Re —C1 键角都在103.7t+/- 2.10
– 考虑—· 组过渡金属原子全部九个价轨道 参与组成的杂化轨道,即一组d5sp3杂化 轨道(图). – 九个杂化轨道中,四个B—型杂化轨道 可用于形成M—L键.四个C—型杂化轨 道则可与另一金属原子的C—型杂化轨 道重叠,形成四个等同的、弧形的单键 (“香焦键”).它们构成一组金属—金属 四重键. – 在d5sp3杂化轨道中,还有一位于M—M 键轴延线上朝外的A—型轨道可用以和 另一轴向的配体组合,也可不加利用.
– 例: X-(X=F、C1、Br、I)、SCN-、CH3- 、Py
• 强π接受性的配体,CO、NO和RNC等均未在金属—金 属四重键化合物中出现过. 企图合成这类化合物的任 何尝试,终因M—M键的断裂,得到单核的产物而宣 告失败.
– 原因:强π接受性配体存在的情况下,形成M—M π键和δ键所 必需的d电子反馈到配体的π*轨道中,降低M—M键稳定性.
金属-金属四重键
• [Re2Cl8]2-离子结构特点 • D4h而不是D4d对称性
– 这种覆盖的构型是金属—金属四重键 化合物极其重要的结构特征.
• 四重键的各组分,即σ πδ键中, δ最 弱,但它对于形成覆盖的构型具有重 要意义.
四1金属多重键

Co(CO)4-
[Co(CO)4]2
HCo(CO)4 (strong acid )
I2+ [Co(CO)4]2
2ICo(CO)4
[Co(CO)4]2 + F2C F2C FF
(CO)4Co C C Co(CO)3 FF
二 金属原子簇
1. HNCC(High Nuclear Carbonyl Cluster )
Wade 规 则 : M(CO)3 与 BH ( 或 CH ) 的 等 瓣 关 系 , (2n+2)、 (2n+4)、(2n+6)骨架电子数规则,
PSEPT( 多面体骨架电子数理论) , (V+ x-12) (9N-L)规则 (nxc)规则 TEC(总电子数)方法
总电子计数TEC ( total electron count)
4n+2 4n+4 4n+6 4n+8
(n为金属原子数)
14n+2 14n+4 14n+6 14n+8
高价过渡金属卤化物(硫化物)原子簇
M6X8
或 [ M6(3-X)8 ]
Mo6Cl84+ Mo6S84–
Mo(II) 簇电子数: 4×6 = 24e
Mo—Mo间的电子数: 24/12(棱)=2 Mo—Mo 单键(2e) ~ 2.60Å
(CO)5 Mn —Cl
(CO)4 Fe=CH2 (carbene)
CHCH
等瓣相似
CO Fe
Fe
Fe
Fe3(CO)12
C C
H C
C3H6
Fห้องสมุดไป่ตู้ Fe
Fe Fe C O
Fe2(CO)8 (不稳定) Fe2(CO)9 (不稳定)
2020全国高中化学竞赛 无机化学北大版 金属原子簇和金属金属多重键共33张

(+3)
(+3)
级键)
Re —Re 3.8486? 不存在金属 -金属键
[Re 2Cl8]2- + PEt2H ( HCl ,苯 )? 1,2,5,6-Re 2Cl4(? -PEt2)(PEt 2H)4
(+3)
(+4)
Trinuclear complexes
di-2-pyridylamine (dpa -)
=6
TEC 和簇合物结构的关系
簇合物
总电子 骨架 数TEC 电子
对数
S
母体多面 体顶点数
n
Rh 6(CO) 16
86
7
Os5(CO) 16
72
6
Os5C(CO) 15
74
7
Fe 4C(CO)
2?
12
62
7
H3Ru 4(CO) 12?
60
6
金属原
子数
6 5 5 4
4
结构
闭式
闭式
巢式
蛛网式 巢式
原子簇的电子计数
Co
Co
Co
CH
Co 4(CO) 12
CH
Co Co
Co
Co(CO) 3
Co3(CO) 9CH ( carbyne)
若干p区和 d 区的等瓣分子片
等瓣相似的分子轨道示意图
CH
CpNi
Co(CO) 3
15e
CH 2
Ni(CO)3
CH3
CH 4
Mn(CO) 5
Ni(CO)4
Fe(CO) 4
16e
Angew. Chemie. Vol 21, 10(1982)711-724
无机化学 第10章 金属原子簇和金属多重键

A.F. Cotton Adv. Inorg. Chem.4n-的链状分子
阴离子堆垛结构的四氰基铂酸盐
配合物
Pt的价 PtPt间 颜色 态 距/pm
金属Pt
0
277.5 金属
K2Pt(CN)43H2O
+2.0 348
白色
K2Pt(CN)4Br0.33H2O +2.3
Cr(CO)6 18e
Parallels between S and Fe(CO)4
S -2
Fe (C O )4-2
S8
Fe 2(CO)9, F e 3(CO)12
H 2S p K 1= 7.24 p K 2= 14.92
S CH2 CH2
H 2Fe (C O )4 pK 1= 4.44 pK 2 =14
Chevrel phase, PbM6S8
高价过渡金属卤化物原子簇M6X12 Nb6Cl122+ Nb(氧化态=14/6) 簇电子数: 〔5 –14/6)×6 =16e Nb—Nb间的电子数: 16/12(棱)=4/3e Nb—Nb 键级: 2/3 ~ 2.90Å
三. 金属-金属多重键
1935年, C. Brosset K3W2Cl9 中, W—W 240pm (2.40Å) W单质中, W—W 275pm 1975年 F. A. Cotton, Re2Cl82– (d4) Re—Re 224pm
(CO)5 Mn —Cl
(CO)4 Fe=CH2 (carbene)
CHCH
等瓣相似
CO Fe
Fe
Fe
Fe3(CO)12
C C
H C
C3H6
Fe Fe
Fe Fe C O
Fe2(CO)8 (不稳定) Fe2(CO)9 (不稳定)
阴离子堆垛结构的四氰基铂酸盐
配合物
Pt的价 PtPt间 颜色 态 距/pm
金属Pt
0
277.5 金属
K2Pt(CN)43H2O
+2.0 348
白色
K2Pt(CN)4Br0.33H2O +2.3
Cr(CO)6 18e
Parallels between S and Fe(CO)4
S -2
Fe (C O )4-2
S8
Fe 2(CO)9, F e 3(CO)12
H 2S p K 1= 7.24 p K 2= 14.92
S CH2 CH2
H 2Fe (C O )4 pK 1= 4.44 pK 2 =14
Chevrel phase, PbM6S8
高价过渡金属卤化物原子簇M6X12 Nb6Cl122+ Nb(氧化态=14/6) 簇电子数: 〔5 –14/6)×6 =16e Nb—Nb间的电子数: 16/12(棱)=4/3e Nb—Nb 键级: 2/3 ~ 2.90Å
三. 金属-金属多重键
1935年, C. Brosset K3W2Cl9 中, W—W 240pm (2.40Å) W单质中, W—W 275pm 1975年 F. A. Cotton, Re2Cl82– (d4) Re—Re 224pm
(CO)5 Mn —Cl
(CO)4 Fe=CH2 (carbene)
CHCH
等瓣相似
CO Fe
Fe
Fe
Fe3(CO)12
C C
H C
C3H6
Fe Fe
Fe Fe C O
Fe2(CO)8 (不稳定) Fe2(CO)9 (不稳定)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
13
例3:Cr2(O2CCH3)4(H2O)2的结构
14
Cr2(O2CCH3)4(H2O)2 在 1 8 4 4 年 被 发 现 , 具有强烈的反磁性,深红色 (单核 Cr(Ⅱ)的化合物一般呈蓝色或紫色, 顺磁性) , 它的结构直到20世纪70年代 才被确定。
由醋酸钠和二氯化铬的稀溶液反应制备:
2Cr 2 (aq) 4CH3COO 2H2O Cr2 (O2CCH 3)4 (H2O)2
11
CH3COO-桥连两个Mo, Mo-O键长212 pm, C-O键长128.0 pm, C-C键长150.0 pm, Mo-Mo-O的键角为91.8°, O-C-O的键角为121.3° Mo2(OOCCH3)4 分子又通过邻近氧 原 子 在 Mo-Mo 键 轴 方 向 上 的 弱 配 位构成了无限长链结构。 分子间的Mo···O 距离为264.5pm
Re 2
I8
8HCl
备:
2KReO4+2NaH2PO2+8HCl K2Re2Cl8+2NaH2PO4+4H2O
2KReO4+4H2+8HCl(浓) 高压
K2Re2Cl8+4H2O
较常用方法Re3Cl9与过量熔融二已胺盐酸盐反应
2Re3Cl9+6Et2NH2Cl(过量)熔融
3(Et2NH2)2Re2Cl8 冷却
17
二甲氧基 苯阴离子
18
18
四重键化合物光谱研究---电子光谱和伸缩振动光谱
19
单晶偏振电子吸收光谱
Raman光谱
光电子能谱观测M2单元 价电子电离带的振动精细 结构
金属-金属四重键基态的电子构型为σ2π4δ2,最低激发态的电子构型 为σ2π4 δ δ*.因此,最低的电子跃迁能相应于从δ成键到δ*反键轨道 的跃迁,即δδ* .测定了若干四重键化合物的跃迁能,从而赋予金 属-金属四重键的定性分子轨道能级图.ppt3
后溶于6MHCl得Re2Cl82-
(过量)Bu4NF•3H2O+(Bu4N)2Re2Cl8 CH2Cl2(Bu4N)2Re2F8•4H2O
2KReO4+2NaH2PO2+8HBr CsBr K2Re2Br8+2NaH2PO4+4H2O 20℃
(Bu4N)2Re2Cl8+8HICH2Cl2 (Bu4N)2Re2I8+8HCl
例:K2Re2Cl8·2H2O 墨绿色晶体,是首先被认识的金属-金属四重键化合物,。
K ReO4 H3PO3 HCl溶液K2 Re2 Cl8 2H2O
K ReO4 H2 高压K2 Re2 Cl8 2H2O
5
X-射线晶体结构的测定[Re2Cl8]2-离子结构
6
229±3pm
D4h点群,要求ReCl4两半部分具有覆盖结构,而非交错构型 Re-Re距离为224pm, Re-Cl键长:229±3pm, Cl-Re-Cl键角:87±3°, Re-Re-Cl键角:103.7±2.1° 覆盖型的结构存在说明δ的存在,两个dxy轨道间重叠达到最大, 若是交错结构,两分子碎片相对转动45°, 两个dxy轨道的δ重叠为零。
17
大多数这类化合物
中
Cr-Cr 距 离 比 羧 基 化 合物的短得多,有
超 短 键 之 称 ( M-M 键长<190 pm)
结构见下页
有 Cr-Cr 超 短 键 的 分 子可能由于空间位 阻的原因,一般无 轴向配体,同时又 不相互缔合,较长 Cr-Cr 四 重 键 除 Cr2(O2CR)4外不存在 Cr2X82-, Cr2X4(PR3)4 等类型的四重键化 合物。
12
Cr(Ⅱ)的四重键化合物
13
Cr(Ⅱ)也能形成Cr2(O2CR)4和Cr2(O2CR)4L2型的四重键化合物。
Cr2(O2CR)4 分子强烈的倾向于在Cr-Cr键轴方向上结合配体L, 形
成Cr2(O2CR)4L2型的分子;而无轴向配体的化合物却很少见。
和Mo(Ⅱ)有显著的区别。
例:Cr2(O2CR)4的结构
1
第四章 金属-金属多重键化学
要求:1金属-金属多重键化合物结构特征 2 典型金属-金属多重键化合物结构特征 描述 3金属-金属多重键化合物研究方法
1
§1. 金属-金属四重键(metal-metal quadruple bond)
2
也可考虑dz2-pz杂化轨 道成σ--σ*
dz2----dz2 (头碰头) σ--σ*
Cr2(O2CR)L2中Cr-Cr键对L敏感,变化范围在220-250pm, 通过 Cr-O轴向连接成无限长链结构
14
15
含
羧
基
配
体
的
金
属
-
金
属
四
重
diglyme: 二甘醇二
键 化
甲基醚
合
Pz: 吡嗪
物
15
(3) 含芳香环体系的配体
16
四重键化合物中的芳香环体系的配体
16
若干Cr(Ⅱ)的含芳香环配体的四重键化合物的合成
其他桥式双齿配体还有:S2CCH3-, O2COC(CH3)3-, PhNC(CH3)O, CH3NC(Ph)NCH3-, PhNNNPh-等,一些无机配体,CO32-, SO42等,也能在金属-金属四重键中充当桥式双齿配体的角色。
9
10
一 些 重 要 的 桥 式 双 齿 配 体
10
例1:Mo2(OOCCCH3)4的结构
s, px, py, dx2-y2轨道杂化成四个 dsp2杂化轨道: 四个 M-Lσ
M2中二重简并的δ轨道分裂: MLσ轨道 和 M-Lσ*轨道。
Pz与dz2杂化: M-Mσ和一个反键 轨道。
两个d4组态的金属离子, 共有8个电子两两配对地填充在成键轨道 上, 其基态电子构型可表示成: σ2π4δ2 键级=(8-0)/2 =4 (M-M键长很短的原因所在) 键级只表示两金属原子间存在四对成键电子, 不代表键强的直接 量度, 因为、和组分对总的键强的贡献有很大的差别。
Bu 4 NF 3H 2 O C H 2 Cl 2 ( Bu 4 N ) 2 Re F 8 4 H 2 O
K Re O 4
H 3 PO 2
CsBr
H Br Cs 2 Re 2 Br8
( Ru 4 N ) 2 Re 2 Cl 8
8HI
2 0 C , CH 2 C l 2 ( Bu 4 N ) 2
6
7
若考虑配位体空间位阻的影响,为了稳定原来的两半分子片, 可以相对转动一定的角度,成为部分交错的构型,根据理论计 算,当扭曲度不大时,对δ键的强度影响不大。
[Re2Cl8]2-中Re-Re之间的距离: 224 pm, 金属中Re-Re键长: 275 pm, Re3Cl9中Re-Re单键键长:248pm, [Re2Cl8]2-中Re-Re键能:481-544 kJ·mol-1, C≡C (B.E.820 kJ·mol-1) ,N≡N(B.E. 946 kJ·mol-1), P≡P( B.E. 523 kJ·mol-1) 比较说明Re-Re四重键是一个很强的化学键,
同系物 Mo2(O2CR)4 (R=H, CF3, CMe3, C6H5等) 具有类似结构, 在Mo-Mo键轴方向上,通过和相邻分子氧原子之间的弱配位体 形成无限长链, 对于Mo的四重键化合物,Mo-Mo键轴方向上 的配体并非是必需的。
11
12
制备方法:
2Mo(CO)6 4CH3COOH Mo 2 (O2CCH 3 )4 12CO 2H2
Cr2(O2CR)4和Mo2(O2CR)4 结构形式相似,
成键程度相差大
Mo2(O2CCH3)4 分子间Mo···O 键长:264.5pm
分子内Mo···Mo距离: 2 09.1pm
Cr2(O2CCH3)4 分子间Cr···O键长:232.7 pm
分子内Cr···Cr距离: 228.8pm
Mo2间形成四重键倾向比Cr2大
用Mo2(OOCCH3)4 为原料还可制备其它钼的四重键化合物: Mo2 (O2CCH3)4 0 C ,浓HCl, KClK4Mo2Cl8 2H2O 红色晶体 用类似的方法,还可制备其它的盐: (enH2)2Mo2Cl8·2H2O, (NH4)2Mo2Br8 等 目前,Mo2(O2CR)4L2型的化合物 虽然已经合成很多种,但测定出 结构的却很少。 例2:Mo2(O2CCF3)4(py)2的结构 注意Mo-N很长(254。8pm)和键轴方向 分子间的距离相近,表明Mo-N键弱
(a) 顺磁性,μ=1.72 B.M.
铼有两种价态:
Ⅲ
Ⅱ
Cl(DTH)2ReⅡReⅢCl4 , 成单电子在Re(Ⅱ)。
(b)分子具有交错的转动构型,
Re-Re之间无δ键。
19
20 扭曲消弱了δ键的强度,随着扭曲角的增大, δ δ*电子跃迁能降低
20
Re和Mo的金属四重键化合物在Raman光谱的低频范围内出现强2的1 谱带,相应于金属-金属键的伸缩振动,预期Raman光谱对鉴定高度 对称的四重键二聚体有特殊重要的意义.
21
§2. 金属-金属三重键
22
从四重键的定性能级图出发,可扩大到对其它多重键的定性描述 有两种方法可以使四重键变为三重键
产物在真空中加热便转为棕色,非晶态的无水物。 若在有机溶剂中加热重结晶又可得到一系列的 Cr2(O2CCR)4L2型化合物,如Cr2(O2CCH3)4(HO2CCH3) 2, Cr2(O2CCH3)4(C5H11N) 2 等。 这表明Cr2(O2CCH3)4倾向于Cr-Cr结合配体成Cr2(O2CCH3)4L2.
4
2. 典型的金属-金属四重键化合物
5
已知d4电子组态Cr(Ⅱ), Mo(Ⅱ), W(Ⅱ), Tc(Ⅲ), Re(Ⅲ)都能形成 金属四重键化合物,典型的四重键化合物主要有三类: 含端梢的单齿配体, 含桥式的双齿配体, 含环状体系的配体
例3:Cr2(O2CCH3)4(H2O)2的结构
14
Cr2(O2CCH3)4(H2O)2 在 1 8 4 4 年 被 发 现 , 具有强烈的反磁性,深红色 (单核 Cr(Ⅱ)的化合物一般呈蓝色或紫色, 顺磁性) , 它的结构直到20世纪70年代 才被确定。
由醋酸钠和二氯化铬的稀溶液反应制备:
2Cr 2 (aq) 4CH3COO 2H2O Cr2 (O2CCH 3)4 (H2O)2
11
CH3COO-桥连两个Mo, Mo-O键长212 pm, C-O键长128.0 pm, C-C键长150.0 pm, Mo-Mo-O的键角为91.8°, O-C-O的键角为121.3° Mo2(OOCCH3)4 分子又通过邻近氧 原 子 在 Mo-Mo 键 轴 方 向 上 的 弱 配 位构成了无限长链结构。 分子间的Mo···O 距离为264.5pm
Re 2
I8
8HCl
备:
2KReO4+2NaH2PO2+8HCl K2Re2Cl8+2NaH2PO4+4H2O
2KReO4+4H2+8HCl(浓) 高压
K2Re2Cl8+4H2O
较常用方法Re3Cl9与过量熔融二已胺盐酸盐反应
2Re3Cl9+6Et2NH2Cl(过量)熔融
3(Et2NH2)2Re2Cl8 冷却
17
二甲氧基 苯阴离子
18
18
四重键化合物光谱研究---电子光谱和伸缩振动光谱
19
单晶偏振电子吸收光谱
Raman光谱
光电子能谱观测M2单元 价电子电离带的振动精细 结构
金属-金属四重键基态的电子构型为σ2π4δ2,最低激发态的电子构型 为σ2π4 δ δ*.因此,最低的电子跃迁能相应于从δ成键到δ*反键轨道 的跃迁,即δδ* .测定了若干四重键化合物的跃迁能,从而赋予金 属-金属四重键的定性分子轨道能级图.ppt3
后溶于6MHCl得Re2Cl82-
(过量)Bu4NF•3H2O+(Bu4N)2Re2Cl8 CH2Cl2(Bu4N)2Re2F8•4H2O
2KReO4+2NaH2PO2+8HBr CsBr K2Re2Br8+2NaH2PO4+4H2O 20℃
(Bu4N)2Re2Cl8+8HICH2Cl2 (Bu4N)2Re2I8+8HCl
例:K2Re2Cl8·2H2O 墨绿色晶体,是首先被认识的金属-金属四重键化合物,。
K ReO4 H3PO3 HCl溶液K2 Re2 Cl8 2H2O
K ReO4 H2 高压K2 Re2 Cl8 2H2O
5
X-射线晶体结构的测定[Re2Cl8]2-离子结构
6
229±3pm
D4h点群,要求ReCl4两半部分具有覆盖结构,而非交错构型 Re-Re距离为224pm, Re-Cl键长:229±3pm, Cl-Re-Cl键角:87±3°, Re-Re-Cl键角:103.7±2.1° 覆盖型的结构存在说明δ的存在,两个dxy轨道间重叠达到最大, 若是交错结构,两分子碎片相对转动45°, 两个dxy轨道的δ重叠为零。
17
大多数这类化合物
中
Cr-Cr 距 离 比 羧 基 化 合物的短得多,有
超 短 键 之 称 ( M-M 键长<190 pm)
结构见下页
有 Cr-Cr 超 短 键 的 分 子可能由于空间位 阻的原因,一般无 轴向配体,同时又 不相互缔合,较长 Cr-Cr 四 重 键 除 Cr2(O2CR)4外不存在 Cr2X82-, Cr2X4(PR3)4 等类型的四重键化 合物。
12
Cr(Ⅱ)的四重键化合物
13
Cr(Ⅱ)也能形成Cr2(O2CR)4和Cr2(O2CR)4L2型的四重键化合物。
Cr2(O2CR)4 分子强烈的倾向于在Cr-Cr键轴方向上结合配体L, 形
成Cr2(O2CR)4L2型的分子;而无轴向配体的化合物却很少见。
和Mo(Ⅱ)有显著的区别。
例:Cr2(O2CR)4的结构
1
第四章 金属-金属多重键化学
要求:1金属-金属多重键化合物结构特征 2 典型金属-金属多重键化合物结构特征 描述 3金属-金属多重键化合物研究方法
1
§1. 金属-金属四重键(metal-metal quadruple bond)
2
也可考虑dz2-pz杂化轨 道成σ--σ*
dz2----dz2 (头碰头) σ--σ*
Cr2(O2CR)L2中Cr-Cr键对L敏感,变化范围在220-250pm, 通过 Cr-O轴向连接成无限长链结构
14
15
含
羧
基
配
体
的
金
属
-
金
属
四
重
diglyme: 二甘醇二
键 化
甲基醚
合
Pz: 吡嗪
物
15
(3) 含芳香环体系的配体
16
四重键化合物中的芳香环体系的配体
16
若干Cr(Ⅱ)的含芳香环配体的四重键化合物的合成
其他桥式双齿配体还有:S2CCH3-, O2COC(CH3)3-, PhNC(CH3)O, CH3NC(Ph)NCH3-, PhNNNPh-等,一些无机配体,CO32-, SO42等,也能在金属-金属四重键中充当桥式双齿配体的角色。
9
10
一 些 重 要 的 桥 式 双 齿 配 体
10
例1:Mo2(OOCCCH3)4的结构
s, px, py, dx2-y2轨道杂化成四个 dsp2杂化轨道: 四个 M-Lσ
M2中二重简并的δ轨道分裂: MLσ轨道 和 M-Lσ*轨道。
Pz与dz2杂化: M-Mσ和一个反键 轨道。
两个d4组态的金属离子, 共有8个电子两两配对地填充在成键轨道 上, 其基态电子构型可表示成: σ2π4δ2 键级=(8-0)/2 =4 (M-M键长很短的原因所在) 键级只表示两金属原子间存在四对成键电子, 不代表键强的直接 量度, 因为、和组分对总的键强的贡献有很大的差别。
Bu 4 NF 3H 2 O C H 2 Cl 2 ( Bu 4 N ) 2 Re F 8 4 H 2 O
K Re O 4
H 3 PO 2
CsBr
H Br Cs 2 Re 2 Br8
( Ru 4 N ) 2 Re 2 Cl 8
8HI
2 0 C , CH 2 C l 2 ( Bu 4 N ) 2
6
7
若考虑配位体空间位阻的影响,为了稳定原来的两半分子片, 可以相对转动一定的角度,成为部分交错的构型,根据理论计 算,当扭曲度不大时,对δ键的强度影响不大。
[Re2Cl8]2-中Re-Re之间的距离: 224 pm, 金属中Re-Re键长: 275 pm, Re3Cl9中Re-Re单键键长:248pm, [Re2Cl8]2-中Re-Re键能:481-544 kJ·mol-1, C≡C (B.E.820 kJ·mol-1) ,N≡N(B.E. 946 kJ·mol-1), P≡P( B.E. 523 kJ·mol-1) 比较说明Re-Re四重键是一个很强的化学键,
同系物 Mo2(O2CR)4 (R=H, CF3, CMe3, C6H5等) 具有类似结构, 在Mo-Mo键轴方向上,通过和相邻分子氧原子之间的弱配位体 形成无限长链, 对于Mo的四重键化合物,Mo-Mo键轴方向上 的配体并非是必需的。
11
12
制备方法:
2Mo(CO)6 4CH3COOH Mo 2 (O2CCH 3 )4 12CO 2H2
Cr2(O2CR)4和Mo2(O2CR)4 结构形式相似,
成键程度相差大
Mo2(O2CCH3)4 分子间Mo···O 键长:264.5pm
分子内Mo···Mo距离: 2 09.1pm
Cr2(O2CCH3)4 分子间Cr···O键长:232.7 pm
分子内Cr···Cr距离: 228.8pm
Mo2间形成四重键倾向比Cr2大
用Mo2(OOCCH3)4 为原料还可制备其它钼的四重键化合物: Mo2 (O2CCH3)4 0 C ,浓HCl, KClK4Mo2Cl8 2H2O 红色晶体 用类似的方法,还可制备其它的盐: (enH2)2Mo2Cl8·2H2O, (NH4)2Mo2Br8 等 目前,Mo2(O2CR)4L2型的化合物 虽然已经合成很多种,但测定出 结构的却很少。 例2:Mo2(O2CCF3)4(py)2的结构 注意Mo-N很长(254。8pm)和键轴方向 分子间的距离相近,表明Mo-N键弱
(a) 顺磁性,μ=1.72 B.M.
铼有两种价态:
Ⅲ
Ⅱ
Cl(DTH)2ReⅡReⅢCl4 , 成单电子在Re(Ⅱ)。
(b)分子具有交错的转动构型,
Re-Re之间无δ键。
19
20 扭曲消弱了δ键的强度,随着扭曲角的增大, δ δ*电子跃迁能降低
20
Re和Mo的金属四重键化合物在Raman光谱的低频范围内出现强2的1 谱带,相应于金属-金属键的伸缩振动,预期Raman光谱对鉴定高度 对称的四重键二聚体有特殊重要的意义.
21
§2. 金属-金属三重键
22
从四重键的定性能级图出发,可扩大到对其它多重键的定性描述 有两种方法可以使四重键变为三重键
产物在真空中加热便转为棕色,非晶态的无水物。 若在有机溶剂中加热重结晶又可得到一系列的 Cr2(O2CCR)4L2型化合物,如Cr2(O2CCH3)4(HO2CCH3) 2, Cr2(O2CCH3)4(C5H11N) 2 等。 这表明Cr2(O2CCH3)4倾向于Cr-Cr结合配体成Cr2(O2CCH3)4L2.
4
2. 典型的金属-金属四重键化合物
5
已知d4电子组态Cr(Ⅱ), Mo(Ⅱ), W(Ⅱ), Tc(Ⅲ), Re(Ⅲ)都能形成 金属四重键化合物,典型的四重键化合物主要有三类: 含端梢的单齿配体, 含桥式的双齿配体, 含环状体系的配体
