第十章 细胞骨架
10.第十章 细胞骨架 细胞生物学
●微管结合蛋白(MAP)
●微管功能 ★
一、微管结构与组成
(一)微管的成分
αβ微管蛋白二聚体是细胞质游离态微管蛋白的
主要存在形式,也是微管组装的基本结构单位。
在二聚体上有鸟嘌呤核苷酸的两个结合位点;
一个秋水仙素的结合位点;一个长春花碱的结合位
点;二价阳Байду номын сангаас子结合位点。
两种微管蛋白形成的二聚体: α-微管蛋白有一个GTP结合位点(不可交换位点, N位点), β-微管蛋白也有一个GTP结合位点(可交换位点,E位点)。
• ATP肌动蛋白浓度高时:在末端聚合的速度大,聚集形 成ATP帽 (ATPcap); • ATP肌动蛋白浓度低时:聚合速度下降,但ATP水解的 速度不变,故ATP帽不断缩小,最后暴露出ADP肌动蛋 白,其对末端亲和力小,不断从末端解离,使纤维缩短。
因此,就每一根微丝来说,长度一般不是固定不变
的,而是呈动力学不稳定状态。
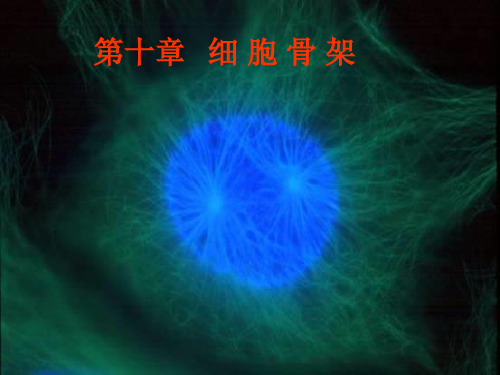
第十章 细 胞 骨 架
细胞骨架(广义)
细胞外基质骨架
细胞膜骨架 细胞质基质骨架(狭义)
核骨架
细胞质基质骨架(狭义)
微管 微丝 中间纤维
细胞骨架(狭义)=细胞质骨架
细胞骨架:是指存在于真核细胞中的蛋白纤维网架体系。
细胞质基质骨架:A微丝、B中间纤维、C微管
5-8nm
用途:处理细胞后,显示细胞中的微丝;同时也可破坏微丝的网络结构,
阻止细胞运动。
四、 微丝结合蛋白
同微丝结合的蛋白,可协同微丝形成多 种不同的亚细胞结构如应力纤维、肌肉肌
原纤维、精子顶端的刺突。
微丝结合蛋白
◆ 肌肉收缩系统中的主要结合蛋白有:肌球蛋白、
原肌球蛋白、肌钙蛋白。 ◆ 非肌肉细胞系统中的主要结合蛋白有:
第十章 细胞骨架

微管结合蛋白:是与微管结合的辅助蛋白,并与微管共存,
参与微管的装配。
微管的形状:中空的管状结构,内径15nm,厚5nm。
微管蛋白由α蛋白和β蛋白形成一个异源二聚体。
微管结合蛋白
微管的存在类型
单管:由13根原纤维组成,是细胞质中常见的形 式,其结构不稳定,易受环境因素而降解。 二联管:由A,B两根单管组成,A管由13根原纤 维,B管有10根原纤维,与A管共用3根原纤维,主要 分布于纤毛、鞭毛内。
后逐渐发现许多非肌细胞的myosin,目前已知的有15种类
型(myosin I-XV)。 Myosin II是构成肌纤维的主要成分之一。由两个重链 和4个轻链组成,重链形成一个双股α 螺旋,一半呈杆状, 另一半与轻链一起折叠成两个球形区域,位于分子一端, 球形的头部具有ATP酶活性
5.参与细胞、Ga2+、Na+、K+的浓 度及药物的影响。 影响微丝组装、去组装的主要药物有细胞松驰素B等。
微丝的主要功能
1.构成细胞的支架 微丝不能单独发挥作用,必须形成网络结构或成束
状结构才能发挥作用。
微绒毛
形态结构特征:是细胞表面的一种特化结构,其核
心是由20-30个同向平行的微丝组成束状结构其中有 微丝结合蛋白绒毛蛋白和毛缘蛋白。另外还有肌球 蛋白-1和钙调蛋白将微丝与绒毛处的质膜相连。正 是由于微丝及其结合蛋白的存在,才使得微绒毛的 形状得以维持。
肌动蛋白是一个由375个氨基酸组成的单链多肽,与一
分子的ATP相连。称为球形-肌动蛋白。微丝是由球形-肌 动蛋白形成的聚合体,也称纤维状-肌动蛋白。微丝的结 构也具有极性,有正负极之分。
微丝结合蛋白
微丝结合蛋白的种类较多,且功能复杂。目前在
第10章细胞骨架
• 肌肉收缩的基本单位是肌小节(sarcomere)。 肌小节是相邻两Z线间的单位。主要结构有:
A带(暗带): 为粗肌丝所在。 H区:A带中央 色浅部份,此 处只有粗肌丝。 I带(明带): 只含细肌丝部 分。 Z线:细肌丝一 端游离,一端 附于Z线 。
肌纤维TEM照片
Sarcomere
肌小节模式图
蛋白丝,抑制肌动蛋白与肌球蛋白结合。
● 肌钙蛋白(troponin. Tn) • 肌钙蛋白分子量 80KD,由3个多肽。Tn-T是一种 长形的纤维状分子, Tn-I和Tn-C都是球形分子。 • 肌钙蛋白 C 特异地与钙结合,肌钙蛋白 T与原肌 球蛋白有高度亲和力,肌钙蛋白 I抑制肌球蛋白的 ATP酶活性,
• ● 原肌球蛋白(tropomyosin, Tm) • 原肌球蛋白是细肌丝中肌动蛋白的结合蛋白,由两
条平行的多肽链组成α螺旋构型,每条原肌球蛋白
首尾相接形成一条连续的链同肌动蛋白细肌丝结合, 正好位于双螺旋的沟中。每一条原肌球蛋白有7个 肌动蛋白结合位点,因此Tm同肌动蛋白细肌丝中7 个肌动蛋白亚基结合。主要作用是加强和稳定肌动
肌肉收缩(muscle contraction)
肌肉可看作一种特别富含细胞骨架的效力非常高的 能量转换器,它直接将化学能转变为机械能。
• 肌细胞在进化的过程中形成了一种高度特化的 的功能:肌收缩(muscle contraction)。在肌细 胞中, 肌动蛋白和肌球蛋白联合形成一种复合物: 称为肌动球蛋白(actomyosin), 一种高度有序的 结构, 并能高效地工作。
Myosin: The actin motor portein
ATPase
Myosin II--Dimer
Mainly in muscle cells
第十章 细胞骨架

●中间纤维的装配
●中间纤维的功能
中间纤维的装配
◆中间纤维装配过程 ◆IF装配与MF,MT装配相比,有以下几个特点:
·IF装配的单体是纤维状蛋白(MF,MT的单体呈球形); ·反向平行的四聚体导致IF不具有极性; ·IF在体外装配时不需要核苷酸或结合蛋白的辅助, 在体内装配后,细胞中几乎不存在IF单体(但IF的存在 形式也可以受到细胞调节,如核纤层的装配与解聚)。
维持肌肉细胞的收缩装置起重要作用 ◆神经元纤维在神经细胞轴突运输中起作用 ◆参与传递细胞内机械的或分子的信息 ◆中间纤维与mRNA的运输有关 ◆中间纤维在细胞分化中的作用
第二节 细胞核骨架
●核基质(Nuclear Matrix) ●染色体骨架 ●核纤层(Nuclear Lamina)
核基质(Nuclear Matrix)
◆ 两条F-肌动蛋白链螺旋盘绕形成微丝(或1条形成的螺旋链)
微丝特异性药物
◆细胞松弛素(cytochalasins):可以切断微丝,并结合 在微丝正极阻抑肌动蛋白聚合,因而导致微丝解聚。
◆鬼笔环肽(philloidin):与微丝侧面结合,防止MF解聚。
微丝结合蛋白
整个骨架系统结构和功能在很大程度上受到不同的细胞 骨架结合蛋白的调节。
维持细胞形态
用秋水仙素处理细胞破坏微管,导致细胞变圆 说明微管对维持细胞的不对称形状是重要的。 对于细胞突起部分,如纤毛、鞭毛、轴突的形成 和维持, 微管亦起关键作用。
细胞内物质的运输
真核细胞内部是高度区域化的体系, 细胞中合成的物质、 一些细胞器等必须经过细胞内运输过程。这种运输过程与细胞 骨架体系中的微管及其Motor protein有关。
第十章 细胞骨架(Cytoskeleton)
细胞生物学-1第十章:细胞骨架与细胞运动

10. 细胞骨架与细胞运动细胞除了含有各种细胞器外, 在细胞质中还有一个三维的网络结构系统,这个系统被称为细胞骨架(图10-1)。
图10-1 细胞骨架系统10.1 细胞骨架(cytoskeleton)的组成和功能细胞除了具有遗传和代谢两个主要特性之外, 还有两个特性, 就是它的运动性和维持一定的形态。
细胞骨架是细胞运动的轨道,也是细胞形态的维持和变化的支架。
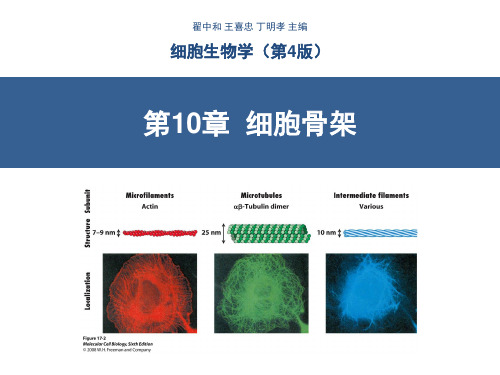
10.1.1 细胞骨架的组成和分布¦ 组成细胞骨架是细胞内以蛋白质纤维为主要成分的网络结构,由主要的三类蛋白纤丝(filamemt)构成,包括微管、微丝(肌动蛋白纤维)和中间纤维。
¦分布微管主要分布在核周围, 并呈放射状向胞质四周扩散。
微丝主要分布在细胞质膜的内侧。
而中间纤维则分布在整个细胞中(图10-2)。
12图10-2 细胞骨架的三类主要成分及其分布10.1.2 细胞骨架的功能什么是细胞骨架?在细胞内的主要功能是什么?细胞骨架对于维持细胞的形态结构及内部结构的有序性,以及在细胞运动、物质运输、能量转换、信息传递和细胞分化等一系列方面起重要作用。
¦作为支架(scaffold),为维持细胞的形态提供支持结构,如红细胞质膜膜骨架结构维持。
¦在细胞内形成一个框架(framework)结构,为细胞内的各种细胞器提供附着位点。
细胞骨架是胞质溶胶的组织者,将细胞内的各种细胞器组成各种不同的体系和区域的网络结构。
¦为细胞器的运动和细胞内物质运输提供机械支持。
细胞骨架作为细胞内物质运输的轨道;在有丝分裂和减数分裂过程中染色体向两极的移动,以及含有神经细胞产生的神经递质的小泡向神经细胞末端的运输都要依靠细胞骨架的机械支持。
¦为细胞从一个位置向另一位置移动提供力。
一些细胞的运动结构, 如伪足的形成也是由细胞骨架提供机械支持。
纤毛和鞭毛等运动器官主要是由细胞骨架构成的。
¦为信使RNA提供锚定位点,促进mRNA翻译成多肽。
第十章 细胞骨架(Cytoskeleton)

成束蛋白:将相邻的微丝交联成平行排列
如:丝束蛋白、绒毛蛋白、 α-辅肌动蛋白。
凝胶形成蛋白:将微丝连接成网状
如:细丝蛋白
4、交联蛋白
A、成束蛋白将相邻的微丝交联成束状结构。丝束蛋白和绒毛蛋白等交联而成的微丝 束为紧密包装型,肌球蛋白不能进入,无收缩功能;B、由α-辅肌动蛋白交联形成 的微丝束相邻的纤维之间比较宽松,肌球蛋白可以进入与之相互作用,可收缩。 C、细丝蛋白将微丝交联成网状。
三、微丝主要结构成分—肌动蛋白的类型
哺乳动物和鸟类已分离到6种肌动蛋白:4种α-肌动蛋白,分别
为横纹肌、心肌、血管平滑肌和肠道平滑肌所特有。另两种为
β-肌动蛋白和γ-肌动蛋白,存在于所有肌细胞和非肌细胞中。
特点:同源性很高,常作为内参基因。但微小差异可能上的变化。
四、微丝特异性药物
◆细胞松弛素(cytochalasins):可以切断微丝,并结合
马达结构域 2条重链
在心肌、骨骼肌、 平滑肌、收缩环、 张力纤维等产生 强大的收缩力。
内吞作用和吞噬泡运输 细胞内膜泡 和其他细胞 器的运输
部分肌球蛋白超家族成员的结构示意图
(二)肌球蛋白的结构
三个功能结构域:马达结构域、调控结构域和“货物” 结合的尾部结构域。 Ⅱ型肌球蛋白:在肌细胞中,组装成肌原纤维的粗丝, 在非肌细胞中,与收缩环的动态结构以及应力纤维的 活动相关。
(3)动力蛋白
特点:既有与微丝或微管结合的马达结构域,又有与
膜性细胞器或大分子复合物特异结合的“货物”结构
域,利用水解ATP所提供的能量有规则地沿微管或微丝
等细胞骨架纤维运动。
(一)肌球蛋白的种类
组装成粗肌丝的单位,肌球蛋白的头部和组成微丝的肌动蛋白 亚基之间的相互作用导致粗丝和细丝之间的滑动。
生物细胞骨架

第一节 微丝(Microfilament)
一、微丝的形态与组成
小肠上皮细胞横切图
小肠上皮细胞纵切图
(微绒毛的中轴是由微丝构成)
1、微丝的结构:微丝(microfilament)是由肌 动蛋白亚单位组成的实心螺旋状纤维,直径约 5--7nm 。
第十章 细 胞 骨 架
“人”有一定的形态是由于 有骨骼系统作为支架。
细胞为什么能维持一定的形态?
细胞质:微管 微丝 中等纤维
细胞核:核骨架
上皮细胞(红色:微 丝;绿色:微管)
细胞骨架(cytoskeleton): 是指真核细胞中由微管、 微丝和中等纤维等蛋白质 成分构成的一个复合的网 架系统。
作用:
成核期:球状肌动蛋白开始聚合, 生长期:两端速度不同 平衡期:正端延长速度等于负端
4.影响微丝组装的因素
• 组装:鬼笔环肽、肌动蛋白单体 的浓度(临界浓度)
• 解聚:细胞松弛素B
二、微丝的功能:1.参与肌肉收缩 2.支撑功能(微绒毛形态的维持)
3.微丝与细胞运动
变形虫的胞质运动 胞吞、胞吐作用等。 微丝参与细胞分裂
极到正极进行运动。 ·Myosin 主要分布于肌细胞,有两个球形头部结构
域(具有ATPase活性)和尾部链,多个Myosin尾部相互缠 绕,形成myosin filament,即粗肌丝。
如:肌球蛋白常聚合为两极纤维
肌球蛋白在 肌细胞中含 量丰富,规 则排列,在
非肌细胞中 含量少,且 无序排列。 是微丝动力 蛋白。
小结 细胞骨架的分布
• 微管主要分布在核 周围, 并呈放射状 向胞质四周扩散。
细胞生物学第十章_细胞骨架

微绒毛: MF同向平行排列
培养的成纤维细 胞中具有丰富的 应力纤维,并通 过粘着斑固定在 基质上。在体内 应力纤维使细胞 具有抗剪切力
当细胞受到外界 刺激时开始运动, 应力纤维发生变 化或消失
培养的上皮细胞中的应力纤维 (微丝红色、微管绿色)
MF反向平行排列
MF相互交错排 列
肌肉的组成
• 由肌原纤维组成,肌原纤维的粗肌丝主要成分是 肌球蛋白,细肌丝主要成分是肌动蛋白、原肌球 蛋白和肌钙蛋白。
• 研究细胞的内部工作机制,窥视细胞如何分裂。通过这些观察,可以揭开癌症工作机 制和组织生长之谜。
二、微丝结合蛋白
• 已知的的微丝结合蛋白有100多种,如: • 1 .核化蛋白:使游离actin核化,开始组装,Arp • 2.单体隐蔽蛋白:阻止游离actin向纤维添加,thymosin • 3.封端蛋白:使纤维稳定,Cap Z • 4.单体聚合蛋白:将结合的单体安装到纤维,profilin • 5.微丝解聚蛋白:cofilin • 6.交联蛋白:fimbrin • 7.纤维切断蛋白:gelsolin • 8.膜结合蛋白:vinculin
• 单体呈哑铃形,称G-actin;多聚体称F-actin。 • 结构高度保守,酵母和兔子actin有88%的同源性。 • 需要翻译后修饰,如N-端乙酰化或组氨酸残基的甲基化。
(二)微丝的装配
• 条件:ATP、适宜温度、K+和Mg2+。
• 过 程 : 2-3 个 actin 聚 集 成 核 心 ( 核 化 ) ; ATPactin分子向核心两端加合(延伸)。
• 属于马达蛋白,多数趋向微丝的(+)极。
• 肌球蛋白II构成粗肌丝。由2重链和4轻链组成,具有2 球形的头和1螺旋化的干,头部有ATP酶活性。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1. II型肌球蛋白
胰蛋白酶处理II型肌球蛋白,产生轻酶解肌球蛋白 (LMM)和重酶解肌球蛋白(HMM);HMM经木瓜蛋白酶处理, 形成肌球蛋白头部(HMM-S1)和杆部(HMM-S2)。
肌球蛋白体外运动的试验模型 纯化的肌球蛋白S1片段被固定在盖玻片上,加入微丝; 当加入ATP时,微丝沿盖玻片移动。
(五)微绒毛
微绒毛中的微丝和微丝交联蛋白 A 微绒毛内部微丝及微丝交联蛋白; B 小肠上皮细胞表面微绒毛; C 耳蜗毛细胞顶端的静纤毛。
(六)胞质分裂环
胞质分裂动力来自于收缩环上肌球蛋白所介导的 极性相反的微丝之间的滑动。 出现时期:有丝分裂末期 成分:肌动蛋白、肌球蛋白 收缩机制:微丝的组装与去组装
成束蛋白将相邻的微丝交联成平行排列,而凝胶形成蛋白
将微丝连接成网状。
微丝交联蛋白都有2个相似的肌动蛋白结合位点,这些蛋
白能够以单分子或二聚体形式将相邻微丝交联起来;
多肽链上两肌动蛋白结合位点的间距决定微丝束或网的松 紧程度。
交联蛋白与微丝的互作 A 丝束蛋白和绒毛蛋白等交联而成的微丝束为紧密包被型,肌 球蛋白不能进入,因而无收缩能力。 B 有α-辅肌动蛋白交联形成的微丝束相连的纤维之间比较宽 松,肌球蛋白可进入并与微丝互作,此种微丝束是可收缩的。 C 细丝性微丝和永久性微丝
A: 微绒毛中的微丝束 B: 细胞质中的张力纤维
C: 伪足中的微丝束 D: 胞质分裂环
A.B属于永久性微丝;
C.D属于暂时性微丝
微丝结合蛋白
末端阻断(加帽) 交联蛋白
单体隔离
单体
长纤维
成束蛋白
与膜结合蛋白
解聚
纤维切割蛋白
微丝结合蛋白功能示意图
微丝结合蛋白的功能:
(二)肌球蛋白的结构
沿微丝运动的分子马达,通常含3个结构域:马达结构域、 调控结构域、与肌球蛋白复合体组装相关尾部结构域。 包含1个肌动蛋白亚基结合位点和1个具有ATPase活性的ATP 结合位点;该结构域在肌球蛋白超家族中高度保守,是肌 球蛋白定性和酚类的依据,负责化学能到机械能的转变。 调控结构域是一段α螺旋,也是肌球蛋白结合轻链的结合 部位,在肌球蛋白上发挥杠杆作用。 根据分子结构差异,分为传统的肌球蛋白和非传统的肌球 蛋白。 VI型肌动蛋白的运动方向为从微丝的正极端向负极端移动, 其余的肌动蛋白都是向微丝的正极端移动。
II型肌球蛋白分子 2重链+4轻链
粗肌丝
所有肌球蛋白都具有相似的 马达结构域(保守区域), 可作为肌球蛋白的分类依据, 而多肽链C端和N端扩展部分 则存在很大差异。 II型肌球蛋白成员在心肌、 骨骼肌和平滑肌中产生强大 收缩力; VII肌球蛋白参与黏着斑的 动态变化; 某些I型肌球蛋白对钙通道 的活性具有调控作用。
每根肌纤维由肌节收缩单元呈线性重复排列而成。 肌原纤维的带状条纹由粗肌丝和细肌丝有序组装而成。 粗肌丝由肌球蛋白组装而成,细肌丝的主要成分为肌动蛋白,辅以原肌球蛋 白和肌钙蛋白。肌球蛋白的头部突出于粗肌丝表面,并可与细肌丝上肌动蛋 白亚基结合,构成粗细肌丝之间的横桥。
松弛(B上)和收缩(C上)状态下,肌节中明暗带有规律的排列状态; 松弛(B下)和收缩(C下)状态下,粗肌丝和细肌丝的结构示意图; D 肌肉中粗肌丝横切图; E 肌肉中粗肌丝和细肌丝交汇处的电镜图,细肌丝围绕粗肌丝的六角形排列。
纤维呈右手螺旋盘绕而成,螺距36 nm;在纤维内部,每个肌动蛋白单体
周围都有4个单体,上下各一,另外2个位于一侧;具有裂缝的一端为负极。
(二)微丝的组装及其动力性特征
1. 微丝组装的条件 G-actin结合ATP;高浓度的Na+、K+;适当浓度Mg2+. 2. 微丝的组装过程 ①成核反应:肌动蛋白寡聚体的形成; 需要Arp2/3复合物的参与;肌动蛋白单体的临界浓度 C0=Koff/Kon,高于C0,自发组装。 ②纤维的延长:正极的组装速度比负极快。
第十章 细 胞 骨 架
一、细胞骨架的发现:戊二醛、常温固定、电镜制片。 二、研究细胞骨架的技术:免疫荧光抗体技术;激光共焦技术。
三、细胞骨架的基 本类型及其分布 A B C D 微丝(MF); 微管(MT); 中间丝(IF) ABC叠加。
四、细胞骨架功能
(1) 结构与支持 (2) 胞内运输 (3 )收缩和运动
位臵:紧贴细胞质膜的区域.
成分:肌动蛋白 + 交联蛋白、凝溶胶蛋白.
相关运动:胞质环流、吞噬作用、变皱膜运动等. 运动机制: Ca2+引起皮层凝溶胶状态的改变。
(三)应力纤维
紧贴黏着斑的细胞质膜内侧的大量呈束状排列的微 丝束。 位臵:黏着斑内的微丝束 成分:微丝、肌球蛋白II、原肌球蛋白、细丝蛋白 和α辅肌动蛋白 功能:使细胞产生张力,参与细胞分化 机制:???
应力纤维和黏着斑的分布
3.细胞伪足的形成与细胞迁移
细胞迁移现象 神经嵴细胞从神经管向外迁移。
细胞迁移过程:
突起的形成→锚定位点的确立→细胞迁移→
尾部前移
细胞迁移的机制:
---肌动蛋白的聚合与肌动蛋白纤维的解聚
荧光标记的鬼笔环肽染色显示体外培养细胞内微丝的分 布及细胞周缘伸出的伪足
应力纤维 细胞皮层
细胞用罗丹明 标记的鬼笔环肽染 色显示微丝的分布
二、微丝网格结构的调节与细胞运动
(一)非肌肉细胞内微丝的结合蛋白
大多数非肌肉细胞中,微丝是一种动态结构,它们持续地 进行组装与去组装。 体内肌动蛋白的组装在2个水平上受到微丝结合蛋白的调 节:①可溶性肌动蛋白的存在状态;②微丝结合蛋白的种 类及其存在状态。 细胞内微丝网络的组织形式和功能通常取决于与之结合的 微丝结合蛋白。 根据微丝结合蛋白作用方式的不同,可将其分为:肌动蛋 白单体结合蛋白、成核蛋白、加帽蛋白、交联蛋白、割断 及解聚蛋白。
3. 加帽蛋白
与微丝末端结合阻止微丝解聚或过度组装的蛋白质。
微丝的负极端有Arp2/3复合物结合,处于稳定态;
微丝的正极端多数通过CapZ或凝溶胶蛋白超家族成
员而被加帽。
凝溶胶蛋白和脱帽作用受细胞膜上GPCR-PIP2调控。
4. 交联蛋白
微丝的排列方式主要由微丝交联蛋白的种类决定。
E. Ca2+的回收
肌肉收缩过程图解
在初始状态,组成粗肌丝的肌球蛋白头部(马
达结构域)未结合ATP时,该肌球蛋白的头部与细 肌丝结合,并成僵直状态。
1-2 ATP结合到肌球蛋白头部导致与肌动蛋白纤维
的结合力下降,肌球蛋白与肌动蛋白分开; 3 ATP水解为ADP + Pi,水解产物仍与肌球蛋白结 合,获能的肌球蛋白头部发生旋转,向肌丝的正 极端抬升; 4 在Ca2+存在下,肌球蛋白头部与靠近肌丝正极 端的一个肌动蛋白亚基结合; 5 Pi释放,肌球蛋白颈部结构域构象改变,导致 肌球蛋白头部与细丝的角度发生变化,拉动细肌 丝导致细肌丝相对粗肌丝的滑动;
稳定微丝结构;
改变微丝的凝溶胶状态;
实现微丝与其他部位的连接;
调节微丝的聚合和降解。
三、肌球蛋白:依赖于微丝的分子马达
在细胞内参与物质运输的马达蛋白可分为3类:沿微丝 运动的肌球蛋白;沿微管运动的驱动蛋白和动力蛋白。 (一)肌球蛋白的种类 在骨骼肌细胞内,多个II型肌球蛋白分子组装成肌原纤 维的粗丝,并被相关结构约束在一定的区域,肌球蛋白的头 部和组成微丝的肌动蛋白亚基之间的互作导致粗细丝之间的 滑动。
一、结构与成分
1. 基本结构成分:肌动蛋白(G-actin)
2. 肌动蛋白单体(G-actin)
组装 去组装
肌动蛋白纤维(F-actin)
3.肌动蛋白在生物进化过程中高度保守,肌动蛋白微
小的差异可能会导致其功能的变化。
肌动蛋白结构:单条肽链折叠而成;1分子ATP和1分子Mg2+结合于中间缝隙。 微丝的结构:一条直径7 nm的扭链,由肌动蛋白单体组成;外观为由2股
2. 非传统类型肌球蛋白
I型肌球蛋白只有1个头部(马达结构域)和尾部,并且在体 外不能组装成纤维。 V型是由2条肽链组成的二聚体,具有2个头部。
四、肌细胞的收缩运动
(一)肌纤维的结构
①
骨骼肌的组成
骨骼肌 肌纤维束 肌纤维
肌原纤维 肌纤维 骨骼肌 肌纤维束
肌原纤维
肌节
肌节
肌纤维是由数百条肌原纤维组成的集束。
中间丝
肌动蛋白丝
(4) 空间组织
肌动蛋白丝
微管
中间丝 马达蛋白 微管 神经元突起 肌动蛋白丝
马达蛋白 小肠上皮细胞 分裂细胞
微管
四、细胞骨架功能
1. 结构与支持作用
2. 胞内运输作用
3. 收缩和运动
4. 空间组织
本章内容
第一节 微丝与细胞运动 第二节 微管及其功能 第三节 中间丝
第一节 微丝与细胞运动
伪足
动物细胞前缘的伪足 及细胞内的微丝
扫描电镜所显示的细胞伪足
1 2 3 4 5 6
非肌细胞前缘肌动蛋白的聚合和伪足的形成 胞外信号与受体结合并启动胞内信号; 胞内信号作用于WASP,并激活Arp2/3复合物,启动微丝的组装; 肌动蛋白单体在微丝正极端聚合,是微丝向胞膜延伸; Arp2/3复合物结合到微丝的侧面,启动微丝侧支的组装; 微丝的正极不断延伸,推动细胞质膜形成伪足; 微丝的负极端解聚。
C.
肌钙蛋白(troponin,Tn)
TnC — 特异地与Ca2+结合 TnT — 与原肌球蛋白有高度亲和力 TnI — 抑制肌球蛋白ATPase活性
