大学物理化学经典课件51相图(1)
相图精品PPT课件

• 但要注意,硅酸盐矿物组成中的硅酸三钙,硅 酸二钙等,是一种新的化合物,具有自己的化 学组成和晶体结构,因而具有自己的物理和化 学性质。所以,它们可为单一的组分。
11
10.3.1单元系统相图举例——以水相图为例
如:水相图 F=3-P
(1)单相区:一相存在 P=1 F=2
(2)各界线:两相共存 P=2 F=1
DC—水的饱和蒸汽压曲线(蒸发曲线) L=G
DB—冰的饱和蒸汽压曲线(升华曲线) G=S DA—冰的熔点曲线(熔融曲线)S=l P A (3)三相点D:三相共存 P=3 F=0
16
多晶转变
1. 多晶转变的类型 机构变化的深刻性分:
①位移式转变 ②重建式转变 (3)按晶型转变的方向分:可逆转变、不可逆 转变
17
10.4.2 ZrO2系统相图
10.5 二元相图的基本类型
二元系统:c=2
相律 f c p 1 3 p
• 单元系统中C=1,根据相律:F=C-P+2=3-P
• 从而看出,系统中的相数不可能少于一个,所 以系统中最大自由度为2,这两个自由度即是 温度和压力,自由度达最小为零,所以系统中 平衡共存的相数最多三个,不可能出现三相以 上的平衡状态。
• 相图中的任意一点都表示了系统的平衡态,称 为“状态点”。
4
(2)相
• 定义:是指系统中具有相同物理性质和化学性 质的均匀部分。
• 需要注意的是这个“均匀”的要求是严格的, 非一般意义上的均匀,而是一种微观尺度的均 匀。
物理化学第5章相律与相图

第五章相律与相图5.1 相平衡相平衡是热力学在化学领域中的重要应用,也是化学热力学的主要内容之一。
在第三章中已经应用热力学原理研究了纯物质系统的两相平衡;在第四章中研究了多组分系统的两相平衡,其结果是用热力学公式表达相平衡的规律。
而本章则是应用热力学原理采用图解的方法来表达相平衡规律,特别是对多相系统的相平衡规律的研究,用图解的方法更显得方便和实用。
研究多相系统的相平衡状态随组成、温度、压力等变量的改变而发生变化,并用图形来表示系统相平衡状态的变化,这种图称为相图,相图形象而直观地表达出相平衡时系统的状态与温度、压力、组成的关系。
相律为多相平衡系统的研究建立了热力学基础,是物理化学中最具有普遍性的规律之一,它讨论平衡系统中相数、独立组分数与描述该平衡系统的变数之间的关系,并揭示了多相平衡系统中外界条件(温度、压力、组成等)对相变的影响。
虽然相律不能直接给出相平衡的具体数据,但它能帮助我们从实验数据正确地画出相图,可以帮助我们正确地阅读和应用相图。
本章首先介绍相律,然后介绍单组分、二组分和三组分系统的最基本的几种相图,其中着重介绍二组分气-液相图和液-固相图,介绍相图的制法和各种相图的意义以及它们和分离提纯方法之间的关系。
应用:a、水泥熟料的烧成过程,系统中有C3S(硅酸三钙)、C2S(硅酸二钙)、C3A(铝酸三钙)、C4AF(铁铝酸四钙)————固相,还有一定的液相,是一个多相的系统。
随着温度升高,这个多相系统中那些相能继续存在?那些相会消失?有没有新的相生成?各相组成如何?各相含量为多少?b、在化工生产中对原料和产品都要求有一定的纯度,因此常常对原料和产品进行分离和提纯。
常用的分离提纯的方法是结晶、蒸馏、萃取和吸收等等,这些过程的理论基础就是相平衡。
相图:根据多相平衡的实验结果,可以绘制成几何图形用来描述这些在平衡状态下的变化关系,这种图相成为相图。
现实意义:水泥、玻璃、陶瓷等形成过程均在多相系统中实现,都是将一定配比的原料经过锻烧而形成的,并且要经历多次相变过程。
第五章相图(冶金物理化学)PPT课件

图中无水平线
Au
l s+l s
960.5℃ Ag
重庆科技学院
冶金与材料工程学院
第五章 相图
(3) 完全互溶型
T
T
l
Nl
s
M
s
A
B
A
B
最低熔点(M),最高熔点(N)——少见。
如 KCl-NaCl系,Ag2S-Cu2S系
重庆科技学院
冶金与材料工程学院
第五章 相图
(4) 固态部分互溶的二元系
① 生成部分互溶的共晶类型
Tf,*A E1 :A物液相线;
T
* f, B
E
2
:B物液相线;
T* f, A
T* f, C
Ⅱ
H
E1
KE1和KE2:C物液相线; 线
HE1D :A、C共晶线; GE2F :B、C共晶线;
Ⅵ A
Ⅰ K
Ⅲ D
Ⅳ
G
E2
C
T* f, B
Ⅴ F
Ⅶ B
重庆科技学院
冶金与材料工程学院
第五章 相图
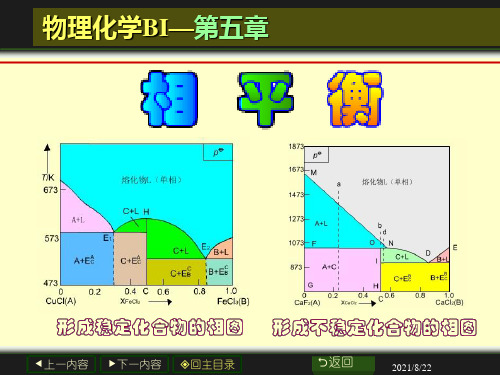
①稳定化合物二元系
冶金与材料工程学院
第五章 相图
5.3.4 常见的几种二元系相图
◆具有简单共晶体(前已讲) ◆生成化合物 ◆完全互熔的固熔体型 ◆固态部分互溶的固熔体型 ◆液态部分互溶型
重庆科技学院
冶金与材料工程学院
第五章 相图
(1)具有简单共晶体的二元系相图 基本要求:
体系最低熔点(共晶点 f=0);T
共晶线,共晶反应
GEH —— 共晶线:
l(E)
冷 热
(G )
(H)
T* f, A
E
——
物理化学相图课件(PDF)

例2 系统中有C(s), H2O(g), CO2(g), CO(g), H2(g)共 存,K=?
答:系统中有反应: C(s)+H2O(g) ⇔CO(g)+H2(g) C(s)+CO2(g) ⇔ CO(g) CO(g)+H2O(g) ⇔CO2(g)+H2(g)
其中S=5, 独立化学平衡数 R≠3=2 ∴ K=5– 2=3
注意:系统确定后,其组分数是确定的,物 种数有一定随意性。
7
例3 NaCl-H2O系统
NaCl,H2O: S=2, R=0, R’=0, K=2 NaCl不饱和水溶液
Na+, Cl-, H2O : S=3, R=0, R’=1: [Na+]=[Cl-], K= 3– 1=2 NaCl饱和水溶液,有NaCl(s)存在 NaCl(s), Na+, Cl-, H2O : S=4, R=1: NaCl(s) ⇔ Na++ Cl-, R’=1: [Na+]=[Cl-], K= 4 – 1– 1=2
∴ f = Φ(K–1) + 2 – K(Φ–1) = KΦ–Φ + 2 – KΦ+K f=K–Φ+2
13
注意:
1) 上面假设每个组分在每相中都存在,但这 不是必要条件。因为在某一相中少一个组 分,就会少一个平衡等式,相律公式不变 2) f = K–Φ + 2是一般关系,其中 2是指T, p。 若考虑更多的因素,如电场,磁场…,f=K – Φ +n, n是外界影响因素。
10
3. 自由度数f (degrees of freedom)
相数不变条件下,能够在一定范围内独立变动的强 度性质称作系统的自由度。即能确立系统状态的独 立变量。如T, p, c 例: ①一杯水和一桶水:
大学物理化学经典课件相图
上一内容 下一内容 回主目录
返回
2021/8/22
5.3.1.7不具有会溶温度类型
乙醚与水组成的双液 系,在它们能以液相存在 的温度区间内,一直是彼 此部分互溶,不具有会溶 温度。
上一内容 下一内容 回主目录
返回
2021/8/22
5.3.2 二组元在液态完全互溶、固态完全不溶
在单相区,物系点与相点重合;在两相区,物 系点和相点不重合,物系点只表示体系总组成,两 个相的组成由对应的相点表示。
上一内容 下一内容 回主目录
返回
2021/8/22
水-苯酚系统溶解度图
D
线:(1)溶解度曲线;
(2)共轭相相点曲线;
(3)相变曲线。
区:帽形区外,溶液为单一液相, 帽形区内,溶液分为两相。
B点温度称为最高临界会溶温度(critical consolute temperature)T B 。温度高于T B ,水和苯胺可完全互溶。
上一内容 下一内容 回主目录
返回
2021/8/22
5.3.1.5具有最低会溶温度类型
水-三乙基胺的溶 解度图如图所示。 在 T B 温度(约为291.2K) 以下,两者可按任意比 例互溶,升高温度,互 溶度下降,出现分层。
上一内容 下一内容 回主目录
返回
2021/8/22
5.3.2.1 作图(热分析法)
• 热分析法是绘制熔点—组成图的最常用的实验方法。 • 原理:
常压Pθ下,将样品加热熔化,再令其自行冷却, 记录不同时间t的温度T的变化即T-t步冷曲线。
将两个组分配制成不同的混合物(包括两个纯组 分) ,测得一系列步冷曲线,拐点和平台的温度T, 标在T-X图上,相点连线——绘制出相图。
大学物理化学51相图

要组成部分。
上一内容 下一内容 回主目录
返回
2020/4/5
5.1 单组分体系的相图
单组分体系的相数与自由度
K 1, f 3
当Φ=1,单相,f=2,双变量体系, Φ=2,两相平衡,f=1,单变量体系, Φ=3,三相共存,f=0,无变量体系 。
返回
2020/4/5
课前指导
2. 本章的教学要求
理解相律的意义、推导,掌握其应用。 掌握单组分系统、水的相图。 掌握二组分凝聚系统典型相图的分析和应用,包括 液态完全互溶固态完全不互溶生成简单共晶的二元系 ,固态完全互溶的二元系,液态部分互溶的二元系, 固态部分互溶的二元系(共晶型,包晶型),生成化 合物的二元系,组元在固态具有晶型转变。 掌握用杠杆规则进行分析与计算。 了解由实验数据绘制简单相图的方法。
两相平衡线上的相变过程
在两相平衡线上的任何 一点都可能有三种情况。如 OA线上的P点:
(1)处于f点的纯水,保持 温度不变,逐步减小压力, 在无限接近于P点之前,气 相尚未形成,体系自由度为2。 既温度和压力都独立可变。
上一内容 下一内容 回主目录
返回
2020/4/5
水的相图
上一内容 下一内容 回主目录
O点 是三相点(triple point),气-液-固三相共存, =3,f=0三相点的温度和压力皆 由体系自定。
上一内容 下一内容 回主目录
返回
2020/4/5
课前指导
3. 本章的重点和难点
重点:相律及其应用;理想的完全互溶双液系的 相图;杠杆规则;非理想的完全互溶双液系的相 图;热分析法绘制低共熔相图;部分互溶固溶体 的相图。 难点:相律及其应用;杠杆规则及其应用;恒沸 混合物;画步冷曲线;部分互溶固溶体的相图。
物理化学 相图课件
3. 自由度数f (degrees of freedom)
相数不变条件下,能够在一定范围内独立变动的强 度性质称作系统的自由度。即能确立系统状态的独 立变量。如T, p, c 例: ①一杯水和一桶水: T, p, f=2,状态相同,不用确定系统的大小; ② NaCl(sln):
T, p, c, f=3
p2 ∆ vap H m ⎛ 1 1 ⎞ ⎜ ⎟ 定积分: ln = − ⎟ p1 R ⎜ T T ⎝ 1 2 ⎠
饱和蒸气压p的实验测定 (∆vapHm的测定)
23
经验规律(Trouton规则) 估算气化热
∆ vap H m
Tb
其中Tb: 正常沸点
≈ 88 J ⋅ K ⋅ mol
−1
−1
条件:正常液体(非极性液体),液体分子 状态与气相分子状态相同。
7
例3 NaCl-H2O系统
NaCl,H2O: S=2, R=0, R’=0, K=2 NaCl不饱和水溶液 Na+, Cl-, H2O : S=3, R=0, R’=1: [Na+]=[Cl-], K= 3– 1=2 NaCl饱和水溶液,有NaCl(s)存在 NaCl(s), Na+, Cl-, H2O : S=4, R=1: NaCl(s) ⇔ Na++ Cl-, R’=1: [Na+]=[Cl-], K= 4 – 1– 1=2
C-C方程
25
三、固-液平衡
dp ∆ fus H m = dT T∆ fusVm
-----Clapeyron方程
∫
p2
p1
dp = ∫
T2Βιβλιοθήκη ∆ fus H mT1
T∆ fusVm
相图及其应用PPT课件
组分数(组元,Component)
组分数:是为了表示体系中各种性质所需要的最少
物种数,或者在一定温度、压力下,体系中可以任意 改变其数量的物质数目,用C表示。 注意:
体系中的物种数(S )和组分数(C )这两个概念的区别 体系中有几种物质,则物种数 S 就是多少;而组分数 C 则
3)固相: 固溶体:即固体溶液,固体以分子或原子状态均匀地分 散到另一种固体的晶格中,形成性质均匀的固体溶液。 对体系中的固体来说,如果固体之间不形成固溶体,则 不论固体分散得多细,一种固体物质就有一个相。 而同一种固体的不同颗粒仍属同一相,因为尽管颗粒之 间有界面,但体相的性质是相同的。 例如:糖和沙子混合,尽管混得很均匀,仍然是两个相。
6
相 (Phase)
1)气相:对体系中的气体来说,由于在通常条件,不论 有多少种气体混合在一起,均能无限掺合,所以体系中 的气体只可能有一个气相。
2)液相:对体系中的液体来说,由于不同液体的互溶程 度不同,可以有一个液相、两个液相,一般不会超过三 个液相(特殊情况可能超过)。
7
相 (Phase)
1. 相图中点、线、区域的含意
由于在普通物理中已学过水的单元系统相图,这里仅就几个 重要的但容易被忽略的问题讨论一下。
① 三相点
同一物质有时可成气态,有时可成液态,有时可成固态,在固态 中 还可能产生相变,这就是说同一物质在不同的温度、压力下可以不同相 状态存在。但是三个相同时共存的只能在唯一的温度和唯一的压强下, 这在T-P图中表现为一个确定的坐标点。这一点当然也必然是三条平衡曲 线的交点,此点称为三相点。
30
一元系统相图
对于水的相图大家都较熟悉, 气、液、固三相点其温度为 273.16K,蒸气压是0.610kPa。 由 于 很 接 近 273.15K , 所 以 有 些初学者往往误认为三相点就 是水的冰点,实际完全不是一 回事。
物理化学(第五版) 演示文稿5-1 相律
推 导:
系统 :有S种物质(1,2,3,…,S)
相 ( α,β,γ,…, )
平衡态 利用已有的知识: 定量、定组成的均相系统只有两个独立变量; 均相系统的强度状态由组成及两个独立强度变量便可 确定
一般情况选 T,p (易测定)
※ 先数变量数
一相一相数
变量数
α相
f 2
例5.2 用精馏法分离苯和甲苯混合物
苯
要求:x(C6H6)≥99.9%
只测定温度、压力(不测浓度)
苯--甲苯 塔釜流出物
可否?
应用相律能回答!
f C 2 222 2
例5.3 单组分系统最多能有几相稳定共存?
f C 2 max 3 f 3 fmax 3 31 2
可用二维坐标表示单组分系统性质之间的关系
相平衡 组分1 1α 1β 1
共有s 种物质
( 1) S
化学平衡
BB 0
若有R个独立反应,则有R个独立关系式
R
已找出独立关系式数 2 ( 1) ( 1) S R 独立关系式有无遗漏?
举例:
向真空容器加入NaHCO3 (s),部分分解为 Na2CO3(s),H2O(g)和CO2(g)。反应: 2NaHCO3(s)=Na2CO3(s) +H2O(g) +CO2(g)
C S R R'
R — 独立的化学反应计量式数目; R′ —除一相中各物质的摩尔分数之和为1这个关系 外,不同物种的组成间的独立关系数。
(3) f ——自由度(数)
用以确定平衡系统的状态所需要的独立的强度变量数 式中“2”—温度、压力
若二者之一恒定不变,则 f C 1
若二者均恒定不变,则
物理化学经典课件相图
上一内容
下一内容
回主目录
返回
2018/10/20
5.3.2.2 相图分析
(1)几何结构 (2)相态分析 (3)杠杆规则的应用
上一内容
下一内容
回主目录
返回
2018/10/20
Cd-Bi二元相图分析
有三个特殊点: A点,纯Bi(s)的熔点 H点,纯Cd(s)的熔点 E点,Bi(s)+Cd(s)+ l 三相共存时的液相相点。 因为E点温度均低于A点和H点的温度,称为低共熔 点(eutectic point)。在该点析出的混合物称为低共熔 混合物(eutectic mixture)。它不是化合物,由两相 组成,只是混合得非常均匀。E点的温度会随外压的改 变而改变。
上一内容 下一内容 回主目录
返回
2018/10/20
溶解度法绘制水-盐相图 图中有两个特殊点:
L点 冰的熔点。盐 的熔点极高,受溶解度 和水的沸点限制,在图 上无法标出。
A点 冰+ (NH4 ) 2 SO4 (s) + 溶液三相共存点。溶液组 成在A点以左者冷却,先 析出冰;在A点以右者冷 却,先析出(NH4 ) 2 SO4 (s)。
上一内容 下一内容 回主目录
返回
2018/10/20
结晶法精制盐类
上一内容
下一内容
回主目录
返回
2018/10/20
5.3.2.3 应用举例
混合物分离
上一内容
下一内容
回主目录
返回
2018/10/20
5.3.3 液态完全互溶、固态完全互溶
---生成连续固溶体类型
• 固溶体:固态溶液,两组分的原子、分子大小相当, 晶体结构相似,可以互相替代晶格中的位置。 • 特点:a)为一相,存在浓度 ; b)与固体混合物不同分类:完全互溶固溶体、 部分互溶固溶体 。 • 结构:(1)置换式固溶体; 如:康铜(60%Cu,40%Ni) (2)间隙式固溶体。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2019/11/25
水的相图
OD 是AO的延长线,是过冷水和水蒸气的介稳平衡 线。因为在相同温度下,过冷水的蒸气压大于冰的 蒸气压,所以OD线在OB线之上。过冷水处于不稳定 状态,一旦有凝聚中心出现,就立即全部变成冰。
O点 是三相点(triple point),气-液-固三相共存, =3,f=0三相点的温度和压力皆 由体系自定。
上一内容 下一内容 回主目录
返回
2019/11/25
水的相图
三个单相区 在气、液、固三个 单相区内,Φ=1,f=2,温度和压 力这两个独立可变因素在一定范 围内变化不会引起相的改变。
上一内容 下一内容 回主目录
返回
2019/11/25
Question
• OC线斜率为负? • OB线比OA线斜率大? 能否从理论上解释?
相律: f K 2
上一内容 下一内容 回主目录
返回
2019/11/25
引言
相图重要性: • 1. 冶金工作者的地图; • 2. 材料设计的指导书; • 3. 小型热力学数据库。
上一内容 下一内容 回主目录
返回
2019/11/25
引言
近代相平衡的发展
• 1882年,拉乌尔得出稀溶液沸点升高和凝固点降低的规律。 • 1887年,范特霍夫提出渗透压公式。 • 1891年,能斯特提出分配定律。 • 1887年,吕.查德里用铂铑热电偶测量粘土加热过程中的变化,是热分析
2019/11/25
水的相图
两相平衡线上的相变过程
在两相平衡线上的任何 一点都可能有三种情况。如 OA线上的P点:
(1)处于f点的纯水,保持 温度不变,逐步减小压力, 在无限接近于P点之前,气 相尚未形成,体系自由度为2。 既温度和压力都独立可变。
上一内容 下一内容 回主目录
返回
2019/11/25
OB为石墨的熔点随压力的变化线; OC为金刚石的熔点随压力的变化线;
(3)常温常压下石墨是热力学的稳定相;
(4)从OA线上读出2000K时约在p=65×108Pa,故转变压力
为 65×108Pa;
(5)
OA线斜率为正值,dp/dT>0 ,而ΔHm<0,则ΔVm< 0 即Vm (金刚石)<Vm (石墨), 则 ρ (金刚石) > ρ(石墨)
法的开始。 • 1919年,柯屈勒发明在上升管中达到平衡的方法,可以在气液平衡实验中
精确测定沸点。 • 1925年,斯韦托斯拉夫斯基在此基础上建立了沸点仪。 • 1928年,奥斯默建立了第一个能有效操作的的气相循环平衡釜,开始了对
混合物气液平衡的精确测定。 • 1876年,吉布斯导出相律,奠定了相平衡的理论基础。 • 1887年,罗彻博研究多相平衡及其分类,用相律说明了不少实际问题,才
上一内容 下一内容 回主目录
返回
2019/11/25
引言
相平衡是热力学在化学领域中的重要应用之一。
研究多相体系的相平衡在化学、化工的科研和生产中 有重要的意义,例如:溶解、蒸馏、重结晶、萃取、 提纯及金相分析等方面都要用到相平衡的知识。
上一内容 下一内容 回主目录
返回
2019/11/25
返回
2019/11/25
课前指导
2. 本章的教学要求
理解相律的意义、推导,掌握其应用。 掌握单组分系统、水的相图。 掌握二组分凝聚系统典型相图的分析和应用,包括 液态完全互溶固态完全不互溶生成简单共晶的二元系 ,固态完全互溶的二元系,液态部分互溶的二元系, 固态部分互溶的二元系(共晶型,包晶型),生成化 合物的二元系,组元在固态具有晶型转变。 掌握用杠杆规则进行分析与计算。 了解由实验数据绘制简单相图的方法。
上一内容 下一内容 回主目录
返回
2019/11/25
2019/11/25
精品课件!
2019/11/25
精品课件!
超临界CO2流体的应用---超临界流体萃取技术
• 利用超临界流体的萃取分离是新近发展起来的高新技术。超临界流 体由于具有较高的体积质量,故有较好的溶解性能,做萃取剂,萃 取效率高,且降压后,萃取剂气化,所剩被溶解物质即被分离出来, 而超临界CO2流体其体积质量几乎是最大的,因此最适宜作超临界萃 取剂。优点如下: (44i8)kg由·m-于3,超且临随界压CO力2流增体加体其积体质积量质大量,增临加界很点快时,其故体对积许质多量有为机物溶 解能力很强。另方面从上图中可以看出,在临界点附近压力和温度
上一内容 下一内容 回主目录
返回
2019/11/25
5.1.3 单元系相图举例
碳的相图
上一内容 下一内容 回主目录
返回
2019/11/25
例
上一内容 下一内容 回主目录
返回
2019/11/25
解
(1) O点是石墨、金刚石、液相共存的三相平衡点; (2)OA为石墨、金刚石之间的相变温度随压力的变化线;
H2O的三相点温度为273.16 K,压力为610.62 Pa。
上一内容 下一内容 回主目录
返回
2019/11/25
O点:H2O的三相点
• 在20世纪30年代初这个三相点还没有公认的 数据。
• 1934年我国物理化学家黄子卿等经反复测试, 测得水的三相点温度为0.00981℃。
• 1954年在巴黎召开的国际温标会议确认此数 据,此次会议上规定,水的三相点温度为 273.16K。
C线曲点7系图的,度.O3,线为统中交、压92M固即,性的点压C力PO体即质阴力CO为a2O则。的的液均影下02.为5超熔固临体一部的1C8过点体界,分体CMOO临升的点处,积P22的界a高升,的于即质。三点;华临蒸此为量图相C曲界O气状超值中之B点线温压态临。线虚后,;度曲的界为线,三为线OCCC上C相COO,3OO线的122点2.该称流2的0为的数的6线为体固°C气值温至超。O—C、为度2,CO临气的液C点为A临界O两液、界为-2界C5相—在O面6止O压.B平气不6消2,、°流力衡平同失COC体为曲衡温,C。
课前指导
1. 本章的主要内容
相律; 水的相图;二组分体系的相图及其应用, 包括:理想的完全互溶双液系,杠杆规则,蒸馏(或 精馏)原理,非理想的完全互溶双液系,部分互溶的 双液系;热分析法绘制低共熔相图、溶解度法绘制水 -盐相图,形成化合物的体系及其它常见二元相图, 区域熔炼等。
上一内容 下一内容 回主目录
上一内容 下一内容 回主目录
返回
2019/11/25
硫的相图
上一内容 下一内容 回主目录
返回
2019/11/25
CO2相图
上一内容 下一内容 回主目录
返回
2019/11/25
详细内容
• 压是力向O的右A变倾线化斜为曲,C线曲O2,线的它的液与斜-—率H固2为O平的正衡相值曲图,线中表,的明即O随CA压O线力2不的增同熔加,点,它随
水的相图
上一内容 下一内容 回主目录
返回
2019/11/25
水的相图
(2)到达P点时,气相出现, 在气-液两相平衡开P点时, 最后液滴消失,成单一气相,
f 2 。
通常只考虑(2)的情况。
上一内容 下一内容 回主目录
返回
5.1.2 相图分析
上一内容 下一内容 回主目录
返回
2019/11/25
水的相图
三条两相平衡线 在两相平衡 线上Φ=2,f=1,压力与温度只 有一个独立可变。指定了压力 ,温度随之而定。
上一内容 下一内容 回主目录
返回
2019/11/25
水的相图
OA 是气-液两相平衡线,即水的蒸气压曲线。它 不能任意延长,终止于临界点。临界点T 647 K , p 2.2107 Pa,在临界点液体密度与蒸气密度相等, 这时气-液界面消失。
上一内容 下一内容 回主目录
返回
2019/11/25
上一内容 下一内容 回主目录
返回
2019/11/25
引言
相变是自然界普遍存在的一种突变现象,也是
物理化学中充满难题和机遇的领域之一。
相变现象丰富多彩,如大海里的万顷碧波,初秋 早晨湖面上的袅袅轻烟和高山上的缕缕薄雾,夏天 黄昏时万里云空中的朵朵彩云及冬日雪后琳琅满目 的雪花和冰晶便是水的各种相态。由此可见自然界 中相变的千姿百态之一斑。
单组分体系的自由度最大为2,是双变量体 系,其相图可用平面图表示,即p-T图。
上一内容 下一内容 回主目录
返回
2019/11/25
5.1.1 实验作图
H2O的相平衡数据
上一内容 下一内容 回主目录
返回
2019/11/25
H2O的相图
上一内容 下一内容 回主目录
返回
2019/11/25
OB 是气-固两相平衡线,即 冰的升华曲线,理论上可延长 至0 K附近。
OC 是液-固两相平衡线,当C点延长至压力大于 2108 Pa ,温度为253k时,有其他晶型的冰生成, 相图变得复杂。
上一内容 下一内容 回主目录
返回
2019/11/25
水的相图
上一内容 下一内容 回主目录
返回
引言
研究对象:多相平衡体系 研究内容:
研究多相平衡体系的状态随外界条件变化 而变化的规律,即温度、压力、浓度等与相态 和相组成的关系。
上一内容 下一内容 回主目录
返回
2019/11/25
引言
相图(phase diagram) 表达多相体系的状态如 何随温度、压力、组成等强度性质变化而变化的图 形,称为相图。
上一内容 下一内容 回主目录
返回
2019/11/25
课前指导
3. 本章的重点和难点
重点:相律及其应用;理想的完全互溶双液系的 相图;杠杆规则;非理想的完全互溶双液系的相 图;热分析法绘制低共熔相图;部分互溶固溶体 的相图。 难点:相律及其应用;杠杆规则及其应用;恒沸 混合物;画步冷曲线;部分互溶固溶体的相图。
