杀菌剂联合毒力测定共15页
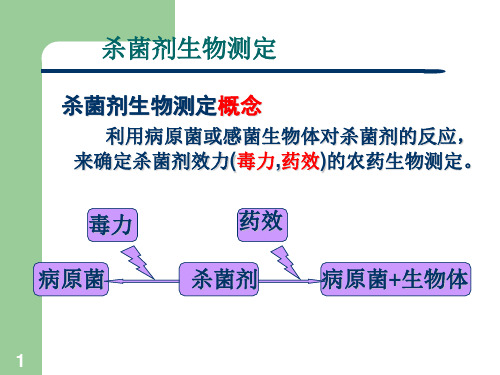
杀菌剂毒力测定
时,每重复了随机观察3个以上视野, 调查孢子总数不少于200个,分别记 录萌发数和孢子总数。
29
Determining fungicide inhibition of pathogen spore germination on concave slides
40
一、杀菌剂毒力测定方法
4 扩散法 管碟法: 在试验平面上放4个牛津杯(外径8mm,
内径6mm,高10mm)。用移液管将已 知浓度的标准液和不同浓度的待测液 移圆筒内,在适温下培养,让其形成 抑菌圈。测其直径。
41
一、杀菌剂毒力测定方法
4 扩散法:农用抗菌素效价测定
抗菌素效价的衡量单位分两类:
一般规定孢子的浓度最好是5万/ml。 15 10*10观察时,每个视野约有35个。
一、杀菌剂毒力测定方法 孢子浓度可用计数器测定 纽鲍尔(Neubauer)血球计数器。 边长为0.05mm的小方格,深度为
0.1mm
16
一、杀菌剂毒力测定方法
1.4 孢子萌发条件 A、温度:各种真菌孢子萌发的最适
6. 数据处理 计算校正的孢子萌发率,求出毒力回
归线,EC50,EC90及95%置信限。
30
一、杀菌剂毒力测定方法
2 生长速率法(mycelium growth rate test)
将不同浓度的药液与融化的培养基混 合,制成带毒培养基平面,在平面上 接种病原菌,以病原菌生长速度快慢 来判定药剂毒力大小。
玉米小斑病菌孢子,适当加入一点玉 米苗的新鲜汁液,在26℃下2h,孢子 萌发率高,整齐。
22
一、杀菌剂毒力测定方法
1.5 调查方法 一般病菌培养20~24小时即可镜检。
29种常用杀菌剂对番茄枯萎病菌和青枯病菌的室内毒力测定

29种常用杀菌剂对番茄枯萎病菌和青枯病菌的室内毒力测定摘要:在实验室内,采用菌丝生长速率法测定了29种杀菌剂对番茄枯萎病菌的抑菌效果,采用纸碟法测定了29种杀菌剂对番茄青枯病菌的抑菌效果。
结果表明,有10种杀菌剂对番茄枯萎病菌的毒力较强(Ec50值相对抑制率计算公式如下:抑菌率=对照菌落直径-处理菌落直径对照菌落直径-菌饼直径×100%。
1.2.2杀菌剂对番茄青枯病菌的毒力测定方法菌液的制备:将番茄青枯病菌在LB斜面上活化,移入50mLLB培养液中,在28℃下振荡(150r/min)培养过夜。
用无菌水将番茄青枯病菌菌液稀释至浓度约为106cFU/mL,备用。
纸碟测定方法参照文献[12-15]:将29种杀菌剂分别制成浓度为1000、100、10、1mg/L,吸取20μL在LB平板中央,每处理重复3皿。
设清水对照。
用上述番茄青枯病菌稀释液(106cFU/mL)喷雾后,28℃培养过夜,调查抑菌圈直径,计算相对抑制率。
应用Excel软件处理系统求出各单剂毒力回归方程、Ec50值及相关系数。
2结果与分析2.1杀菌剂对番茄枯萎病菌的毒力测定采用菌丝生长速率法测定了29种杀菌剂对番茄枯萎病菌的抑菌效果。
2.2杀菌剂对番茄青枯病菌的毒力测定采用纸碟法测定了29种杀菌剂对番茄青枯病菌的抑菌效果。
结果表明,有3种杀菌剂对番茄青枯病菌有较强的毒力,其Ec50值均小于10mg/L(表3、图2),其中3%中生菌素的毒力最强,Ec50值为3.3742mg/L。
其余26种杀菌剂对番茄青枯病菌不表现毒力。
表33种杀菌剂对番茄青枯病菌的室内毒力测定结果药剂名称毒力回归方程相关系数(r)Ec50(mg/L)3%中生菌素y=7.10x+1.250.96823.374280%代森锰锌y=5.58x+0.830.97565.58872%春雷霉素y=4.11x+1.210.94198.35873结论与讨论番茄具有较高的营养价值,深受广大消费者的喜爱。
杀菌剂的毒力测定和

第十页,编辑于星期二:三点 五分。
第十一页,编辑于星期二:三点 五分。
第十二页,编辑于星期二:三点 五分。
第十三页,编辑于星期二:三点 五分。
第十四页,编辑于星期二:三点 五分。
第十五页,编辑于星期二:三点 五分。
第十六页,编辑于星期二:三点 五分。
第一页,编辑于星期二:三点 五分。
第二页,编辑于星期二:三点 五分。
第三页,编辑于星期二:三点 五分,编辑于星期二:三点 五分。
第六页,编辑于星期二:三点 五分。
第七页,编辑于星期二:三点 五分。
第八页,编辑于星期二:三点 五分。
第九页,编辑于星期二:三点 五分。
6种杀菌剂及其混配剂对香栓孔菌的室内毒力测定

Tox ct s fSi n cd s a e rM i t r s t a t ss a e l n n La o a o y iiy Te to x Fu gii e nd Th i x u e o Tr me e u v o e s i b r t r
CHEN J n ,GAO op n 孙 ,ZHANG W e u Gu — ig i~,QI i— u ,WANG Yu 。 ny 。 J e,
W U Ba -u 。 oj n 。WEIXin -I 。 a gjl ,ZHAN Hu il n a—i 。
( .Fe g he g Fo etPetCo to n a a tn ra 1 n c n rs s nr la d Qu r n ie Bu e u,Fe gc e g,Lio i g 1 1 0,Ch n n hn a n n 8 0 1 ia
退菌特 、 石硫合 剂、 可杀 得 、 多菌 灵和 百 菌 清 的 E 分别 为 1. 1 2 . 3 18 4 、6 . 8 4 2 2 和 6 9 、6 8 、 1. 9 3 5 3 、 1 . 9
15 6 7 g・ ; 菌特和代 森锰 锌按 1: 、 3和 3: 5 . 6m I 退 l1: 1比例 混配都表现 出一 定的增效作 用, 中 其 按 1: 3比例 混配增效作 用非常 明显 , 共毒 系数 高达 4 5 9 , C。 为 4 4 1. 0 E 5 仅 . 8mg・ 。 I 。 _ 关 键词 : 木腐 朽病 害; 栓孔 茵 ; 菌剂 ; 力 测定 林 香 杀 毒
杀菌剂的毒力测定和

但近代随着新型内吸杀菌剂的发展,对杀菌剂的生物筛选
逐渐由经典的离体筛选趋向活体筛选。 因为它不仅模拟田间实际,同时可以防止那些在离体平板 上无效,而必须在植物活体上方显示活性的化合物漏筛。 但活体筛选涉及的因素较多,对寄主植物、试验条件要求
较高,如光照、湿度、温度,为控制病原菌与寄主相互作用的
条件,必须有适合的温室,费工耗资都较大。 离体测定能反映化合物毒力的本质和程度,方法简便,为 研制新农药不可缺少,但它存在有一点缺点,应该和温室活体 的盆栽试验结合起来。
过试验确定其药效的好坏,经济效益的高低,
也就是说,田间试验是确定一种药剂在生产 上有无实用价值的主要方法。 田间实验的具体方法可参考《农药药效 试验的设计与分析》一书,防治效果可用以 下公式计算。
一,活性效应显现较快,缺点是有时与活体测
定结果不一致,有时会漏筛或误筛,如用粉锈
宁处理大麦白粉病菌,离体测定不仅分生孢子
能萌发且能形成吸器,但此药在活体上却表现
高效。所以初筛手段不采用平板法,采用盆栽
法,即病原---寄主植物组合法。
2.盆栽方法
在温室内进行的,具体方法随各种不同病害
而异,例:小麦赤霉病采用分生孢子 --- 幼苗
抑制百分率=50%,机率值=5
将 5 代入回归方程,然后求其反对数,即
LD-P-Line(剂量对数---机率值直线)。
ED50 可以作为多种药剂对同一病菌等效剂 量的毒力比较,在一定的范围内可以用它来 衡量一种药剂对病原菌毒力的大小,但不能 做为田间防治的实际指标。
三、田间试验
室内筛选的药剂必须进行田间试验,通
(3)生长速率测定法
即在琼脂培养基中加入药液,冷凝后接
菌的方法,用木塞钻孔器切取正常培养基上
杀菌剂的毒力测定方法

生长速率测定法注意事项:
1)带毒培养基的制作
应先加药液再加培养基(1:9); 对一些受热易分解的药剂则要待培养基 冷却到50度左右时再加入。
2)接种病原菌
如果是菌丝接种,打孔制作菌饼时 取材要从种菌皿的外缘开始,避免使用 中心区的菌丝。
如果是孢子液接种,用接种针蘸取 孢子液后,在带药培养基上划一直线。
6 扩散法
原理:在已接种的培养基上加少量的 抗菌物质,使其接触培养基和病原菌,经 一定时间培养后,接触部分的周围由于抗 菌物质的扩散,而产生抑菌圈(或抑菌 带),其大小与药剂浓度有关系,以此来 比较杀菌剂的毒力大小。
此法主要用于抗生素的效价测定。
农用抗生素的效价
效价是衡量抗生素有效成份和质量好坏的 一个指标。
药剂抗菌力也即药剂毒力。
5 气体效力测定
原理:有些杀菌剂具有挥发性,且有杀 菌特性,在测定这类杀菌剂毒力时,可将麦 芽汁-琼脂培养基置于皿底内,冷凝后接种病 原菌孢子,然后盖上皿盖并倒过来使底成 “盖”,使盖成“底”,并将杀剂菌剂置于 “底”内,放到适于病菌孢子发芽生长的环 境中培养一定时间后观察。
如:嘧啶胺类化合物在室内,以 100ug/ml对灰霉病菌孢子没有抑制作用; 300ug/ml对菌丝生长也不能抑制; 1ug/ml的浓度在田间使用时,却能很好 的防治灰霉病。
药剂与病菌的作用关系
传统的:以其“毒力”抑制或杀死病菌。一 般是一致的。
病菌
药剂
环境
新类型的杀菌剂:
影响病菌的致病过程; 影响寄主的抗病性;
即在各处理组的调查孢子总数中增加调查 孢子数量,增加的数量根据对照组孢子萌发 率换算出来。
如:CK孢子萌发率达98%时,在调查处理 组时,拟定调查数量为100时,此时就要调查 102个,并对其不萌发孢子数减去2,然后计 算孢子萌发率。
实验十五杀菌剂混合毒力测定
三、操作步骤 (一) 孢子悬浮液配制
(二) 带菌培养板制作
水浴加热融化 44-45℃
加孢子悬浮液 混匀,迅速倒入培养皿中
带菌培养板
(三) 带药滤纸条放置
将4 条滤纸条放入药液(单剂或混剂)中浸泡一定时间后沥去多 余的药液,垂直交叉放入带菌平板,置于一定温度下培养,观察 菌落抑制区域的生长形状,并测定大小。
实验十五 杀菌剂混合毒力测定
一、试验目的 学习滤纸条交叉放药法判定杀菌剂混用对生物的影响 了解杀菌剂混合后的生物效应
二、试验原理相加源自药剂 A + 药剂 B
增效
拮抗
本实验通过滤纸条交叉放药法,来简易地判别任何 两种不同药剂混合对病菌生长的影响。
相加
增效
滤纸条交叉放药法对生物的影响
拮抗 互不干扰
七种杀菌剂对番茄早疫病病原菌室内毒力测定
七种杀菌剂对番茄早疫病病原菌室内毒力测定方案,为番茄早疫病的防治提供科学依据,制定出切实可行的防治措施。
1 材料与方法1.1材料1.1.1供试菌株番茄早疫病病原菌株采集于豫北地区番茄种植大棚中的病果,经组织分离、纯化获得病原菌[10]。
1.1.2试验药剂50%异菌脲(病可丹)可湿性粉剂为山东鑫星农药有限公司生产,50%氯溴异氰尿酸(比秀)可湿性粉剂为以色列海法作用保护有限公司生产,80%丙森锌(好锌泰)水分散粒剂为陕西美邦农药有限公司生产,10%苯醚甲环唑(病可丹)水分散粒剂为山东鑫星农药有限公司生产,50%醚菌酯(信赖)可湿性粉剂为陕西美邦农药有限公司生产,32.8%烷基腈氧基醌(凯银)水分散粒剂、35%腐霉利悬浮剂为宜宾川安高科农药有限责任公司生产。
1.2方法1.2.1杀菌剂单剂毒力测定将7种杀菌剂单剂与PDA培养基充分混匀,配制成0.01、0.05、0.10、0.50、1.00、5.00mg/L系列浓度的平板。
采用菌丝生长速率法测定,用5mm打孔器在培养6d后的番茄早疫病菌平板上打孔,用镊子取菌丝面向下接种在含药PDA培养基上,每皿1个菌碟,28℃倒置培养,以去离子水作为对照组,每个处理设3次重复,于接种后第3天检查菌丝生长情况并用十字交叉法测量菌落生长直径,通过菌丝生长抑制率值和各药剂浓度对数值间的线性回归性进行分析,求出各菌株EC50并计算相对抑菌率。
抑菌率计算方法为每个菌落使用十字交叉法测量2次,取其平均数作为菌落的大小。
计算7种杀菌剂对菌丝生长的抑制百分率,公式如下:菌落增长直径=菌落测量直径-菌盘直径抑菌率=(对照菌落增长直径-含药培养基上菌落增长直径)/对照增长菌落直径x100%[11]以浓度对数为横坐标(x),相对抑制率几率值为纵坐标(丫),求出各药剂对供试菌株的毒力回归曲线方程y=a+bx、相关系数r与有效抑制浓度(EC50)。
根据EC50分析比较不同杀菌剂对供试病菌菌丝生长的影响[12]。
8种杀菌剂对西瓜疫霉菌的毒力测定和田间药效试验
摘
要: 采用室 内毒 力测定和田间试验相结合的方法研 究 了 8种 药剂对西瓜 疫病 的毒 力和 药效 。室内毒 力测定结果表
明 ,0 5 %烯酰吗啉、8 6 %精 甲霜 ・ 锰锌 、0 6 %唑 醚 ・ 森联、2 代 7 %霜脲 ・ 锰锌 、4 6 %嗯 霜 ・ 锰锌 、0 丙森锌 、o 7% 4 %三 乙膦 酸铝、 72g L霜霉威 盐酸 盐的 E 5 分 别为 0 33 83 2 25 2 .6 4 、3 0 17 3 .2 7 、5 08 3 3 .96 、8 .55 2 / C0 值 .40 、. 96 、 1 186 2 .2 9 、 167 5 3 .3 3 、7 8 17 80 769
mL 其 中 5%烯酰吗啉对西瓜疫霉 菌的毒力最强。田间试验结果表 明,2 , 0 7 %霜脲 ・ 锰锌 、0 5 %烯酰吗啉和 6 %精 甲霜 ・ 8 锰锌
3种 处理 的 防 效较 好 。
关键词 : 西瓜 ; 疫霉菌 ; 毒力; 田间药效
中 图分 类号 :4 19 文 献标 识 码 : 文 章 编 号 : 0 8 8 (o2 o 06 o ¥ 8. A 1 1— 5 1 2 1 )6— 0 7一 3 0
H i gn , u —gn , UQn—seg , U hn yn ELe— a MA H i a g G i hn G O C eg— u ( .Istt o l t rt tn J nx A ae yo A r u ua S i cs N nhn 32 0 C ia 2 Z eghuFu re 1 ntu f a o c o , i gi cdm f g cl rl c ne , acag300 , hn ; . hnzo riTe i e PnP ei a i t e t
5种杀菌剂对桃炭疽病菌的毒力测定
中国园艺文摘 2018年第3期5种杀菌剂对桃炭疽病菌的毒力测定胡晓颖,赵 杰(上海市浦东新区农业技术推广中心,上海 201201)摘 要:以桃炭疽病菌为试验菌,采用生长速率法,测定5种杀菌剂对病菌的毒力,结果表明:咪鲜胺锰盐、氟啶胺、多菌灵、苯醚甲环唑和吡唑醚菌酯5种杀菌剂都具有较高的毒力。
咪鲜胺锰盐与氟啶胺的联合毒力测定结果表明:咪鲜胺锰盐和氟啶胺按3∶1和6∶1复配表现为增效作用,咪鲜胺锰盐和氟啶胺按1∶6、1∶3和1∶1复配表现为相加作用。
关键词:杀菌剂;桃炭疽病菌;毒力测定水蜜桃是我国的主要果品之一,也是上海市浦东新区的主要果树,常年种植面积0.2…万余hm2。
桃炭疽病是水蜜桃的主要病害,能侵染桃树枝梢、叶片和果实[1],在上海市浦东新区以秋季叶片受害最重,造成叶片穿孔或枯焦,严重时导致大量叶片枯死和早落,影响花芽和结果枝充实,从而影响翌年结果产量。
科技工作者在桃树炭疽病菌生物学特性和防治方面开展大量工作[2-5],但不同地区和寄主存在差异。
本文以当地桃炭疽病菌为试验材料,通过开展杀菌剂的毒力测定,筛选出高效低毒药剂,为防治该病害提供技术参考。
1 材料与方法1.1 供试病菌从浦东新区盛果期桃树病叶上分离获得桃炭疽病菌[Colletotrichum gloeosporioides…(Penz.)…Sacc.],病菌于PDA培养基上25℃培养5…d后用于毒力测定。
1.2 供试药剂50%咪鲜胺锰盐可湿性粉剂(江苏辉丰农化股份有限公司)、50…g/L氟啶胺悬浮剂(浙江石原金牛农药有限公司)、50%多菌灵悬浮剂(江苏龙灯化学有限公司)、30%吡唑醚菌酯悬浮剂(深圳诺普信农化股份有限公司)、10%苯醚甲环唑水分散粒剂(江苏丰登农药有限公司)。
1.3 试验方法1.3.1 毒力测定方法…采用生长速率法[6]:将以上第一作者简介:胡晓颖(1979-),女,农艺师;从事作物栽培研究。
通讯作者:赵 杰,硕士,高级农艺师。
