《构成物质的微粒(Ⅱ)——原子和离子》PPT课件
合集下载
《构成物质的微粒(Ⅱ)-原子和离子》精品复习课件

知识回顾
注意:原子在化学变化中是否可分? 原子是化学变化中最小粒子,不能再分,但原子本身 还有更复杂的结构,通过其他方法可以再分。在化学 变化中,原子的种类、质量、数量等都不发生变化。
知识回顾
3.原子的性质 (1)质量、体积都很_小___。 (2)在不停地运动且与温度有关;温度越高,运动 速率越_快___。 (3)原子间存在间隔。同一物质气态时原子间间隔 最__大__,固态时原子间间隔最_小___。 物体的热胀冷缩 现象就是原子间的间隔受热时_增__大___,遇冷时__变__小__ 的缘故。
例题解析
►类型二 原子结构中各粒子间的关系 命题角度:考查学生对原子结构的掌握情况。
例2 据报道上海某医院正在研究用放射性碘治疗肿瘤。 这种碘原子的核电荷数为53,相对原子质量为125。下 列关于这种原子的说法中,错误的是( B )
A.中子数为72
B.质子数为72
C.电子数为53
D.质子数和中子数之和为125
知识回顾
8.原子种类与原Байду номын сангаас结构的关系
原子分类
稀有气 体原子
最外层电 子数
原子结构 变化趋势 化学性质
(稳定或不 稳定)
(得失电子)
(稳定或 活泼)
8个(氦 为2个)
相对稳 定结构
不得不失
稳定
金属原子
一般小 于4个
不稳定结构
易失电子
活泼
非金属原子
一般大 于4个
不稳定结构
易得电子
活泼
知识回顾
知识点2 离子
1.定义:__带__电____的原子叫做离子。
2.分类: 离子
阳离子 阴离子
带正电的原子,如Na+ 带负电的原子,如Cl-
注意:原子在化学变化中是否可分? 原子是化学变化中最小粒子,不能再分,但原子本身 还有更复杂的结构,通过其他方法可以再分。在化学 变化中,原子的种类、质量、数量等都不发生变化。
知识回顾
3.原子的性质 (1)质量、体积都很_小___。 (2)在不停地运动且与温度有关;温度越高,运动 速率越_快___。 (3)原子间存在间隔。同一物质气态时原子间间隔 最__大__,固态时原子间间隔最_小___。 物体的热胀冷缩 现象就是原子间的间隔受热时_增__大___,遇冷时__变__小__ 的缘故。
例题解析
►类型二 原子结构中各粒子间的关系 命题角度:考查学生对原子结构的掌握情况。
例2 据报道上海某医院正在研究用放射性碘治疗肿瘤。 这种碘原子的核电荷数为53,相对原子质量为125。下 列关于这种原子的说法中,错误的是( B )
A.中子数为72
B.质子数为72
C.电子数为53
D.质子数和中子数之和为125
知识回顾
8.原子种类与原Байду номын сангаас结构的关系
原子分类
稀有气 体原子
最外层电 子数
原子结构 变化趋势 化学性质
(稳定或不 稳定)
(得失电子)
(稳定或 活泼)
8个(氦 为2个)
相对稳 定结构
不得不失
稳定
金属原子
一般小 于4个
不稳定结构
易失电子
活泼
非金属原子
一般大 于4个
不稳定结构
易得电子
活泼
知识回顾
知识点2 离子
1.定义:__带__电____的原子叫做离子。
2.分类: 离子
阳离子 阴离子
带正电的原子,如Na+ 带负电的原子,如Cl-
2022年秋科粤版九年级化学上册课件:构成物质的微粒(Ⅱ)—原子和离子第1课时原子

2.3 构成物质的微粒(Ⅰ)——分子
探究点二 分子与原子的区别与联系
[情景展示]分子和原子都可以构成物质。 [问题探究] “原子小、分子大;分子重,原子轻”这样的说法对吗?分子 和原子有何联系呢? [思考交流]
2.3 构成物质的微粒(Ⅰ)——分子
[归纳总结] 关于分子和原子的区别,特别要注意在没有前提条件下以下几种 说法都是错误的:①分子大,原子小;②分子重,原子轻;③分 子能直接构成物质,而原子不能;④分子能保持物质的化学性质, 而原子不能。当物质由分子直接构成时,分子保持该物质的化学 性质,此时构成分子的原子不能保持物质的化学性质;当物质由 原子直接构成时,原子保持该物质的化学性质;分子是由原子构 成的,在化学变化中分子可以分解成原子。
[问题探究] 上图所示物质是纯净物吗?纯净物和混合物从微观角度如何解 释? [思考交流]
2.3 构成物质的微粒(Ⅰ)——分子
[归纳总结] 运用分子的观点区分混合物和纯净物:从宏观上看,由一种物质 组成的是纯净物,如氧气、水等;由两种或两种以上物质组成的 是混合物,如空气、澄清石灰水等。从微观角度上看,对由分子 直接构成的物质来讲,纯净物是由同种分子构成的,混合物是由 不同种分子构成的。 [课堂速记]
2022年秋科粤版九年级 化学上册课件:构成物 质的微粒(Ⅱ)—原子
和离子第1课时原子
第二章 空气、物质的构成
2.3 构成物质的微粒(Ⅱ) ——原子和离子
第1课时 原子
问题导学
新知学习
互动探究
课堂反馈
2.3 构成物质的微粒(Ⅰ)——分子
问题导学
2.3 构成物质的微粒(Ⅰ)——分子
新知学习
知识点一 原子是什么
2.3 构成物质的微粒(Ⅰ)——分子
科粤版化学-九年级上册-《构成物质的微粒(Ⅱ)-原子和离子》

课堂 小结
❖化学变化中的最小微
粒
❖原子
❖质 子
❖原 ❖原子的结
核
❖中
子
构
❖核外电 子
原 子 和
❖相对原子质
子
量
离 子
❖原子得失电子形成离 ❖离 ❖带电的原子子或原子
子
团❖阳离
❖分 类
❖阴子离
子
Thyoaunk
End
一个氢原子的质量只有1.674×10-27kg,
即
1.674
kg
1 000 000 000 000 000 000 000 000 000
H
如此小的值,
该如何计算
相对原子质量(Ar) =
原子的实际质量 碳原子质量的1/12
新知 学习
C
碳原子
碳原子质量的1/12
氧原子的相对原子质量= O ÷ ≈16
❖原子的构 成
新知 学习
点 击 图 片 播 放 动 画
新知 学习
物理学家玻尔
+++ ++++ +++
电子壳层模型
新知 学习
表示原子核以及 核内的质子数
+8 ❖2❖6
表示电子层 以及电子层 上的电子数
❖氧原子的结构示意 图
最外层电子数不超过8个(只有一层的,电子不超过2个)
新知 学习 非金属原子 稀有气体原子
原子是构成物质世界的最小微粒吗?
新知 学习
英国科学家汤姆森
-
-
--
-
电子
汤姆森原子模型
新知 学习
α粒子束发生偏转
α
粒 子
+
粤教版化学-九年级上册-《2.3 构成物质的微粒(Ⅱ)——原子和离子》参考课件

稀有气 体元素
非金属 元素
金属元 素
1-18号元素的原子结构示意图
氢(H) 氢(H)
氦(He) 氦(He)
锂(Li) 铍(Be) 硼(B) 碳(C) 氮(N) 氧(O) 氟(F) 氖(Ne )
钠(Na) 镁(Mg) 铝(Al) 硅(Si) 磷(P) 硫(S)
稀有气 体元素
最外层 是否达到相 电子数 对稳定结构
-
-
--
-
-
钠原子
-- - +11 - -
--
氯原子
-
---
-
- +17
-
-
--
-- -
-
-
钠原子
---
-
+11
-
-
--
氯原子
-
-- -
-
+17
-
--
-
-
-
--
--
钠离子
--
-
--
+11
--
-
--
+11 2 8 Na+
氯离子
我
-
-
-
--
--
-
-
+17
, !
谢 谢
也 稳 定
了
-
---
-
-
-
-
+17 2 8 8
(填“得到”或“失去”)一个电子, 所形成的离子符号为__C_l_-__。
Cl
(3)钠原子和氯原子相同的是___③___(填序号)。
①质子数 ②电子数 ③电子层数 ④最外层电子数。
达标测试
下图形象地表示了氯化钠的形 成过程.下列相关叙述中不正
2.3 构成物质的微粒(‖)—原子和离子

相互联系:分子
分裂 原子 构成
注意:分子和原子不能比较大小 一切分解反应都可以说明在化学变化中分 子可分,原子不可分。 微粒之间的间隔大小决定物质有三态
例1、能证明分子在化学反应中可以再分的变化是( A、碘受热变成碘蒸气 B、一定条件下用二氧化碳制干冰 C、块状硫研磨成硫粉 D、加热氧化汞产生氧气
构成原 子的粒 子 质量/kg 相对质 量
电子 质子 9.109×10-31
原子核 中子
1.673×10-27 1.675×10-27
1/1836
1.007
1.008
结论:原子核虽小,但整个原子的质量几乎
集中在原子核上。(质子和中子)
1、原子的内部结构是怎样的?
2、原子不显电性的原因?
3、原子的核外电子是怎样排布的?
2.3
构成物质的微粒(‖)— 原子和离子
(第三课时)
原子的质量有多大 离子怎样形成
原子核比原子小得多 原子(体育场 ) 原子核(蚂蚁)
原子很小,原子核更小
原子很小,让我们看看一个原子有多重:
一个碳原子的质量是:
即1.993×10-26千克 一个氧原子的质量是: 0.00000000000000000000000002657千克 即2.657×10-26千克 一个铁原子的质量是: 0.00000000000000000000000009288千克 即9.288×10-26千克
)
6、分子、原子、物质之间的关系
原子 构成 分子 构成 物质
直接构成
注:直接由原子构成的物质有:金属、稀有气体、 固体非金属。
检查站(课本47页)
空气中的物质 氮气N2 氧气O2 二氧化碳CO2 水蒸气H2O 稀有气体He Ne 构成该物质的分 构成该分子的原 子 子
《构成物质的微粒——原子和离子》PPT

A.分子和原子都可以构成物质 B.由分子构成的物质,分子是保持其化学性质的最小粒 子 C.在化学变化中,分子可以分成原子,原子又可以结合 成新的分子 D.分子和原子之间都有间隔,分子之间间隔较大,原子 之间间隔较小
4.分子和原子的主要区别是( B)
A.分子质量大,原子质量小 B.在化学反应中分子可分,原子不可分 C.分子会运动,原子不会运动 D.分子间有空隙,原子间无空隙
A.分子运动而原子不运动 B.分子可分而原子不可分 C.分子构成物质而原子不能构成物质 D.原子可以构成分子,分子可以分成原子
2.下列关于原子的叙述中,正确的是 ( A )
A.原子是化学变化中的最小微粒 B.原子是静止不动的微粒 C.原子是保持物质化学性质的最小微粒 D.原子是不能再分的最小微粒
3.下列关于分子和原子的说法,错误的是 ( D )
2.在化学变化中,分子本身发生变化,而原子 本身没有变化,只是重新组合成新的分子,构 成新的物质,所以,原子是化学变化中的最小 微粒。
有些物质是由原子直接构成的。
由原子直接的物质分为三类
1、金属
如:金、银、铜、铁、镁、汞等
2、非金属
如:碳、硫、磷、等
3、稀有气体 如:氦气、氖气、氩气等
化学反应的实质:
练习
空气中的物质
氮气(N2) 氧气(O2) 二氧化碳(CO2)
水蒸气(H2O) 稀有气体 (He、
Ne、Ar等)
构成该物质的 构成该物质的
分子
原子
氮气分子
氮原子
氧气分子
氧原子
二氧化碳 氧原子,碳
分子
原子
水分子
氧原子,碳 原子
它们的一个分子由相应的各一 个原子构成
练习:
4.分子和原子的主要区别是( B)
A.分子质量大,原子质量小 B.在化学反应中分子可分,原子不可分 C.分子会运动,原子不会运动 D.分子间有空隙,原子间无空隙
A.分子运动而原子不运动 B.分子可分而原子不可分 C.分子构成物质而原子不能构成物质 D.原子可以构成分子,分子可以分成原子
2.下列关于原子的叙述中,正确的是 ( A )
A.原子是化学变化中的最小微粒 B.原子是静止不动的微粒 C.原子是保持物质化学性质的最小微粒 D.原子是不能再分的最小微粒
3.下列关于分子和原子的说法,错误的是 ( D )
2.在化学变化中,分子本身发生变化,而原子 本身没有变化,只是重新组合成新的分子,构 成新的物质,所以,原子是化学变化中的最小 微粒。
有些物质是由原子直接构成的。
由原子直接的物质分为三类
1、金属
如:金、银、铜、铁、镁、汞等
2、非金属
如:碳、硫、磷、等
3、稀有气体 如:氦气、氖气、氩气等
化学反应的实质:
练习
空气中的物质
氮气(N2) 氧气(O2) 二氧化碳(CO2)
水蒸气(H2O) 稀有气体 (He、
Ne、Ar等)
构成该物质的 构成该物质的
分子
原子
氮气分子
氮原子
氧气分子
氧原子
二氧化碳 氧原子,碳
分子
原子
水分子
氧原子,碳 原子
它们的一个分子由相应的各一 个原子构成
练习:
科粤版九年级化学上册--第二章 2.3《构成物质的微粒(Ⅱ)—原子和离子》第一课时课件

1.原子的定义。 2.原子的构成。 3.原子核外电子排布知识。
练习巩固
1.下列有关原子的叙述,正确的是( B )
A.任何物质都是由原子直接构成的 B.原子是化学变化中的最小粒子 C.原子核带正电,电子带负电,所以原子是带电的粒 子 D.核电荷数=质子数=中子数=核外电子数
练习巩固
2.原子是由位于原子中心带
电的
和
核外带
电的
构成的,由于 所
带电量和
所带电量相等,但
,因
此整个原子不显电性。原子核一般是由 构成
的,质子带
,中子
,原子的质
量主要集中在
上。
板书设计
2.3构成物质的微粒(Ⅱ)—原子 1.原子定义: 2.原子的构成 3.原子的核外电子排布
布置作业
1.完成同步测试卷 2.画1——20号原子的结构示意图 3.预习离子
无法分割
讲授新课 汤姆森原子模型
-
---
-
汤姆森认为
原子是带正电荷的小球, 电子镶嵌在里面
讲授新课 卢瑟福实验
为什么绝大多数α粒 子能顺利穿过金箔, 而极少数α被反弹回 来?
高速α粒子流
讲授新课 卢瑟福实验
讲授新课 卢瑟Leabharlann 原子模型-- + - 卢瑟福认为
- 原子大部分体积是空的,
电子围绕很小的带正电荷 的原子核运转
粤教版初中化学九年级上册
第2单元
第3课
导入新课
上节课我们学习了构成物质的微粒—分子。那 分子能不能分割呢?对,分子可以分割,可以 分成更小的微粒,这就是原子,下面我们来看一 个实验。
讲授新课
图为氧化汞分解实验照片 将红色粉末氧化汞装在试管 里加强热。 现象:试管内壁上出现银光 闪闪的物质,并能收集到能 支持可燃物燃烧的气体。
练习巩固
1.下列有关原子的叙述,正确的是( B )
A.任何物质都是由原子直接构成的 B.原子是化学变化中的最小粒子 C.原子核带正电,电子带负电,所以原子是带电的粒 子 D.核电荷数=质子数=中子数=核外电子数
练习巩固
2.原子是由位于原子中心带
电的
和
核外带
电的
构成的,由于 所
带电量和
所带电量相等,但
,因
此整个原子不显电性。原子核一般是由 构成
的,质子带
,中子
,原子的质
量主要集中在
上。
板书设计
2.3构成物质的微粒(Ⅱ)—原子 1.原子定义: 2.原子的构成 3.原子的核外电子排布
布置作业
1.完成同步测试卷 2.画1——20号原子的结构示意图 3.预习离子
无法分割
讲授新课 汤姆森原子模型
-
---
-
汤姆森认为
原子是带正电荷的小球, 电子镶嵌在里面
讲授新课 卢瑟福实验
为什么绝大多数α粒 子能顺利穿过金箔, 而极少数α被反弹回 来?
高速α粒子流
讲授新课 卢瑟福实验
讲授新课 卢瑟Leabharlann 原子模型-- + - 卢瑟福认为
- 原子大部分体积是空的,
电子围绕很小的带正电荷 的原子核运转
粤教版初中化学九年级上册
第2单元
第3课
导入新课
上节课我们学习了构成物质的微粒—分子。那 分子能不能分割呢?对,分子可以分割,可以 分成更小的微粒,这就是原子,下面我们来看一 个实验。
讲授新课
图为氧化汞分解实验照片 将红色粉末氧化汞装在试管 里加强热。 现象:试管内壁上出现银光 闪闪的物质,并能收集到能 支持可燃物燃烧的气体。
九年级化学上册2.3构成物质的微粒Ⅱ—原子和离子3
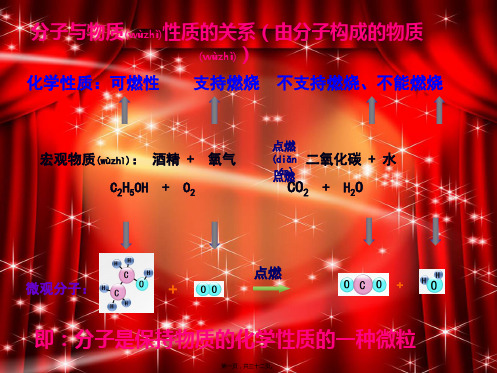
现象:试管内壁上出现(chūxiàn)银光闪闪的水银(又名汞), 并能生成使带火星木条复燃的气体(氧气)。
第五页,共三十二页。
氧化汞发生了用下面文字表示(biǎoshì)的变化:
氧化汞 加热(jiā rè) 汞 + 氧气
(HgO) (Hg) (O2)
思考:
1.在化学变化中,反应物氧化汞的分子(fēnzǐ)发 生了怎样变化?
分子与物质(wùzhì)性质的关系(由分子构成的物质 ) (wùzhì)
化学性质:可燃性 支持燃烧 不支持燃烧、不能燃烧
宏观物质(wùzhì): 酒精 + 氧气 C2H5OH + O2
点燃
(diǎn 二氧化碳 + 水
点rán燃C)O2 + H2O
点燃
微观分子:
+
+
即:分子是保持物质的化学性质的一种微粒
(2)有一小部分α粒子改变了原来的运动路径,原因
是
它们途径金原子核附近时,受到斥力而改变
了原来运动方向.说明原子核带正电
(3)极少数α粒子被弹了回来。原因是
它们撞击到金原子核而被弹回.说明(shuōmíng)原子 原子核几乎集中了原子的全部质量
第二十六页,共三十二页。
当堂 检测 (dānɡ tánɡ)
1.1803年,道尔顿原子(yuánzǐ)模型
道尔顿认为
原子是坚硬(jiānyìng)、光滑的实心小球, 无法分割
第十四页,共三十二页。
2.1904年汤姆森原子(yuánzǐ)模型
-
---
英国(yīnɡ
-
汤姆森认为
物理 ɡuó)
原子是带负电荷的
学家汤 姆森
电子镶嵌在里面(lǐmiàn)就象
第五页,共三十二页。
氧化汞发生了用下面文字表示(biǎoshì)的变化:
氧化汞 加热(jiā rè) 汞 + 氧气
(HgO) (Hg) (O2)
思考:
1.在化学变化中,反应物氧化汞的分子(fēnzǐ)发 生了怎样变化?
分子与物质(wùzhì)性质的关系(由分子构成的物质 ) (wùzhì)
化学性质:可燃性 支持燃烧 不支持燃烧、不能燃烧
宏观物质(wùzhì): 酒精 + 氧气 C2H5OH + O2
点燃
(diǎn 二氧化碳 + 水
点rán燃C)O2 + H2O
点燃
微观分子:
+
+
即:分子是保持物质的化学性质的一种微粒
(2)有一小部分α粒子改变了原来的运动路径,原因
是
它们途径金原子核附近时,受到斥力而改变
了原来运动方向.说明原子核带正电
(3)极少数α粒子被弹了回来。原因是
它们撞击到金原子核而被弹回.说明(shuōmíng)原子 原子核几乎集中了原子的全部质量
第二十六页,共三十二页。
当堂 检测 (dānɡ tánɡ)
1.1803年,道尔顿原子(yuánzǐ)模型
道尔顿认为
原子是坚硬(jiānyìng)、光滑的实心小球, 无法分割
第十四页,共三十二页。
2.1904年汤姆森原子(yuánzǐ)模型
-
---
英国(yīnɡ
-
汤姆森认为
物理 ɡuó)
原子是带负电荷的
学家汤 姆森
电子镶嵌在里面(lǐmiàn)就象
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
金刚石是由_碳__原__子_构成的
石墨
归纳:原子
1、原子是化学变化中的最小粒子 2、原子可以构成分子: 如氧分子是由_两__个__氧__原__子__构成的。 3、原子可以直接构成物质:如金刚石和石墨 都是由_碳_原__子_构成的,铁是由_铁_原__子__构成的。
4、原子具有微观粒子的共性。
原子和分子大吗?
【复习】分子的性质
1.分子的 体积和质
量很小 2、 分子总是在 不断地运动
3.分 子 间 有间隔
分子是保持其化学性质的一种微粒
原子的性质
1.原子的体 积和质量
也很小 2、
原子总是在 不断地运动
3.原子 间 有间隔
原子是化学变化中的最小粒子。
H 一个氢原子
H
H 两个氢原子构成一个氢分子
O 一个氧原子 O 两个氧原子构成一个氧分子 O
常见分子模拟模型
讨论:氢气在氯气中燃烧生成氯化氢,试分析在氢气
与氯气的反应、水的分解等化学变化中,分子和原子
的变化情况,推论在化学变化中,发生变化的是分子
还是原子?
H H
Cl 点燃
Cl
Cl 重新 H Cl 组合
一个碳原子的质量:1.993×10 -26 kg
氢原子 1.667*10—27Kg 碳原子 1.993*10—26Kg 氧原子 2.657*10—26Kg 铁原子 9.288*10—26Kg
三、原子的质量有多大
1.实际质量 2.相对质量
相对原子质量——以一种碳原子的质量的1/12作为 标准,其它原子的质量跟它比较所得的数值,就是 这种原子的相对原子质量。
1897年汤姆生发现电子
二、原子内部有何奥秘
质子 原子 (原带子正电核)((1中不个带子质电子)带1个单位正电荷) (中性) 核外电子
(1个电子带1个单位负电荷)
1.原子的质量主要集中在原子核上。 2.核电荷数=质子数 =核外电子数。
3.质子数相同的原子为同“类”原子; 质子数和中子数均相同的原子为同“种”原子数。
1、由分子构成的物质在发生物理变化时,物质的分子 本身没有变化,通过演示可以得出:分子是保持物质化 学性质的最小微粒。
化学变化的实质: 在化学变化中分子分裂成原 子,原子不能再分,而是重新构成新的分子。
2、在化学变化中,发生变化的是分子,原子没有发生 变化,所以说:原子是化学变化中的最小微粒。
物理变化和化学变化比较:
4.并非所有的原子内都有中子。
锂原子的构成
+3 2 1
原子是非常小的微粒。 如氧原子的直径为1.48×10-
10m,如果 把氧原子紧密地 排成 1.48cm长的一列,大 约需要1亿个原子。 如果将氢原子与直径为1cm 的小球相比,相当于将一个 水果与地球相比。
一个氧原子的质量:2.657×10-26 kg
①X原子的相对原子质量 =
1 个 X原子的实际质量 一个碳-12原子的实际质量/12
②相对原子质量是一个比值,它的SI单位是“一”, 符号是“1”(一般省略不写)。
③相对原子质量≈质子数+ 中子数。
④原子的相对原子质量之比等于其实际质量之比。
【有关原子核密度的资料 】 原子核密度很大,假如在1cm3的容器里装 满原子核,则它的质量相当于1.2×108 t, 可以形象地比喻为需要3000万辆载重4t的 卡车来运载。
1、在下列各物质中,含有氧分子的是( )。
A、CO2
B、H20 C、MnO2 D、空气
2、从微粒的角度解释下列问题:
(1)混合物和纯净物有何不同?
(2)水蒸发后,化学性质没有变。
3、说出下列物质各是由什么微粒构成?
A.CO2 B、H2O C、Cu D、He F、金刚石
4、下列说法中正确的是( ) A、水电解生成氢气和氧气,说明水中含有氢分子和氧分子。 B、在水电解的反应中,氢原子和氧原子都没有发生变化。 C、水的蒸发和水的电解都生成气体,它们都是化学变化。 D、物质在变化中表现出来的性质,就是物质的化学性质。 5、判断下列说法是否正确,变说明理由。 (1)同种物质的分子性质相同,不同种物质的分子性质不同。 (2)同种原子可以结合成分子,不同种原子不能结合成分子。 (3)空气是由空气分子构成的。
物理变化
化学变化
宏观
没有生成新物质
微观
分子没有改变,分子间的间 隔改变
生成了新物质 分子本身改变,生成了新分子
分子是保持其化学性质的一种微粒
一、原子是什么 1.定义:原子是化学变化中的最小粒子。
➢ 化学变化中,分子可以分成原子,而原子不能分。 原子是构成物质的又一种基本粒子,常见的金属 (铁、铜、汞等)及稀有气体(如氦、氖等)都 是由原子直接构成。
1、一滴水的分子个数:1021个水分子构成, 1ml水需要约20滴水组成。
2、如果把水分子放大到乒乓球那么大,那么 乒乓球就要放大到地球那么大。
3、铅笔留下的黑色的笔迹是碳原子的堆积, 一个句号竟有1018个碳原子。
分子很小,原子更小
原子的内部是 什么样子呢?
1911年卢瑟福α粒子散射实验
卢瑟福原子模型
2.3 物质构成的微粒(Ⅱ)——原子 和离子
构成物质的微粒(Ⅱ) ——原子
原 子是什 么 原子内部有何奥秘 原子的质量有多大
离子怎样形成
氧化汞分解的微观过程
分解
+
氧化汞分子
+
汞原子
组合
氧原子
氧分子
组合以 从这幅图中获
得哪些信息?
氧化汞受热分解生成了汞和氧气。 氧化汞是由氧化汞分子构成的。 氧化汞分子分解成了汞原子和氧原子。 汞原子直接构成了金属汞。 每两个氧原子构成一个氧分子。
H
H O 两个氢原子和一个氧原子构成一个水分子
所以说:分子是由原子构成的。
总结
分子和原子都是肉眼看不见的; 分子、原子都是构成物质的基
本粒子; 分子是由原子构成的。
从本课题中我们应该知道: ⑴物质是由原子、分子等微小粒子构成的。 ⑵分子是保持物质化学性质的最小粒子。 ⑶原子是化学变化中的最小粒子,原子可以相 互结合形成分子。
➢ 原子小但现代技术可操纵原子。
人类对原子的认识
原子学说创始 人--道尔顿
人类对原子的认识
通过移动 硅原子构 成的文字
原子操 纵术
通过扫描隧道显微镜移动12个 溴原子所拍的纳米级图像
巴克纸中的多壁碳纳米管 在原子力显微镜下的图像
扫描隧道电子显显镜 拍摄的硅原子图像
铁原子写出 的原子图像
金刚石
石墨
归纳:原子
1、原子是化学变化中的最小粒子 2、原子可以构成分子: 如氧分子是由_两__个__氧__原__子__构成的。 3、原子可以直接构成物质:如金刚石和石墨 都是由_碳_原__子_构成的,铁是由_铁_原__子__构成的。
4、原子具有微观粒子的共性。
原子和分子大吗?
【复习】分子的性质
1.分子的 体积和质
量很小 2、 分子总是在 不断地运动
3.分 子 间 有间隔
分子是保持其化学性质的一种微粒
原子的性质
1.原子的体 积和质量
也很小 2、
原子总是在 不断地运动
3.原子 间 有间隔
原子是化学变化中的最小粒子。
H 一个氢原子
H
H 两个氢原子构成一个氢分子
O 一个氧原子 O 两个氧原子构成一个氧分子 O
常见分子模拟模型
讨论:氢气在氯气中燃烧生成氯化氢,试分析在氢气
与氯气的反应、水的分解等化学变化中,分子和原子
的变化情况,推论在化学变化中,发生变化的是分子
还是原子?
H H
Cl 点燃
Cl
Cl 重新 H Cl 组合
一个碳原子的质量:1.993×10 -26 kg
氢原子 1.667*10—27Kg 碳原子 1.993*10—26Kg 氧原子 2.657*10—26Kg 铁原子 9.288*10—26Kg
三、原子的质量有多大
1.实际质量 2.相对质量
相对原子质量——以一种碳原子的质量的1/12作为 标准,其它原子的质量跟它比较所得的数值,就是 这种原子的相对原子质量。
1897年汤姆生发现电子
二、原子内部有何奥秘
质子 原子 (原带子正电核)((1中不个带子质电子)带1个单位正电荷) (中性) 核外电子
(1个电子带1个单位负电荷)
1.原子的质量主要集中在原子核上。 2.核电荷数=质子数 =核外电子数。
3.质子数相同的原子为同“类”原子; 质子数和中子数均相同的原子为同“种”原子数。
1、由分子构成的物质在发生物理变化时,物质的分子 本身没有变化,通过演示可以得出:分子是保持物质化 学性质的最小微粒。
化学变化的实质: 在化学变化中分子分裂成原 子,原子不能再分,而是重新构成新的分子。
2、在化学变化中,发生变化的是分子,原子没有发生 变化,所以说:原子是化学变化中的最小微粒。
物理变化和化学变化比较:
4.并非所有的原子内都有中子。
锂原子的构成
+3 2 1
原子是非常小的微粒。 如氧原子的直径为1.48×10-
10m,如果 把氧原子紧密地 排成 1.48cm长的一列,大 约需要1亿个原子。 如果将氢原子与直径为1cm 的小球相比,相当于将一个 水果与地球相比。
一个氧原子的质量:2.657×10-26 kg
①X原子的相对原子质量 =
1 个 X原子的实际质量 一个碳-12原子的实际质量/12
②相对原子质量是一个比值,它的SI单位是“一”, 符号是“1”(一般省略不写)。
③相对原子质量≈质子数+ 中子数。
④原子的相对原子质量之比等于其实际质量之比。
【有关原子核密度的资料 】 原子核密度很大,假如在1cm3的容器里装 满原子核,则它的质量相当于1.2×108 t, 可以形象地比喻为需要3000万辆载重4t的 卡车来运载。
1、在下列各物质中,含有氧分子的是( )。
A、CO2
B、H20 C、MnO2 D、空气
2、从微粒的角度解释下列问题:
(1)混合物和纯净物有何不同?
(2)水蒸发后,化学性质没有变。
3、说出下列物质各是由什么微粒构成?
A.CO2 B、H2O C、Cu D、He F、金刚石
4、下列说法中正确的是( ) A、水电解生成氢气和氧气,说明水中含有氢分子和氧分子。 B、在水电解的反应中,氢原子和氧原子都没有发生变化。 C、水的蒸发和水的电解都生成气体,它们都是化学变化。 D、物质在变化中表现出来的性质,就是物质的化学性质。 5、判断下列说法是否正确,变说明理由。 (1)同种物质的分子性质相同,不同种物质的分子性质不同。 (2)同种原子可以结合成分子,不同种原子不能结合成分子。 (3)空气是由空气分子构成的。
物理变化
化学变化
宏观
没有生成新物质
微观
分子没有改变,分子间的间 隔改变
生成了新物质 分子本身改变,生成了新分子
分子是保持其化学性质的一种微粒
一、原子是什么 1.定义:原子是化学变化中的最小粒子。
➢ 化学变化中,分子可以分成原子,而原子不能分。 原子是构成物质的又一种基本粒子,常见的金属 (铁、铜、汞等)及稀有气体(如氦、氖等)都 是由原子直接构成。
1、一滴水的分子个数:1021个水分子构成, 1ml水需要约20滴水组成。
2、如果把水分子放大到乒乓球那么大,那么 乒乓球就要放大到地球那么大。
3、铅笔留下的黑色的笔迹是碳原子的堆积, 一个句号竟有1018个碳原子。
分子很小,原子更小
原子的内部是 什么样子呢?
1911年卢瑟福α粒子散射实验
卢瑟福原子模型
2.3 物质构成的微粒(Ⅱ)——原子 和离子
构成物质的微粒(Ⅱ) ——原子
原 子是什 么 原子内部有何奥秘 原子的质量有多大
离子怎样形成
氧化汞分解的微观过程
分解
+
氧化汞分子
+
汞原子
组合
氧原子
氧分子
组合以 从这幅图中获
得哪些信息?
氧化汞受热分解生成了汞和氧气。 氧化汞是由氧化汞分子构成的。 氧化汞分子分解成了汞原子和氧原子。 汞原子直接构成了金属汞。 每两个氧原子构成一个氧分子。
H
H O 两个氢原子和一个氧原子构成一个水分子
所以说:分子是由原子构成的。
总结
分子和原子都是肉眼看不见的; 分子、原子都是构成物质的基
本粒子; 分子是由原子构成的。
从本课题中我们应该知道: ⑴物质是由原子、分子等微小粒子构成的。 ⑵分子是保持物质化学性质的最小粒子。 ⑶原子是化学变化中的最小粒子,原子可以相 互结合形成分子。
➢ 原子小但现代技术可操纵原子。
人类对原子的认识
原子学说创始 人--道尔顿
人类对原子的认识
通过移动 硅原子构 成的文字
原子操 纵术
通过扫描隧道显微镜移动12个 溴原子所拍的纳米级图像
巴克纸中的多壁碳纳米管 在原子力显微镜下的图像
扫描隧道电子显显镜 拍摄的硅原子图像
铁原子写出 的原子图像
金刚石
