江苏省高考化学最后一卷

2015江苏高考最后一卷化学
单项选择题:本题包括10小题,每小题2分,共计20分。每小题只有一个
....选项符合题意。1. 化学在生产和日常生活中有着重要的作用。下列有关说法不正确的是()
A.12月2日我国发射的“嫦娥三号”卫星中使用的碳纤维,是一种新型无机非金属材料
B.氢氧化铁溶胶、水玻璃、淀粉溶液均具有丁达尔效应
C.“地沟油”经过加工处理后,可以用来制肥皂和生物柴油
D.只要符合限量,“食用色素”“碘元素”、“亚硝酸盐”可以作为某些食品的添加剂2. 下列表述正确的是()
A.BF3的电子式为:
B.2CH3CH2OD+O2Cu
————→
Δ
2CH3CHO+2DHO
C.二氧化硫、氨、煤的液化均为物理变化
D.在鸡蛋白溶液中加入浓Na2SO4溶液,蛋白质的性质会改变并发生变性
3. 在下列各指定溶液中,离子可能大量共存的是()
A.澄清透明的溶液中:Cu2+、Fe3+、NO3-、Cl-
B.使pH试纸变蓝的溶液中:NH4+、Na+、SO42-、Cl-
C.含有大量ClO-的溶液中:K+、OH-、I-、SO32-
D.c(Fe3+)=0.1mol·L-1的溶液中: K+、ClO-、SO42-、SCN-
4. 生活中的某些问题,常涉及到化学知识,下列分析不正确
...的是()A.冰箱中使用的含氟制冷剂泄漏后,会破坏臭氧层
B.Cl2和SO2都有漂白作用,都可以使有色棉布褪色
C.减少硫的氧化物和氮氧化物向空气中的排放,是防止酸雨形成的有效措施
D.严格地讲实验室使用排风扇是种不负责任的防污染手段,因为产生的有害气体没有得到转化或吸收
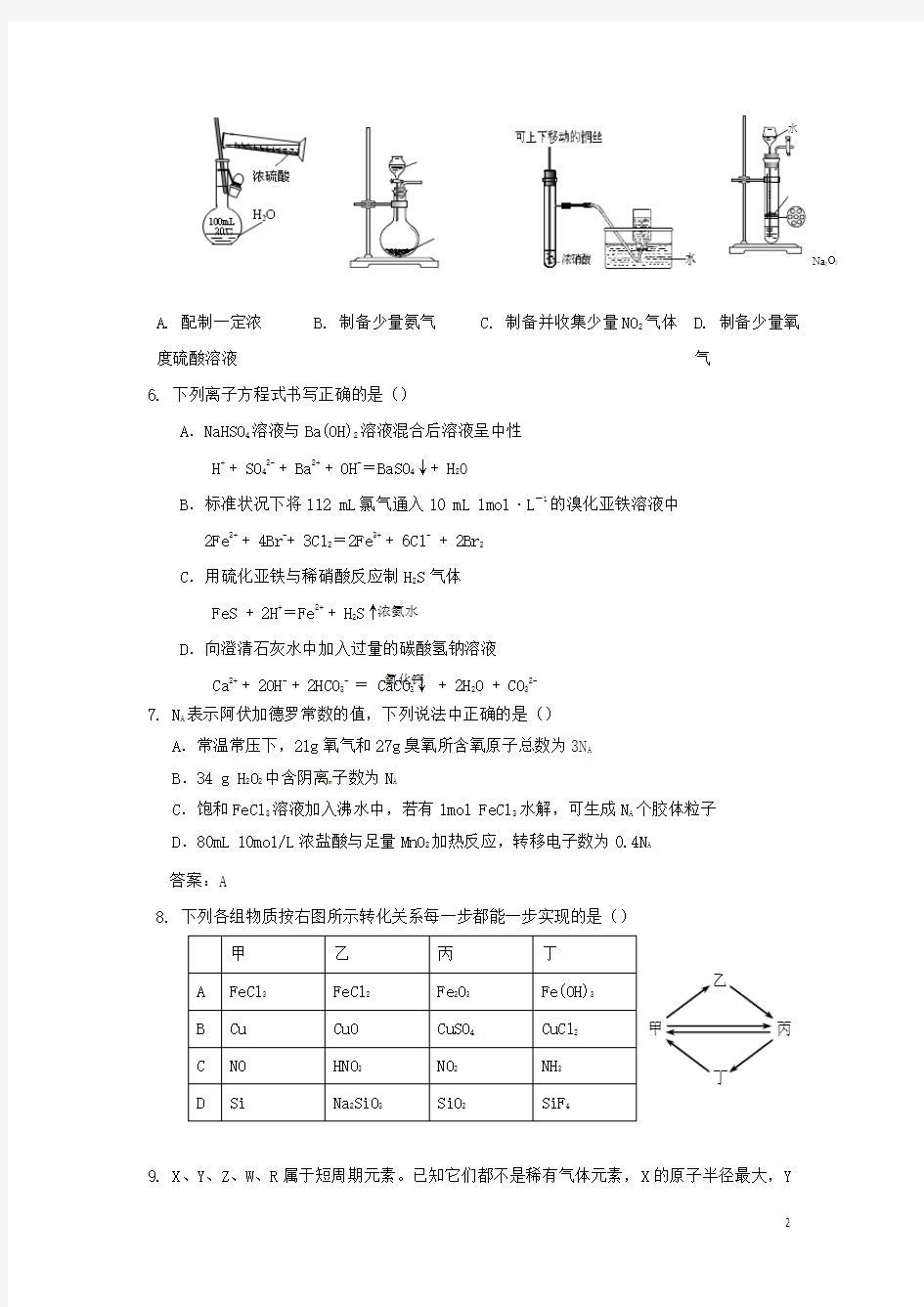
5. 课外实验小组设计的下列实验合理的是()
氧化钙浓氨水
水
Na 2O 2
A. 配制一定浓 度硫酸溶液
B. 制备少量氨气
C. 制备并收集少量NO 2气体
D. 制备少量氧
气
6. 下列离子方程式书写正确的是()
A .NaHSO 4溶液与Ba(OH)2溶液混合后溶液呈中性
H +
+ SO 42-
+ Ba 2+
+ OH -
=BaSO 4↓+ H 2O
B .标准状况下将112 mL 氯气通入10 mL 1mol·L -1
的溴化亚铁溶液中 2Fe 2+
+ 4Br -+ 3Cl 2=2Fe 3+
+ 6Cl -
+ 2Br 2 C .用硫化亚铁与稀硝酸反应制H 2S 气体
FeS + 2H +
=Fe 2+
+ H 2S↑
D .向澄清石灰水中加入过量的碳酸氢钠溶液
Ca 2+
+ 2OH -
+ 2HCO 3-
= CaCO 3↓ + 2H 2O + CO 3
2-
7. N A 表示阿伏加德罗常数的值,下列说法中正确的是()
A .常温常压下,21g 氧气和27g 臭氧所含氧原子总数为3N A
B .34 g H 2O 2中含阴离子数为N A
C .饱和FeCl 3溶液加入沸水中,若有1mol FeCl 3水解,可生成N A 个胶体粒子
D .80mL 10mol/L 浓盐酸与足量MnO 2加热反应,转移电子数为0.4N A
答案:A
8. 下列各组物质按右图所示转化关系每一步都能一步实现的是()
甲 乙 丙 丁
甲 丙
乙
丁
A FeCl 3 FeCl 2 Fe 2O 3 Fe(OH)3
B Cu CuO CuSO 4 CuCl 2
C NO HNO 3 NO 2 NH 3
D Si
Na 2SiO 3
SiO 2
SiF 4
9. X 、Y 、Z 、W 、R 属于短周期元素。已知它们都不是稀有气体元素,X 的原子半径最大,Y
元素的原子最外层电子数为m ,次外层电子数为n ,Z 元素的原子L 层电子数为m +n ,M 层电子数m -n ,W 元素与Z 元素同主族,R 元素原子与Y 元素原子的核外电子数之比为2︰1。 下列叙述错误..
的是() A .X 与Y 形成的两种化合物中阴、阳离子的个数比均为1∶2 B .Y 的氢化物比R 的氢化物稳定,Y 的氢化物熔沸点比R 的氢化物低 C .Z 、W 、R 最高价氧化物对应水化物的酸性强弱顺序是:R> W> Z D .Y 分别与Z 、W 、R 以两种元素组成的常见化合物有5种 答案:B
10. 下列有关热化学方程式的叙述正确的是()
A .已知C(石墨,s)=C(金刚石,s) △H>O ,则金刚石比石墨稳定
B .已知2H 2(g)+O 2(g)=2H 20(1) △H=-571.6kJ·mol -1
,则氢气的燃烧热为-285.8kJ ·mol
-1
C .含20.0 gNaOH 的稀溶液与稀盐酸完全中和,放出28.7 kJ 的热量,则该条件下稀醋 酸和稀NaOH 溶液反应的热化学方程式为:
)1()()()(233O H aq COONa H aq COOH CH aq NaOH +=+ △H=-57.4kJ ·mol -1
D .已知)(2)(2)(222g CO g O s C =+ )(2)()(2;21g CO g O s C H =+? 2H ?则△H 1>△H 2 不定项选择题:本题包括5小题,每小题4分,共计20分。每小题只有一.个或两个....选项符合题意。若正确答案只包括一个选项,多选时,该小题得0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就得0分。
11. 饱和氯水中存在平衡:①C12+H 2O ?H +
+Cl —
+HClO ,②HClO ?H +
+ClO —
取饱和氯水分别进
行下列实验,相应结论错误的是( )
A .逐滴加入氨水中,所得溶液中c(H +
)逐渐增大 B .继续通入过量C12,①、②均向右移动,溶液pH 减小 C .加入CaCO 3悬浊液中,CaCO 3的溶解平衡向右移动
D .加入一定量NaOH 溶液中,所得溶液中离子浓度的关系可能为c(Cl -)+ c(ClO -)= c(Na +
) 12.快乐是什么?精神病学专家通过实验发现:在大脑的相应部位——“奖赏中心”,给予柔和的电击,便会处于似乎极度快乐的状态。人们已经将“奖赏中心”部分的脑电图绘制出来,并认为,在各区域之间传递信息的化学物质是多巴胺,所以“奖赏中心”又称为多巴胺系统。多巴胺结构如右图,下列说法错误..
的是( )
A. 多巴胺分子式为C 8H 11NO 2
B. 多巴胺可以发生加成、取代、氧化反应
C. 和溴水反应时,1mol 多巴胺可以消耗6mol 溴单质
D. 多巴胺既可与强酸反应,又可以与强碱反应 13. 下列叙述正确的是()
A .0.1mol·L -1
Na 2HPO 4溶液中:c (Na +
) + c (H +
) = 2c (HPO 42-
) + c (OH -)
B .pH=4的醋酸与pH=10的NaOH 溶液等体积混合后pH>7
C .在pH=12的Ba(OH)2溶液和pH=12的Na 2CO 3溶液中,由水电离的c (H +
) 后者大 D .25℃时,AgCl 固体在20mL0.01mol·L -1
氨水中的溶解度比在20mL0.01mol·L -1
NaCl 溶液中的溶解度大
14. 下列实验操作或结论正确的是 ( )
A .配制一定物质的量浓度的溶液时,将量取液态物质的量筒用水洗涤,洗涤液倒入容量瓶
B .用加热法可以分离KMnO 4和碘单质的混合物
C .经氯气消毒的自来水,若用于配制Na 2CO 3溶液和FeSO 4溶液均会使所配溶液变质
D .将金属钠在研钵中研成粉末,使钠与水反应的实验更安全
15. 下列四个图像所反映的内容与相应反应符合的是(a 、b 、c 、d 均大于0)()
A .4NH 3(g)+5O 2+6H 2O(g)
B .N 2(g)+3H 23(g)
△H =-a kJ ·mol
-1
△H =-b kJ ·mol –1
C .2SO 32(g)+O 2(g)
D .2N 2O 52(g)+O 2(g)
△H =+c kJ ·mol –1
△H =+d kJ ·mol –1
SO 3
物质的量分数
压强
(容积恒为2 L ) 时间
时间
(恒温) 压强
HO NH 2
HO
非选择题
16.(12分)某经济开发区将钛冶炼厂与氯碱厂、甲醇厂组成了一个产业链(如图所示),
大大地提高了资源利用率,减少了环境污染。
钛铁矿(FeTiO 3焦炭 34
食盐水甲醇
Mg ,Ar 800℃
请填写下列空白:
⑴写出钛铁矿经氯化得到四氯化钛的化学方程式: 。 ⑵由CO 和H 2合成甲醇的方程式是:CO(g)+2H 2CH 3OH(g)。
①已知该反应在300℃时的化学平衡常数为0.27,该温度下将2 mol CO 、3 mol H 2和2 mol CH 3OH 充入容积为2 L 的密闭容器中,此时反应将 (填“向正反应方向进行”、“向逆反应方向进行”或“处于平衡状态”)。 ②若不考虑生产过程中物质的任何损失,该产业链中每合成19.2 t 甲醇,至少需额外补充H 2 t 。
⑶用甲醇-空气碱性(KOH )燃料电池作电源电解精炼粗铜(右图),在接通电路一段时间后纯Cu 质量增加3.2 g 。
①请写出燃料电池中的负极反应式: 。
②燃料电池正极消耗空气的体积是
(标准状况,空气中O 2体积分数以20%计算)。
17. 蓓萨罗丁是一种抗癌药物.其合成路线如图:
纯Cu
CuSO 4溶液
(1)化合物E的含氧官能团为和(填名称)。
(2)反应①→⑥中属于消去反应的是(填序号)。(3)合成路线中,化合物G的结构简式为。
(4)写出同时满足下列条件的D的同分异构体的结构简式。
①能与FeCl3溶液发生显色反应;②1mol该物质与足量银氨溶液反应,能生成4mol Ag;③核磁共振氢谱显示有4种化学环境不同的氢
(5)已知:I.
II.
写出以甲苯、丙酮()和乙炔为原料,制备化合物C的合成路线流程图(无机试剂任用)。
合成路线图示例如下:H2C=CH2 CH3CH2Br CH3CH2OH。
18.(12分)已知Cr(OH)3在碱性较强的溶液中将生成[Cr(OH)4]―,铬的化合物有毒,由于+6价铬的强氧化性,其毒性是+3价铬毒性的100倍。因此,必须对含铬的废水进行处理,可采用以下两种方法。
【方法一】还原法在酸性介质中用FeSO4等将+6价铬还原成+3价铬。
具体流程如下:
有关离子完全沉淀的pH如下表:
有关离子Fe2+Fe
3+Cr
3+
完全沉淀为对应氢氧化物的pH 9.0 3.2 5.6 (1)写出Cr2O72―与FeSO4溶液在酸性条件下反应的离子方程式。
(2)还原+6价铬还可选用以下的试剂(填序号)。
A.明矾 B.铁屑 C.生石灰 D.亚硫酸氢钠(3)在含铬废水中加入FeSO4,再调节pH,使Fe3+和Cr3+产生氢氧化物沉淀。则在操作②中可用于调节溶液pH的试剂为:(填序号);
A.Na2O2 B.Ba(OH)2 C.Ca(OH)2 D.NaOH
此时调节溶液的pH范围在(填序号)最佳。
A.3~4 B.6~8 C.10~11 D.12~14 【方法二】电解法将含+6价铬的废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解。阳极区生成的Fe2+和Cr2O72一发生反应,生成的Fe3+和Cr3+在阴极区与OH一结合生成Fe(OH)3和Cr(OH)3沉淀除去。
(4)写出阴极的电极反应式。
(5)电解法中加入氯化钠的作用是:。
19. (15分)可利用下图中的实验装置测定足量铜与适量一定浓度的浓硝酸反应生成的NO 气体和NO2气体的物质的量之比(用m表示),其中装置C由广口瓶和量气管组成,量气管由甲、乙两根玻璃管组成,用橡皮管连通,并装入适量水,甲管有刻度(0mL~50mL),乙管可上下移动。
A B C
Cr2O72-Cr3+Cr(OH)3Cr2O3
①H2SO4溶液②调节pH ③加热
适量FeSO4溶液
