金刚石的晶体结构分析
金刚石原子结构

金刚石原子结构
金刚石原子结构的原型是金刚石晶体,又称钻石。
在金刚石晶体中,每个碳原子都以SP3杂化轨道与另外4个碳原子形成共价键,构成正四面体。
由于金刚石中的C-C键很强,所以金刚石硬度大,熔点极高;又因为所有的价电子都被限制在共价键区域,没有自由电子,所以金刚石不导电。
金刚石原子结构与闪锌矿结构(zincblende structure)非常相似,不同之处在于,构成闪锌矿结构的两个面心立方点阵上的原子是不同种类的,例如Zn和S, 而构成金刚石结构的原子是同种类的。
闪锌矿结构的堆积率随两种原子的相对大小而变。
金刚石与石墨同样由碳原子构成,是同素异形体。
由于碳原子的结合方式不同,两种物质的性质迥异。
石墨中的碳原子是按sp2杂化的方式形成共价键的,在一个平面上以共价键结合成蜂窝状结构,层与层间靠比较弱的范德华力结合。
同一层内碳原子之间的结合比金刚石还强,所以石墨的熔点比金刚石更高。
但层间结合较弱,很容易发生滑移,所以硬度很低。
石墨中碳原子的4个价电子中的3个形成共价键,另外一个价电子在晶体中形成大π键,可以沿石墨层导电。
金刚石与其他的碳同素异型体之间的差别也是有碳原子结合方式的不同而引起的.。
立方金刚石的晶体结构

❖ 双晶是两个以上同种晶体按一定的对称规律 形成的规则连生。钻石常出现接触双晶类型, 接触双晶是指双晶个体以平面相接触而连生 在一起。
(由两个八面体构成的天然双晶钻石晶体)
(由两个立方体构成的天然穿插双晶)
2-2金刚石的主要机械物理性能
❖ 2-2-1机械性能 ❖ 1、硬度 ❖ 莫氏硬度10、 ❖ 显微硬度10600 (大于30GPa) ❖ 硬度 金刚石的摩氏硬度为10,是
24
0.03
36
1.04
109
3.75
189
4.2
536
5.4
795
30.8
1120
100
1427
146
2060
833
10600 117000
﹡以α–石英作为100,为相对标准。
几种常见材料的硬度比较
2.硬度与原子结构的关系 各向异性 晶体不同方向硬度有一定差异< 111 >> <
110> > < 100> ……(用立方模型表示)。这给钻石的 加工带来了方便。金刚石的高硬度保证了钻石的耐 磨性,永不磨损。 为什么沿不同方向加工的难易不一样?
最硬的物质。 ❖ 这种10级硬度是相对的。实际上它
是硬度为9的刚玉的绝对硬度的150 倍,比硬度为7的水晶大1000倍
矿物
滑石 石膏 方解石 萤石 磷灰石 正长石 石英 黄玉 刚玉 金刚石
摩斯硬度
1 2 3 4 5 6 7 8 9 10
压入硬度 研磨硬度﹡
(Vicker kg/mm2) (Rosival)
❖ 4、强度 ❖ 强度是衡量金刚石晶体质量的主要指标 ❖ 1)抗压强度 ❖ 一般磨料级1.5GPa ❖ 高品级3-5GPa ❖ 2)抗冲击韧性 ❖ 3)弹性模量与压缩系数
金刚石的物理性质

金刚石的物理性质金刚石和石墨之间的物理性质的差异是由于碳原子的不同排列。
金刚石和石墨都是由碳原子组成的固体非金属元素,但由于金刚石和石墨中碳原子的排列方式不同,金刚石和石墨的物理性质有很大不同。
金刚石是立方晶体结构,金刚石结构中的每个原子与相邻的4个原子形成正四面体。
在金刚石晶体中,每个碳原子都以SP3杂化轨道与另外4个碳原子形成共价键,构成正四面体。
由于金刚石中的C-C键很强,所以金刚石硬度大,熔点极高;又因为所有的价电子都被限制在共价键区域,没有自由电子,所以金刚石不导电。
石墨结构中的每个原子全部以sp2杂化轨道和邻近的三个碳原子形成三个共价单键并排列成平面六角的网状结构,这些网状结构以范德瓦耳斯力联成互相平行的平面,构成层片结构。
石墨晶体中层与层之间距离较大,是以范德华力结合起来的,即层与层之间属于分子晶体。
分子间作用力很小,所以石墨层与层之间可以滑动,可做李润滑剂;同一平面层上的碳原子各有一个P电子,形成大π键,在电场作用下可以定向移动,所以石墨是电的良导体。
金刚石俗称“金刚钻”。
也就是我们常说的钻石,它是一种由纯碳组成的矿物。
金刚石是自然界中最坚硬的物质。
金刚石硬度高,耐高温。
硬度高的金刚石可用作钻孔机的钻头,也可用作玻璃刀具。
石墨是元素碳的同素异形体,每个碳原子的外围与另外三个碳原子(以多个六边形排列成蜂巢状)相连,形成共价分子。
因为每个碳原子发射一个电子,而这些电子可以自由移动,所以石墨是电导体。
石墨是最软的矿物之一。
石墨很软。
它会在石墨纸上留下深灰色的痕迹来制作铅笔芯;石墨滑腻、柔软、耐高温,可用作耐高温的润滑剂。
石墨具有良好的导电性和耐高温性。
因此,石墨可以用作高温电炉的电极和普通电极。
石墨具有良好的传热性能和耐腐蚀性。
石墨可以用作石墨坩埚,因为它能抵抗温度的突然变化。
石墨具有很强的耐酸碱性和耐腐蚀性。
利用石墨的耐酸碱和耐腐蚀性能,可用作化工管道、耐酸罐和耐碱罐。
晶体解答
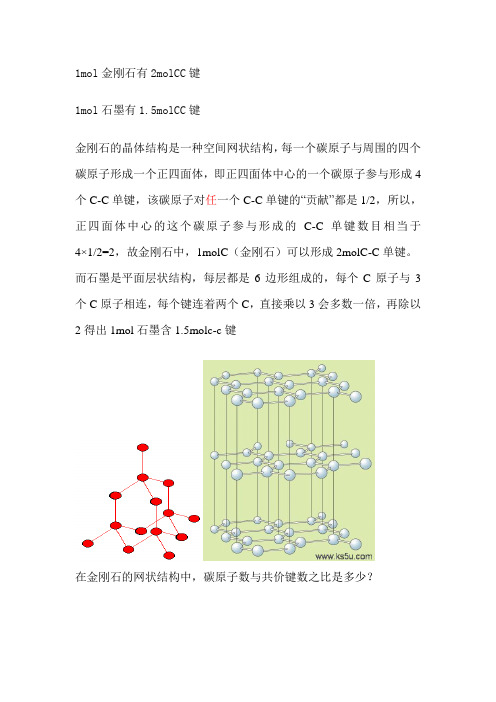
1mol金刚石有2molCC键1mol石墨有1.5molCC键金刚石的晶体结构是一种空间网状结构,每一个碳原子与周围的四个碳原子形成一个正四面体,即正四面体中心的一个碳原子参与形成4个C-C单键,该碳原子对任一个C-C单键的“贡献”都是1/2,所以,正四面体中心的这个碳原子参与形成的C-C单键数目相当于4×1/2=2,故金刚石中,1molC(金刚石)可以形成2molC-C单键。
而石墨是平面层状结构,每层都是6边形组成的,每个C原子与3个C原子相连,每个键连着两个C,直接乘以3会多数一倍,再除以2得出1mol石墨含1.5molc-c键在金刚石的网状结构中,碳原子数与共价键数之比是多少?金刚石的网状结构中,一个C原子,是由4个键的,分别和傍边的4个碳原子链接。
这样说,一个C原子该拥有4个键,但是每一个键都是2个C原子共有。
所以,其实,共价键的数目是4n/2=2n,即碳原子数的2倍在金刚石的晶体结构中,一个碳原子被几个最小环共用?金刚石中最小环为六元环,每个碳连接其他四个碳原子形成正四面体,延生出去的四个键每两个键可形成一个六元环,4选2组合可得6个,即被6个最小环共用。
金刚石断裂1MOL共价键,实际有多少C原子参加反应?在金刚石晶体中,平均一个碳拥有4/2=2个键,所以断裂一摩尔,有1/2=0.5摩尔C原子参加反应金刚石和石墨晶体中碳原子的成键方式和排列方式:成键方式相同,排列方式不同。
对么?金刚石与石墨是同素异型体,都是由碳元素组成。
石墨为层状结构;金刚石为立体网状结构,属立方晶系。
从成键的角度看,石墨中碳原子采取sp2杂化;金刚石中每一个碳原子和四个C等价结合,采用sp3杂化轨道。
通过高温高压的方式,可以将石墨转换为金刚石。
石墨晶体中碳原子个数与共价键个数之比为什么是2:3?请详细解答一个C被3个六圆环共用, 所以是6*1\3.一个键被两个六圆环共用, 所以是6*1\2最后是2:3石墨晶体中C只连3个共价键最外层不是不够8个电子了吗,为什么还能稳定?三根键用去3个价电子还有1个与其他的剩余的电子轨道重叠形成1根大派键,大派键贯穿整个石墨层,大派键中的电子可以在其中随意移动,所以石墨在这个方向上可以导电,大派键可以使石墨的能量降低。
金刚石成分

金刚石成分
金刚石是常见的碳化物,它的基本成分是碳原子,通常呈正交六方晶体结构。
由于它的结构及成分,金刚石可以耐高温、耐磨、耐腐蚀、无磁性,在工业上得到了广泛应用。
金刚石的结构由四个不同的原子组成,即碳原子、氢原子、氧原子和氮原子。
它们都是小分子,在金刚石中以正交六方晶体结构存在,形成一个超强紧凑的网状结构。
每个碳原子都被六个水分子连接,其中有四个氢原子、一个氧原子和一个氮原子。
金刚石的成分也是结构中的一个重要组成部分。
金刚石是一种碳化物,主要由碳原子组成,含有较少的氢、氧和氮原子。
它的碳原子之间以共价键连接,形成一个紧凑的三维网络结构。
由于共价键的作用,碳原子的结合特别稳定,使金刚石具有良好的耐高温、耐腐蚀、耐磨、无磁性等特性。
金刚石的耐磨性是它应用最为广泛的特点之一,它可以在极端条件下保持磨损程度极低。
金刚石的硬度是由它的晶体结构决定的,由于其结构密度非常大,所以其硬度也很高。
这使得金刚石能够抵抗磨损,大大延长了它的使用寿命。
另外,金刚石还具有优良的耐酸碱性,可以在酸碱环境中运行而不受影响。
它还具有可塑性,可以根据要求进行加工,可以根据要求生产出不同形状的金刚石零件。
最后,金刚石还具有无磁性特点,在电子工业中有广泛的应用。
它可以用来制造一些可以防止电磁波干扰的装置,这是它应用的一个重要领域。
总之,金刚石的结构及成分使它具有非常优良的物理性能,被广泛应用于工业中。
它的优点有:耐高温、耐腐蚀、耐磨、无磁性、耐酸碱、可塑性等。
金刚石晶体的结构基元

金刚石晶体的结构基元金刚石晶体的结构基元,哎呀,说到这个话题,脑海里浮现出一颗颗闪闪发光的宝石,简直让人垂涎欲滴。
想象一下,在阳光下,金刚石的光芒像小星星一样闪烁,真是让人心动不已。
这些宝石可不是凭空而来的,它们的背后有着一套相当复杂又美妙的结构。
我们得知道,金刚石可不是随便就能形成的。
它们的原材料可真是“下足了功夫”,碳元素经过高温高压的“洗礼”,在地球深处千锤百炼,最终变成了坚硬的金刚石。
真是有点像那些历经风雨的老顽童,外表硬朗,内心却充满故事。
说到金刚石的结构,我们不得不提到它的晶体格子。
它的结构就像是一个精密的蜂窝,碳原子在其中排列得整整齐齐,真是个“排队打卡”的典范。
每一个碳原子都和四个邻居亲密无间,形成了强大的共价键。
哎,这种亲密关系可不是一般的牢固,像是好朋友之间的默契,紧紧相依,难以分离。
金刚石之所以这么坚硬,正是因为这种紧密的排列和强大的结合力。
就像你跟你的小伙伴一起去探险,团结就是力量嘛。
在这结构里,每个碳原子像一个小小的英雄,扮演着不可或缺的角色。
想象一下,金刚石就像是一场盛大的聚会,每个碳原子都是这里的明星,人人都想跟它们搭上话。
正是因为这种紧密的组织,金刚石才有了超强的硬度,谁都不敢轻易招惹它。
就像在学校里,最强的那位同学,大家都不敢轻易挑战,生怕被“打回原形”。
再说到金刚石的光学性质,哎呀,真的是绝了。
金刚石不仅硬,还能把光线折射得七扭八歪,绚丽得让人目眩神迷。
想象一下,光线穿过金刚石,就像是舞台上的灯光效果,瞬间变得五光十色,真是让人心动不已。
那种“闪耀”的感觉,简直是让人无法抗拒,仿佛一颗颗流星在夜空中划过,梦幻得让人心驰神往。
没错,这种光学特性也是它的一大魅力所在,谁能拒绝如此诱人的光芒呢?金刚石的热导性能也是顶呱呱的。
它能迅速散热,就像是身手敏捷的运动员,在比赛中轻松应对各种挑战。
热量一来,它就像个“冰山美人”,毫不在意,迅速将热量带走。
这一点在一些高科技领域可是一大法宝,能帮助我们解决很多问题。
金刚石结构原子密度
金刚石结构原子密度金刚石是一种由碳元素构成的晶体物质,具有非常高的硬度和热导率。
它的结构是由碳原子按照特定的排列方式形成的,并且具有高度有序的晶格结构。
金刚石的结构是由碳原子形成的晶格,每个碳原子都与四个相邻的碳原子形成共价键。
金刚石晶体的正六面体单元中,每个碳原子被包围在一个四面体中,与四个相邻的碳原子形成共价键。
在金刚石中,每个碳原子与邻近的三个碳原子通过共价键形成平面网格结构,这个网络在三维空间中重复出现,形成了金刚石的晶格。
这种结构使得金刚石具有非常高的硬度,使其成为世界上最坚硬的物质之一金刚石晶体的密度可以通过计算每个碳原子的质量和总体积来确定。
每个碳原子的质量约为12克/摩尔,而金刚石的晶格常数约为0.356纳米。
因此,金刚石的密度约为3.5克/立方厘米。
这个密度值相对较高,使得金刚石成为一种重质物质。
金刚石的高密度与其晶体结构有关。
由于每个碳原子与四个相邻的碳原子形成共价键,这些键在三维空间中形成了一个非常坚固的结构。
这种结构使得金刚石具有高度有序的晶格,其中的碳原子相互紧密地堆积在一起。
金刚石晶体结构的稳定性可以通过其键长和键能来解释。
金刚石中的碳-碳键长度为约0.154纳米,同时其结合能为736千焦耳/摩尔。
这意味着金刚石中的碳原子之间的化学键非常紧密和稳定,这种稳定性使得金刚石具有高硬度和高密度的特性。
总之,金刚石的结构是由碳原子形成的三维晶格结构。
每个碳原子与四个相邻的碳原子形成共价键,形成一个高度有序的晶体结构。
金刚石的密度约为3.5克/立方厘米,这一密度值与其晶体结构的紧密堆积有关。
金刚石的结构稳定性和硬度与碳原子之间的化学键紧密相关,并且使其成为一种非常重要的工业材料。
证明金刚石体对角线上共有5个原子共线
证明金刚石体对角线上共有5个原子共线金刚石是一种非常坚硬的物质,由碳原子经过高压高温形成。
结晶结构为六方密堆积结构,每个碳原子都与周围四个碳原子共价绑定,形成一种稳定的结构。
金刚石晶体的晶胞结构是复杂的,而金刚石最著名的性质之一就是它极其坚硬,这与它的晶体结构有着密切的关系。
我们知道,金刚石晶体结构是由一个个石墨烯层组成,每个石墨烯层上得碳原子呈六角形排列。
而整个金刚石的结构就是由这个石墨烯层叠加而成的,我们可以研究金刚石的晶体结构来证明它的一些性质。
在研究金刚石的晶体结构时,我们发现了一个有趣的现象,那就是金刚石体对角线上共有5个原子共线。
这一现象激起了人们的极大兴趣,并引起了科学家们的深入研究。
在本篇文章中,我们将通过理论计算和实验结果来证明金刚石体对角线上共有5个原子共线的结论。
一、金刚石的晶体结构让我们来了解一下金刚石的晶体结构。
根据X射线衍射实验的结果,我们可以确定金刚石的晶体结构为菱面体结构。
在这种结构中,每个碳原子都与周围四个碳原子形成共价键,形成了一种均匀而稳定的结构。
这种结构使得金刚石具有了极高的硬度,成为了一种理想的切割和磨削工具。
二、金刚石体对角线上的原子排列接下来,让我们来证明金刚石体对角线上共有5个原子共线的结论。
我们可以通过以下步骤来证明这一结论:1. 理论计算我们可以通过理论计算的方法来证明金刚石体对角线上共有5个原子共线。
我们可以利用量子力学的理论和计算方法,来分析金刚石的晶体结构,从而确定其对角线上的原子排列情况。
通过分子动力学模拟和密度泛函理论计算,我们可以得到金刚石晶体结构的详细信息,包括对角线上的原子排列情况。
2. 实验验证除了理论计算外,我们还可以通过实验方法来验证金刚石体对角线上共有5个原子共线的结论。
通过X射线衍射和透射电子显微镜等实验手段,我们可以直接观察金刚石晶体结构,验证其中对角线上的原子排列情况。
三、结论通过以上的理论计算和实验验证,我们可以得出结论:金刚石体对角线上共有5个原子共线。
金刚石晶体中正四面体结构单元
金刚石晶体中正四面体结构单元全文共四篇示例,供读者参考第一篇示例:金刚石是一种由碳原子构成的晶体结构,它是自然界中最坚硬的物质之一。
金刚石的硬度和稳定性取决于其独特的晶体结构,其中正四面体结构单元在金刚石晶体中起着至关重要的作用。
金刚石的晶体结构是由碳原子通过共价键相互连接而成的,每个碳原子与周围四个碳原子形成共价键,使得晶体结构呈现出正四面体的形态。
在正四面体结构单元中,每个碳原子位于一个正四面体的顶点上,并与其他三个碳原子通过共价键相连接,形成一个坚固的三维网状结构。
这种高度有序的排列使得金刚石具有非常高的硬度和稳定性,使其成为硬度测试中的标准材料。
除了硬度和稳定性外,正四面体结构单元还赋予金刚石许多其他优良的物理和化学性质。
金刚石具有很高的热导率和耐腐蚀性,这些性质使得金刚石在工业领域中广泛应用于切割、磨削和钻孔等工艺中。
金刚石还表现出优异的光学性质,如高折射率和高透光率,使得金刚石被用于制造高性能的光学器件和激光器件。
在实际应用中,金刚石晶体的正四面体结构单元可以通过化学气相沉积等方法进行人工合成,以满足不同领域对金刚石材料的需求。
通过调控晶体的形貌、尺寸和取向,可以获得具有不同特性和用途的金刚石晶体材料。
这些人工合成的金刚石晶体不仅可以模拟自然金刚石的独特性质,还可以改善其硬度、导热性和光学性能,为金刚石材料的研究和应用提供了更多的可能性。
金刚石晶体中的正四面体结构单元是金刚石硬度和稳定性的重要保障,也是金刚石优良性质的重要来源。
通过深入研究金刚石晶体结构及其在不同条件下的性质变化,可以更好地理解金刚石的特性和应用潜力,促进金刚石材料在各个领域的创新应用。
【文章结束】第二篇示例:金刚石是一种由纯碳组成的晶体,其晶体结构是由正四面体结构单元组成的。
金刚石晶体具有极高的硬度和优异的光学性能,在工业和珠宝等领域广泛应用。
本文将对金刚石晶体中正四面体结构单元的形成、性质以及应用进行详细介绍。
金刚石的晶体结构是由碳原子通过共价键连接而成的,其中每个碳原子周围都有四个相邻的碳原子,形成一个正四面体结构单元。
NaCl、CsCl、CO2、SiO2、金刚石、石墨、C60晶体结构的特点分析
晶体结构的特点分析通常采用均摊法来分析这些晶体的结构特点。
均摊法的根本原则是:晶胞任意位置上的原子如果是被n个晶胞所共有,则每个晶胞只能分得这个原子的1/n。
1.氯化钠晶体由下图氯化钠晶体结构模型可得:每个Na+紧邻6个Cl ,每个Cl紧邻6个Na (上、下、左、右、前、后),这6个离子构成一个正八面体。
设紧邻的Na+与Cl-间的距离为a,每个Na+与12个Na+等距离紧邻(同层4个、上层4个、下层4个),距离为一2a。
由均摊法可得:该晶胞中所拥有的1 1 1Na+数为8 6 4,Cl 数为1 12 -8 2 44,晶体中Na+数与Cl-数之比为1:1,则此晶胞中含有4个NaCI结构单元。
2.氯化铯晶体每个Cs+紧邻8个CI-,每个CI-紧邻8个Cs+,这8个离子构成一个正立方体。
设紧邻的Cs+与CI-间的距离为a,则每个Cs+2与6个Cs+等距离紧邻(上、下、左、右、前、后)。
在如下图的晶1 1 1胞中Cs+数为8 -12 — 6 - 1 8,CI在晶胞内其数目为8 4 2 •C E十OC1-8,晶体中的Cs数与CI数之比为1:1,则此晶胞中含有8个CsCI结构单元。
3.干冰每个CO2分子紧邻12个CO2分子(同层4个、上层4个、1 1下层4个),则此晶胞中的CO2分子数为8—6—4。
8 2表示—3?分千4.金刚石晶体(晶体硅同)每个C原子与4个C原子紧邻成键,由5个C原子形成正四面体结构单元,C-C 键的夹角为109 28'。
晶体中的最小环为六元环,每个C原子被12个六元环共有,每个C-C键被6个六元环共有(用组合法计算一个碳原子所形成的4个键有C42= 6种两两相邻的组合,故一个碳原子最多可形成 C42 >2= 6 X2 =12个六元环;固定一个键,其余三个键与该键有 C31 = 3种两两相邻的组合,故一个C-C键最多可形成C31X = 6个六元环.由"平均值原理"知一个六元环实际拥有 6X1 1 1/12 = 1/2个碳原子,拥有6X1/6 = 1个C-C键.),每个环所拥有的C原子数为6 -12 21 1拥有的C-C键数为6 6 1,则C原子数与c-c键数之比为齐1:25.二氧化硅晶体每个Si原子与4个0原子紧邻成键,每个0原子与2个Si 原子紧邻成键。
