第二章有机化合物的化学键
第二章第一节 共价键
C-O
C=O N-N N=N N≡N
351
745 193 418 946
H-F
H-Cl H-Br H-I H-H
568
431.8 366 298.7 436
[思考] (1)键能是共价键强度的一种标度,键能的 大小与键的强度有什么关系? 规律:键能越大,化学键越牢固,由该键形成 的分子越稳定。 (2)键能与化学反应的能量变化有什么联系? 怎样利用键能的数据计算反应的热效应? 化学反应的反应热: ∆H=反应物键能总和-生成物键能总和
H 原子、Cl原子都只有一个未成对电子,因 而只能形成H2、HCl、Cl2分子,不能形成H3、 H2Cl、Cl3分子。
(2)具有方向性 最大重叠原理
形成共价键时,两个参与成键的原子轨道总是 尽可能沿着电子出现机会最大的方向重叠成键, 而且原子轨道重叠越多,电子在两核间出现的 机会越多,体系的能量下降也就越多,形成的 共价键越牢固。因此,一个原子与周围的原子 形成的共价键就表现出方向性( s 轨道与 s 轨道重叠形成的共价键无方向性,例外)。
某些共价键键能/kJ· -1 mol 表2-1
键 键能 键 键能
F-F
Cl-Cl Br-Br I-I C-C C=C C≡C
157
242.7 193.7 152.7 347.7 615 812
N-O
N=O O-O O 413.4 462.8 390.8
3、共价键的特征 ①饱和性;②方向性。
4、共价键的类型 ①σ键:以形成化学键的两原子核的连线为 轴作旋转操作,共价键电子云的图形不变, 这种特征称为轴对称。如H-H键。 特点:头碰头、电子云为轴对称,键强度大, 不易断裂。 类型:s—sσ键 、s—pσ键、p—pσ键等。
(汪小兰)有机化学第四版课后答案完全版

(汪小兰)有机化学第四版课后答案完全版《有机化学第四版》是一本权威的化学教材,深入浅出地介绍了有机化学的基本原理与应用。
课后习题是帮助学生巩固知识、提高运用能力的重要辅助材料。
下面是《有机化学第四版》课后答案的完全版,共3000字。
第一章:有机化学与有机化合物1. 有机化学是研究碳元素的化合物的科学。
有机化合物中的碳原子通常与氢、氧、氮、卤素等元素形成合键。
有机化学主要关注有机化合物的结构、性质和反应。
有机化学在石油炼制、药物合成、材料科学等领域具有重要的应用价值。
2. 有机化合物的命名通常采用结构命名法、系统命名法和常用命名法。
结构命名法是指根据有机化合物的结构式来命名。
系统命名法是根据化合物中含有的官能团来命名。
常用命名法是根据化合物的常用名称来命名。
3. 有机物的结构可分为线性、分支、环状和立体异构体。
线性结构是指分子中的原子按照直线排列。
分支结构是指分子中的原子按照支链的方式排列。
环状结构是指分子中的原子形成环状结构。
立体异构体是指化合物的空间结构不同。
4. 有机化合物的活性主要取决于其官能团。
常见的官能团包括醇、醛、酮、酸、酯、酰氯、酰胺等。
每种官能团都有其特定的性质和反应。
5. 有机化合物的性质与其分子结构有关。
分子中的原子的电性和键的键能决定了化合物的物理性质。
分子的极性和分子量也对物理性质有一定影响。
6. 有机化合物的化学反应主要包括取代反应、加成反应、消除反应和重排反应。
取代反应是指一个官能团被另一个官能团取代。
加成反应是指两个或多个分子结合形成一个新的分子。
消除反应是指一个分子中的原子或基团被移除,形成一个双键或三键。
重排反应是指分子中的原子或基团的位置发生变化。
7. 有机化学是一个广泛应用于生物化学、药物化学、材料科学等领域的学科。
通过有机化学的研究,人们可以合成新的药物、开发新的材料,提高生产效率,改善生活质量。
第二章:有机化合物的化学键与分子构象1. 有机化合物的化学键主要有共价键、极性键和离子键。
第二章有机化合物的化学键
::
路易斯结构式 凯库勒结构式 (电子式) (一短线代表一对共用电子) 3 配位共价键:形成共价键的一对电子由一个原子 提供的特殊的共价健
:
:
(二)共价键的形成
1 价键法(现代价键理论)
简称VB法,又称电子配对法.把价键的形成看作 是原子轨道重叠或电子配对的结果——定域的观点 (1)原子轨道重叠或自旋反平行电子配对形成共价键 (2)原子轨道重叠越多,键越牢固 ____称最大重叠原理 (3)元素原子的共价键数等于所含单电子数 (4)共价键具有方向性和饱和性 (5)成键两个电子局限在成键的两个原子间运动(定域) (6)能量相近的原子轨道可以进行杂化,组合成 能量相同的杂化轨道
ψ 2=φ A-φ φ
A
ψ 2=φ A-φ
B
B
φ
φ
B
φ
B
A
ψ 1=φ A+φ
B
ψ 1=φ A+φ
B
成键轨道中含能量较低的原子轨道φA 成分较多,能量与φA较接近,能量 降低较少,不易形成稳定分子
二,共价键的属性(键参数) (一)键长
以共价键相结合的两个原子核间距离 (1)1 左右 (2)不同的共价键有不同的键长 (3)相同的共价键在不同的化合物中也有可能稍不同 键长越长,越易受外界电场的影响而极化 ——从键长估计化学键的牢固性(越短越牢固) 一个两价或两价以上原子形成共价键时, 键与键之间的夹角称为键角
δ δ δ+
H3C
" 直弯弯弯弯
δ Cl
δδ+
CH2
CH2
δ+
2 特点:诱导效应沿碳键移动时减弱很快,到第三
个原子后可忽略不计
第二章Lewis结构与共振论

分子的静电荷=+1
(c) SO42
1 S:6-[0+ 2 ×8]=2 1 O:6-[6+ 2 ×2]=-1
O O S O O
O
所以
2
O S O O
2+
二、Lewis结构式的书写程序及优势结构 以NO2的Lewis结构为例 1、计算价电子总数 NO2=5+2×6=17 2、写出原子实符号,填入电子数
i. sp3--- CH4 (methane)
C(6e) 2p 化合价 valence shell(4e) 2s promotion sp3 hybridization excited state energy: Es < Esp3 < Ep hybrid orbital
ground state
1、真实分子的能量低于所写出的任何一个共 振式的能量,最稳定的极限结构与共子振杂 化体的能量差称为共振能 2、等价共振式对杂化体的贡献也等价 3、稳定的共振式对杂化体的贡献也大 4、共价键数目越多的共振式越稳定
5、除特例外,拥有形式电荷数量最小的结构 最稳定 6、负电荷在电负性大的原子上,正电荷在电 负性小的原子上则较稳定 7、所有的原子都有完整的价电子层,则较稳定 8、同类化合物中,共振式较多的较为稳定
H2C
C H
CH2
•
H3C
•
C H
CH2
书写规则:
1、电子动,原子核位置不动
H 2 C C CH 2 H
H 2C C H
CH 2
2、所有共振式,必须符合Lewis结构式
H3C OH
3、共振式中必须具有相等的未成对电子数
H2C C CH2 H
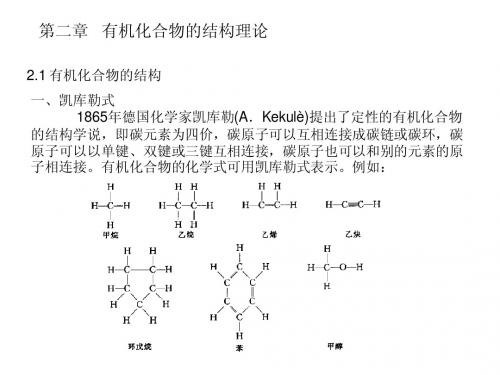
第二章 有机化合物的结构理论
H—H键的电子云是围绕键轴对称分布的,这种类型的键叫做σ键。
2.共价键的饱和性。 如果一个未成对电子已经配对,就不能再与别的原子的未成对电 子配对。例如氯化氢分子中的氢原子和氯原子的未成对电子已互相配 对,就不能再与其它的原子形成共价键。
3.共价键的方向性。 原子轨道互相重叠程度越大,体系能量就越低,形成的共价键也 就越牢固,因而应使原子轨道最大限度地互相重叠。例如两个2px轨道 只有在x轴方向上才能最大限度地互相重叠形成σ键。两个原子的p轨 道若互相平行,则在侧面能有最大的重叠,这种类型的共价键叫做π 键,π电子云分布在两个原子键轴的平面的上方和下方。
2.异裂(heterolytic) 共价键异裂时,成键的一对电子为某一个原子或基团占有,生 成正离子和负离子。通过共价键的异裂的反应叫做离子型反应。 大多数有机反应都是离子型反应或自由基反应。此外还有协同 反应,在协同反应中,既无自由基也无离子生成,共价键的断裂 和形成是同时进行的。
2.3. 分子间的弱相互作用力 一. 分子间的弱相互作用力类型 分子中相连原子之间存在强烈的吸引力,这种吸引力叫做化学键, 它是决定分子化学性质的重要因素。在物质的聚集态中,分子之间还存在 着一种弱的吸引力,把它统称为范德华(van der Waals)引力,它是决定 物质的沸点、熔点、气化热、熔化热、溶解度、粘度、表面张力等物理化 学性质的重要因素。从本质上讲,这种吸引力是由于分子中电荷分布不均 匀[或瞬间分布不均)而出现的静电作用力。常见的有如下3种。 (1). 偶极-偶极作用力(静电力):这种作用力产生于极性分子的静电相互作 用。如氯甲烷分子中,氯原子电负性较大,氯原子一端带有部分负电荷, 而碳原子上带有部分正电荷。一个分子带负电荷的一端吸引另一个分子带 正电荷的一端,于是分子间出现正负极相吸的排列,即
有机化学-化学键

④一般来说,对于组成和结构相似的物质,相对分子质量越大,分子间 一般来说, 于组成和结构相似的物质,相对分子质量越大, 作用力越大,物质的熔、沸点越高。如卤素单质: 作用力越大,物质的熔、沸点越高。如卤素单质:
温度/℃ 温度/℃ 250 沸点 200 I2 150 100 熔点 100 150 2 I2 Br 50 200250 0 50 Cl Br2200250 -50 2 相对分子质量 -100 Cl2 -150 F -200 2 F 2 -250
①分子间作用力比化学键弱得多,是一种微弱的相互作用,它主要影响物 分子间作用力比化学键弱得多,是一种微弱的相互作用, 得多 微弱的相互作用 质的熔、沸点等物理性质 而化学键主要影响物质的化学性质 物理性质, 化学性质。 质的熔、沸点等物理性质,而化学键主要影响物质的化学性质。
②分子间作用力主要存在于由分子构成的物质中,如:多数非金属单质、 分子间作用力主要存在于由分子构成的物质中, 多数非金属单质、 稀有气体、非金属氧化物、 氢化物、有机物等, 稀有气体、非金属氧化物、酸、氢化物、有机物等,而SiO2、金刚石的微粒 间则不存在分子间作用力。 间则不存在分子间作用力。 只有分子间的距离很小时才有。 ③分子间作用力的范围很小,只有分子间的距离很小时才有。 分子间作用力的范围很小 只有分子间的距离很小时才有
非金属单质 H2、Cl2, 某些化合物 C2H6、Na2O2、 H2 O2
存 在
离子化合物 共价化合物 KCl、NaOH、 NH4Cl、 HCl、NH3 , 、 、 、 、 Na2SO4 某些离子化合物 NH4Cl、NaOH 、
1.物质中化学键的存在规律 离子化合物中一定有离子键,可能还有共价键。 一定有离子键 (1)离子化合物中一定有离子键,可能还有共价键。简单离子组成的离子化合物 中只有离子键, MgO、NaCl等 复杂离子(原子团) 中只有离子键 , 如 MgO 、 NaCl 等 , 复杂离子 ( 原子团 ) 组成的离子化合物中既 有离子键,又有共价键, Cl、NaOH、 有离子键,又有共价键,如NH4Cl、NaOH、Na2O2等。 (2)共价化合物中只有共价键,一定没有离子键,如HCl、CH4、CO2、H2SO4等。 共价化合物中只有共价键,一定没有离子键, HCl、 只有共价键 离子键 金刚石等。 (3)在非金属单质中只有共价键,如Cl2、O2、金刚石等。 在非金属单质中只有共价键, 只有共价键 构成稀有气体的单质分子,由于原子已达到稳定结构,是单原子分子, (4)构成稀有气体的单质分子,由于原子已达到稳定结构,是单原子分子,分子 中不存在化学键。 中不存在化学键。 (5)非金属元素主要形成共价化合物,也可形成离子化合物, 非金属元素主要形成共价化合物,也可形成离子化合物, Cl中的 如NH4Cl中的 与Cl-。
有机化学有机化合物的化学键

正负电荷重心不再重合,电负性大的一端显负电, 电负性小的一端显正电。即在键的两端出现了正 极和负极,这样的共价键具有极性,称极性共价 键,简称极性键。 相同原子形成共价键电荷均匀分布,是非极性键。 键矩定义为:μ=q×d (D) 键的极性大小主要由成键原子间的电负性差值决定。 电负性差值越大,键的极性就越强。
δδδ+ δδ+ δ+ δCH3 CH2 CH2 Cl
诱导效应沿碳链减弱很快,一般到第三个原子后,可 忽略不计。
整理课件
39
诱导效应的影响和强度以碳氢化合物中的氢为标
准。吸引电子能力比氢强的基团称吸电子基,其诱导 效应为负效应,用“-I”表示;吸引电子能力比氢弱的 基团称斥电子基,其诱导效应为正效应,用“+I”表示。 常见基团的诱导效应次序:
分子轨道理论,电子离域。
常见原子轨道组合有:
整理课件
14
s-s组合
s-px组合
整理课件
15
px-px组合
py-py组合 pz-pz组合
整理课件
16
注意:这里不能对s、px、py、pz绝对 化,如C的sp3杂化轨道与H的s轨道 的组合相当于s-px组合。
整理课件
17
第二节 共价键的属性
一、共价键的极性与极化性
E
+E
E
+
+
整理课件
34
三、非等性共振结构
共振结构参与杂化的比重是不同的,能量 越低、越稳定的的共振结构式在共振杂 化体中占较大的分量,贡献越大,越趋 近于真实结构。
整理课件
35
如:苯的共振结构式为
有机化学第二章 化学键

原子核外电子运动的波函数ψ——原子轨道(轨道函数) 电子在核外空间出现的几率——电子云密度 ∝ ∣ψ 2∣
常见原子轨道的类型与形状:
z
2s
x
2py
2px
y
2pz
S-AO
3 个p-AO
x
y z
主量子数为2的 p-AO有三个能量相等的简并轨道,对称
分布在原子核外空间的x、y、z轴上
在数学上把分子轨道处理为原子轨道的线性组合,
因此,波函数ψ是用各个原子轨道乘上权重因子后的
总和来表示:
ψ=C1φ1+ C2φ2+…+Cnφn
这种方法称为原子轨道线性组合——分子轨道 (LCAO-MO)近似法。所选的原子轨道的这种组合叫做 基组集合。
分子轨道的数目(成键的+非键的+反键的)等于
产生分子轨道的基组集合中原子轨道的总数:
C≡C < C=C < C—C 2. 对于spn杂环的p区元素原子,其共价键键长与其杂化态有关,n 值愈大,键长愈长:
键型 C—C
C—H
杂化
sp3—sp3 sp3—sp2 sp3—sp sp2—sp2 sp2—sp sp—sp sp3—H sp2—H sp—H
键长(nm)
0.154 0.151 0.146 0.134 0.143 0.120 0.110 0.108 0.106
视频
碳原子各种原子轨道形状及相对伸展半径
原子轨道
s
p
sp
sp2
sp3
轨道形状
成键能力 轨道夹角
球形
1.000
0°
哑铃形
1.732
90 °
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
C H 4 C H 3
C H 3HE d ( C H 3H )= 4 2 3 k J .m o l - 1 C H 2HE d ( C H 2H )= 4 3 9 k J .m o l - 1
C H 2 C H HE d ( C H H )= 4 4 8 k J . m o l - 1
C H CHE d ( C H ) = 3 4 7 k J . m o l - 1
第二章有机化合物的化学键
(一)诱导效应
1. 诱导效应: 由于成键原子电负性不同,而使整个 分子中电子云沿碳链向某一方向传递的现象,称 为诱导效应(inductive effect),用 I 表示。 这属于分子内原子间相互影响的电子效应
H
HC H
109 .5 o
H
甲烷
H
106o
H
CH3
112o
C CH3
丙烷
109.5 o
戊烷
104o
O
乙醚
N
H
107o
H H
氨分子 第二章有机化合物的化学键
H
121o
118o C O
H
甲醛
(3)键能
指成键时体系放出的能量或断键时体系吸收 的能量。 双原子分子键能就是其离解能 多原子分子键能通常是键的离解能平均值。
第二章有机化合物的化学键
第二节 决定共价键中电子分布的因素
电子效应 主要因素 立体效应
(1)共用电子对沿共价键移动,通过键的 极性传递所表现的分子中原子之间的相互 影响称为电子效应。它主要包括诱导效应 和共轭效应。
(2) 立体效应说明了分子中原子或原子团 在空间的分布(空间位阻)对分子性质产生 的影响。
指成键原子核之间的距离
一些共价键的键长
共价键 CC CH CN CO CF
键长/nm 共价键
0.154 0.109
C Cl C Br
0.147
CI
0.143 0.141
CC CC
第二章有机化合物的化学键
键长/nm 0.177 0.191 0.212 0.134 0.120
(2)键角: 指键与键之间的夹角。
第二章有机化合物的化学键
(2)杂化轨道理论
(a)碳原子轨道的sp3杂化
跃迁
sp3杂化
2p 2s
2p 2s
sp3
每个sp3杂化轨道含1/4 s 成分和 3/4 p成分
键角为 109.5°
sp3杂化轨道形状
碳原子的sp3杂化轨道
第二章有机化合物的化学键
第二章有机化合物的化学键
•σ键的形成及其特性
原子轨道沿键轴相互交盖,形成对键轴呈圆柱 形对称的轨道称为σ 轨道。σ轨道构成的共价键称为 σ键。
例如:甲烷分子中有四个C-Hσ键。 相类似,乙烷分子中有六个C-Hσ键和一个 C -Cσ键。
甲烷
乙烷
第二章有机化合物的化学键
(b)碳原子轨道的sp2杂化
1个s p 2 杂化轨道 = 1/3 s + 2/3 p
键角120°
余下一个未参与杂化的p轨道,垂
直于三个杂化轨道对称轴所在的
平面。
第二章有机化合物的化学键
μ=0
μ>0
诱导偶极矩或瞬间偶极矩
第二章有机化合物的化学键
不同的共价键,对外界电场的影响有不同的感 受能力,这种感受能力叫做可极化性。 键的可极化性对分子的反应性能起着重要作用。
例如:C-X键的极性: C-F > C-Cl > C-Br > C-I
C-X键的可极化性: C-I > C- Br> C-Cl > C-F C-X键的化学活性:C-I > C- Br> C-Cl > C-F
偶极矩为零的分子是非极性分子;偶极矩不为零的分 子是极性分子;偶极矩越大,分子极性越强。
第二章有机化合物的化学键
(6)极化性
键的极性是分子本身所固有的,而键的极化性是 指共价键在外电场的影响下,引起键内电子云密度 的重新分布,从而改变了键的极性,称这种现象为 键的极化性。
δ+
δ-
B r B rB r B rE+
甲烷C-H键键能(414kJ.mol-1)是上述解离能的平均值。 键能越大化学键越牢固
第二章有机化合物的化学键
一些共价键的键能
共价键 键能/kJ.mol-1 共价键
CC
347
C Cl
CH
414
C Br
键能/kJ.mol-1 339 285
CN
305
CI
218
CO
360
CF
485
CC
611
CC
837
第二章有机化合物的化学键
价键理论: (分子轨道理论,略) a.价键理论认为一个原子如果有几个未成对电子,
就可以与几个自旋相反的电子配对成键。例如: 甲烷 b.一个电子与另一个自旋相反的电子配对以后,就 不能再与第三个电子配对,称为共价键的饱和性 例如:H2 c.共价键具有方向性 电子配对也就是原子轨道的重叠 例如:HCl
sp2
平面三角形
第二章有机化合物的化学键
以乙烯分子为例:
乙烯分子中的σ键
乙烯分子中的π键
第二章有机化合物的化学键
C=C 键:1 s 键 ( sp2 – sp2) + 1 p 键(p – p)
第二章有机化合物的化学键
(c)碳原子轨道的 sp 杂化 1个sp 杂化轨道 = 1/2 s + 1/2p
一个sp 杂化轨道
二个sp 杂化轨道
பைடு நூலகம்未参与杂化的两个p轨道的对称轴互相垂直且都垂 直于sp杂化轨道对称轴所在直线。
第二章有机化合物的化学键
乙炔分子的σ键
乙炔分子中π键的形成
C≡C 键:1 s 键 ( sp2 – sp2) + 2 p 键 (p – p)
第二章有机化合物的化学键
(二)共价键的属性
(1)键长:
化学环境不同的相同共价键的键能是有差异的!
第二章有机化合物的化学键
(4)键的极性:
当成键原子电负性不同时, 电负性大的原子带部分负 电荷(δ-);电负性小的原子带有部分正电荷(δ+)。
键的极性强弱用偶极矩(μ)来衡量,它是正电中心或
负电中心上的电荷值与两电荷中心之间的距离的乘积:
μ=q×d
δ+
H
δ-
第二章 有机化合物的化学键
(一)共价键:
(1)共价键的形成 (2)共价键的属性
(二)决定共价键中电子分布的因素:
(1)电子效应 :诱导效应和共扼效应 (2)立体效应
(三)共振论
第二章有机化合物的化学键
第一节 共价键
(一)共价键的形成:
(1)价键理论: 共价键的定义:由原子各提供的电子形成电
子对,共享而成得化学键叫共价键
Cl H
Cl μ=3.57x10-30(C.m)
第二章有机化合物的化学键
(5)分子的极性
双原子分子,键的极性就是分子的极性。
多原子分子偶极矩是各个共价键偶极矩的矢量和
Cl
Cl
Cl
HC H
H
HC Cl
H
Cl C Cl
Cl
μ=6.47x10-30(C.m) μ=3.28x10-30(C.m) μ=0(C.m)
