高中化学化学键PPT课件
合集下载
高中化学 化学键.ppt

【生之学 师之导】 1.化学键与物质类别的关系 (1)只含共价键的物质 ①非金属元素构成的单质,如I2、N2、P4、金刚石、晶 体硅等。 ②非金属元素构成的共价化合物,如HCl、NH3、 SiO2、CS2等。
答案:(1) (2)AC (3)H2O 水分子间存在氢键 (4)H2O2+H2S===2H2O+S↓
课堂师生互动
离子化合物与共价化合物的判断
【生之学 师之导】 1.离子化合物与共价化合物的比较
2.判断方法 (1)根据构成化合物的元素种类来判断,一般地,活泼金 属(第IA、ⅡA族)和活泼非金属(第ⅥA、ⅦA族)的元素形成 的是离子键,对应的物质是离子化合物;同种或不同种非金 属原子之间形成的是共价键,对应的物质是共价化合物。 (2)根据化合物的类型来判断,大多数碱性氧化物、强碱 和盐属于离子化合物;非金属氢化物、非金属氧化物、含氧 酸属于共价化合物。
答案:B
5.关于氢键的下列说法中正确的是( ) A.每个水分子内含有两个氢键 B.在水蒸气、水和冰中都含有氢键 C.分子间形成氢键能使物质的熔点和沸点升高 D.HF的稳定性很强,是因为其分子间能形成氢键
解析:水在固态和液态时,分子间存在着氢键,而气态 时氢键被破坏,所以选项A、B错误。氢键的存在能使物质的 熔、沸点升高,在水中的溶解度增大,但氢键并不影响物质 的稳定性,因此选项D错误。
依次增大,它们的原子序数之和为20,且Y2-与Z+核外电子
层的结构相同。下列化合物中同时存在极性和非极性共价键
的是( )
A.Z2Y C.Z2Y2
B.X2Y2 D.ZYX
解析:短周期只有三个周期,X、Y、Z所在周期数依次 增大,则X只能在第一周期,Y2-与Z+核外电子层结构相同, 则Y为第二周期氧元素,Z是第三周期钠元素,由原子序数之 和可求出X的原子序数为1,是氢元素。则所给4个选项中物 质分别为Na2O、H2O2、Na2O2、NaOH,同时存在极性和非 极性共价键的是H2O2。
答案:(1) (2)AC (3)H2O 水分子间存在氢键 (4)H2O2+H2S===2H2O+S↓
课堂师生互动
离子化合物与共价化合物的判断
【生之学 师之导】 1.离子化合物与共价化合物的比较
2.判断方法 (1)根据构成化合物的元素种类来判断,一般地,活泼金 属(第IA、ⅡA族)和活泼非金属(第ⅥA、ⅦA族)的元素形成 的是离子键,对应的物质是离子化合物;同种或不同种非金 属原子之间形成的是共价键,对应的物质是共价化合物。 (2)根据化合物的类型来判断,大多数碱性氧化物、强碱 和盐属于离子化合物;非金属氢化物、非金属氧化物、含氧 酸属于共价化合物。
答案:B
5.关于氢键的下列说法中正确的是( ) A.每个水分子内含有两个氢键 B.在水蒸气、水和冰中都含有氢键 C.分子间形成氢键能使物质的熔点和沸点升高 D.HF的稳定性很强,是因为其分子间能形成氢键
解析:水在固态和液态时,分子间存在着氢键,而气态 时氢键被破坏,所以选项A、B错误。氢键的存在能使物质的 熔、沸点升高,在水中的溶解度增大,但氢键并不影响物质 的稳定性,因此选项D错误。
依次增大,它们的原子序数之和为20,且Y2-与Z+核外电子
层的结构相同。下列化合物中同时存在极性和非极性共价键
的是( )
A.Z2Y C.Z2Y2
B.X2Y2 D.ZYX
解析:短周期只有三个周期,X、Y、Z所在周期数依次 增大,则X只能在第一周期,Y2-与Z+核外电子层结构相同, 则Y为第二周期氧元素,Z是第三周期钠元素,由原子序数之 和可求出X的原子序数为1,是氢元素。则所给4个选项中物 质分别为Na2O、H2O2、Na2O2、NaOH,同时存在极性和非 极性共价键的是H2O2。
高中化学必修二1-3化学键 课件(共16张PPT)

(4)
(2)(2) 和(6) 质量数相等,但不能互称
同位素。
(3)(3) 和(4) 的中子数相等,但质子数 不相等,所以不是同一种元素。
氯的原子序数为17, 3517Cl是氯的一种
核素,下列说法正确的是 BD
A、 3517Cl原子所含的质子数为18
B、1/18mol的1H35Cl分子所含中子数 约为NA个
概念辨析 元素:具有相同核电荷数的同一类
原子的总称。 核素:具有一定数目质子和一定数
目中子的原子。
同位素:质子数相同而中子数不同 的不同原子的互称。
同素异形体:有相同元素组成不同 形态的单质。O3和O2
课堂练习
2142在 M((g11、))63((Li51、))(73和2(L)i5、)174(N互、61)为64(同3C)位中2131素N:a。、
核 组卷网
素
原子的组成
原子核
学科网
原子核由质子和中子组成
核外电子
原子的质量 取决于 原子核
质量数:
质量数(A) = 质子数(Z) + 中子数(N)
表示原子的通式为
A Z
X
质量数
234 92
U
表示一个质量数为234,院用放射性同位素 12553I 治疗肿瘤该同位素原子核内的中子数
C、3.5g35Cl2的体积约为2.24L
D、35Cl2气体的摩尔质量为70g/mol
1375CCl: 34.966 含量:75%
3177CCl: 36.969 含量:25%
问题:
Cl:35.5
35 17
Cl中的35表示:
35 17
Cl原子的质量数
,
Cl中的34.966表示:
人教版高中化学必修二第一章第三节《化学键》课件(共38张PPT)
活泼的金属元素和酸根离子形成的盐 把NH4+看作是活泼的金属阳离子
金属氧化物:Na2O,Al2O3等
强碱:NaOH Ba(OH)2等
如何表示氯化钠的形成过程--电子式
•资料卡片
电子式 为方便起见,我们在 元素符号周围用“ · ”或 “×”来表示原子的最外 层电子(价电子)。这种 式子叫做电子式。例如:
归纳:分子间作用力与化学键的比较
作用微粒 作用力大小
意义
化学键 相邻原子间 作用力大 范德华力 分子之间 作用力小
影响化学性质和 物理性质
影响物理性质 (熔沸点等)
一些氢化物的沸点
讨论: 为什么HF、H2O和NH3的沸点会反
常呢?
2.氢键
1)形成条件:原子半径较小,非金属性很强的 原子(N、O、F)与H原子形成强极性共价键 ,与另一个分子中的半径较小,非金属性很强 的原子Y (N、O、F),在分子间H与Y产生
1.原子、离子都要标出最外层电子,离子须标明 电荷;
2.阴离子要用方括号括起来;
3.相同的原子可以合并写,相同的离子要单个写 ;
4.不能把“→”写成“====”;
⑴ 用电子式表示氧化镁的形成过程 ⑵ 用电子式表示硫化钾的形成过程
氢气在氯气中燃烧
写出该过程的化学方程式和实验现象 思考:活泼的金属元素和活泼非金属元素化 合时形成离子键。请思考,非金属元素之间 化合时,能形成离子键吗?为什么?
较强的静电吸引,形成氢键
2)表示方法:X—H…Y—H(X.Y可相同或不 同,一般为N、O、F)。
3)氢键能级:比化学键弱很多,但比分子间作 用力稍强
特征:具有方向性。
氢键作用:使物质有较高的熔沸点(H2O、HF 、 NH3) 使物质易溶于水
金属氧化物:Na2O,Al2O3等
强碱:NaOH Ba(OH)2等
如何表示氯化钠的形成过程--电子式
•资料卡片
电子式 为方便起见,我们在 元素符号周围用“ · ”或 “×”来表示原子的最外 层电子(价电子)。这种 式子叫做电子式。例如:
归纳:分子间作用力与化学键的比较
作用微粒 作用力大小
意义
化学键 相邻原子间 作用力大 范德华力 分子之间 作用力小
影响化学性质和 物理性质
影响物理性质 (熔沸点等)
一些氢化物的沸点
讨论: 为什么HF、H2O和NH3的沸点会反
常呢?
2.氢键
1)形成条件:原子半径较小,非金属性很强的 原子(N、O、F)与H原子形成强极性共价键 ,与另一个分子中的半径较小,非金属性很强 的原子Y (N、O、F),在分子间H与Y产生
1.原子、离子都要标出最外层电子,离子须标明 电荷;
2.阴离子要用方括号括起来;
3.相同的原子可以合并写,相同的离子要单个写 ;
4.不能把“→”写成“====”;
⑴ 用电子式表示氧化镁的形成过程 ⑵ 用电子式表示硫化钾的形成过程
氢气在氯气中燃烧
写出该过程的化学方程式和实验现象 思考:活泼的金属元素和活泼非金属元素化 合时形成离子键。请思考,非金属元素之间 化合时,能形成离子键吗?为什么?
较强的静电吸引,形成氢键
2)表示方法:X—H…Y—H(X.Y可相同或不 同,一般为N、O、F)。
3)氢键能级:比化学键弱很多,但比分子间作 用力稍强
特征:具有方向性。
氢键作用:使物质有较高的熔沸点(H2O、HF 、 NH3) 使物质易溶于水
【高中化学】化学键PPT课件

科学地、辩证地看问题。
要点提示
重点:理解离子键、共价键的含义。 难点:用电子式表示离子化合物和共价化合物的过程。 教具准备:多媒体课件、导学案。
复习
化学键:相邻的两个或多个
原子(或离子)之间强烈的相互作 用叫做化学键。
离子键 极性键 化学键 共价键 非极性键 金属键
由阴阳离子之间通过静电作用所形 成的化学键叫离子键 原子之间通过共用电子对所形成的 化学键叫共价键
讨论
活泼的金属元素和活泼非金属元素 的原子之间化合时形成离子键。那么, 非金属元素的原子之间能形成离子键吗? 为什么? 一般不能,因非金属元素的原子均 有获得电子的倾向。 非金属元素的原子间可通过共用电 子对使双方最外电子层均达到稳定结构。 (如HCl的形成)
原子之间通过共用电子对所形成的相 互作用,叫做共价键。 非极性共价键 再如氢分子的形成: H﹣H(结构式) H · + ·H → H H 特点: 共用电子对不偏移,成键原子不显电性
Na和Cl2的反应
Na
+11
281
+11 2 8
Na+
Cl-
Cl
+17
287
+17
288
离子键
定义: 使阴阳离子结合成化合物的静电作 用,叫做离子键。
问题:
1.形成离子键的微粒是什么? 阴、阳离子。 2.离子键是一种什么性质的相互作用? 静电作用(静电引力和斥力)。 3.离子键的成键过程怎样?
阴阳离子接近到某一定距离时,吸引和排斥达到平衡 就形成了离子键。
复 习:
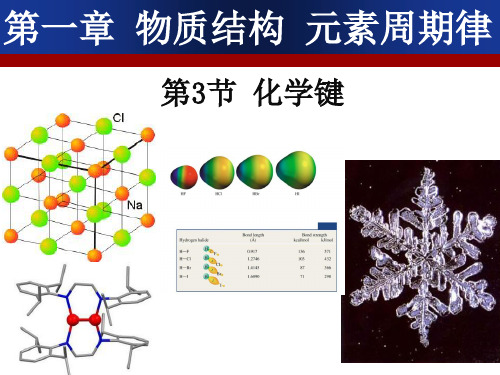
第三节 化 学 键
• 知识与技能:
• •
复习目标:
1、认识化学键的涵义。 2、理解离子键、共价键的含义。知道离子键、共价键的形成,了解 键的极性。 • 3交流讨论:离子化合物和共价化合物的区别。
要点提示
重点:理解离子键、共价键的含义。 难点:用电子式表示离子化合物和共价化合物的过程。 教具准备:多媒体课件、导学案。
复习
化学键:相邻的两个或多个
原子(或离子)之间强烈的相互作 用叫做化学键。
离子键 极性键 化学键 共价键 非极性键 金属键
由阴阳离子之间通过静电作用所形 成的化学键叫离子键 原子之间通过共用电子对所形成的 化学键叫共价键
讨论
活泼的金属元素和活泼非金属元素 的原子之间化合时形成离子键。那么, 非金属元素的原子之间能形成离子键吗? 为什么? 一般不能,因非金属元素的原子均 有获得电子的倾向。 非金属元素的原子间可通过共用电 子对使双方最外电子层均达到稳定结构。 (如HCl的形成)
原子之间通过共用电子对所形成的相 互作用,叫做共价键。 非极性共价键 再如氢分子的形成: H﹣H(结构式) H · + ·H → H H 特点: 共用电子对不偏移,成键原子不显电性
Na和Cl2的反应
Na
+11
281
+11 2 8
Na+
Cl-
Cl
+17
287
+17
288
离子键
定义: 使阴阳离子结合成化合物的静电作 用,叫做离子键。
问题:
1.形成离子键的微粒是什么? 阴、阳离子。 2.离子键是一种什么性质的相互作用? 静电作用(静电引力和斥力)。 3.离子键的成键过程怎样?
阴阳离子接近到某一定距离时,吸引和排斥达到平衡 就形成了离子键。
复 习:
第三节 化 学 键
• 知识与技能:
• •
复习目标:
1、认识化学键的涵义。 2、理解离子键、共价键的含义。知道离子键、共价键的形成,了解 键的极性。 • 3交流讨论:离子化合物和共价化合物的区别。
人教版高中化学必修第一册精品课件 第四章物质结构元素周期律 第三节 化学键-第1课时 离子键 共价键

导电性
熔融态或水溶液中导电
熔融态不导电,溶于水有的导电 (如硫酸),有的不导电(如蔗糖)
实例
强碱、大多数盐、活泼 金属的氧化物等
酸、非金属的氢化物、非金属的氧化物等
五、化学键与物质类别的关系图示
致用
D
2.下列物质中,既含有离子键,又含有共价键的是( )
A
3.[2023江苏丹阳高级中学开学考试] 下列物质中既存在离子键,又存在共价键的是 ( )
续表
类型
应用示例
书写规范
离子化合物
__
先根据离子电子式的书写方法,分别 写出阴、阳离子的电子式,然后让 阴、阳离子间隔排列,注意相同离子 不能合并
共价化合物
_
将共用电子对画在两原子之间,每个 原子的未成对电子和孤电子对也应画 出
续表
2.用电子式表示简单物质的形成过程
致用
C
A. B. C. D.
⑤
⑦
④⑥
③⑦
共价键
离子键、共价键
02
考点二 电子式的书写及物质形成过程 的表示
导入
(2)用电子式表示下列物质的形成过程:
知新
1.分类规范书写电子式
类型
应用示例
书写规范
复杂阴、阳离子用 “[ ]”括起来,右 上角标出电荷数及电 性,原子之间的共用 电子对要表示出来
_、 _
用“[ ]”括起来,右上角标出电荷数及 电性,原子之间的共用电子对要表示出 来
D
4.下列说法中不正确的是( )
B
A.离子化合物一定含有阴离子和阳离子 B.熔融状态下能导电的物质一定是离子化合物 C.两种元素单质形成离子化合物的过程中一定伴有电子得失 D.原子序数为12和9的原子所对应的元素可形成离子化合物
熔融态或水溶液中导电
熔融态不导电,溶于水有的导电 (如硫酸),有的不导电(如蔗糖)
实例
强碱、大多数盐、活泼 金属的氧化物等
酸、非金属的氢化物、非金属的氧化物等
五、化学键与物质类别的关系图示
致用
D
2.下列物质中,既含有离子键,又含有共价键的是( )
A
3.[2023江苏丹阳高级中学开学考试] 下列物质中既存在离子键,又存在共价键的是 ( )
续表
类型
应用示例
书写规范
离子化合物
__
先根据离子电子式的书写方法,分别 写出阴、阳离子的电子式,然后让 阴、阳离子间隔排列,注意相同离子 不能合并
共价化合物
_
将共用电子对画在两原子之间,每个 原子的未成对电子和孤电子对也应画 出
续表
2.用电子式表示简单物质的形成过程
致用
C
A. B. C. D.
⑤
⑦
④⑥
③⑦
共价键
离子键、共价键
02
考点二 电子式的书写及物质形成过程 的表示
导入
(2)用电子式表示下列物质的形成过程:
知新
1.分类规范书写电子式
类型
应用示例
书写规范
复杂阴、阳离子用 “[ ]”括起来,右 上角标出电荷数及电 性,原子之间的共用 电子对要表示出来
_、 _
用“[ ]”括起来,右上角标出电荷数及 电性,原子之间的共用电子对要表示出 来
D
4.下列说法中不正确的是( )
B
A.离子化合物一定含有阴离子和阳离子 B.熔融状态下能导电的物质一定是离子化合物 C.两种元素单质形成离子化合物的过程中一定伴有电子得失 D.原子序数为12和9的原子所对应的元素可形成离子化合物
高中化学必修二第一章 第三节化学键 课时1 离子键和共价键(共59张PPT)

•
下列有关离子化合物的说法正确的
是( )
• A.离子化合物一定易溶于水
• B.离子化合物由非金属元素和金属元素共
同组成
• C.熔融状态下能够导电的物质,一定是离
子化合物
• D.离子化合物在晶体状态下有离子存在,
但不导电
【解析】 离子化合物不一定易溶于水,如 AgCl、BaSO4等;离子化合物不一定由非金 属元素和金属元素共同组成,如NH4Cl等铵 盐全部由非金属元素组成;熔融状态能导电 的物质,不一定是离子化合物,如金属单质; 离子化合物由阴、阳离子构成,在晶体状态 下,离子不能自由移动,故不能导电。
• 【答案】 D
• 4.氯化钠是日常生活中人们常用的调味品。 在下列事实中,可以证明NaCl中一定存在离 子键的是( )
• (3)证明某化合物一定存在离子键的方法是看在熔融 状态下能否导电。
• 3.离子化合物
• (1)定义:由离子键构成的化合物叫做离子化 合物。
• (2)构成微粒:阴离子、阳离子。
• (3)主要物理性质:熔、沸点较高,硬度较大。
• (4)导电性:固态时不导电,溶于水或受热熔 化后导电。
• (5)溶解性:大多数离子化合物易溶于水,难 溶于汽油、苯、四氯化碳等有机溶剂。
子化合物 • C.离子化合物一定能导电 • D.只有在活泼金属元素和活泼非金属元素
化合时,才能形成离子键
• 【解析】 正确理解离子键和离子化合物的 内涵和外延才能解答本题。
• A项,离子键是指阴、阳离子间的静电作用, 包括引力和斥力二者的平衡;B项,离子键 形成的只能是离子化合物;C项,离子化合 物在熔融状态或水溶液里才能导电,D项NH 与活泼非金属元素之间也可形成离子键。
4.3 化学键 课件高中化学人教版(2019)必修第一册
第四章 物质结构 元素周期律
第三节 化学键
原子
化学键
使离子相结合或原子相结合的相互作用力。 注意:不包括分子
定义:相邻的原子之间强烈的相互作用。
一、离子键 1、NaCl的形成过程 ⑴钠在氯气中燃烧的化学方程式为___2N__a_+__C_l_2=_点=__=燃_=_=_2_N_a_C_l__。
Na +11 2 8 1
变化规律 用力越___大_,物质的熔、沸点也越高。例如,熔、沸点:I2 > Br2 > Cl2 >F2
2.氢键
冰中氢键的存在使冰的结构中有空隙,造成其密度低于液态水。
定义 形成条件 存在
是一种比化学键弱,但比范德华力强的分子间作用力 除H外,形成氢键的原子通常是N﹑O﹑F 氢键存在广泛,如蛋白质分子、醇、羧酸分子、H2O、NH3、 HF等分子之间。分子间氢键会使物质的熔点和沸点 升高
八、化学键与化学反应的实质
1、化学键
定义:相邻的原子之间强烈的相互作用。
离子键 分类:
共价键
极性键 非极性键
静电引力 静电作用
静电斥力
2、化学反应的实质: 化学反应的实质是旧化学键的断裂和新化学键的形成。
①化学反应的本质是旧化学键的断裂和新化学键的形成,只有化学键的 3、注意: 断裂,不一定是化学变化,如熔融NaCl。
①离子化合物中一定含有离子键。 ②含有离子键的物质一定是离子化合物。 ③离子化合物中一定含有阴离子和阳离子。
(2)二个“不一定” ①离子化合物中不一定含有金属元素,如NH4Cl、NH4NO3等。 ②含有金属元素的化合物也不一定是离子化合物,如AlCl3。
练习: 1、下列化合物中有离子键的是
( (1)(3)(4) )
第三节 化学键
原子
化学键
使离子相结合或原子相结合的相互作用力。 注意:不包括分子
定义:相邻的原子之间强烈的相互作用。
一、离子键 1、NaCl的形成过程 ⑴钠在氯气中燃烧的化学方程式为___2N__a_+__C_l_2=_点=__=燃_=_=_2_N_a_C_l__。
Na +11 2 8 1
变化规律 用力越___大_,物质的熔、沸点也越高。例如,熔、沸点:I2 > Br2 > Cl2 >F2
2.氢键
冰中氢键的存在使冰的结构中有空隙,造成其密度低于液态水。
定义 形成条件 存在
是一种比化学键弱,但比范德华力强的分子间作用力 除H外,形成氢键的原子通常是N﹑O﹑F 氢键存在广泛,如蛋白质分子、醇、羧酸分子、H2O、NH3、 HF等分子之间。分子间氢键会使物质的熔点和沸点 升高
八、化学键与化学反应的实质
1、化学键
定义:相邻的原子之间强烈的相互作用。
离子键 分类:
共价键
极性键 非极性键
静电引力 静电作用
静电斥力
2、化学反应的实质: 化学反应的实质是旧化学键的断裂和新化学键的形成。
①化学反应的本质是旧化学键的断裂和新化学键的形成,只有化学键的 3、注意: 断裂,不一定是化学变化,如熔融NaCl。
①离子化合物中一定含有离子键。 ②含有离子键的物质一定是离子化合物。 ③离子化合物中一定含有阴离子和阳离子。
(2)二个“不一定” ①离子化合物中不一定含有金属元素,如NH4Cl、NH4NO3等。 ②含有金属元素的化合物也不一定是离子化合物,如AlCl3。
练习: 1、下列化合物中有离子键的是
( (1)(3)(4) )
4.3.2 共价键(教学课件)(共18张PPT)—高中化学人教版(2019)必修一

100℃
2000℃
H2O(l)
H2O(g)
H2(g)+O2(g)
物理变化
Hale Waihona Puke 化学变化(H2O之间存在着相互作用)
(H2O内H、O存在着相互作用)
结论:H2O内H和O之间的相互作用远大于H2O之间的作用。
共价键
认识共价键的形成
··C····l · + ·C····l ·· H · + ·C····l ··
第四章 物质结构 元素周期律
第三节 化学键
第二课时 共价键
课前导入
你有没有想过,为什么2个氢原子结合成氢分子,2个氯原子结合成氯分子,而 不是3个、4个呢?为什么一个氢原子和一个氯原子结合成氯化氢分子,而不是以 其他的个数比相结合呢?
课前导入
【思考与交流】通常情况下,水加热至100℃时可以变为水蒸气;加热至 2000℃或通电时才能解离成氢气和氧气。这说明了什么?
先破坏离子键
后形成离子键
化学键与分子间作用力
化学键与分子间作用力
2.分子间作用力 (1)分子间作用力 是指把分子聚集在一起的作用力,又叫范德华力。范德华力比化学键弱得多,对物 质的熔点、沸点等有影响。 (2)氢键 分子间形成的氢键也是一种分子间作用力。它比化学键弱,但比范德华力强,氢 键会使物质的熔点和沸点升高。
离子键 (得失电子、阴阳离子、静电作用)
化学键
共价键
非极性键 极性键
(不同原子、共用电子对偏移) (相同原子、共用电子对不偏移)
(3) 化学反应的实质 旧化学键先破后立和新化学键的形成过程
点燃
Cl2+2H2 == 2HCl
AgNO3 +NaCl = AgCl ↓ + NaNO3
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
分子 H2 N2 H2O CO2 CH4
电子式
4、共价键的存在: 不仅存在于非金属单质和共价化合物中,
如:H2,HCl,CO2, 也存在于有些离子化合物中
如:NaOH NH4形成分子的化合物。
例:HCl H2O CO2 CH4 NH3
注: 共价化合物中一定含有共价键
含有共价键的化合物不一定是共价化合物 离子化合物中也可能含有共价键
【课堂练习】
1.请用电子式表示下列物质的形成的过程。
HF、H2O、CO2
2.下列物质含有共价键的离子化合物AD的是:
A. Ba(OH)2 B. KCl C. H2O D. NaHCO3
思考?
共价单质和共价化合物都含有共 价键,但通常说像单质分子H2 、 N2 中,成键原子不显电性,而像 HF、H2O、CO2 分子中原子显电 性,为什么呢?
层电子数,而且还应用中括号“[ ]”括起
来,并在右上角标出“n-”电荷字样。
[:O····:]2-
[:C·l·:]-
(4)离子化合物的电子式: 由阴、阳离子的电子式组成,但对相 同离子不能合并。
AB型 NaCl
A2B型 Na2S
AB2型 MgCl2
注意:相同的离子不能写在一起,一般对称排列.
[ 练习] 写出下列微粒的电子式:
你想过吗?
1.为什么一百多种元素可形成千千万 万种物质?
2. 为什么两个氢原子可以形成氢分子, 而两个氦原子却不能形成氦分子?
第三节 化学键
回顾实验:钠在氯气中燃烧
2Na+Cl2 点燃 2NaCl
交流·研讨
运用核外电子排布的 知识和化学键知识分析氯 化钠的形成过程。
不稳定 稳定
电子转移 Na+ Cl-
b. 离子的电子式:
[ ×]—
[ × × ]2-
Na+
归纳:电子式是怎样写的?
Mg2+
书写要点
电子式
(1)原子的电子式:常把其最外层电子 数用小黑点“.”或小叉“×”来表示。 H·
(2)简单阳离子的电子式:就是其离子符
号,不要求画出离子最外层电子数。 Na+ Mg2+
(3)简单阴离子的电子式:不但要画出最外
思考
在氯化钠晶体中,Na+和Cl- 间存在
哪些力?
演示:Na与Cl形成NaCl的过程
1、Na+离子和Cl-离子间的静电吸引作用
2、电子与电子、原子核与原子核间的 静电斥力作用
一.离子键
1.定义:带相反电荷离子之间的相互作用称为
离子键
成键原因: 电子得失 成键粒子: 阴阳离子
成键本质:静电作用(静电吸引和静电排斥)
书写要点
1.反应物要用原子的电子式表示,相同的可合并。
2.生成物要用离子化合物的电子式表示,相同的离子 要单个写。
3.用于连结反应物和生成物的符号
是“
” , 而不是=。电子转移的箭头可标也可不标
[ 练习] ⑴ 用电子式表示MgO的形成过程
·Mg ·+
·· ·O···→
Mg2+[:O··:]2··
⑵ 用2K电·+子式·S··表···示→K2SK的+ 形[:S··成··:]过2- 程K+ (3)用电子式表示CaBr2的形成过程
思考:
活泼金属与活泼非金属化合时易形成离子键, 那么非金属和非金属之间相互作用时,原子又是怎样 结合成分子的?H 2、HCl是怎样形成的?
分析氯化氢的形成过程
共价键 1、概念:
原子间通过共用电子对所形成的相互作用
成键微粒:原子
注 共价键的实质:原子间的静电作用。 意
成键元素:同种或不同种非金属元素
成键元素: 活泼的金属元素(ⅠA,ⅡA) 和活泼的非金属元素(ⅥA,ⅦA)
成键过程: 阴阳离子接近到某一定距离时,吸引和排
斥达到平衡,就形成了离子键。
由离子键构成的化合物叫做离子化合物。
2.离子化合物:由离子键构成的化合物。
思考 哪些物质中存在离子键呢?
1、活泼的金属元素(IA、IIA)和活泼的非金属元素 (VIA、VIIA) 之间的化合物。(如:Na2O.Na2O2) 2、活泼的金属元素和酸根离子形成的盐,即大部分盐。 (如:NaNO3) 3、铵根和酸根离子(或活泼非金属元素)形成的盐。 (如:NH4Cl , (NH4)2SO4 )
:B··r···+·Ca·+:B··r···→ [:B··r··:]-Ca2+[:B··r··:]-
注 箭头左方相同的微粒可以合并, 意 箭头右方相同的微粒不可以合并。
小结:
失去电子
活泼金属原子
得到电子
活泼非金属原子
阳离子 阴离子
电子式
静电作用
离子化合物
离子键
离子晶体
离子键 带相反电荷离子之间的相互作
4、金属阳离子与OH-(如 NaOH),即强碱。
质疑
化学反应中一般是原子的最外 层电子发生变化,所以化学反应中 需要表示出最外层电子的变化,那 么用什么来表示呢?
二.电子式
· 在元素符号周围用小黑点 (或×)来表示原
子的最外层电子。这种式子叫做电子式。
a. 原子的电子式:
H × Na × ×Mg×
用称为离子键。
含有离子键的化合物一定是离子化合物。
电子式 在元素符号周围用小黑点(·)或小
叉(×)表示的式子叫电子式。
1.离子标电荷
注 2.阴离子用括号
意
3.相同原子可合并, 相同离子不合并. 4.不把 “→”当“=”
1.根据原子序数,下列各组原子能以 离子键结合的是(C )
A.10与19
B.6与16
C.11与17
D.14与8
2.主族元素A和B形成AB2型离子化合物, 用电子式表示AB2的形成过程。
·· · · ·· · · ·· ·· ·· ··
B····+ A + B····
[ B····]-A2+ [ B····]-
复习提问:
下列物质中存在离子键的是( A、D ) A。NaCl B.H2 C. HCl D.MgBr2
溴原子, 硫离子,钙离子
··
B··r···
:
[ :S····]2-
Ca2+
[ 练习] 写出下列化合物的电子式:
KBr,Na2O,CaCl2 ,CaO
··
用电子式表示离子化合物的形成过程 用N电a子·式+表C示····l ·Na→ClN的a形+ [:成C··l··过:]-程 用电子式表示MgCl2的形成过程
共价键
H ·+ ·C····l:→ H C····l
·· ··
2、共价键的形成条件: 一般是非金属原子之间
如:H2 N2 HCl H2O HF 等均以共价键形成分子
3.共价键的表示方法 (1)电子式:
(2)结构式:用一根短线表示一对共用电子 对,表示如下:
H-H N三N H-Cl H-O-H H-F
