α-苯乙胺思考题
3α-苯乙胺的制备与拆分

有机化学综合试验B3α-苯乙胺的制备与拆分实验简介(±)-α-苯乙胺的制备应用到了鲁卡特反应醛或酮在高温下与HCOONH4反应得到伯胺得反应称为鲁卡特反应醛或酮与氨反应形成α-氨基醇,α-氨基醇继而脱水成亚胺,亚胺经催化加氢转变为胺,这是由羰基化合物合成胺的一种重要方法。
在鲁卡特反应中,甲酸或甲酸根离子(HCOO-)起还原作用,氢原子以强还原性氢负离子(H-)的形式转移至亚胺。
.在鲁卡特反应中,以醛酮作原料分别与氨,伯胺或仲胺反应可以得到相应的伯,仲,叔胺.鲁卡特反应通用性较强,可以用来处理多数脂肪酮,脂环酮,脂肪-芳香酮,杂环酮等,尤其是芳香酮及高沸点芳香酮更为适用(±)-α-苯乙胺的制备α-苯乙胺的用途α-苯乙胺有芳香味液体。
能从空气中吸收二氧化碳,呈强碱性,与乙醇、乙醚互溶,溶于水。
α-苯乙胺是制备精细化工产品的一种重要中间体,它的衍生物广泛用于医药化工领域,主要用于合成医药、染料、香料及乳化剂等。
一、实验目的学习由鲁卡特反应制取胺的原理及实验方法,掌握蒸馏和水蒸气蒸馏的操作技术二、实验原理1、试剂:甲酸铵25.4g;苯乙酮15ml;苯95ml;浓盐酸;氢氧化钠;氯仿;甲苯;2、原理:氨首先与羰基发生亲核加成,接着脱水生成亚胺,亚胺随后被还原成胺。
与还原胺化不同,这里不是用催化氢化,而是用甲酸作为还原剂。
反应式:O CH3║│C6H5CH3+2HCO2NH4→C6H5CH—N6H5CHO+NH3↑+CO2+2H2O↑CH3 CH3││+C6H5CH—NHCHO+HCl+H2O→C6H5CHNH3Cl—+HCO2HCH3 CH3│+ │C6H5CHNH3Cl+NaOH→C6H5CHNH2+NaCl+H2O(±)—苯乙胺三、试验装置图与流程图四、实验步骤五、数据分析与处理实验产物的产量为2.1mL查得α-苯乙胺苯的密度为0.94g/mL,则n(α-苯乙胺苯)=(2.1X0.94)/120=0.01645moL。
12章 13章 14章 答案
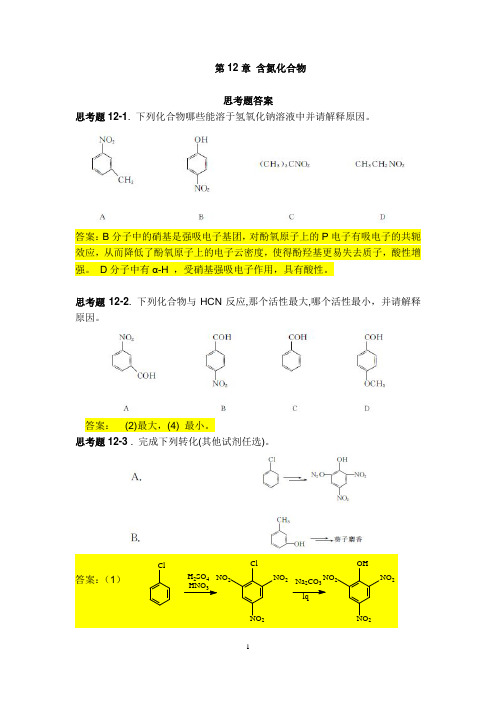
第12章 含氮化合物思考题答案思考题12-1. 下列化合物哪些能溶于氢氧化钠溶液中并请解释原因。
答案:B 分子中的硝基是强吸电子基团,对酚氧原子上的P 电子有吸电子的共轭效应,从而降低了酚氧原子上的电子云密度,使得酚羟基更易失去质子,酸性增强。
D 分子中有α-H ,受硝基强吸电子作用,具有酸性。
思考题12-2. 下列化合物与HCN 反应,那个活性最大,哪个活性最小,并请解释原因。
答案: (2)最大,(4) 最小。
思考题12-3 . 完成下列转化(其他试剂任选)。
思考题12-4. 分别指出下列化合物是芳胺还是脂肪胺, 并用1。
,2。
,3。
表示出其属于伯、仲、叔胺哪一类?答案:脂肪胺: (1) (叔胺),(2) (伯胺), (3) (仲胺);芳胺: (4) (伯胺) 。
思考题12-5. 写出下列化合物的结构,并指出哪些胺有对映异构体。
A .N-甲基-N-乙基丙胺 B.顺-2-甲基环己胺C.氢氧甲基乙基苯基铵D.碘化甲基乙基丙基异丙基铵思考题12-6. 按沸点逐渐增加的次序排列每组化合物。
A .乙醇,二甲胺,甲醚 B.三甲胺,二乙胺,二异丙基胺 答案:A 乙醇>二甲胺>甲醚.B 二异丙基胺 >二乙胺 > 三甲胺.思考题12-7 按碱性逐渐增强的次序排列每组化合物。
(1)氢氧化钠,氨,甲基胺,苯胺。
(2)苯胺,吡咯,吡啶。
(3)苯胺,对甲氧基苯胺,间硝基苯胺,对硝基苯胺。
思考题12-8. 请设计分离对甲基苯酚、环己基甲酸和对甲基苯胺混合物的方法。
答案:第一步往混合液中加入碳酸氢钠溶液,能溶解羧酸,分液后,(有机层留作第二步用)往无机层中加稀酸,羧酸即游离出。
第二步 向分离出的有机层中加入稀盐酸,胺能溶于盐酸溶液.分液,无机层中加入氢氧化钠溶液即胺析出.思考题12-9.如何除去(CH 3CH 2CH 2CH 2)3N +HCl - 中少量的(CH3CH 2CH 2CH 2)4N +Cl - ?答案:加入氢氧化钠溶液,季铵盐能溶于其中,仲胺析出分层.思考题12-10 用过量碘化甲烷处理(S) 毒芹碱,接着加入氧化银并加热,预测得到的主要产物是什么,写出它的结构并用系统命名法命名。
合成化学实验四 α
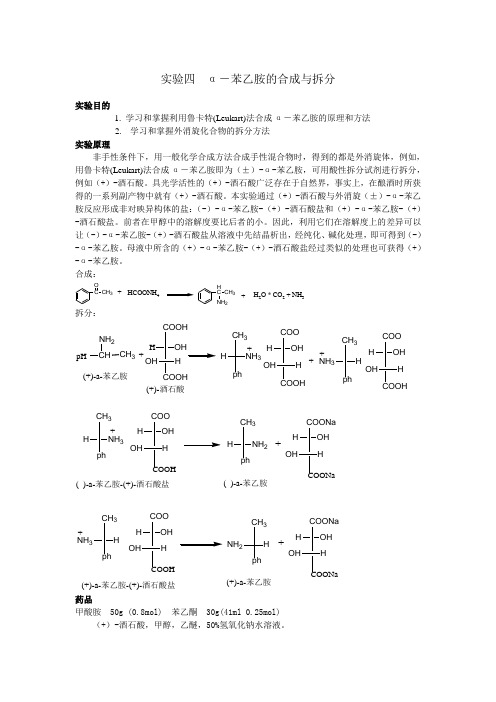
实验四 α-苯乙胺的合成与拆分实验目的1. 学习和掌握利用鲁卡特(Leukart)法合成α-苯乙胺的原理和方法2. 学习和掌握外消旋化合物的拆分方法实验原理非手性条件下,用一般化学合成方法合成手性混合物时,得到的都是外消旋体,例如,用鲁卡特(Leukart)法合成α-苯乙胺即为(±)-α-苯乙胺,可用酸性拆分试剂进行拆分,例如(+)-酒石酸。
具光学活性的(+)-酒石酸广泛存在于自然界,事实上,在酿酒时所获得的一系列副产物中就有(+)-酒石酸。
本实验通过(+)-酒石酸与外消旋(±)-α-苯乙胺反应形成非对映异构体的盐:(-)-α-苯乙胺-(+)-酒石酸盐和(+)-α-苯乙胺-(+)-酒石酸盐。
前者在甲醇中的溶解度要比后者的小。
因此,利用它们在溶解度上的差异可以让(-)-α-苯乙胺-(+)-酒石酸盐从溶液中先结晶析出,经纯化、碱化处理,即可得到(-)-α-苯乙胺。
母液中所含的(+)-α-苯乙胺-(+)-酒石酸盐经过类似的处理也可获得(+)-α-苯乙胺。
合成:C OCH 3HCOONH 4HC CH 3NH 2++H 2O * CO 2 + NH 3拆分:pHCHNH 2CH 3+3_++NH +_(+)-a-苯乙胺(+)-酒石酸_3+( )-a-苯乙胺-(+)-酒石酸盐_2+_( )-a-苯乙胺_NH (+)-a-苯乙胺-(+)-酒石酸盐+_NH +(+)-a-苯乙胺药品甲酸胺 50g (0.8mol) 苯乙酮 30g(41ml 0.25mol)(+)-酒石酸,甲醇,乙醚,50%氢氧化钠水溶液。
实验步骤(±)-α-苯乙胺的合成装置:以250ml三口瓶作反应器,搭建一蒸馏装置,侧口装温度计,温度计插到液面下,尾气吸收。
用电炉加热。
在250ml三口瓶中加入22.2g甲酸胺,12mL苯乙酮及几粒沸石,缓慢加热至150-155℃,混合物开始溶解同时有馏分馏出,并不断放出气泡(氨和二氧化碳),反应 1.5h,温度可达185-190℃,停止加热,将馏分倒入分液漏斗中。
实验二十三外消旋α-苯乙胺的合成和拆分

实验二十三外消旋α-苯乙胺的合成和拆分实验二十三外消旋α-苯乙胺的合成和拆分一、实验目的1、学习外消旋α-苯乙胺的合成方法。
2、掌握外消旋体的拆分的基本原理和方法、学习旋光度的测定方法 3二、基本原理在非手性条件下,由一般合成反应所得的手性化合物为等量的对映体组成的外消旋体,故无旋光性。
利用拆分的方法,把外消旋体的一对对映体分成纯净的左旋体和右旋体,即所谓的消旋体的拆分。
拆分外消旋体最常用的方法是利用化学反应把对映体变为非对映体。
如果手性化合物分子中含有一个易于反应的极性基团,如羧基,氨基等,就可以使它与一个纯的旋光化合物(拆解剂)反应,从而把一对对映体变成两种非对映体。
由于非对映体具有不同的物理性质,如溶解性,结晶性等,利用结晶等方法将他们分离、精制,然后再去掉拆解剂,就可以得到纯的旋光化合物,达到拆分目的。
常用的拆解剂有马钱子碱、奎宁和麻黄素等旋光纯的生物碱(拆分外消旋的有机酸)以及酒石酸、樟脑磺酸等旋光纯的有机酸(拆分外消旋的有机碱)。
外消旋的醇通常先与丁二酸酐或邻苯二甲酸酐形成单酯,用旋光醇的碱把酸拆分,再经碱性水解得到单个的旋光性的醇。
对映体的完全分离当然是最理想的,但是实际工作中很难做到这一点,常用光学纯度表示被拆分后对映体的纯净程度,它等于样品的比旋光除以纯对映体的比旋光。
光学纯度(op)=样品的[a]/纯物质的[a]*100%。
本实验用(+)-酒石酸为拆解剂,它与外消旋α-苯乙胺形成非对映异构体的盐。
旋光纯的酒石酸在自然界颇为丰富,它是酿酒过程中的副产物。
由于(-)-胺(+)-酸非对映体的盐比另一种非对映体的盐在甲醇中的溶解度小,故易从溶液中呈结晶析出,经稀碱处理,使(-)-α-苯乙胺游离出来。
母液中含有(+)-胺(+)-酸盐,原则上经提纯后可以得到另一个非对映体的盐,经稀碱处理后得到(+)-胺。
本实验只分离对映异构体之一,即左旋异构体,因右旋异构体的分离对学生来说显得困难。
本实验用(+)-酒石酸为拆解剂,它与外消旋α-苯乙胺形成非对映异构体的盐。
综合化学实验讲义

.综合化学实验实验讲义有机化学教研室编制实验一 醋酸正丁酯的制备一、实验目的1 掌握醋酸正丁酯合成的原理和方法;2 学习通过恒沸物除去反应体系中水分的方法。
二、实验原理醋酸正丁酯是一种良好的有机溶剂,可以应用于人造革、医药、塑料及香料等工业,并可以用作萃取剂和脱水剂。
醋酸正丁酯通过酯化反应由醋酸和正丁酯制备,加入极少量的浓硫酸作为催化剂。
CH3COOH +CH 3CH 2CH 2CH 2OH 浓硫酸CH 3COOCH 2CH 2CH 2CH 3+H 2O通过将体系中形成的副产物水除去,可以提高酯化反应的转化率。
利用乙酸正丁酯-正丁醇-水形成恒沸物,可以通过分水器将反应过程中形成的水分分出,促进酯化反应平衡向右移动,提高反应的转化率。
三、实验方法250 ml 的四口烧瓶中加入27.9 m l 正丁醇和14.4 ml 醋酸再加入10滴浓硫酸,反应装置装上分水器和回流冷凝管。
可以在分水器中预先加入少量水,使水面略低于支管口的位置。
开始加热回流,并记录分出水的体积。
约40分钟后至体系中不再有水分分出为止,停止加热。
计算分出的水分,并与理论应分出的水量进行比较。
冷却后将分水器中酯层和烧瓶中的反应物一起倒入分液漏斗,用20ml 水洗涤,分出水层。
酯层再用25m l 浓度为10 wt%的碳酸钠溶液洗涤至中性,分出水层。
将酯层再用20 ml 水洗涤,分出水层。
酯层用无水硫酸镁干燥。
干燥好的酯层经蒸馏,收集124-126 ºC 的馏分。
称重,计算产率。
四、注意事项1. 实验中使用的作催化剂的浓硫酸不可过量,以免引起有机物碳化脱水等;2. 控制体系的回流温度3. 反应产物洗涤过程五、思考题1. 影响反应产物转化率的主要因素有哪些?实验中是如何提高反应的转化率的?2. 分水器使用的原理及方法?3. 反应过程中如何除去水分的?4. 怎样计算反应完全时分出的水量?酯化反应时为何要加过量的酸或碱?5. 乙酸丁酯有哪些应用?实验二 苯乙烯-马来酸酐共聚物的合成一、实验目的1 学习自由基聚合的原理和沉淀聚合方法;2 掌握苯乙烯-马来酸酐共聚物的合成方法。
α-苯乙胺的制备与拆分

•α-苯乙胺的制备与拆分Ⅰ. 预习报告一、实验目的•学习并掌握诺伊卡特反应(Leuchart reaction),并用以合成(±)-a-苯乙胺;•学习并掌握外消旋体化合物的拆分方法,并用酒石酸拆分(±)-a-苯乙胺•学习旋光仪测定物质旋光度的方法;•通过学习熟悉外消旋a-苯乙胺的制备,巩固萃取、水蒸气蒸馏等基本操作,学习掌握水蒸气蒸馏的原理、作用及操作技术;•熟练掌握各种操作,提高实验技能,达到训练的目的。
二、实验原理(1)醛或酮在高温下与甲酸铵作用得到伯胺的反应称为R.Leuchart反应,方程式如下:在反应中氨首先与羰基发生亲和加成,接着脱水生成亚胺,亚胺随后被还原生成胺。
与还原胺化不同,这里不是用催化氢化,而是用甲酸作为还原剂,反应过程如下:外消旋á-苯乙胺的合成:制备:实验是苯乙酮与甲酸铵作用得到外消旋–α–苯乙胺,反应过程如下:拆分:实验采用L–(+)–酒石酸与(±)–α–苯乙胺反应,产生两个非对映异构体的盐的混合物,这两个盐在甲醇中的溶解度有显著差异,可以用分步结晶法将它们分离开来,然后再分别用碱对这两个已分离的盐进行处理,就能使(+)、(–)–α–苯乙胺分别游离出来,从而得到纯的(+)–α–苯乙胺和(–)–α–苯乙胺。
(3)仪器与试剂仪器:圆底烧瓶、三口烧瓶、蒸馏装置、分液漏斗、水蒸汽蒸馏装置、锥形瓶、分液漏斗等。
拆分所需仪器包括量筒必须干燥。
试剂:苯乙酮,甲酸铵,浓盐酸,氢氧化钠,甲苯,L-(+)-酒石酸,a-苯乙胺,甲醇,乙醚,50%的氢氧化钠溶液,粒状NaOH。
(4)物理性质熔点 -65℃沸点 194.5-195℃相对密度 0.9640溶解情况溶于水,易溶于醇和醚性状、味道苯乙胺为无色具的鱼腥味的强碱性液体特性苯乙胺能吸收空气中的二氧化碳,成相应的碳酸盐。
用冷冻盐水冷却也不固化(熔点-65℃)。
苯乙胺盐酸盐为片状结晶。
熔点217℃(从醇中析出),易溶于水、溶于醇,但不溶于醚。
实验 二α-苯乙胺的拆分与旋光度测定

α-苯乙胺的拆分与旋光度测定
实验目的2、学习旋光度的测定方法
拆分原理
COOH CHNH2 CH3 (+)- - 苯乙胺 H + HO OH H COOH (+)- 酒石酸
CH3 H NH3 H HO COO OH H COOH (+)- 胺 (+)- 酸盐 + NH3 CH3 H H HO COO OH H COOH ( )- 胺 (+)- 酸盐
拆分外消旋体最常用的方法是利用化学反应把一对对映 体变成两种非对映体。由于非对映体具有不同的物理性质, 利用结晶等方法将其分离、精制,然后再去掉拆解剂,就可 以得到纯的旋光化合物,达到拆分目的。
试剂
6.3g (0.041mol)(+)-酒石酸, 甲醇,乙醚,
50%氢氧化钠,浓盐酸
主要实验装置
普通蒸馏
实验操作
1. s-(-)-α-苯乙胺的分离
(-)-胺(+)-酒石酸盐制备
250 mL锥型瓶
6.3g(+)-酒石酸、90mL甲醇 5g α-苯乙胺
加热近60 ℃使互溶 搅拌下缓慢滴加
冷至室温,塞住瓶口,放置24h以上,应析出白色棱状晶体 抽滤,冷甲醇洗涤晶体,干燥, 得(-)-胺(+)-酒石酸盐约4g
α-苯乙胺的1H NMR
A B C D
1.355 4.050 1.87 7.18 to 7.38
思考题
你认为本实验中关键步骤是什么?如何控制
反应条件才能分离出纯的旋光异构体?
(-)-胺(+)-酒石酸盐分解→s-(-)-α-苯乙胺
250mL锥形瓶 8g(-)-胺(+)-酒石酸盐 30mL水 5mL 50%氢氧化钠 结晶部分溶解 搅拌使固体完全溶解
( S) -( - ) -α-苯乙胺萃取过程的研究
2 结果与讨论
2. 1 萃取剂的选择 苯乙胺是一种有机碱, 其萃取特性类似于麻黄
碱、氯代乙酰乙酰甲胺[ 3, 4] 等物质。虽然有很多溶剂
对其有较好的萃取能力, 但萃取剂的选择除应考虑 萃取分配比外, 还应考虑萃取后萃取相苯乙胺与萃 取剂的分离问题。苯乙胺在常压下的沸点为 187 °C, 若萃取剂的沸点与其有较大的差距, 则可采用蒸馏 的方法予以回收。实验中选择了低沸点的烷烃类、芳
由于氯仿与苯乙胺沸点差别比较大, 因而采用 蒸馏的办法分离萃取剂氯仿和拆分剂苯乙胺。在以 ( S) -( - ) - -苯乙胺为拆分剂的工业化生产中, 分离
后的两者均可循环使用。
由于苯乙胺的沸点较高, 在常压下蒸馏回收苯
乙胺, 可能会导致它部分消旋, 实验中也发现过这一
须采用多级萃取。根据图 2、图 3 萃取平衡曲线和生 产实际的工艺要求, 采用两级萃取。对于初始水相中 NaOH 浓度不同的几个初始料液。两级萃取的实验 结果如表 4 所示。
表 4 两级萃取实验 结果 Table 4 Ex per iment data o f tw o-sta ge ex tr act ion
distr ibutio n co efficient C MBA = 45. 4 g/ L; Ext ract agent : Chlorof orm; Phase rat io: 1∶10( V/ V )
由图 1 可见, 随着温度的升高, 苯乙胺的分配系 数 D 值上升, 说明温度升高对萃取有利。表 3 为实 验测定的不同温度下苯乙胺在水中的溶解度, 结果 表明在所测温度范围内苯乙胺在水中的溶解度随温 度升高而降低, 且在 50 °C时逐渐趋近于定值( 液液
89. 1
84. 5
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
D 由羰基合成酰胺类化合物。 3、为什么用苯对水解溶液进行萃取? A 萃取反应产物。 B 提纯反应产物。 C 萃取未反应的苯乙酮。 (正确) D 提取甲酸胺。 4、水汽蒸馏时,馏出液是什么? A 馏出液是水。 B 馏液是苯乙酮 C 馏出液是氢氧化钠
D 馏出液是苯乙胺加水。 (正确) 5、水汽蒸馏时蒸汽倒入管应插入到什么位置? A 液面上。 B 三口瓶瓶口处。 C 液面与瓶底1/2位置处。 D 尽量接近瓶底。 (正确) 6、 (+)-α-苯乙胺的拆分应该用什么拆分剂? A (+)-酒石酸。 B (+)-麻黄碱。 C (+)-苯乙醇酸。
(+)-α-苯乙胺的合成及拆分思考题
1、 α-苯乙胺的用途是什么? A 制备医药、香料等的中间体。 (正确) B 食品添加剂 C 杀虫剂、防腐剂等中间体 D 橡胶、塑料等促进剂 2、鲁卡特反应是由什么原料来制备什么产物的反映? A 由醇类制取醚类化合物。 B 由醛、酮制酸基化合物 C 由羰基合成胺类化合物。 (正确)
D (+)-酒石酸。 (正确) 7、拆分时,溶剂量(甲醇)太少,有什么后 果? A (+)- α-苯乙胺- (+)-酒石酸析不出。 B (-) - α-苯乙胺- (+)-酒石酸析不出。 C (+)- α-苯乙胺- (+)-酒石酸先析出。 D (-) - α-苯乙胺- (+)-酒石酸和(+)- α苯乙胺- (+)-酒石酸一同析出,无法分离。 (正确)
