中考化学表格型计算题
【化学】中考化学化学计算题及其解题技巧及练习题(含答案) (2)

【化学】中考化学化学计算题及其解题技巧及练习题(含答案)一、中考化学计算题1.马英同学取某地石灰石样品12g进行测定实验,现将100g稀盐酸分五次加入石灰石样品中(杂质不溶于水也不参与反应),充分反应后测得生成气体的总质量如表所示:第1次第2次第3次第4次第5次加入稀盐酸的质量/g2020202020生成气体的总质量/g 1.1 2.2m 4.4 4.4试求:(1)m的值为______g。
(2)12g石灰石样品中碳酸钙的质量是_____。
(3)所用稀盐酸溶液中溶质的质量分数是_____。
(4)反应完全后最终溶液中氯化钙的质量分数是____。
(结果保留小数点后一位小数)【答案】3.3g。
10g 9.1% 10.5%【解析】【详解】(1)分五次加入盐酸后,前两次,每次都增加1.1g二氧化碳,第四、五都生成4.4g二氧化碳,说明第三次没有完全反应,也增加1.1g,所以m值是3.3g;故填:3.3;(2)设参加反应的碳酸钙质量为x;第4次反应完全后用去稀盐酸的溶质的质量为y;第4次反应完全后生成氯化钙的质量为z,10073111==x y z解得x=10g,y=7.3g,z=11.1g,故填10g;(3)稀盐酸的溶质质量分数:7.3g×100%9.1%80g≈,故填9.1%;(4)反应完全后最终溶液中氯化钙的质量分数:11.1g100%10.5%10g+100g-4.4g≈⨯,故填10.5%;答:m的值为3.3g;12g石灰石样品中碳酸钙的质量是10g;所用稀盐酸溶液中溶质的质量分数9.1%;反应完全后最终溶液中氯化钙的质量分数10.5%。
2.某氢氧化钠样品中含有少量的碳酸钠杂质。
现取20g 样品于烧杯中,加入180g 水使其完全溶解,再向其中逐滴加入稀盐酸至过量,测得生成气体质量与所加稀盐酸质量关系如图所示,请回答下列问题:(1)下图中0—A 无气体产生,说明盐酸优先跟样品中的_____(填化学式)发生反应。
中考化学二轮复习专题七化学计算题

11. (2018徐州)工业上采用离子交换膜电解槽电解饱和食盐水,可得到高 浓度的烧碱溶液(含NaOH 35%~48%),某兴趣小组欲验证一化工厂生 产的NaOH溶液是否达到了高浓度标准,进行了如下操作,请你参与计算: (1)用37%的浓盐酸配制200 g 7.3%的盐酸,需要加水(密度为1 g·mL-1) ________mL。(计算结果保留一位小数) (2)采集该化工厂电解槽中的NaOH溶液20 g,向其中滴入所配制的盐酸, 当溶液的pH=7时,消耗盐酸100 g,判断电解槽中NaOH溶液是否达到 高浓度标准。(写出计算过程)
(1)67.5% (2)解:设100 g硫酸溶液中硫酸的质量为x
Zn+H2SO4=== ZnSO4+H2↑
98
2
x
0.25 g
98 = x
x=12.25 g
2 0.25g
硫酸溶液中硫酸的质量分数为
12.25g
×100%=12.25%
100g
答:所用硫酸溶液的溶质质量分数为12.25%。
2. (2017徐州)徐州地区石灰石资源丰富。某化学兴趣小组称取4.0 g石灰
(1)溶解时玻璃棒的作用是_________________。 (2)实验中加入过量CaCl2溶液的目的是___________________________。 (3)通过计算判断该工业纯碱是否为合格品。(写出计算过程,结果精确 到0.1%)。 【提示】分析图中实验过程,判断“滤渣”的成分,找出代入化学方程式 计算的纯净物质量。
实验序号
①
②③Biblioteka 样品的质量/g10
20
30
生成气体的质量/g
0.1
0.2
0.25
试计算所用硫酸溶液的溶质质量分数(写出计算过程,结果精确到0.01%)。
中考化学计算题
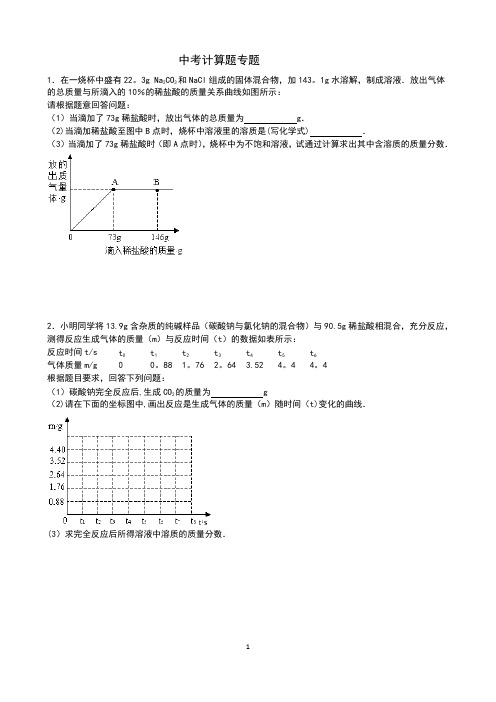
中考计算题专题1.在一烧杯中盛有22。
3g Na2CO3和NaCl组成的固体混合物,加143。
1g水溶解,制成溶液.放出气体的总质量与所滴入的10%的稀盐酸的质量关系曲线如图所示:请根据题意回答问题:(1)当滴加了73g稀盐酸时,放出气体的总质量为g.(2)当滴加稀盐酸至图中B点时,烧杯中溶液里的溶质是(写化学式) .(3)当滴加了73g稀盐酸时(即A点时),烧杯中为不饱和溶液,试通过计算求出其中含溶质的质量分数.2.小明同学将13.9g含杂质的纯碱样品(碳酸钠与氯化钠的混合物)与90.5g稀盐酸相混合,充分反应,测得反应生成气体的质量(m)与反应时间(t)的数据如表所示:反应时间t/s tt1t2t3t4t5t6气体质量m/g 0 0。
88 1。
76 2。
64 3.52 4。
4 4。
4根据题目要求,回答下列问题:(1)碳酸钠完全反应后,生成CO2的质量为g(2)请在下面的坐标图中,画出反应是生成气体的质量(m)随时间(t)变化的曲线.(3)求完全反应后所得溶液中溶质的质量分数.3.为测定锌铜合金中锌的含量,取该合金放入如图盛有稀硫酸的锥形瓶中,发生反应:Zn+H2SO4=ZnSO4+H2↑.多次实验后,取平均值所得数据如下表:反应前充分反应后装置及反应剩余物质质量装置和足量的稀硫酸质量锌铜合金质量342.10g16.00g357。
70g若不考虑干燥剂吸收空气中的水蒸气,计算:(1)根据质量守恒定律求生成氢气的质量.(2)该合金中锌的质量分数.4.我们知道,每次做完实验后,剩余废液不能直接倾倒入排污管,必须回收处理.某班同学实验后收集到含有碳酸钠和氢氧化钠的混合废液5。
11kg,一个兴趣小组用废弃的溶质质量分数为19。
6%的硫酸来处理,并回收处理后的溶液.他们向废液中加入稀硫酸时,所得溶液pH与加入的稀硫酸质量的关系曲线如图所示.求:(1)通过如图可知,当反应进行至图中点时(填“A"、“B”或“C”),废液恰好处理完(即碳酸钠和氢氧化钠混合废液刚好完全转化成硫酸钠溶液).(2)当向混合液中加入稀硫酸至N点时,加入的稀硫酸质量为5Kg,此时溶液总质量为10kg.求此时所得溶液中溶质的质量分数(写出计算过程,溶于水的气体忽略不计).5.化肥对提高农作物的产量具有重要的作用,碳铵(碳酸氢铵)就是农民朋友经常使用的一种氮肥,碳铵易溶于水、受潮时常温分解,温度越高分解越快,遇碱时放出氨气.某校化学兴趣小组为测定某碳铵肥料样品的纯度,将8。
中考化学二轮专题复习-题型五计算题

2. 明代宋应星所著《天工开物》中有关炼铁方法的记载是“凡炉
中炽铁用炭,煤炭居十七……”,其原理是
3C+2Fe2O3
高温
=====
4Fe+3CO2↑。
(1)若将32 g氧化铁样品还原为铁,计算可得到铁的质量。
(2)实验结束后,小明同学将所得黑色固体称量后发现,固体质
量明显大于理论计算值。如表中为不同温度下还原氧化铁的主
实验数据,完成以下计算和问题: 乙中混有少量甲,可用降温结晶法提纯乙
(2)计算该固体混合物中硫酸铜的质量分数(写出计算过程)。 充分溶解后,观察到如图1所示的现象。 (4)在工业上,可用紫铜、稀硫酸、硫酸亚铁、空气为原料生产硫酸铜。 请计算该氢氧化钠溶液中溶质的质量分数(写出计算过程)。
6 (2)MnO2 (2021黔东南州)某化学兴趣小组的同学在社会实践中,对废品回收站中废弃电器零件黄铜(铜、锌合金)中铜的含量产生了兴趣,为了测定该黄铜中铜的含量,小组同学将黄铜带入化 学实验室,称取该黄铜样品50克放入指定容器中,然后分四次加入稀硫酸,实验数据记录如下: 答:可得到铁的质量为22.
4.9 答:可得到铁的质量为22.
5 g+(20 g -17.
8.7
CuSO4 + 2NaOH=== Na2SO4 + Cu(OH)2↓
利用了洗涤剂的乳化作用。
0 3 g碳酸钠需要消耗氢氧化钠的质量为 w
(1)放热 反应后溶液缓慢冷却至室温
60
0
60
3 g样品中氢氧化钠的质量为15.
(2)解:设该氢氧化钠溶液中溶质的质量为 x
图1
(1)反应生成氢氧化铜的质量为________。 (2)计算该固体混合物中硫酸铜的质量分数(写出计算过程)。 (3)在图2中画出加入氢氧化钠溶液过程中硫酸钠质量的变化曲线 (标出曲线中必要的数据)。
初中化学中考计算题专项练习(共三种题型,学会至少多拿15分)

中考化学计算题专项练习班级考号姓名总分题型一:文字叙述型1.黄铜是铜和锌的合金,在20g黄铜样品中加入足量稀盐酸使其完全反应,生成氢气0.2g,求样品中铜的质量分数?2.把7g含杂质的锌片(杂质不与硫酸反应)放在盛有100g足量的稀硫酸的烧杯里,反应停止后称得烧杯里物质的总质量为106.8g。
(1)计算反应后生成的氢气的质量;(2)计算不纯的锌片中单质锌的质量分数。
3、用氯酸钾和二氧化锰的混合物16g,加热制取氧气,待完全反应,冷却后称量,得到11.2g 固体物质,计算原混合物中二氧化锰的质量?4、取34克过氧化氢溶液再加入0.5克二氧化锰后至质量不减小时,所得剩余物的质量33.7克。
求:(1)根据质量守恒定律,反应生成氧气的质量为。
(2)计算该过氧化氢溶液中溶质的质量分数。
5.某化学活动小组需要用溶质质量分数为19.6%的稀硫酸和锌粒反应来制取氢气,但实验室现有的是溶质质量分数为98%的浓硫酸。
试计算:(1)硫酸中氢、硫、氧元素的质量比为:_______________(2)将10g浓硫酸配制成所需的稀硫酸,需要水的质量为多少?(3)取上述配制好的稀硫酸20g与足量锌粒充分反应,能制得氢气质量为多少?题型二:图像呈上升趋势型1.在一烧杯中盛有22.3 g Na2CO3和NaCl组成的固体混合物,加足量水溶解,配成溶液。
向其中逐渐滴加溶质质量分数为10%的稀盐酸,放出气体的总质量与所滴入稀盐酸的质量关系曲线如图所示。
请根据题意回答问题:(1)当滴加了73 g稀盐酸时,放出气体的总质量为___________g。
(2)当滴加稀盐酸至图中B点时,烧杯中溶液里的溶质是___________。
(3)当滴加了73 g稀盐酸时(即A点时),烧杯中为不饱和溶液,试通过计算求出其中含溶质的质量。
2.现取13.4g含氯化钙的氯化钠固体样品,全部溶于96.6g水中,向所得的混合溶液中滴加溶质质量分数为10.6%的碳酸钠溶液,记录了如图所示的曲线关系。
中考化学计算题及详细答案

有关化学式的计算题1、计算CuSO4·5H2O的式量______________________________2、计算NH4NO3中所含各元素的质量比_________________________________3、某黄铁矿中含FeS2为72%,计算该黄铁矿中硫元素的质量分数是()A.36%B.38.4%C.42.6%D.48%4、某元素R的单质跟氧气化合生成的氧化物中,R元素跟氧元素的质量比为21:8,原子个数比为3:4,又知氧元素的相对原子质量为16,则元素R的相对原子质量为()A.24B.27C.56D.655、在SO3和SO2的两种物质中,相同的是()A.氧元素的质量分数B.硫元素的质量分数C.元素种类D.原子个数比6、A、B两种化合物均由R和氧两种元素组成的,在化合物A和B中,R元素的质量分数分别为50%和40%,若A的化学式为RO2,则B的化学式为() A.R2O B.RO C.R2O3 D.RO37、在FeSO4和Fe2 (SO4) 3的混合物中,氧元素的质量分数为a%,则该混合物中铁元素的质量分数为()A.2a%B.1-a%C.1-0.5a%D.1-1.5a%8、甲、乙两种化合物x2y和yz2中,y元素的质量分数分别约为40%和50%,则在丙化合物x2yz3中y 元素的质量分数约为()A.20% B.25% C.30% D.35%(一)标签型化学式计算题:1、锌是人体健康必需的元素,锌缺乏容易造成发育障碍,易患异食癖等病症,使人体免疫功能低下。
市售的葡萄糖酸锌口服液对治疗锌缺乏病具有较好的疗效。
下图是某品牌葡萄糖酸锌口服液的标签,请根据标签信息回答:(1)葡萄糖酸锌中各元素的质量比;(3)某患者除正常饮食吸锌元素外,还需服用该品牌葡萄糖酸锌口服液。
若治疗一个疗程需补充104mg锌元素,而这些锌有75%来自该口服液,则患者共需服用支葡萄糖酸锌口服液?(简写出解题过程)(二)叙述型化学式计算题:1、蛋白质是由多种氨基酸[丙氨酸:CH3CH(NH2)COOH等]构成的极为复杂的化合物,人体通过食物获得蛋白质,在胃肠道里与水发生反应,生成氨基酸,试计算:(1)丙氨酸分子中氮原子与氧原子的个数比。
山东省日照市中考化学专题复习训练:专题六 综合计算题

专题六 综合计算题类型一 文字表达型将铁粉和铜粉的混合物7 g ,参加到盛有58.1 g 稀盐酸的烧杯中,恰好完全反响,此时烧杯内各物质的总质量为64.9 g 。
试计算: (1)原混合物中铁粉的质量分数。
(2)反响后所得溶液中溶质的质量分数。
参与反响的物质有哪些,应该用什么方程式进展计算。
分析模型步骤一:分析题干信息,确定化学方程式Fe +2HCl===FeCl 2+H 2↑。
步骤二:分析题干中的数据,抓住打破口“恰好完全反响〞,即铁粉恰好完全反响,盐酸也恰好完全反响。
步骤三:利用化学方程式进展计算。
生成氢气的质量7 g +58.1 g -64.9 g =0.2 g Fe +2HCl===FeCl 2+H 2↑ √ √ 0.2 g由此可以计算出混合物中铁的质量,溶液中溶质的质量。
步骤四:计算纯度、溶液中溶质质量分数。
铁粉的质量分数=铁粉的质量混合物质量×100%溶质质量分数=溶质质量溶液质量×100%注:画“√ 〞表示可由数据求得,下同。
1.(2021·山西中考)黄铜(铜锌合金)的外观与黄金极为相似,容易以假乱真。
小红同学想测定黄铜中锌的含量。
她称取20 g 黄铜样品放入烧杯中,参加足量稀硫酸充分反响后,测得生成氢气的质量为 0.2 g。
(1)该反响属于____________(填根本反响类型)。
(2)求黄铜样品中锌的质量分数(写计算过程)。
2.(2021·潍坊中考)工业纯碱中常含有少量的氯化钠。
某学习小组对其组成展开探究。
现取24 g纯碱样品,参加100 g水使其完全溶解,再参加96 g过量的氯化钙溶液,完全反响后,过滤、洗涤、枯燥得沉淀20 g。
完成以下问题:(1)反响后溶液中含有的溶质是________________________(写化学式)。
(2)通过数据,能求出的量有__________(写字母序号)。
A.反响后溶液的总质量B.参加反响的氯化钙的质量C.样品中碳酸钠的质量分数D.氯化钙溶液中溶质的质量分数(3)计算反响后溶液中氯化钠的质量分数。
中考专题复习:几种化学计算题型的突破--课件

三.统计图型试题的突破
热点题型精讲
数学统计图应用于化学知识的学习和考查,能 直观明了地显示各种数据的大小及其相对关系,近 几年中考试题中,运用统计图来考查化学基础知识 的题目屡见不鲜。
类型一 :用扇形图考查物质(或元素)含量的相关知识
例6:下列图示的各物质(或元素)相对含量错误的是-----( A )
例1:某学习小组欲测定石灰石中碳酸钙的质量分数,采用的方法如下: 取该石灰石样品16g,把80g稀盐酸分四次加入,实验过程所得数据如下表 (已知石灰石样品中含有的二氧化硅等杂物不溶于水,不与稀盐酸反应)。
实验次数 加入稀盐酸的质量/g 剩余固体的质量/g
1
20 光
11 余
2
20 光
6余
3
20
余
2.8 光
【答案】D
例9:在一密闭容器内加入甲、乙、 丙、丁四种物质,在一定条件下发生 化学反应,反应前后各物质的质量变 化如右图。下列说法中正确的是( C ) A. 该反应为化合反应 B. 丙一定为该反应的催化剂 C. 参加反应的乙、丁质量比为3∶2 D. 丁相对分子质量是甲的2倍
3
甲增加2g,乙减小6g,丁增加4g 实际反应为:乙 → 甲+ 丁
样品中碳酸钙的质量分数为(13.2g/16g)*100%=82.5%
3.由实验1、2可知,当20g稀盐酸反应光时,消耗碳酸钙的质量 为5g。 设稀盐酸中溶质的质量分数为x
CaCO3+2HCl===CaCl2+H2O+CO2↑ 100 73
5g 20g*x 列式(略) 解得x=18.25% 答:略
类型二:实验分几次完成,每次加入的固体或溶液质量不等。
中考化学专题复习
几种化学计算题型的突破
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
在一烧杯中盛有22.3 g Na2CO3和 NaCl 构成的固体混淆物,加足量水溶解,配成溶液。
向此中渐渐滴加溶质质量分数为 10%的稀盐酸,放出气体的总质量与所滴入稀盐
酸的质量关系曲线以下图。
请依据题意回答以下问题:
(1)当滴加了73 g 稀盐酸时,放出气体的总质量
为g。
(2)当滴加稀盐酸至图中B 点时,烧杯中溶液里的溶
质是(写化学式)。
(3)当滴加了 146g 稀盐酸时(即点时),烧杯中为不饱和溶液,试经过计算求出此中
溶液质量。
6
7、(济南市)在一烧杯中盛有 100gBaCl 2和HCl的混淆溶液,向此中渐渐滴加溶质质量分数为 10%的Na2CO3溶液,混淆溶液的质量与所滴入 Na2CO3溶液的质量关系曲线以下图:
请依据题意回答以下问题:(1)在实验过程中,
有气体放出,还能够看到的显然实验现象是。
(2)在实验过程中放出气体的总质量为
g。
(3)当滴入 Na2 CO3溶液至图中 B 点时,经过计算求此所得不饱和溶液中溶质质量分数
是多少?(计算结果精准到 0.1% )
向盛有 22.3 g Na 2CO3和 NaCl 固体混淆物的烧杯中加入216.1 g稀盐酸恰巧反响,反响过程用精细仪器测得烧杯连同药品的质量(m) 与反
应时间 (t) 的关系以以下图所示:烧杯连同药品的开端
质量为 300 g 。
回答以下问题:
(1)当固体混淆物与稀盐酸恰巧完整反响
时,所需时间约为S。
(2) 完整反响后,产生二氧化碳气体质量g 。
(3)反响后,获得室温下的不饱和溶液。
所得溶液中溶质的质量分数为多少?
例5:某同学为研究铜铁合金中铁的质量分数,先后进行了三次实验,实验数
据以下表:
第一次序二次序三次
所取合金 /g 20 20 40
所加稀硫酸 /g 100 120 80
生成氢气 /g 0.4 0.4 0.4
依据该同学的实验,试回答以下问题:
(1)上表三次实验中,合金里的铁恰巧完整反响时,耗费稀硫酸溶液的质量是_____g。
(2)该铜铁合金中铁的质量分数是多少?
(3)第三次实验所得溶液溶质质量分数为____________(结果保存至 0.1%)。
1、甲、乙、丙三位同学分别取某石灰石样品与 50g盐酸进行实验,所得结果以下:
求:⑴该石灰石样品中碳酸钙的质量分数。
⑵盐酸中溶质的质量分数。
2、石灰厂为了测定一批石灰石样品中碳酸钙的质量分数,取用 4 g
石灰石样品,把 20
g稀盐酸分 4次加入样品中 ( 样品中除碳酸钙外,其他的成分既不与盐酸反响,也
不溶于水 ) ,充足反响后经过滤、干燥等操作,最后称量,得实验数据以下表:稀盐酸用量第一次加入 5 g第二次加入5 g第三次加入5 g第四次加人5 g
节余固体 3 2 1 1
(1) 该石灰石样品中碳酸钙的质量分数是;
(2)计算该稀盐酸的溶质质量分数 ( 写出计算过程,结果精准到 0.1 %) 。
3、(北京市)人工养殖海产品需要大批的海水,1kg海水中含钠离子的质量约
为10.76g ,镁离子的质量约为 1.29g ,还含有大批氯离子和硫酸根离子等。
请依据计算,从下表中选择两种盐,配制一种最简单、最廉价的 " 人工海水 " ,使该"人工海水 " 中的钠元素、镁元素的含量和海水基真同样。
物质Na 2 SO 4MCl 2NaClMSO 4
价钱(元 /500 )7 8 4 12
(1)选择的两种盐是。
(2)计算配制 1t" 人工海水 " 所需盐的成本(写出计算式即可)。
