【2019年整理】西南大学网络教育作业答案分析化学
1095《有机化学(二)》西南大学网教19秋作业答案
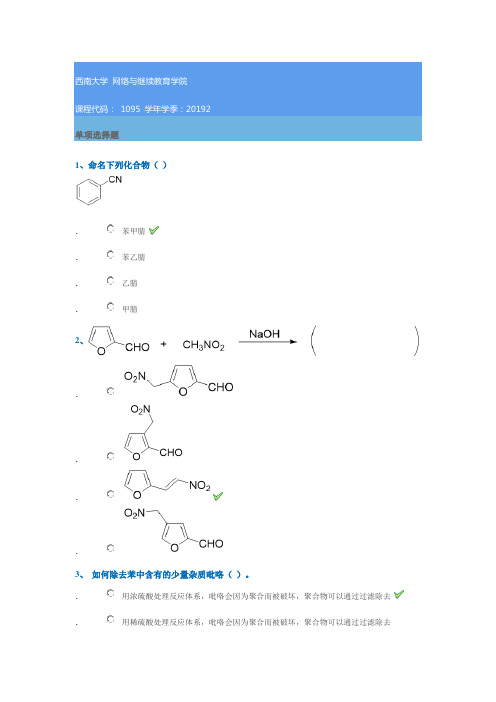
1095 20192单项选择题1、命名下列化合物( ).苯甲腈. 苯乙腈. 乙腈 .甲腈2、....3、 如何除去苯中含有的少量杂质吡咯( )。
. 用浓硫酸处理反应体系,吡咯会因为聚合而被破坏,聚合物可以通过过滤除去.用稀硫酸处理反应体系,吡咯会因为聚合而被破坏,聚合物可以通过过滤除去.用浓硫酸处理反应体系,吡咯很容易与浓硫酸发生磺化反应而溶解在浓硫酸中,从苯中分离出去。
.用稀硫酸处理反应体系,吡咯很容易与稀硫酸发生磺化反应而溶解在稀硫酸中,从苯中分离出去。
4、........5、()是最常用的淀粉鉴定试剂。
.茚三酮.2,4-二硝基氟苯.碘.异硫氰酸苯酯6、命名下列化合物().戊二酸酐.反丁烯二酸酐.丁二酸酐.顺丁烯二酸酐7、下列化合物中,碱性最强的是()。
....8、下列化合物中,()可以用作化学合成染料。
....9、蛋白质的基本组成单位是()。
.氨基酸.脱氧核糖核酸.核糖核酸.葡萄糖10、()是一切糖类甜味剂中甜味最大的单糖。
.D-木糖.D -半乳糖.D-果糖.D-葡萄糖11、....12、....13、....14、下列化合物中,()不能与水形成氢键。
.甲胺.二甲胺.甲烷.三甲胺15、....16、命名下列化合物().2-甲基呋喃.1-甲基四氢呋喃.2-甲基四氢呋喃.1-甲基呋喃17、... .18、写出对氨基苯乙酮的结构( )....19、....20、....21、....22、( )和亚硝酸或亚硝酸盐及过量的酸在低温下反应可生成芳香重氮盐 。
. 芳香铵盐 . 芳香三级胺. 芳香一级胺.芳香二级胺23、为何酰胺熔沸点比分子量相近的酯高( )。
. 范德华力 . A and B. 分子间氢键作用 .分子间静电作用24、下列氨基酸中,( )不属于必需氨基酸。
. 蛋氨酸 . 异亮氨酸. 精氨酸.赖氨酸25、两个或两个以上的异戊二烯分子以头尾相连的方式结合起来的化合物称为______。
.生物碱.甾体化合物.萜类化合物.蛋白质26、....27、....28、下列基团中____不能用来保护羟基. THP (四氢吡喃基). 对甲氧基苄氧基甲基p -MeOC6H4CH2OCH2―简写为PMBM. 硅保护基,例如三乙基硅基(TES ) .苄基29、下列反应中,( )不属于周环反应。
(1128)《分析化学(一)》西南大学2020年12月机考考试参考答案

一、单项选择题(本大题共15小题,每道题3.0分,共45.0分)1.以下溶液稀释10倍pH 改变最大的是A.0.1mol·L -1 NH4AcB.0.1mol·L -1 NaAcC.0.1mol·L -1 HAcD.0.1mol·L -1 HCl2.某些金属离子(如Ba 2+、 Mg 2+、Ca 2+等)能生成难溶的草酸盐沉淀,将沉淀滤出,洗涤后除去剩余的C 2O 42-后,用稀硫酸溶解,用KMnO4标准溶液滴定与金属离子相当的C 2O 42-,由此测定金属离子的含量。
此滴定方式为( )。
A.直接滴定法B.返滴定法C.间接滴定法D.置换滴定法3.用EDTA 滴定金属离子时,一般要使用缓冲溶液,原因是()A.EDTA与金属离子作用后释放出氢离子B.酸效应C.共存离子效应D.副反应系数4.用吸附指示剂法测定Cl-时,应选用的指示剂为A.二甲基二碘荧光黄B.荧光黄C.甲基紫D.曙红5.在氧化还原反应的任一瞬间,氧化态和还原态都能迅速地建立平衡,其电极电位符合能斯特方程的电对称为()A.可逆电对B.不可逆电对C.对称电对D.不对称电对6.下列违反无定形沉淀的生成条件的是( )A.沉淀作用宜在较浓的溶液中进行B.沉淀作用宜在热溶液中进行C.在不断搅拌下,迅速加入沉淀剂D.沉淀宜放置过夜,使沉淀陈化7.在置信度为95%时,测得Al2O3的平均值的置信区间为35.21±0.10,其意是( )A.在所测定的数据中有95%的数据在此区间内B.若再进行测定系列数据,将有95%落入此区间C.总体平均值μ落入此区间的概率为95%D.在此区间内包括总体平均值μ的把握有95%8.下列哪种情况不属于系统误差A.滴定管未经校正B.所用试剂中含有干扰离子C.天平两臂不等长D.砝码读错9.偏差是衡量( )A.精密度B.置信度C.准确度D.精确度10.浓度为c mol·L-1的Na2CO3溶液的物料平衡是()A.2[Na+]+[CO32-]=cB.[H2CO3]+ [HCO3-]+[CO32-]=cC.[Na+]=cD.2[Na+]=[CO32-]= c11.下面结果应以几位有效数字报出0.1010x(25.00-24.80)/1.00000 ( )A.5位B.3位C.4位D.2位12.用已知浓度的NaOH溶液滴定相同浓度的不同弱酸时,若弱酸的Ka越小,则( )A.消耗的NaOH越多B.滴定突跃越大C.滴定突跃越小D.指示剂颜色变化越不明显13.EDTA滴定金属离子,准确滴定(TE<0.1%)的条件是( )A.lgK MY≥6B.lgK MY'≥6C.lg(cKMY)≥6D.lg(cK MY')≥614.标定硫代硫酸钠溶液的基准物质是( )A.NaOHB.K2Cr2O7C.HAcD.KHC8H4O415.有一组平行测定所得的分析数据,要判断其中是否有可疑值,应采用( )A.t检验法B.G-检验法C.F检验法D.F检验法加t检验法二、判断题(本大题共10小题,每道题2.0分,共20.0分)1.共轭碱得到质子形成共轭酸,故HPO42-的共轭酸是H3PO4。
西南大学[1128]《分析化学(一)》作业答案
![西南大学[1128]《分析化学(一)》作业答案](https://img.taocdn.com/s3/m/6c7be2e56f1aff00bed51ea2.png)
2016 西南大学【 1128】《化学分析(一)》61、 绝对误差: 答案:指测量值与真值 (真实值 )之差 62、 精密度: 答案:表示分析结果与真实值接近的程度 63、H 2SO4 (c1)+HCOOH( c2)水溶液的质子平衡式 。
答案: [H + ] = [OH -]+[HCOO-]+2 c1 64、 用Fe3+滴定 Sn2+ ,若浓度均增大10 倍,则滴定突跃(指增加、减少几个单位或不变)。
答案: 不改变65、 用淀粉作指示剂,直接碘量法可在滴定前加入,以蓝色为滴定终点;间接碘量法在近终点时加入, 以蓝色为滴定终点。
答案:出现;消失66、 缓冲溶液的作用是 答案:调节溶液的酸度67、 测定一物质中某组分的含量,测定结果为(%): 59.82 ,60.06 , 59.86 , 60.24 。
则相对平均偏差为;相对标准偏差为。
答案:0.26%; 0.33%68、 准确度高低用衡量,它表 示。
精密度高低用衡量,它表示 。
答案:误差;测定结果与真实值的接近程度;偏差;平行测定结果相互接近程度69、用淀粉作指示剂,直接碘量法可在滴定前加入,以蓝色为滴定终点;间接碘量法在近终点时加入,以蓝色为滴定终点。
答案:出现;消失70、浓度均为 1.0 mol/L HCl 滴定 NaOH 溶液的滴定突跃是 pH=3.3~10.7 ,当浓度改为 0.010mol/L 时,其滴定突跃范围是_________________。
答案:5.3~8.771、 HPO 4 2-的共轭碱是;共轭碱是。
答案:PO4 3-; H 2PO 4 -72、对某试样进行多次平行测定,各单次测定的偏差之和应为;而平均偏差应,这是因为平均偏差是。
答案:0;不为 0;各偏差绝对值之和除以测定次数73、 0.05020 是位有效数字, pH=10.25 是位有效数字。
答案:4;274、用 Fe3+滴定 Sn 2+,若浓度均增大10 倍,则在化学计量点前0.1% 时电极电位,在化学计量点后电极电位( 指增加、减少或不变 )。
西南大学网络学院高等有机化学答案已整理

请简述根据反应中键断裂及其形成方式不同的 反应分类及其特点
[论述题] 参考答案:
有机反应的数目和范围十分庞大,根据反应中键的断裂及形成方式可将 有机反应分为:自由基反应、离子反应和分子反应。 任何反应都有键的断裂和/或键的形成,若化学键断裂的方式是每个碎片 各有一个电子,则形成自由基(或称游离基),称之为均裂。自由基性 质非常活泼,能继续引起一系列反应。自由基反应一般在光、热或引发 剂的作用下进行。 若化学键断裂的方式是一个碎片上有两个电子,另一碎片上没有电子, 称之为异裂。有机化合物由碳-碳键异裂可产生碳正离子、碳负离子。 碳正离子、碳负离子都是有机反应过程中产生的活泼中间体,其化学性 质非常活泼,往往在生成的瞬间就参加反应。由共价键异裂产生离子而 进行的反应称为离子型反应。离子型反应一般在酸或极性物质催化下进 行。 近几十年来,人们在有机反应中又发现某些反应,不受溶剂极性的影 响,不被酸或碱所催化,亦不受引发剂的影响。反应时共价键的断裂和 生成是经过多中心环状过渡态协同地进行。这类反应属于分子反应,又 称为周环反应或称协同反应。
5 [论述题] 请区别试剂的“碱性”和“亲核性”。 参考答案: 1.亲核试剂的性能
在亲核取代反应中,亲核试剂的作用是提供一对电子与RX的中心碳 原子成 键,若试剂给电子的能力强,则成键快,亲核性就强。亲核试 剂的强弱和浓 度的大小对SN1反应无明显的影响。亲核试剂的浓度愈 大,亲核能力愈强,有 利于SN2反应的进行。试剂的亲核性与下列因 素有关: 1)试剂所带电荷的性质 带负电荷的亲核试剂比呈中性的试剂的亲核能力强。 例如,OH - > H2O;RO- > ROH等。 2)试剂的碱性 试剂的碱性(与质子结合的能力)愈强, 亲核性(与碳原子结合的能力)也愈强。 例如: C2H5O- > HO- > C6H5- > CH3COO3)试剂的可极化性 碱性相近的亲核试剂,其可极化性愈大,则亲核能力愈强。原子半径 大的原 子的可极化度大 例如:试剂OH -与SH –的可极化度是OH -< SH–, 则其亲核性是OH -< SH –。
西南大学网络与继续教育学院2019年秋季复习题-[1095]《有机化学(二)》
![西南大学网络与继续教育学院2019年秋季复习题-[1095]《有机化学(二)》](https://img.taocdn.com/s3/m/104c74458e9951e79b892777.png)
西南大学网络与继续教育学院课程代码: 1095 学年学季:20192单项选择题1、命名下列化合物().苯甲腈.苯乙腈.乙腈.甲腈2、....3、如何除去苯中含有的少量杂质吡咯()。
.用浓硫酸处理反应体系,吡咯会因为聚合而被破坏,聚合物可以通过过滤除去.用稀硫酸处理反应体系,吡咯会因为聚合而被破坏,聚合物可以通过过滤除去.用浓硫酸处理反应体系,吡咯很容易与浓硫酸发生磺化反应而溶解在浓硫酸中,从苯中离出去。
.用稀硫酸处理反应体系,吡咯很容易与稀硫酸发生磺化反应而溶解在稀硫酸中,从苯中离出去。
4、........5、()是最常用的淀粉鉴定试剂。
.茚三酮. 2,4-二硝基氟苯.碘.异硫氰酸苯酯6、命名下列化合物().戊二酸酐.反丁烯二酸酐.丁二酸酐.顺丁烯二酸酐7、下列化合物中,碱性最强的是()。
....8、下列化合物中,()可以用作化学合成染料。
....9、蛋白质的基本组成单位是()。
.氨基酸.脱氧核糖核酸.核糖核酸.葡萄糖10、()是一切糖类甜味剂中甜味最大的单糖。
. D-木糖. D-半乳糖.D-果糖. D-葡萄糖11、....12、....13、....14、下列化合物中,()不能与水形成氢键。
.甲胺.二甲胺.甲烷.三甲胺15、....16、命名下列化合物(). 2-甲基呋喃. 1-甲基四氢呋喃. 2-甲基四氢呋喃. 1-甲基呋喃17、....18、写出对氨基苯乙酮的结构()....19、....20、....21、....22、()和亚硝酸或亚硝酸盐及过量的酸在低温下反应可生成芳香重氮盐。
.芳香铵盐.芳香三级胺.芳香一级胺.芳香二级胺23、为何酰胺熔沸点比分子量相近的酯高()。
.范德华力. A and B.分子间氢键作用.分子间静电作用24、下列氨基酸中,()不属于必需氨基酸。
.蛋氨酸.异亮氨酸.精氨酸.赖氨酸25、两个或两个以上的异戊二烯分子以头尾相连的方式结合起来的化合物称为______。
.生物碱.甾体化合物.萜类化合物.蛋白质26、....27、....28、下列基团中____不能用来保护羟基. THP(四氢吡喃基).对甲氧基苄氧基甲基p-MeOC6H4CH2OCH2―简写为PMBM .硅保护基,例如三乙基硅基(TES).苄基29、下列反应中,()不属于周环反应。
西南大学网络网络教育《分析化学》几道典型计算题(含有解析)

13.某溶液含Ca2+、Mg2+及少量Fe3+、Al3+ ,今加入 三乙醇胺,调到pH=10,以铬黑T为指示剂,用EDTA滴 定,此时测定的是( )。
24.衡量样本平均值的离散程度时,应采用( )。 25.定量分析中精密度和准确度的关系是( )。
精选课件
分析化学(0067)
三.名词解释(每题5分)
1.误差 2.偏差 3.准确度 4.精密度 5.标准偏差 6.滴定度 7.置信区间 8.酸度
9.质子等衡式 10.酸效应系数 11.条件稳定常数 12.吸光度 13. 滴定终点 14.有效数字 15.参比溶液
分析化学(0067)
直播课程二
精选课件
分析化学(0067)
10.某对称氧化还原反应为2A++3B4+=2A4++3B2+当反 应达到计量点时的电位值是( )。
11.已知0Ma4/OMn 2 , 1.5V 1 0B2r/Br 1.0V 9.MnO4 氧化Br-的最 高pH值是(忽略离子强度的影计算BaSO4在pH=10.0,含有0.01mol/L EDTA溶液中溶解度(pKsp(BaSO4)=9.96, lgKBaY=7.86,pH=10时,lgαY(H)=0.45)。
8.为测定有机胺的摩尔质量,常将其转变成 1:1的苦味酸胺的加合物,现称取加合物0.0500克, 溶于乙醇中制成1升溶液,以1cm的比色皿,在 最大吸收波长380nm处测得吸光度为0.750,求有 机胺的摩尔质量(M(苦味酸)=229, ε=1.0×104L/mol.cm)。
西南大学2019秋季1127有机化学作业答案

1.
2.
3.
4.
40、下列化合物中,有旋光性的是 ( )
1. 2. 3. 4.
、41
1. ②>④>③>① 2. ①>③>④>② 3. ①>②>③>④ 4. ①>④>②>③
、 试剂指的是 42 Grignard
()
1. B. R-Li 2. R2CuLi 3. R-Zn-X 4. R-Mg-X
1. 构象异构体 2. 顺反异构体 3. 互变异构体
4. 对映异构体
、48
1. A≈B>C>D 2. B>C>D>A 3. A>B>C>D 4. C>D>A>B
、49
1. 3 2. 4 3. 2 4. 1
50、下列化合物酸性最强的是 ( )
1. 2. 3. 4.
、化合物: 、 、 、 相对稳 51
1. 反-3-己烯>顺-3-己烯>1-己烯 2. 1-己烯>顺-3-己烯>反-3-己烯 3. 4. 顺-3-己烯>1-己烯>反-3-己烯
46、下列能发生碘仿反应的化合物是 ( )
1. 3-戊酮 2. 戊醛 3. 2-苯基乙醇 4. 异丙醇
47、β-丁酮酸乙酯能与2,4-二硝基苯肼作用产生黄色沉淀,也能与三氯化铁起显色 反应,这是因为存在着 ( )
1. 羟基的共轭效应大于诱导效应,使苯环电子云密度增大 2. 羟基只具有诱导效应 3. 羟基只具有共轭效应 4. 羟基的诱导效应大于共轭效应,结果使苯环电子云密度增大
64、下列物质的化学活泼性顺序是①丙烯 ②环丙烷 ③环丁烷 ④丁烷 ( )
1. ①>②>③>④ 2. ①>②>④>③ 3. ②>①>③>④ 4. ①>②>③=④
1. 2.
3. 4.
69、比较下面三种化合物发生碱性水解反应最快的是 ( )
19秋西南大学[1128]《分析化学(一)》作业复习资料答案
![19秋西南大学[1128]《分析化学(一)》作业复习资料答案](https://img.taocdn.com/s3/m/770fdbe184868762caaed5e5.png)
西南大学19秋网络与继续教育学院
课程名称:《分析化学(一)》课程代码:1128 学年学季:20192 注:92题无标准答案,不能接受请不要下载,下载既是接受。
单项选择题
1、某同学在实验过程中,错误地将NaCl当成NH4Cl,属于()
A. 过失误差/【对】
系统误差
偶然误差
不确定
2、在EDTA滴定中,溶液的pH越低,则Y(H)值越
始终不变
大/【对】
小
不确定
3、3600有()位有效数字
无限
不确定/【对】
2
4
4、关于以K2CrO4为指示剂的莫尔法,下列说法正确的是( )
滴定应在弱酸性介质中进行
莫尔法的选择性较强
本法可测定Cl—和Br—,但不能测定I—或SCN—/【对】
指示剂K2CrO4的量越少越好
5、H2O的共轭酸是
OH-
H2
O2-
H3O+/【对】
6、e有()位有效数字
2
4
不确定
无限/【对】
7、下列有利于形成晶形沉淀的条件是( )。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第一次作业1:[单选题]误差是衡量A :精密度B :置信度C :准确度D :精确度参考答案:C2:[单选题]偏差是衡量A :精密度B :置信度C :准确度D :精确度参考答案:A3:[论述题]测得W 的百分含量为20.39、20.41、20.43,计算平均值的标准偏差和置信度为95%的置信区间(t 0.05, 2=4.30)20.41%; 1.3%330.02%;0.0115%i i x x d x d S S ∑∑======== )%049.041.20(±=μ参考答案:计算题答案4:[单选题]根据分析天平的称量误差(±0.0002g)和对测量的相对误差(0.1%),下列论述中正确的是A :试样重量应≥0.02gB :试样重量应≥0.2gC :试样重量应<0.2gD :试样重量就≥2.0g参考答案:B5:[单选题]定量分析中精密度和准确度的关系是A :准确度是保证精密度的前提B :精密度是保证准确度的前提C :分析中,首先要求准确度,其次才是精密度D :分析中,首先要求精密度,其次才是准确度参考答案:B6:[单选题]可以减少偶然误差的方法是A :进行仪器校正B :作对照试验C:作空白试验D:增加平行测定次数参考答案:D7:[单选题]下面结果应以几位有效数字报出A:5位B:3位C:4位D:2位参考答案:D8:[多选题]可以减免分析测试中系统误差的方法是A:进行仪器校正B:认真细心操作C:作空白试验D:增加平行测定次数参考答案:AC9:[单选题]计算x=11.05+1.3153+1.225+25.0678,答案x应为A:38.66B:38.6581C:38.64D:38.67参考答案:A10:[单选题]用NaOH滴定HAc,以酚酞指示剂滴到pH=9,会引起A:正误差B:负误差C:操作误差D:过失误差参考答案:A11:[单选题]偶然误差正态分布曲线的两个重要参数是A:准确度和精密度B:F检验和t检验C:标准偏差和总体平均值μD:置信度和可靠性范围参考答案:C12:[论述题]二.什么是精密度?精密度用什么来量度?参考答案:二.精密度是测定结果之间相互符合的程度,用偏差来量度.13:[论述题]一.什么是准确度?准确度用什么来量度?参考答案:一.准确度是测定结果与真值相符合的程度,用误差来量度.第二次作业1:[论述题]称2.000g 含Mn0.56%的钢样,溶解,在一定条件下用Na 2AsO 3-NaNO 2标准溶液滴定,用去20.36毫升,求Na 3AsO 3-NaNO 2对Mn 的滴定度T 。
ml g T NaNO AsO Na 0005500.036.20%56.0000.2233=⨯=- 参考答案:计算题答案2:[单选题]有限次测量结果的偶然误差是服从A :正态分布B :t 分布C :高斯分布D :泊松分布参考答案:B3:[单选题]若已知一组测量数据的总体标准偏差 ,要检验该组数据是否符合正态分布,则应A :t 检验B : F 检验C :Q 检验D : u 检验参考答案:D4:[单选题]有两组分析数据,要比较它们的精密度有无显著差异,则应用 A : t 检验B : F 检验C :Q 检验D : u 检验参考答案:B5:[单选题]在置信度为95%时,测得Al2O3的平均值的置信区间为35.21±0.10,其意义是A :在所测定的数据中有95%的数据在此区间内B :若再进行测定系列数据,将有95%落入此区间C :总体平均值μ落入此区间的概率为95%D :在此区间内包括总体平均值μ的把握有95%参考答案:D6:[单选题]欲将两组测定结果进行比较,看有无显著性差异,则应当用 A :先用t 检验,后用F 检验B :先用F 检验,后用t 检验C :先用Q 检验,后用t 检验D :先用u 检验,再用t 检验参考答案:B7:[单选题]将0.0089gBaSO4,其下列换算因数中,表达应为A:0.59B:0.588C:0.5884D:0.58837参考答案:B8:[单选题]常量分析的试样质量范围是A:>1.0gB:1.0-10gC:>0.1gD:<0.1g参考答案:C9:[多选题]标定HCl溶液的基准物质是A:基准Na2CO3B:邻苯二甲酸氢钾C:硼砂D:Na3PO4参考答案:AC10:[多选题]标定NaOH溶液的基准物质是A:HCOOHB:二水合草酸(H2C2O4•2H2O)C:邻苯二甲酸氢钾D:硼砂参考答案:BC11:[单选题]用含有水份的基准Na2CO3标定HCl溶液浓度时,将使结果A:偏高B:偏低C:无影响参考答案:A12:[论述题]二.什么是标准溶液?标准溶液的配制方法有那些?参考答案:二.已知准确浓度的试剂溶液称为标准溶液.标准溶液的配制方法有直接法和间接法(标定法).13:[论述题]一.什么是基准物质?作为基准物质的条件是什么?参考答案:一.可以直接配制和标定标准溶液的物质就是基准物质.基准物质必须满足以下条件:1.有确定的组成;2.纯度高(大于99.9%);3.性质稳定;4.试剂参加滴定反应时,应按反应式定量进行,无副反应.第三次作业1:[论述题]称取含Na 3PO 4-Na 2B 4O 7・10H 2O (A )试样1.000g ,溶解后,通过氢型强酸型阳离子交换树脂RH 收集流出液,以甲基红指示剂,用0.1000mol/L NaOH 滴定,耗去30.00毫升。
随后加入足量甘露醇,以百里酚酞为指示剂,继续用NaOH 滴定,耗去40.00毫升。
求原混合试样Na 3PO 4%(M=164)和Na 2B 4O 7・10H 2O%(M=381)。
问为何用甲基红为指示剂?20.401001000000.10.16400.301000.0%43=⨯⨯⨯⨯=PO Na 因为这时产物是H 3BO 3和H 2PO 4-,其pH 在4.4-6.2之间,故选甲基红 O H HPO OH PO H NaOH BO H O B Na 2244233742,4~4~1+=+---因52.91001000000.1381)301.0401.0(41%=⨯⨯⨯⨯-⨯=A 参考答案:计算题答案2:[单选题]H3PO4的pKa1-pKa3分别为2.12,7.20,12.36,其中pKb3是 A :6.80B :1.64C :11.88D :12.88参考答案:C3:[单选题]二乙三胺五乙酸(H5L )的pKa1~pKa5分别为1.94,2.87,4.37,8.69,10.56。
其溶液中的Na2H3L 组分浓度最大的pH 值是A :3.62B :5.00C :9.62D : 2.87参考答案:A4:[单选题]0.10mol/L 的NaH2PO4(pH1)和NH4H2PO4(pH2)两种溶液pH 关系是A :pH1=pH2B :pH1>pH2C :pH1<pH2参考答案:A5:[单选题]H2A的pKa1=2.0,pKa2=5.0。
溶液中当[H2A]=[A2-] 时的pH值是A:1.0B:3.5C:2.5D:7.0参考答案:B6:[多选题]浓度为cmol/L的NaOH溶液的质子条件是A:[OH-]=[H+]+[Na+]B:[OH]=[H+]-cC:[OH-]=[H+]+cD:[H+]=[OH-]-[Na+]参考答案:AC7:[单选题]浓度为0.010mol/L氨基乙酸(pKa1=2.35, pKa2=9.60)溶液的pH 值是A:3.9B:4.9C:5.9D:6.9参考答案:C8:[单选题]100ml 0.10mol/LHCl 溶液pH由1.0增到4.44时,需加固体NaAc 的克数(忽略体积变化)是A:4.23B:2.23C:1.23D:0.23参考答案:C9:[单选题]六次甲基四胺(pKb=8.83)配成缓冲溶液的pH缓冲范围是A:8~10B:4~6C:6~8D:3~5参考答案:B10:[单选题]强酸滴定弱碱应选用的指示剂是A:酚酞B:百里酚酞C:甲基红D:百里酚蓝参考答案:C11:[多选题]下面0.10mol/L的酸不能用NaOH作直接滴定分析A:HCOOH(pKa=3.45)B:H3BO3(pKa=9.22)C:NH4NO3(pKb=4.74)D:H2O2(pKa=12)参考答案:BCD12:[论述题]二.什么是酸的分布分数?参考答案:二.酸在溶液中达到离解平衡时,某个组分的平衡浓度与酸的分析浓度的比值就是该组分的分布分数.13:[论述题]一.什么是质子条件?参考答案:一.酸给出质子等于碱所获得质子的平衡关系式就是质子条件.第四次作业1:[单选题]作业附件A:8.9B:11.8C:14.3D:11.3参考答案:D2:[论述题]移取25.00mlpH为1.0的Bi3+、Pb2+试液,用0.02000mol/L EDTA滴定Bi3+,耗去15.00毫升EDTA,今欲在此液中继续滴Pb2+,问应加入多少克的六次甲基四胺,pH才能调至5.0?解:Bi3+滴定后,溶液中总H+为0.1× 25.00+0.02000× 15.00=3.1 mmol加入六次甲基四胺(A)后,A与H+反应成HA,为维持溶液的pH为5.0, 六次甲基四胺必须过量,总须六次甲基四胺的量为:CV=[HA]V/δHA=3.1/10-5/10-5+10-5.13=5.4 mmol故六次甲基四胺的质量m=5.4× 140.1/1000=0.76g参考答案:计算题答案3:[单选题]EDTA的酸效应曲线是指A:αY(H)-pH曲线B:pM-pH曲线C:lgKMY-pHD:lgαY(H)-pH曲线参考答案:D4:[多选题]当M与Y反应时,溶液中有另一络合物L存在,若αM(L)=1表示A:与L没有副反应B:M与L的副反应相当严重C:M的副反应较小D:[M′]=[M]参考答案:AD5:[单选题]用EDTA直接滴定有色金属离子,终点呈现的颜色是A:游离指示剂的颜色B:EDTA-金属离子络合物的颜色C:指示剂-金属离子络合物的颜色D:上述A与B的混合颜色参考答案:D6:[单选题]铬黑T在溶液中存在下列平衡,它与金属离子形成的络合物显红色A:<6.3B:>11.6C:6.3~11.6D:6.3±1参考答案:C7:[单选题]用含有少量Ca2+、Mg2+离子的蒸馏水配制EDTA溶液,然后于pH=5.5。
以二甲酚橙为指示剂,用标准锌溶液标定EDTA溶液的浓度。
最后在pH=10.0,用上述EDTA溶液滴定试样Ni2+含量。
问对测定结果的影响是A:偏高B:偏低C:没有影响参考答案:A8:[单选题]在pH=5.0的醋酸缓冲溶液中用0.002mol/L的EDTA滴定同浓度的溶液中Pb2+。
