2018-蛋白质化学2
2018年高考全国卷II理综化学试题和详细解析
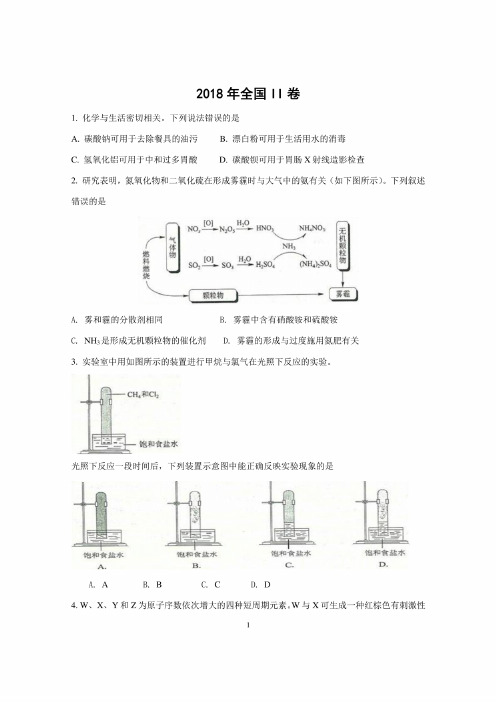
2018年全国II 卷1. 化学与生活密切相关。
下列说法错误的是A.碳酸钠可用于去除餐具的油污B.漂白粉可用于生活用水的消毒C.氢氧化铝可用于中和过多胃酸D.碳酸根可用于胃肠X 射线造影检查2. 研究表明,氮氧化物和二氧化硫在形成雾霾时与大气中的氨有关(如下图所示)。
下列叙述错误的是A.5NH.NO,B.雾霾中含有硝酸铉和硫酸铉/,燃料燃烧雾和霾的分散剂相同C.3.NH3是形成无机颗粒物的催化剂D.雾霾的形成与过度施用氮肥有关实验室中用如图所示的装置进行甲烷与氯气在光照下反应的实验。
CH,和6饱和食盐水光照下反应一段时间后,下列装置示意图中能正确反映实验现象的是A. D.A. AB.C. CD. DB 4.W 、X 、Y 和Z 为原子序数依次增大的四种短周期元素。
W 与X 可生成一种红棕色有刺激性气味的气体;Y的周期数是族序数的3倍;Z原子最外层的电子数与W的电子总数相同。
下列叙述正确的是A.X与其他三种元素均可形成两种或两种以上的二元化合物B.Y与其他三种元素分别形成的化合物中只含有离子键C.四种元素的简单离子具有相同的电子层结构D.W的氧化物对应的水化物均为强酸5.M代表阿伏加德罗常数的值。
下列说法正确的是A.常温常压下,124gP4中所含P—P键数目为4N aB,100mL lmol-L-1FeCl3溶液中所含Fe’+的数目为0.1MC.标准状况下,11.2L甲烷和乙烯混合物中含氢原子数目为2MD.密闭容器中,2mol SO2和1mol O2催化反应后分子总数为2M6,我国科学家研发了一种室温下“可呼吸”的Na—CO?二次电池。
将NaC104溶于有机溶剂作为电解液,钠和负载碳纳米管的镣网分别作为电极材料,电池的总反应为:3CQ2+4N a7——^.2Na2C03+Co下列说法错误的是A,放电时,C10「向负极移动B.充电时释放CO?,放电时吸收CO?D,充电时,正极反应为:Na*+e-=Na 7,下列实验过程可以达到实验目的的是C.放电时,正极反应为:3C02+4e-=2C032-+C编号实验目的实验过程A配制0.4000mol•L-1的NaOH溶液称取4.0g固体NaOH于烧杯中,加入少量蒸德水溶解,转移至250mL容量瓶中定容B探究维生素C的还原性向盛有2mL黄色氯化铁溶液的试管中滴加浓的维生素C溶液,观察颜色变化C制取并纯化氢气向稀盐酸中加入锌粒,将生成的气体依次通过NaOH 溶液、浓硫酸和KMnO,溶液D 探究浓度对反应速率的影响向2支盛有5mL不同浓度NaHSO3溶液的试管中同时加入2mL5%H202溶液,观察实验现象8.我国是世界上最早制得和使用金属锌的国家,一种以闪锌矿(ZnS,含有SiCh和少量FeS、CdS、PbS杂质)为原料制备金属锌的流程如图所示:2稀f酸O r ZnO锌粉1浮选精於f焙广H:浸H氧彳V杂—1还:除杂f滤液f电解»锌气体滤渣1滤渣2波渣3金属离子T73+Zn Cd2+Fe T72+Fe72+开始沉淀的pH 1.5 6.3 6.27.4沉淀完全的pH 2.88.38.29.4相关金属离子[co(M"+)=O.l moLL』]形成氢氧化物沉淀的pH范围如下:回答下列问题:(1)焙烧过程中主要反应的化学方程式为o(2)滤渣1的主要成分除SiO2外还有;氧化除杂工序中ZnO的作用是,若不通入氧气,其后果是o(3)溶液中的CcP+可用锌粉除去,还原除杂工序中反应的离子方程式为o (4)电解硫酸锌溶液制备单质锌时,阴极的电极反应式为;沉积锌后的电解液可返回________工序继续使用。
第1单元 第3讲 蛋白质和核酸

第3讲蛋白质和核酸判断正误并找到课本原文1.细胞的各项生命活动都离不开蛋白质,蛋白质是生命活动的主要承担者。
(必修1P29)(√)2.氨基酸是组成蛋白质的基本单位。
(必修1P29)(√)3.每种氨基酸都含有一个氨基(—NH2)和一个羧基(—COOH),并连接在同一个碳原子上。
(必修1P29)(×)4.连接两个氨基酸分子的化学键叫作肽键。
由两个氨基酸缩合而成的化合物,叫作二肽。
(必修1P30)(√)5.氨基酸之间能够形成氢键等,从而使肽链能盘曲、折叠,形成具有一定空间结构的蛋白质分子。
(必修1P30)(√)6.氨基酸序列改变或蛋白质的空间结构改变,可能会影响其功能。
(必修1 P31)(√)7.经过加热、加酸、加酒精等引起细菌和病毒的蛋白质变性,可达到消毒、灭菌的目的。
(必修1P32)(√)8.真核细胞的DNA主要分布在细胞核中,线粒体、叶绿体内也含有少量的DNA。
(必修1P34)(√)9.一般情况下,DNA由两条脱氧核苷酸链构成,RNA由两条核糖核苷酸链构成。
(必修1P35)(×)10.DNA分子是储存、传递遗传信息的生物大分子,部分病毒的遗传信息储存在RNA中。
(必修1P35)(√)11.细胞中的各种化合物的含量和比例是保持不变的,以保证细胞生命活动的正常进行。
(必修1P36)(×)12.一切疾病都与基因受损有关。
(必修1P36)(×)(2018·浙江4月选考)蛋白质在生物体内具有重要作用。
下列叙述正确的是()A.蛋白质化学结构的差异只是R基团的不同B.某些化学物质可使蛋白质的空间结构发生改变C.蛋白质控制和决定着细胞及整个生物体的遗传特性D.“检测生物组织中的蛋白质”需同时加入双缩脲试剂A和B答案 B解析蛋白质化学结构的差异包括组成其氨基酸的种类、数量、排列顺序及肽链的盘曲、折叠方式及其形成的空间结构不同,A错误;某些化学物质可使蛋白质的空间结构发生改变,如酒精,B正确;控制和决定着细胞及整个生物体的遗传特性的是基因(或DNA),C错误;检测生物组织中的蛋白质时应先加入双缩脲试剂A液创造碱性环境,再加入双缩脲试剂B液发生显色反应,D错误。
1.3.1蛋白质结构和功能

肽键数= 6-1
肽键数= 8-2
肽键数=脱去的水分子数=氨基酸数-肽链数
关于组成蛋白质的肽链、氨基酸、肽 键、脱去水分子的数目对应关系表如下:
氨基 酸数
脱去水 游离的 肽键数 分子数 氨基
游离的 羧基
一条 肽链
n
n-1 n-1
至少 1个
至少 1个
m条 肽链
n
n-m n-m
至少 m个
至少 m个
3.蛋白质结构多样性与功能多样性
氨基酸分子的结合方式:脱水缩合
HOH HO
H
NH2 C C N C C OH H N
肽键
R1
R2
二肽
H2O H2O
H C COOH R2
思考讨论:氨基酸是如何形成蛋白质的呢?
P21-22
氨基酸
脱水缩合
肽 链
盘曲折叠
具有复杂 空间结构 的蛋白质
二肽
三肽
多肽
3.肽键数与氨基酸个数的关系
氨基酸
肽键
肽键数= 3-1
()
A.三种化合物可以用一个结构通式表示 B.三种化合物的共同点之一是都含有一个氨基、一个羧基 C.三种化合物都不能与双缩脲试剂发生紫色反应 D.三种化合物两两结合形成的物质的游离氨基数相同
[解析] 三种物质都是构成蛋白质的氨基酸,都可用氨基酸的结构通式表 示,A 正确;图中三种氨基酸的共同点应为“至少都含有一个氨基、一个羧 基”,B 错误;双缩脲试剂鉴定蛋白质产生紫色反应,是由于蛋白质中有肽键, 氨基酸中无肽键,故不能与双缩脲试剂发生紫色反应,C 正确;三种化合物两 两结合形成的物质中游离的氨基数都为 1,D 正确。
Байду номын сангаас 蛋白质的功能还有许多,可以说,一 切生命活动都离不开蛋白质,蛋白质是 生命活动的主要承担者。
2018-2019学年化学同步苏教版必修2专题3 第三单元 人工合成有机化合物

1.常见有机反应类型:取代反应、加成反应和聚合反应。 2.由乙烯合成乙酸乙酯的反应流程:
3.加聚反应的条件和特点: (1)条件:单体必有碳碳双键或碳碳叁键等不饱和键; (2)特点:产物只有高聚物; (3)实例:nCH2===CH2―→ CH2—CH2 ,
4. CH2CH2 中单体是 CH2===CH2,链节是 CH2CH2, 聚合度是 n。
答案:C
5.已知有机物 A 既是一种重要的化工原料,也是一种水果催熟 剂。由 A 为原料衍生出的部分化工产品如下图所示。回答下 列问题:
(1)A 中所含官能团的名称为_碳__碳__双__键__。 (2)写出下列反应的反应类型:A―→B_加__成__反__应_,B―→F取__代__反__应__。
(3)写出下列反应的化学方程式 催化剂 ①A―→E: __①__n_C__H_2_=_=_=_C__H_2_―__△ ―__→___C__H_2_—__C__H_2_______;
②实例: 乙烯、苯乙烯、氯乙烯发生加聚反应的化学方程式为 a.乙烯: nCH2===CH2―→ CH2—CH2 ;
b.苯乙烯:
。
c.氯乙烯:nCH2===CHCl―→ CH2—CHCl ③链节、单体和聚合度(以合成聚乙烯为例): 单体:CH2===CH2,链节: —CH2—CH2—,聚合度: n 。
(4)去掉不符合四价的碳原子间的价键(一般为双键),即得合 成该加聚产物的单体。如判断
1.将下列物质及其对应的化学式与结构单元用线连起来。
2.如何由乙炔合成聚氯乙烯塑料?写出各步反应的化学方程式。 答案:CHCH―H① ―C→l CH2===CHCl―加②―聚→ CH2—CHCl 。 催化剂 CHCH+HCl ――→ CH2CHCl 催化剂 nCH2===CHCl ――→ CH2—CHCl
新教材浙科版高中生物精品 第一单元 第2课时 蛋白质和核酸

5.不同生物的核酸、核苷酸及碱基的种类
项目
核酸 核苷酸 碱基 遗传物质
举例
原核生物 _D_N__A_和__R_N__A_ 8 种 5 种 _D__N_A__ 细菌、蓝细菌
真核生物 _D_N__A_和__R_N__A_ 8 种 5 种
病毒
只含DNA 只含RNA
4种 4种 4种 4种
_D_N__A_ _D_N__A_ _R_N__A_
2.下列关于人体中蛋白质功能的叙述,错误的是 A.效应B细胞产生的抗体可结合相应的病毒抗原 B.肌细胞中的某些蛋白质参与肌肉收缩的过程
√C.蛋白质结合Mg2+形成的血红蛋白参与O2运输
D.细胞核中某些蛋白质是染色体的重要组成成分
蛋白质结合Fe2+形成的血红蛋白参与O2的运输,C错误。
归纳
总结
各类蛋白质的分布及功能
3.蛋白质结构多样性与功能多样性
种类 排
列顺序
数目 空间结构
血红蛋白 抗体
4.蛋白质的变性 由各种 物理 、 化学 因素改变引起的蛋白质空间结构的改变,都会导致 蛋白质分子 生物学活性 的改变。如高温杀菌、消毒等。
(必修1 P12)蛋白质肽链的盘曲和折叠被解开时(热变性),其特定功 能是否发生改变,还能被双缩脲试剂染成紫色吗?为什么?
形成过程会生成4个水分子 B.脑啡肽含有2个游离的氨基和2个游离的羧基
√C.用特殊水解酶作用于图中的①和②,可形成0条多肽链
D.高温、低温、过酸、过碱都可以使脑啡肽失去生物学活性
脑啡肽含有5个4种氨基酸,属于五 肽,在蛋白质分子合成过程中,失 去水分子数=肽键数,所以这一过 程共生成4个水分子,A错误; 据图可知,该脑啡肽由4种氨基酸组成,含有1个游离的氨基(—NH2) 和1个游离的羧基(—COOH),B错误; 用特殊水解酶作用于图中的①和②,可得到2个二肽和1个氨基酸,故 形成0条多肽链(三肽以上称为多肽),C正确; 高温、过酸、过碱都可以破坏蛋白质的空间结构使脑啡肽失去生物学 活性,但低温不会,D错误。
生化实验报告书

实验名称:蛋白质变性实验实验日期: 2023年10月25日实验者:张三一、实验目的1. 了解蛋白质变性现象及其影响因素。
2. 掌握蛋白质变性实验的原理和方法。
3. 分析不同条件下蛋白质变性的情况。
二、实验原理蛋白质变性是指蛋白质分子在物理或化学因素作用下,其空间结构发生改变,导致其生物活性丧失的过程。
蛋白质变性受多种因素影响,如温度、pH值、有机溶剂、重金属离子等。
本实验通过观察蛋白质在不同条件下的变性情况,分析蛋白质变性的影响因素。
三、实验材料与仪器材料:1. 牛血清蛋白(BSA)2. 0.1M HCl3. 0.1M NaOH4. 10%硫酸铵5. 95%乙醇6. 0.1M Tris-HCl缓冲液(pH7.4)仪器:1. 电子天平2. 恒温水浴锅3. 移液枪4. 试管5. 试管架6. 移液器7. 紫外可见分光光度计四、实验方法1. 将BSA溶液分别置于不同温度(25℃、50℃、75℃、100℃)的水浴锅中加热5分钟,观察蛋白质变性情况。
2. 将BSA溶液分别置于不同pH值的0.1M HCl和0.1M NaOH溶液中处理5分钟,观察蛋白质变性情况。
3. 将BSA溶液与10%硫酸铵溶液按1:1比例混合,观察蛋白质变性情况。
4. 将BSA溶液与95%乙醇按1:1比例混合,观察蛋白质变性情况。
5. 将蛋白质变性后的溶液用0.1M Tris-HCl缓冲液(pH 7.4)透析过夜,去除未变性的蛋白质。
6. 使用紫外可见分光光度计测定透析前后溶液的吸光度,分析蛋白质变性情况。
五、实验结果与分析1. 在不同温度下,随着温度升高,蛋白质变性程度逐渐加剧,吸光度降低。
2. 在不同pH值下,蛋白质在酸性或碱性条件下易变性,吸光度降低。
3. 在10%硫酸铵溶液中,蛋白质变性程度较高,吸光度降低。
4. 在95%乙醇中,蛋白质变性程度较高,吸光度降低。
5. 透析后,未变性的蛋白质被去除,溶液吸光度降低。
六、实验结论1. 温度、pH值、有机溶剂、重金属离子等物理或化学因素均可导致蛋白质变性。
高中化学:蛋白质

2、下面关于蛋白质的叙述不正确的是
(C )
A.在豆浆中加入少量石膏,能使豆浆中的蛋白质凝结,从而制成豆腐
B.蛋白质都是高分子化合物
C.蛋白质在酶的作用下水解的最终产物是葡萄糖
D.若误食重金属盐而引起中毒,可服用大量牛奶或豆浆进行解救
3、下列有关蛋白质的性质描述说法错误的是
产生盐的结构简式为__________________________________________。
__天__然___有__机__高分子 。 2. 蛋白质性质
(1) 蛋白质的水解反应
蛋白质―酸――、―碱―水―或解―酶―反等―应―催―化――剂→多肽―水――解―反――应→氨基酸(最终产物)
【思考与交流】 观察甘氨酸和苯丙氨酸的结构简式,辨认其中的官能团,并说明
其结构的共同点。
氨基酸分子中都含有氨基(一NH2)和羧基。在一定条件下,氨 基酸之间能发生聚合反应,生成更为复杂的多肽,进而构成蛋白质。 人体从食物中摄取的蛋白质在消化道内酶的作用下,经过水解反应生 成各种氨基酸。
【实验探究】
【实验7-8】 (1) 向盛有鸡蛋清溶液的试管中加入几滴酷
酸铅溶液,观察现象。 (2) 向盛有鸡蛋清溶液的试管中滴入几滴浓
硝酸,加热,观察现象。 (3) 在酒精灯的火焰上分别灼烧一小段头发和丝Biblioteka 品,小心地闻气味。【实验探究】
【实验探究】 (2) 蛋白质的变性
变性:蛋白质在一些化学试剂或一些物理因素作用下,失去生理活性,溶 解度下降而析出的过程。
第七章 有机化合物 第四节 基本营养物质
蛋白质
哪
些
物
质
中
含
高一生物必修知识点:2.2.2蛋白质的结构和功能

高一生物必修知识点:2.2.2蛋白质的结构和功能【必修一】高中生物必备知识点:2.2.2蛋白质的结构和功能1、组成及特点:(1) 蛋白质是由C(碳)、H(氢)、O(氧)、N(氮)组成,一般蛋白质可能还会含有P(磷)、S(硫)、Fe(铁)、Zn(锌)、Cu(铜)、B(硼)、Mn(锰)、I(碘)、Mo(钼)等。
这些元素在蛋白质中的组成百分比约为:碳50% 氢7% 氧23% 氮16% 硫0~3% 其他微量。
(2) 一切蛋白质都含N元素,且各种蛋白质的含氮量很接近,平均为16%。
(3) 氨基酸分子相互结合的方式是:一个氨基酸分子的羧基(-COOH)和另一个氨基酸分子的氨基(—NH 2 )相连接,同时脱去一分子水,这种结合方式叫做脱水缩合。
连接两个氨基酸分子的化学键(-NH-CO-)叫做肽键。
有两个氨基酸分子缩合而成的化合物,叫做二肽。
肽链能盘曲、折叠、形成有一定空间结构的蛋白质分子。
2、蛋白质的性质:(1) 两性:蛋白质是由α-氨基酸通过肽键构成的高分子化合物,在蛋白质分子中存在着氨基和羧基,因此跟氨基酸相似,蛋白质也是两性物质。
(2) 水解反应:蛋白质在酸、碱或酶的作用下发生水解反应,经过多肽,最后得到多种α-氨基酸。
(3) 胶体性质:有些蛋白质能够溶解在水里(例如鸡蛋白能溶解在水里)形成溶液。
蛋白质的分子直径达到了胶体微粒的大小(10-9~10-7m)时,所以蛋白质具有胶体的性质。
(4) 盐析:少量的盐(如硫酸铵、硫酸钠等)能促进蛋白质的溶解。
如果向蛋白质水溶液中加入浓的无机盐溶液,可使蛋白质的溶解度降低,而从溶液中析出。
这样盐析出的蛋白质仍旧可以溶解在水中,而不影响原来蛋白质的性质,因此盐析是个可逆过程.利用这个性质,采用分段盐析方法可以分离提纯蛋白质。
(5) 变性:在热、酸、碱、重金属盐、紫外线等作作用下,蛋白质会发生性质上的改变而凝结起来.这种凝结是不可逆的,不能再使它们恢复成原来的蛋白质.蛋白质的这种变化叫做变性。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
小结:结构是功能的基础
蛋白质一级结构 决定
一级结构是空间构象基础,关键氨 基酸变化可致空间构象、功能改变。
蛋白质一级结构不是决定空间构象 的唯一因素。
蛋白质空间构象
决定 蛋白质功能
牛核糖核酸酶实验 镰刀形红细胞贫血症 血红蛋白的变构效应 朊病毒
第五节 理化性质和分离纯化
一、两性电离及分离方法
C +NH3
H
L-氨基酸的丙甘通氨氨式酸酸
(二)分类
1.非极性
2.极性不带电荷
3.碱性
• 含2个氨基;等电点高;在pH7.0时,碱性
4.酸性
• 含有2个羧基;等电点低;在pH7.0时,酸性
水分子及与离子间的结合
蛋白质和DNA中的氢键
物质的引入改变水分子间的氢键网
非极性和极性的分布
折叠的多肽链 水层 非极性 极性
3 茚三酮反应
三、肽键与多肽链
(一)成肽反应
什么时候发生?
几个小名词
• 肽键
HOHH
•肽
H2N C C N C COOH
• 二肽
R
R
• 氨基酸残基
• N-末端
• C-末端
(二) 生物活性肽
谷胱甘肽 催产素(分娩,泌乳,信任,亲密)-自闭症治疗? 加压素 抗利尿激素 胰高血糖素 缓激肽 促甲状腺激素释放因子 胃泌素 血管紧张素II P物质 脑啡肽
第四节 结构与功能的关系
一 一级结构与功能 二 空间结构与功能 三 修饰可调节功能
第四节 蛋白质结构与功能的关系
一 一级结构与功能
(一)一级结构决定空间构象
牛核糖核酸酶
去除尿素、 β-巯基乙醇
天然状态, 有催化活性
尿素、 -破坏氢键 β-巯基乙醇 -破坏二硫键
非折叠状态,无活性
(二) 一级结构与分子病
1960年 Peter Nowell发现慢性骨髓性白血 病(CML)患者,22号染色体短。 1973年,Janet Rowley发现9号与22号染色体易位。
1983年,发现基因融合。9号上C-abl移至22号断 裂点区(bcr),形成bcr/abl融合基因,编码P210, 增强酪氨酸激酶活性,改变了多种蛋白酪氨酸磷 酸化水平,扰乱信号途径,抑制凋亡。
双向电泳图
3.离子交换层析
二 高分子性质
1. 稳定的胶体溶液
水化膜
+++
酸
+
+碱
++
带正电荷的蛋白质 在等电点的蛋白质
碱
--
-
-
酸
- --
-
带负电荷的蛋白质
2. 透析与超滤
人工肾
血液透析图
超滤(ultrafiltration)
待超滤的蛋白质溶液 磁力搅拌器
加压的氮气 超滤膜
3. 沉降与超速离心
酸性
HOHH
+H32N C C N C COOH
R
R
HOHH
PI(等电点)+H32N C C N C COO-
R
R
碱性
HOHH
H2N C C N C COO-
R
R
1. 等电点沉淀法
水化膜
+++
酸
+
+碱
++
带正电荷的蛋白质 在等电点的蛋白质
碱
--
-
-
酸
- --
-
带负电荷的蛋白质
脱水作用
++ +
+
+
+ ++
同向排列
反向排列
几个蛋白质包含的二级结构
肌红蛋白
细菌孔蛋白
脂肪酶
酪氨酸激酶部分
蚕丝
胶原蛋白
5. 模体(motif) /超二级结构
2-3个二级结构组合, 与功能有关.
螺旋-环-螺旋 发卡
基元 希腊钥匙
结合DNA的模体
6. 结构域(domain)
大蛋白质可分割成几个球状区域,分别有功能。
三、三级结构
抑制与氧结合(2)
代谢活跃(pH和CO2)-促进O2释放,给组织供氧 (Bohr效应)
血红蛋白变构在氧从肺运到组织时的作用
肺部高氧利于形成R结构,BPG一般不结合;在组织,氧浓度降 低及玻尔效应利于形成T结构,而BPG利于稳定T结构。
CO中毒
1. CO与血红蛋白亲和力高,但可逆。 2. 每天1包烟,使CO结合血红蛋白提高2.5%,
2001年格列卫上市,CML 5年生存率从30%提高到89%。
https:///wiki/Bcr-Abl_tyrosine-kinase_inhibitor
蛋白质
由 许 多 氨 基 酸 (amino acids) 通 过 肽 键 (peptide bond)相连形成的高分子含氮化合物。
4.亨丁顿舞蹈病
hd基因上(CAG)重复数增多,谷氨酰胺增多,不 易溶,损坏脑细胞,特别与肌肉控制有关的细胞, 导致神经系统退化,动作失调,颤搐,能发展成 痴呆,甚至死亡。
2. 构象变化调节功能—血红蛋白
氧促进与氧的结合
Hb:“S”形曲线
血红蛋白结合氧, 空间结构改变影响结合
Hb结合O2的别构效应
第二节 蛋白质的分子结构
一、一级结构
氨基酸的排列顺序,及二硫键的位置。 化学键: 肽键(主要); 二硫键(次要)
牛胰岛素一级结构
肽链在空间中如何?
为何会折叠? 非共价键相互作用
二、二级结构
肽平面
一段肽链的局部结构,即主链原子的相对位置。不涉及侧链 。
1. -螺旋/-helix
2. -折叠
O2
协同效应: 蛋白质的一个亚基与其配体结合后,影响另一个亚 基与配体结合能力。
抑制与氧结合(1) BPG( 2,3-二磷酸甘油酸)促进成T构象,氧亲和力低
有BPG左移
无BPG右移
BPG与胎儿HbF结合力弱,致HbF与氧亲和力高, 利于氧从母亲外周血向胎儿外周血转运.
母体与胎儿
血液贮存
•贮存时BPG丢失。 •因此血液贮存时加葡萄糖、丙酮酸、二羟丙 酮,腺嘌呤等。
(三) 特殊氨基酸 1. 编码
20种 + 硒半胱氨酸(UGA有义表达),吡咯赖氨酸(UAG有义表达)
2. 非编码
1. 游离:瓜氨酸,鸟氨酸,同型半胱氨酸、D-氨基酸等。 2. Pr中氨基酸的修饰:-OH, -CH3, -COCH3, -P, -COOH…..
(四)氨基酸理化性质
1 等电点 (isoelectric point, pI) :
假如不同加压素受体基因型,表达水平
会不同。是否要知道某男生基因型?
------Nature Neuroscience, 2013; doi:10.1038/nn.3420
不同国家的相互信任水平
Zak, Scientific American, 2008,306(6), 88
蛋白质糖基化-不可逆
糖尿病患者:糖化血红蛋白沉积 于小动脉管壁,引起微血管病 变.
肽链中所有原子在三维空间的排布位置。
肌红蛋白
C端 N端
• 维持三级结构的化学键
二硫键
疏水作用 氢键 离子键 范德华力
四、四级结构
有蛋白质有>=2条肽链,叫亚基 (subunit)。经非共价键形 成的空间排布。
通常单亚基没有功能 氢键和离子键。
血红蛋白亚基间盐键
血红蛋白的一、二、三、四级结构
人:库鲁病,脑软化病,克-雅病(CJD),变异
型CJD(人类疯牛病),致死性家族性失眠症。
动物:牛海绵状脑病(疯牛病),羊瘙痒症,貂
传染性脑病,猫海绵状脑病
1986-2014年,177英国人和55其它国人食用感染牛肉感染变异型CJD
2. 阿尔茨海默症
β-淀粉样蛋 白
3. 帕金森病
α突触核蛋白(α-synuclein)聚集于多巴胺神经元,形成路易 小体(Lewy bodies )
• 血红蛋白串联,形成 不溶纤维束,使细胞 扭成镰刀形。
突变携带者对疟疾有抗性
疟原虫感染后,pH降低,HbS 凝集,细胞变形,在脾脏被吞 噬,利于清除感染细胞。
分子病
基因突变引起蛋白质发生变异导致疾病。
白虎:神兽还是怪物
SLC45A2的突变(A477V),丙氨酸变为缬氨酸。影响黄和红色素 的合成,对黑色影响弱,未影响其它功能。Cell,2013,23:1031
交配影响基因表达
背景: 草原田鼠交配后形成一夫一妻,与催产 素、加压素、多巴胺和受体结合有关.
• 交配:使催产素、加压素受体基因组蛋白乙酰化, 表达上调,促进伙伴关系形成。
• 促进乙酰化药物:使田鼠没有交配也形成伙伴偏 好。
讨论:
金风玉露一相逢,便胜却人间无数! 用此类药物,促进家庭和谐? “爱情药水”--- 催产素香水
第一章 蛋白质的结构与功能
• 概述 • 组成 • 结构 • 结构与功能的关系 • 理化性质和分离纯化
功能
信号传递
第二节 分子组成
一、元素:
主要C、H、O、N和S, 少量P, Fe, Cu, Zn, Mn, I, … 。
N含量:16%
三聚氰胺
二、基本单位--氨基酸
(一)通式
COO-
CHRH3
茚三酮反应 (蓝紫色) 双缩脲反应(紫红色络合物) 酚试剂反应: 磷钼酸-磷钨酸(蓝色)
亲和层析
Western Blot原理
ELISA法检测微量抗原
蛋白质组学-proteomics
一种细胞或一种生物所表达的全部蛋白质
(1)蛋白质表达谱 (2)蛋白质翻译后修饰 (3)细胞定位 (4)蛋白质相互作用 (5)蛋白质生物信息学研究 (6)蛋白质结构解析
