制剂处方工艺小试研究流程
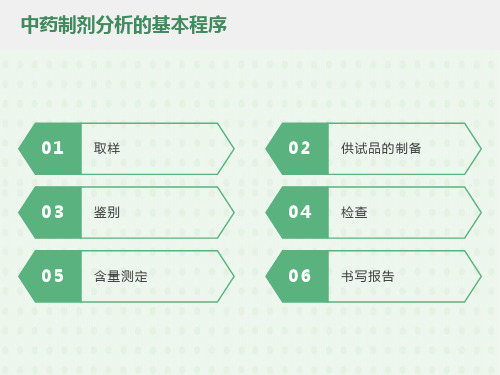
中药制剂分析的基本程序
1药味的选定:一般选的在方剂中期主要作用的药物及贵重药及毒性药的质量控制。
2测定成分的选定:原料药必须有含量限度
3测定方法及条件的选定:
4方法学考查内容:
含量测定
01
02
03
04
05
供试品的制备(净化方法)
形状鉴别
显微鉴别
(注目前薄层色谱法最常用)Fra bibliotek理化鉴别
鉴别
制剂通则的检查:检查项目及内容与剂型有关;如丸剂要求检查水分,重量差异,溶散时限,装量差异;片剂要求测定重量差异、崩解时限等;酒剂要求测定乙醇含量、甲醇量、总固体及装量等;注射剂要求测定装量、澄明度、不溶性颗粒等。
液体样品取样法 对于均匀的液体直接取样,对于均匀性较差的液体需分层取样
(注:供试品检查完毕后,应保留一半数量的作为留样观察,保存时间为半年或一年,并对该中药制剂做定期检查)
取样
供试品的制备(提取)
提取(1)溶剂提取法 选择溶剂的原则是相似相溶性,常用的提取溶剂有;水,甲醇,乙醇,乙醚,丙酮,氯仿,乙酸乙酯,石油醚等。 (2)萃取法适用于液体制剂 (3)冷浸法适用于固体制剂及对热不稳定性成分的提取 (4)回流提取对热不稳定的及具有挥发性的成分的物质不适用 (5)连续回流提取法,对热不稳定的物质不适宜用 (6)超生萃取法 特点提取效率高,操作简单 (7)水蒸气蒸馏法适用于加水加热不破坏,具有挥发性的物质。挥发油及一些小分子的生物碱如麻黄碱,槟榔碱,某些酚性物质如丹皮酚等可用本法提取 (8)超临界流体萃取法 (9)升华法如游离基蒽醌类化合物,斑蝥素等 (10)微波辅助萃取法
01
取样
02
供试品的制备
03
鉴别
04
检查
05
药物制剂研发流程

药物制剂研发流程药物制剂研发的流程可以大致分为以下几个阶段:1.药物发现和筛选:这一阶段主要是通过筛选和测试各种药物,发现具有潜在治疗作用的药物。
这一阶段的工作主要由科研人员和实验室完成。
2.药学研究:在确定具有治疗潜力的药物后,需要进行药学研究,以了解药物的化学性质、药理作用、毒理学等方面的信息。
这些信息将有助于确定药物的最佳使用方式和剂量。
3.制剂研发:这一阶段主要关注药物的剂型设计和制备工艺。
制剂研发的目标是确定一种能够实现药物最佳疗效和安全性的剂型,并研究出高效的制备工艺。
4.临床试验:在制剂研发完成后,需要进行临床试验以评估药物的安全性和有效性。
临床试验通常分为多个阶段,每个阶段都有特定的目的和试验设计。
5.药品注册和审批:在完成临床试验后,需要将药物提交给药品监管机构进行注册和审批。
这一阶段需要对药物的研发过程、临床试验结果、生产工艺和质量标准等信息进行全面的评估,以确保药物的安全性和有效性。
6.工业化生产和上市:在获得药品注册和审批后,药物可以进入工业化生产和上市阶段。
这一阶段需要制定生产工艺和质量标准,并进行大规模的生产和质量控制。
在药物制剂研发的整个过程中,各个阶段都有其特定的目标、工作内容和注意事项。
科研人员需要不断进行实验和数据分析,以确定最佳的药物配方、剂量和使用方式。
同时,他们还需要关注药品的安全性和质量控制,以确保最终产品的质量和疗效符合要求。
此外,随着科学技术的发展和人们健康需求的不断变化,药物制剂研发也在不断地更新和完善。
现代药物制剂研发不仅关注药物的疗效和安全性,还注重药物的舒适性和美观性等方面的研究。
例如,研究人员可以通过计算机辅助设计和3D 打印技术等方法,设计出更加精细和个性化的药物剂型。
同时,随着生物技术的发展,基因治疗和细胞治疗等新型治疗方式也逐渐成为药物制剂研发的新方向。
这些新型治疗方式可以为一些难以治愈的疾病提供新的治疗手段和方法。
例如,基因治疗可以针对疾病的根源进行基因修复或替换,从而达到根治疾病的目的;细胞治疗则可以通过培养和修饰人体自身的细胞来治疗疾病,这些方法可以为药物制剂研发带来新的机遇和挑战。
制剂处方及工艺研究课程

❖ 注射剂的剂型选择还应符合《化学药品 注射剂基本技术标准》的规定,要根据药 物的特性综合权衡大容量注射液、小容量 注射液和粉针剂
---- 无菌保证水平 ---- 杂质的控制水平 ---- 工艺的可行性 ---- 临床使用的方便性等
❖ 基于以上基本原则,经专家审评会
议讨论确认存在以下情况的注册申请 将不予批准:
实例2:罗格列酮 依替膦酸罗格列酮胶囊
❖ FDA发布双磷酸盐类制剂的用药警示信 息:
❖ 2005年FDA曾报告过阿仑膦酸钠、利塞膦酸钠引起的 骨、关节、肌肉疼痛不良反应事例;
❖ 2008年1月7日,FDA再次发布双磷酸盐类药物的严重 肌肉骨骼疼痛潜在风险警示信息。
❖ 双磷酸盐类药物导致严重肌肉骨骼疼痛 的风险因素尚不明确,FDA将继续评价上 市后有关不良反应 。
❖ 适应症---缓解偶尔伴有失眠的各种疼痛, 帮助入睡并延长睡眠。
❖ Advil PM的两个活性成分均为速释。
❖ 该申报品种的适应症为用于因疼痛影响睡 眠者, 对于各种疼痛影响睡眠的患者应快速 止痛和入睡。
❖ 而本品的布洛芬全部为缓释成分,苯海 拉明为速释成分,止痛比普通制剂慢,此 剂型对于疼痛伴有入睡困难的患者不合适。
❖ 其中不良反应表现为溶血性贫血的有11 例;未收到致畸、致癌的相关病例报告。
❖ 2004年11月14日, 药审中心组织召开了“利 巴韦林专题讨论会”。
❖ 会议回顾、分析了利巴韦林在国内不同临床专 业使用的历史和现实情况,会议对利巴韦林的安 全性问题进行了深入的探讨。会议研究并讨论了 对利巴韦林产品的处理建议 。
-----本品水溶性好,制成分散片加水后在水 中呈分散状态的是片剂辅料而不是药物, 因此并不是实际意义上的分散片;
制剂处方工艺小试研究流程

制剂处方工艺小试研究流程
一、引言
二、研究目的
三、实验设计
1.确定实验方案:根据研究目的和资料分析确定制剂的小试研究方案,包括制剂配方的选择、实验样品的制备和分析方法的确定等。
2.原料准备:根据实验方案,准备所需的原料和药物。
3.实验装置准备:准备好所需的实验装置和仪器设备,包括称量仪器、混合设备、反应槽、温度控制设备等。
4.实验分组:根据实验方案,将实验样品分为不同的处理组和对照组,以比较不同工艺参数条件下的制剂特性。
四、实验步骤
1.制备药物:按照药物配方的比例,准确称取所需的原料和药物,进
行预处理和加工。
2.成分配伍:根据实验方案,将制备好的原料和药物按照一定的配伍
次序进行混合。
3.掺蜜和粉碎:根据实验方案,将混合好的原料进行掺蜜和粉碎处理,使其更加均匀。
4.试样制备:根据实验方案,将加工好的试样按照要求进行分装和标识。
5.实验操作:根据实验方案,对试样进行一系列的操作,包括溶解、滴定、过滤等。
5.结果分析:根据实验操作得到的结果,进行数据处理和分析,比较不同工艺参数下的试样特性。
六、结果讨论
1.结果分析:根据实验操作得到的结果,比较不同工艺参数下试样的性能差异。
2.问题分析:分析实验中遇到的问题和困难,并提出解决方案。
3.结论和建议:根据实验结果,得出结论和建议,为进一步优化制剂工艺提供依据。
七、结论
制剂处方工艺小试研究是确定制剂合理工艺的重要手段,通过小试研究可以优化制剂的制备过程,提高产品的质量和稳定性。
该研究流程包括了实验设计、实验步骤、结果分析和结论讨论等环节,可以帮助研究者确定最佳的制剂配方和工艺参数。
制剂研发的基本工作基本流程

制剂研发的基本工作基本流程制剂研发的基本工作基本流程(主要环节)1相关文献资料调研等前期准备主要对其原料药进行资料调研。
主要包括与制备制剂以及体内过程可能相关的各种基本理化性质,比如logP值(脂溶性如何以及可能的溶剂)、pKa值(酸碱性,尤其对注射剂)、溶解度(不同pH值和性质的溶出/溶解体系,初步判断是否具有pH值依赖等)、渗透性(初步判断其在体内的吸收与否)、晶型(晶型的不同,药物溶解性及稳定性有可能不同)、药物的剂型及规格、作用机制(靶点以及发挥作用的路径等)、药理毒理信息(有效治疗浓度和中毒剂量判断)、药动学行为(整个的ADME过程及各自的特点),相关制剂的上市信息、临床信息、专利情况以及有关的文献资料(综述或者具体研究)等。
对其以上市产品进行信息调研。
包括其上市产品说明书,涉及大量的不良反应、临床治疗学、群体药动学等相关资料。
还有国内及进口制剂剂型、规格以及相关特点(改剂型时尤其注意);产品的质量标准(原研标准、国内首仿标准、药典标准。
这些标准能否弄到,并要比较不同标准的异同和实时标准更新);原研处方组成及工艺研究资料(有时需要注意原研处方未必是最优处方);原研处方中辅料情况(是否都可买到及是否有标准,有否进口);药品稳定性资料(关注杂质变化、限度及其原因);国内外专利情况(是否侵权及能否避开);生产注册情况(产品原研厂家、国内生产申报厂家,注册与正式产品之间有差异,需要分析原因);参比制剂的来源(通过对参比制剂的研究,如对外观、性状、溶出情况等等的观察,以及对含量、溶出度、有关物质、硬度、片重(装量)等参数的测定,往往能得到一些对项目开发有重要参考价值的数据或资料)。
最后要对所有信息进行汇总形成该研药物的制剂研发调研报告,内容要包括或参比制剂的相关信息概述、所研药物制剂的开发策略、各阶段的原料大概需求、各阶段的研究时间表、研究过程可能遇到或者出现的问题以及初步的解决方案等。
该立题报告要突出调研二字,不能是信息的大杂烩,而应该是经过自己的信息提炼、分析和总结后得出的切实可行的项目开展方案。
药物制剂开发研究流程

---------------------------------------------------------------最新资料推荐------------------------------------------------------药物制剂开发研究流程药物制剂开发研究流程 (1)前期准备工作(处方前研宄):a:文献检索,如果是三类 or 四类,通过文献检索查询国外处方构成,有那些成分如稀释剂是什么,润湿剂,黏合剂是什么等等,常用的文献检索工具有各国家药典,Merck 索引,FDA,EMEA,Drugfuture,百度,Google (千万不要小看百度和 google,这两个异常强大)等网络工具。
通过这些资料的收集,能对原料药和其制剂的专利家族信息,原料药测试方法,药物杂质,溶出方法等进行充分的了解,对后续的工作有指导意义。
b:参比制剂的购买,必须是原研厂家可做参比药物的规格,本品种为 300mg,最好能每个规格选择至少 3 批不同批号的产品用于对照制剂研宄。
评价的项目有片形,颜色,刻字,包装规格,包装材质,密封系统,棉花和干燥剂,片重,厚度,硬度,水分含量,脆碎度,崩解时限,含量,杂质等。
c:辅料采购,对原研药处方组成进行分析后确定使用了的辅料,同时采购可能需要用到的辅料。
d:包装材料的采购,参照原研厂家的包装,并结合目前国内及公司本身情况,拟定包材种类,进行米购。
e: API 的采购,同时进一步了解原料药理化性质,如结构式,1 / 7分子量,晶型,结晶习惯,溶解度,稳定性,LogP,PKa,熔点,粒径分布,堆/实密度,可压缩性,流动性,吸湿性,比表面积等一列的数据。
评价原料药稳定性数据,残留溶剂,原料药的质量标准,原料药的含量,杂质等。
注意化学纯度和光学纯度,可以以先采购小样,然后检测择优选择。
f: API 原料采购回后:测定其物理化学性质后,重点考察其稳定性及与辅料的配伍研宄。
制剂处方工艺小试研究流程
XXXX药业有限公司l、目的:建立制剂处方工艺小试研究流程,规范操作,能最终确定处方工艺,达到处方合理,工艺稳定。
2、适用范围:适用于固体制剂研究所制剂处方工艺研发项目的小试研究操作。
3、该流程有关责任:固体制剂研究所、质量部。
4、规程内容4.1处方工艺研究前的准备工作4.1.1 硬件设施的确认:确认实验和检验所需的仪器是否到位,是否需要购买。
4.1.2通过了解原料药的性质、辅料的性质选择适宜的原辅料,并确认是否需要购买。
4.1.3 进行原辅料相容性试验,研究药物与辅料间及药物与药物间的相互作用。
4.1.4 文献查找,查找可参照的文献资料,为研究提供帮助,缩短小试研究的时间。
4.1.5初步质量研究:制定初步的质量标准,并对检测方法进行方法学验证,验证出合适的方法以便对样品进行检测。
4.2 处方及工艺研究4.2.1 处方工艺设计:在前期对药物和辅料有关研究的基础上,根据剂型的特点,结合已掌握药物的理化性质和生物学性质,制定几种基本的处方工艺,以便开展筛选和优化。
4.2.2 制备样品:根据设计好的处方工艺进行样品制备。
4.2.3 处方工艺基本性能评价:根据剂型的特点,选择影响制剂质量的相关项目,进行制剂的基本性能考察。
如果考察不合格,则需重新设计处方工艺。
4.2.4 影响因素试验:选择制剂基本项目考察合格的处方的样品进行影响因素试验,考察其稳定性。
对于稳定性不好的处方可进行相容性试验,去除或替换掉对主药稳定性影响较大的辅料,以达到稳定性的要求。
若无法达到稳定性要求则需重新设计处方工艺。
4.3 部门内部评估4.3.1 在基本已经确定了处方工艺的情况下,部门内部对其进行评估4.3.2 评估结果为可行,则进行下面的工作,不可行则需重新设计处方工艺。
4.4 工艺放大和重现4.4.1 对已确定的处方工艺进行放大试验,并最终能达到中试的要求,并对放大后的样品进行基本性能评价。
4.4.2 工艺重现性:为保证制剂质量的一致性,一般至少需要对连续三批样品的制备过程进行考察。
制剂小试研发流程

制剂小试研发流程一、研发开始前的准备。
做制剂小试研发之前呀,咱得先把一些事儿搞清楚。
这就像是出门旅行之前得收拾好行李一样。
首先得确定咱要研发的制剂类型,是片剂呀、胶囊剂呀,还是注射剂之类的呢?这可太重要啦,不同的制剂类型那研发的路数可不一样呢。
然后就是了解目标产品的一些基本要求,比如说这个制剂是用来治疗啥病的,对药效有啥特殊要求,这就像是知道目的地之后,才能规划路线嘛。
另外呢,咱得把研发团队凑齐喽。
这就像组建一个超级英雄战队,有搞药物化学的小伙伴,他们就像是能看穿药物分子结构的魔法师;还有做药剂学的,他们是把各种成分组合在一起的魔法师助手;当然也少不了做分析检测的,他们就像拥有超级透视眼的侦探,能把制剂里的成分和含量看得一清二楚。
再说说物料准备,这就像厨师做菜得先备好食材一样。
要把各种原料、辅料都准备好,还得保证这些物料的质量都是杠杠的。
要是原料就有问题,那后面做出来的制剂肯定也是个“歪瓜裂枣”呀。
二、制剂配方的初步设计。
有了前面的准备,就可以开始设计制剂配方啦。
这一步就像是搭积木,要把各种成分按照合适的比例组合在一起。
这时候就得发挥咱的知识和经验啦,参考一些已有的文献资料,看看别人是怎么做类似制剂的,但可不能完全照抄哦,毕竟每个制剂都有它的独特之处。
比如说设计一个片剂的配方,要考虑主药的性质,是容易溶解的呢,还是比较难溶的。
如果是难溶的主药,就得想办法加一些助溶剂之类的辅料,就像给一个不爱出门的小朋友找个小伙伴一起玩,这样他就愿意出来啦。
对于辅料的选择也很有讲究呢,要考虑它的安全性、稳定性,还有和主药的相容性。
可不能随便找个辅料就往上加,要是它们两个“打架”,那可就糟了。
在这个过程中,可能会有很多不同的配方想法冒出来,那就一个一个试呗。
这就像试衣服一样,哪个配方穿起来(也就是在性能上)最合适,就选哪个。
不过试的过程中要做好记录哦,不然试了半天,啥都没记住,那就白忙活了。
三、小试样品的制备。
配方初步确定了,就可以动手制备小试样品啦。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
l、目的:建立制剂处方工艺小试研究流程,规范操作,能最终确定处方工艺,达到处方合理,工艺稳定。
2、适用范围:适用于固体制剂研究所制剂处方工艺研发项目的小试研究操作。
3、该流程有关责任:固体制剂研究所、质量部。
4、规程内容
4.1处方工艺研究前的准备工作
4.1.1 硬件设施的确认:确认实验和检验所需的仪器是否到位,是否需要购买。
4.1.2通过了解原料药的性质、辅料的性质选择适宜的原辅料,并确认是否需要购买。
4.1.3 进行原辅料相容性试验,研究药物与辅料间及药物与药物间的相互作用。
4.1.4 文献查找,查找可参照的文献资料,为研究提供帮助,缩短小试研究的时间。
4.1.5初步质量研究:制定初步的质量标准,并对检测方法进行方法学验证,验证出合适的方法以便对样品进行检测。
4.2 处方及工艺研究
4.2.1 处方工艺设计:在前期对药物和辅料有关研究的基础上,根据剂型的特点,结合已掌握药物的理化性质和生物学性质,制定几种基本的处方工艺,以便开展筛选和优化。
4.2.2 制备样品:根据设计好的处方工艺进行样品制备。
4.2.3 处方工艺基本性能评价:根据剂型的特点,选择影响制剂质量的相关项目,进行制剂的基本性能考察。
如果考察不合格,则需重新设计处方工艺。
4.2.4 影响因素试验:选择制剂基本项目考察合格的处方的样品进行影响因素试验,考察其稳定性。
对于稳定性不好的处方可进行相容性试验,去除或替换掉
对主药稳定性影响较大的辅料,以达到稳定性的要求。
若无法达到稳定性要求则需重新设计处方工艺。
4.3 部门内部评估
4.3.1 在基本已经确定了处方工艺的情况下,部门内部对其进行评估
4.3.2 评估结果为可行,则进行下面的工作,不可行则需重新设计处方工艺。
4.4 工艺放大和重现
4.4.1 对已确定的处方工艺进行放大试验,并最终能达到中试的要求,并对放大后的样品进行基本性能评价。
4.4.2 工艺重现性:为保证制剂质量的一致性,一般至少需要对连续三批样品的制备过程进行考察。
4.4.3 影响因素试验:放大后的样品同样需要进行影响因素试验,考察其稳定性,同时进行内包材的相容性试验,选择适宜的内包材。
4.4.4 质量研究:进行质量研究,以选择适宜的方法,并在中试开始前完成。
4.5 小试评估:对小试研究的成果进行分析评估,各项指标是否符合要求,符合则小试结研究束,不符合则需要重新设计处方工艺。
5、小试研究完成后及时撰写研发项目的阶段性报告,并备案。
6注意事项
6.1在进行小试研究时,必须初步确定中试的处方和工艺;
6.2 在进行小试研究时,研发人员必须进行清洁方法摸索,初步确定清洁设备所用的溶剂和清洁方法。
7简易流程图如下:。
