HZHJSZ0132 水质 游离二氧化碳的测定 酚酞指示剂滴定法
总酸度、游离酸度的测定方法

总酸度、游离酸度的测定方法
确定磷化液的总酸度和游离酸度的酚酞指示剂和溴酚蓝指示剂该如何配制?浓度是多
少,用什么做溶剂,酒精还是蒸馏水?
酚酞:酚酞1g,加乙醇100ml溶解即得
溴酚蓝:取溴酚蓝0.1g,加0.05mol/L氢氧化钠溶液3.0ml溶解,水稀释至200ml,即得。
本法采用酸碱滴定法。
取试样10mL,用0.1mol/L氢氧化钠标准溶液滴定,所消耗的毫升数用点数表示。
A1试剂
氢氧化钠:0.5mol/L标准溶液(按GB601配制和标定);
酚酞指示剂:1%乙醇溶液;
甲基橙指示剂:0.1%水溶液;
溴酚兰指示剂:1g溶于1000mL20%乙醇中。
A2试验方法
A2.1游离酸度的测定
用移液管吸取10mL试液于250mL锥形烧瓶中, 加50mL蒸馏水, 加2-3滴甲基橙指示液 (或溴酚兰指示液)。
用氢氧化钠标准液滴定至溶液呈橙色(或用溴酚兰指示液滴定至由黄变为蓝紫色)即为终点,记下消耗氢氧化钠标准液毫升数A。
A2.2总酸度的测定
用移液管吸取10mL试液于250mL锥形烧瓶中, 加50mL蒸馏水, 加2-3滴酚酞指示液。
用氢氧化钠标准液滴定至溶液呈粉红色, 即为终点。
记下消耗氢氧化钠标准液毫升数B。
A3计算方法
酸度点数按下列公式计算:
游离酸度(点)= ……………….(A1)
总酸度(点)= ………………….(A2)
式中:A、B——滴定时耗去氢氧化钠标准液毫升数,mL;
C——氢氧化钠标准液实际浓度,mol/L;
V——取样毫升数,mL。
水质简分析主要试验步骤及计算
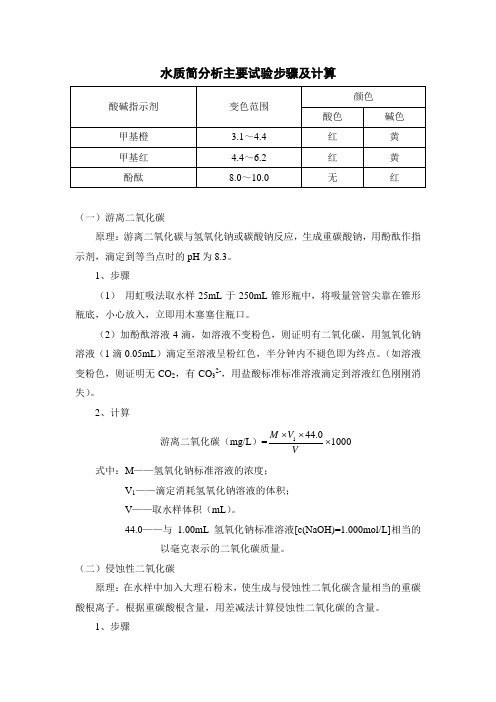
水质简分析主要试验步骤及计算(一)游离二氧化碳原理:游离二氧化碳与氢氧化钠或碳酸钠反应,生成重碳酸钠,用酚酞作指示剂,滴定到等当点时的pH 为8.3。
1、步骤(1) 用虹吸法取水样25mL 于250mL 锥形瓶中,将吸量管管尖靠在锥形瓶底,小心放入,立即用木塞塞住瓶口。
(2)加酚酞溶液4滴,如溶液不变粉色,则证明有二氧化碳,用氢氧化钠溶液(1滴0.05mL )滴定至溶液呈粉红色,半分钟内不褪色即为终点。
(如溶液变粉色,则证明无CO 2,有CO 32-,用盐酸标准标准溶液滴定到溶液红色刚刚消失)。
2、计算游离二氧化碳(mg/L )=10000.441⨯⨯⨯V V M 式中:M ——氢氧化钠标准溶液的浓度;V 1——滴定消耗氢氧化钠溶液的体积;V ——取水样体积(mL )。
44.0——与1.00mL 氢氧化钠标准溶液[c(NaOH)=1.000mol/L]相当的以毫克表示的二氧化碳质量。
(二)侵蚀性二氧化碳原理:在水样中加入大理石粉末,使生成与侵蚀性二氧化碳含量相当的重碳酸根离子。
根据重碳酸根含量,用差减法计算侵蚀性二氧化碳的含量。
1、步骤(1)吸取未加大理石粉末的水样25mL 于150mL 三角瓶中,加入甲基橙溶液4滴,用盐酸标准溶液滴定到黄色突变为橙色,消耗的盐酸标准溶液的体积为V 1(mL );(2)另取加大理石粉末的水样25mL 于三角瓶中,按(1)的步骤进行测定,消耗的盐酸标准溶液的体积为V 2(mL )。
2、计算侵蚀性二氧化碳(mg/L )=10000.22)(12⨯⨯-VV V c 式中:c ——盐酸标准溶液的浓度,mol/L ;V 2——加大理石粉末的水样所消耗的盐酸标准溶液的体积,mL ; V 1——未加大理石粉末的水样所消耗的盐酸标准溶液的体积,mL ; V ——所取水样的体积,mL ;22.0——与1.00mL 盐酸标准溶液[c(HCl)=1.000mol/L]相当的以毫克表示的二氧化碳质量。
游离碱度及总碱度的测定

脱脂槽液的化验
1、脱脂槽液定义
总碱度是指水中所含能与酸发生中和作用的全部物质,即能接受质子H+的物质的总量。
游离碱度是指水中所含OH-离子的总量。
2、化验
(1)游离碱度:用移液管取10ml脱脂液于锥形瓶中,加入4—5滴酚酞指示剂,溶液呈粉红色,用0.1mol/L盐酸标准溶液滴定至溶液变为无色时为终点,所消耗滴定液的体积数(ml)即为游离碱度点数。
(2)总碱度:用移液管吸取10ml脱脂液脱脂液于锥形瓶中加入50ml蒸馏水,再加2—3滴溴酚蓝指示剂,用0.1mol/L的盐酸标准溶液滴定至黄色即为终点,所消耗盐酸标液毫升数即为总碱度点数。
十一、磷化槽液的化验
1、定义
总酸度:磷化液中游离酸和化合酸的总和称为总酸度。
游离酸度:磷化液中游离H+的浓度称为游离酸度。
酸消耗:磷化液中所含碱性离子消耗酸的总和称为酸消耗。
2、化验
(1)总酸度:
用移液管取处理液10ml于锥形瓶中,加3—5滴酚酞指示剂,溶液无色,用0.1N氢氧化钠标准溶液滴定至溶液变成粉红色并保持30秒不褪色为终点,这时所消耗的氢氧化钠毫升数即为总酸度的点数。
(2)游离酸度:
用移液管吸取处理液10ml于锥形瓶中,加3―5滴溴酚蓝指示剂,用0.1mol/l的氢氧化钠标准溶液滴定溶液黄色变为蓝紫色为终点,所消耗氢氧化钠标液毫升数即为工作液游离酸度的点数。
(3)酸消耗:
取处理液10ml于锥形瓶中,加2—3滴溴甲酚绿指示剂,用0.1N 的盐酸标准溶液滴定至溶液由蓝色变为绿色为终点,所消耗的盐酸标液毫升数即为酸消耗点数。
(完整版)酚酞指示剂测定水中碱度环境监测第四版

(环境)水质卫生检验方法标准HZHJSZ00130水质碱度总碱度酸碱指示剂滴定法HZ-HJ-SZ-0130水质碱度(总碱度重碳酸盐和碳酸盐)的测定酸碱指示剂滴定法水的碱度是指水中所含能与强酸定量作用的物质总量。
水中碱度的来源是多种多样的地表水的碱度基本上是碳酸盐重碳酸盐及氢氧化物含量的函数,所以总碱度被当作这些成分浓度的总和。
当水中含有硼酸盐磷酸盐或硅酸盐等时,则总碱度的测定值也包含它们所起的作用。
废水及其他复杂体系的水体中还含有有机碱类金属水解性盐类等,均为碱度组成部分。
在这些情况下碱度就成为一种水的综合性特征指标,代表能被强酸滴定的物质的总和。
碱度的测定值因使用的终点pH 值不同而有很大的差异,只有当试样中的化学组成已知时才能解释为具体的物质。
对于天然水和未污染的地表水可直接用酸滴定至pH8.3 时消耗的量为酚酞碱度;以酸滴定至pH 为4.4~4.5 时消耗的量为甲基橙碱度;通过计算可求出相应的碳酸盐重碳酸盐和氢氧根离子的含量。
对于废水污水则由于组分复杂,这种计算无实际意义往往需耍根据水中物质的组分确定其与酸作用达终点时的pH 值,然后用酸滴定以便获得分析者感兴趣的参数并作出解释。
碱度指标常用于评价水体的缓冲能力及金属在其中的溶解性和毒性,是对水和废水处理过程的控制的判断性指标,若碱度是由过量的碱金属盐类所形成,则碱度又是确定这种水是否适宜于灌溉的重要依据。
用标准酸滴定水中碱度是各种方法的基础,有两种常用的方法即酸碱指示剂滴定法和电位滴定法电位滴定法。
根据电位滴定曲线在终点时的突跃确定特定pH 值下的碱度,它不受水样浊度色度的影响适用范围较广用指示剂判断滴定终点的方法简便快速,适用于控制性试验及例行分析,二法均可根据需要和条件选用。
样品采集后应在4 保存分析前不应打开瓶塞不能过滤稀释或浓缩样品应于采集后的当天进行分析特别是当样品中含有可水解盐类或含有可氧化态阳离子时应及时分析。
一原理水样用标准酸溶液滴定至规定的pH 值,其终点可由加入的酸碱指示剂在该pH 值时颜色的变化来判断:当滴定至酚酞指示剂由红色变为无色时溶液pH 值即为8.3 指示水中氢氧根离子(OH-)已被中和,碳酸盐(CO32-)均被转为重碳酸盐(HCO3-) 反应如下OH-+H+H2O=CO32-+H+ +HCO3-当滴定至甲基橙指示剂由桔黄色变成桔红色时溶液的pH 值为4.4~4.5 指示水中的重碳酸盐(包括原有的和由碳酸盐转化成的)已被中和反应如下HCO3+H+=H2O+CO2根据上述两个终点到达时所消耗的盐酸标准滴定溶液的量可以计算出水中碳酸盐重碳酸盐及总碱度。
碱度的测定(容量法)

碱度的测定(容量法)一. 概要水的碱度是指水中含有能接受H+的物质的量。
如OH-、CO32-、HCO3-等,都是水中常见的碱性物质,它们都能与酸进行反应,因此,可用适宜的指示剂以标准酸溶液对它们进行滴定。
碱度可以分为酚酞碱度和甲基橙碱度(即总碱度或全碱度)两种。
酚酞碱度的滴定终点PH约为8.3,甲基橙碱度的滴定终点PH约为4.2,若碱度很小时,甲基橙碱度宜以甲基红---亚甲兰作指示剂,终点PH约为5.0以酚酞作指示剂时,滴定反应如下:OH-+H+===H2O (PH=8.3时,全部完成)CO32-+H+===HCO-(PH=8.3时,全部完成)再以甲基橙作指示剂继续滴定时,反应如下:HCO-+H+=== H2O+CO2(全部完成)二.试剂1.1%(重/容)酚酞指示剂(以乙醇为溶剂)2.0.1%(重/容)甲基橙指示剂3.甲基红—亚甲兰指示剂:准确称取0.1000g甲基红和0.0680g亚甲基兰,在研钵中研摩均匀后,溶于80ml95%乙醇中4.无水碳酸钠5.0.1N、0.05N、0.01N硫酸标准溶液:1).配置:量取3ml浓硫酸(ρ=1.84),缓缓注入1000ml蒸馏水中,冷却,摇匀2).标定:a.0.1N硫酸标准溶液的配制与标定:以碳酸钠作基准:称取0.2g于270---300℃灼烧恒重的基准无水碳酸钠(精确到0.0002g),溶于50ml蒸馏水中,加2滴甲基红—亚甲基兰指示剂,用待标定的0.1N硫酸标准溶液滴定至溶液由绿色变为紫色(PH约为5),煮沸2—3min,冷却后继续滴定至紫色。
同时作空白试验,硫酸标准溶液的当量浓度N按下式计算:N=G/[(V1- V2)×0.05299]式中G---无水碳酸钠的质量,g;V1---滴定碳酸钠消耗硫酸溶液的体积,ml;V2---空白试验消耗硫酸溶液的体积,ml;0.05299---每毫克当量碳酸钠的质量,g;b.0.05N、0.01N硫酸标准溶液的配制与标定:用0.1000N硫酸标准溶液准确的稀释至2倍或10倍制得三.测定方法1.大碱度水样(如锅炉水、冷却水、生水等)的测定方法1)取100ml透明水样注入250ml锥形瓶中2)加入2—3滴1%酚酞指示剂。
如何准确测定化学水中的游离二氧化碳

近年来 石化行业 大力 提倡 挖潜 增效 ,降 低能 耗物耗 ,从 粗放 型管理向科学 化集 约型 管理 迈进 。在 水质 管理 方面 就 引进了 比较科学 的管理模式 ,改变 了过去从 出水 量而简 单核 算 酸耗 碱耗的计算方式 ,而是采用酸碱 耗计算 公式 ,如 :碱耗 = 100%碱质量/[(进水 酸度 +游 离 二氧 化碳 )/44 +SiO2/ 60) 周期制水量 ];酸耗 =100% 酸质 量/[(出水酸 度 +进 水碱度 ) 周期 制水 量 ]来 核 算水 质 处理 过 程 中 的酸耗 碱 耗 ,从 而降低了化学水 的生产成本 ,既保 证 了出水 量 ,又提高 了 水 质 质 量 。在 这 过 程 中 ,需 要 监 测 游 离 二 氧 化 碳 含 量 ,为 了得到准确 的测 定数 据 ,我们 积极 检索 分析方 法 ,通过 实验 确定用 ”固定 法”测定游 离二 氧化碳含量 ,努力 为工艺生产提 供及时 、准确 、可靠 的分析数据 ,把好 产品质量关 。 1 实验 部分 1.1 试 剂 1.1.1 C(NaOH)=0.02mol/L氢氧化 钠 标准 溶液 :配制 符 合 GB/T601—2002标准 1.1.2 C(1/2H SO )=0.02mol/L硫酸标 准溶液 :配制符 合 GB/T601—2002标 准 1.1.3 1% 酚 酞指 示 剂 (乙醇溶 液 ):配 制符 合 GB/T603—
2002
1.1.4 0.1% 甲基橙 指示剂 :配制符合 GB/T603—2002
1.2 仪 器
1.2.1 带有 100mL刻度 的锥形瓶
1.2.2 25mL碱式滴定管
1.2.3 5mL酸式滴定 管
1.3 测定 方 法
.
1.3.1 取 样管上连接一根一端带有有 玻璃管的厚壁胶管 。 1.3.2 打开取样阀 门,放水 不少于 5min,并保 证其无气泡 。 1.3.3 于取样 瓶 中预 先加入 2滴 1% 酚酞指示 剂 和一定 量 的氢氧化钠标准溶 液 。氢 氧化钠 标 准溶 液 的加入 量应 根据
土壤中水溶性CO32-和HCO3-的测定——双指示剂-中和滴定法 (1)
土壤中水溶性CO32-和HCO3-的测定——双指示剂-中和滴定法在盐土中常有大量HCO3-,而在盐碱土或碱土中不仅有HCO3-,也有CO32-。
在盐碱土或碱土中OH-很少发现,但在地下水或受污染的河水中会有OH-存在。
在盐土或盐碱土中由于淋洗作用而使Ca2+或Mg2+在土壤下层形成CaCO3和MgCO3或者CaSO4·2H2O和MgSO4·H2O沉淀,致使土壤上层Ca2+、Mg2+减少,Na+/(Ca2++Mg2+)比值增大,土壤胶体对Na+的吸附增多,这样就会导致碱土的形成,同时土壤中就会出现CO32-。
这是因为土壤胶体吸附的钠水解形成NaOH,而NaOH又吸收土壤空气中的CO2形成Na 2CO3之故。
因而CO32-和HCO3-是盐碱土和碱土中的重要成分。
土壤-Na+ + H2O ↔土壤-H+ + NaOH2NaOH+ CO2 → Na2CO3+ H2ONa 2CO3+CO2+H2O ↔2NaHCO3一、实验目的:了解土壤中水溶性CO32-和HCO3-1的测定原理;掌握水溶性CO32-和HCO3-1的测定方法。
二、实验原理土壤水浸出液的碱度主要决定于碱金属和碱土金属的碳酸盐及重碳酸盐。
溶液中同时存在碳酸根和重碳酸根时,可以应用双指示剂进行滴定。
Na2CO3+HCl= NaHCO3+NaCl (pH8.3为酚酞终点) (1)NaHCO3+HCl=NaCl+CO2+H2O (pH4.1为溴酚蓝终点)(2)由标准酸的两步用量可分别求得土壤中CO32-和HCO3-的含量。
滴定时标准酸如果采用H2SO4,则滴定后的溶液可以继续测定Cl-的含量。
对于质地粘重,碱度较高或有机质含量高的土壤,会使溶液带有黄棕色,终点很难确定,可采用电位滴定法(即采用电位计指示滴定终点)。
三、试剂配制(1)5g·L-1酚酞指示剂:称取酚酞指示剂0.5g,溶于100mL 600mL·L-1的乙醇中。
水质侵蚀性二氧化碳的测定甲基橙指示剂滴定法(精)
HZHJSZ00134 水质侵蚀性二氧化碳的测定甲基橙指示剂滴定法HZ-HJ-SZ-0134水质甲基橙指示剂滴定法天然水中含有的游离二氧化碳2CO2 Ca(HCO3MgCO3十CO2十H2O¾Í»áÈܽâ̼ËáÑÎÕⲿ·ÖÄÜÓë̼ËáÑÎÆð·´Ó¦µÄ¶þÑõ»¯Ì¼侵蚀性二氧化碳对水工建筑物具有侵蚀破坏作用对金属(铁具有强烈侵蚀作用对水体进行侵蚀性二氧化碳的测定有两种常用的方法电位滴定法不受余氯的干扰色度的影响用酸滴定法简便快速如水样的各种碱度和游离二氧化碳已经测定计算法简单快速用虹吸法采样取满瓶水样避免与空气接触加入碳酸钙(CaCO3粉末甲基橙指示剂滴定法水样中的色度可改用电位滴定法测定加入0.1mol/L 硫代硫酸钠溶液l~2滴2 原理水中侵蚀性二氧化碳能与碳酸钙(CaCO3作用其反应如下Ca(HCO32由此以甲基橙为指示剂其反应如下CaCl2+2H2CO3根据滴定到达终点时减去采样当天用同一盐酸标淮溶液滴定(未加碳酸钙粉末的消耗量3 试剂如无说明3.1 碳酸钙(CaCO3粉末3.2 甲基橙指示剂(1g/L3.3 盐酸标准溶液(量取9mL分析纯浓盐酸(ñ注入1000mL容量瓶内此溶液约为0.1mol/L准确称取三份在180每份约0.1~0.15g(称准至0.0001g¼ÓÈë100mL水用盐酸标准溶液滴至溶液出现淡桔红色为止标定同时作一空白滴定按下式计算盐酸标准溶液的浓度1000/52.995c盐酸标准溶液浓度(mol/LW无水碳酸钠的重量(g3.4 盐酸标准滴定液(将0.1mol/L盐酸标准溶液稀释4倍即得4 仪器4.1 25mL酸式滴定管4.3250mL锥形瓶加入0.1%甲基橙指示剂3滴用盐酸标准溶液滴至溶液由桔黄色变为淡桔红色为止5.2用虹吸法采样于500mL具塞水样瓶中(吸管插入采样瓶底加入碳酸钙粉末约3gÎðʹƿÖвúÉúÆøÅÝ5.3 将加入碳酸钙粉末的水样放置5天5.4 5天后用慢速滤纸过滤然后吸取100mL滤液于250mL锥形瓶中用盐酸标准溶液记录其用量(V2mg/LV2-V122c盐酸标准滴定液浓度(mol/LV2五天后(加过碳酸钙粉末滴定时所消耗的盐酸标准滴定液用量(mL 22侵蚀性二氧化碳(1/2CO2的摩尔质量(g/mol°²»ÕÊ¡ÇøºÓË®自来水湖水瓶装矿泉水等17种水样的分折含侵蚀性CO20~86.68mg/L变异系数0~15.09注意事项应使用10mL微量滴定管滴定V1或V2(3 应在打开水样瓶后立即进行滴定以防止气体溶入易被微生物分解使结果偏高振荡6h的方法来消除影响勿使碳酸钙粉末漏入滤液中水和废水监测分析方法水和废水监测分析方法中国环境科学出版社1997。
二氧化碳结合力测定滴定法
六、方法学评价
1.
本方法准确度:不准确度应 ≤20%精确度较低、只能作为对照 测定或急诊、手术应急。 2. 方法有比色法和滴定法两种。 3、终点不易准确判断 4、受样本保存时间限制 5、操作简便
七、全自动生化分析仪的 使用
1.静脉采血 2.血清制备 3.检测项目 4.上机操作
CO2-CP表示呼吸和代谢两方面的综 合结果。在代谢性酸碱平衡失调时,它 能及时地反映体内碱储备的增减变化。 在呼吸性酸碱平衡失调时,必须在肾以 NH 2 或H+形式增加或减少算得排出,对 回吸收HCO2 做出相应代偿反应时,方能 表现出体内碱储备 HCO2 的变化,因而 CO2-CP不能及时反映血中CO2的急剧变 化。对伴有通气障碍而发生的酸碱平衡 失调的判断,其实用价值受到限制。
3.检测项目
TP
G ALB
4、全自动生化分析仪的操作
全班分为两个实验组上机操作。
重度代谢性酸中毒CO2-CP <14.47 mmol/L(<30 容积%),极度代谢性酸中毒CO2-CP <4.49 mmol/L(<10容积%)。CO2-CP下降与BUN增高呈 负相关。 ⑵呼吸性碱中毒:脑溢血、肺炎、支气管哮喘、 癔病等因换气过度,使CO2排出过多而降低。 2、CO2-CP增高 ⑴代谢性碱中毒:各种原因引起的剧烈呕吐, 如急性胃炎、幽门梗阻、胃痉挛、妊娠呕吐等, 使酸根大量丢失导致CO2-CP增高。 ⑵呼吸性酸中毒:慢性支气管炎、阻塞性肺气 肿、广泛性肺纤维化、慢性肺心病等所致通气和 换气功能障碍,均可引起增高。
0.5 测定管所耗0.01mol/ LNaOH量(ml) = 0.5 标准管所耗0.01mol / LNaOH量(ml) ×25.0
三、参考值:
如何准确测定化学水中的游离二氧化碳
如何准确测定化学水中的游离二氧化碳
胡玉苗
【期刊名称】《山东化工》
【年(卷),期】2016(45)10
【摘要】游离二氧化碳的含量是化学水装置的一项重要工艺参数,如何选择适当的分析方法准确测定游离二氧化碳尤为重要.测定方法有直接法和固定发两种,通过实验决定选用”固定法”测定化学水中游离二氧化碳含量,此方法灵敏度较高,滴定终点颜色易于判断,适于现场控制分析.
【总页数】3页(P42-43,47)
【作者】胡玉苗
【作者单位】中韩石化武汉乙烯,湖北武汉430000
【正文语种】中文
【中图分类】TM621.8
【相关文献】
1.水中游离二氧化碳与碳酸盐零共存现象研究 [J], 宋树成;郭如侠
2.总有机碳分析仪测定水中的游离二氧化碳 [J], 滕明德;徐磊;高庚申;尹亚茹
3.水中侵蚀性二氧化碳大于游离二氧化碳的原因分析 [J], 许慧云
4.不同化学试剂脱除淡盐水中游离氯的研究 [J], 霍文兰;王建国;霍孔孔;白妮
5.试论海水中游离氨基酸(DFAA)的生物化学行为及其示踪作用 [J], 黄丽东;吴瑜端
因版权原因,仅展示原文概要,查看原文内容请购买。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
HZHJSZ00132 水质游离二氧化碳的测定 酚酞指示剂滴定法
HZ-HJ-SZ-0132
水质酚酞指示剂滴定法
二氧化碳(CO2)在水中主要以溶解气体分子的形式存在
通常将二者的总和称为游离二氧化碳
以及水生物的呼吸作用因此其含量的测定
地表水中游离二氧化碳的含量一般小于10mg/L表明水体污染已影响到鱼类的生长
某些矿泉水中含量较高
即酚酞指示剂滴定法和电位滴定法色度的影响用酚酞指示剂滴定法简便快速控制和例行检验工作还有图解法
用虹吸法采样特别当样品中含有可水解盐类或含有可氧化态阳离子时如果现场测定困难并在低于取样时的温度下妥善保存不能过滤并尽快地测定
不适用于含有酸性工矿废水和酸再生阳离子交换器的出水
有色均干扰测定如水样的矿化度高于1000mg/L
会对测定产生干扰
以消除干扰铜氨亚硝酸盐硅酸盐
2 原理
由于游离二氧化碳(CO
2
CO
NaHCO3
H2CO
NaHCO3十H2O
当其到达终点时故可选用酚酞作指示剂
可计算出游离二氧化碳的含量
用蒸馏水或去离子水冷却至室温电导率小于2ìS/cm
称取1g酚酞然后用0.1mol/L氢氧化钠溶液滴至出现淡红色为止
终点标准比色液称取碳酸氢钠(NaHCO3)8.401g于少量水中稀释至标线加入酚酞指示剂4滴作为滴定时比较终点颜色用
溶于100mL水中用0.1mol/L 盐酸溶液滴至溶液红色刚刚消失为止
1
2
3.5 氢氧化钠标准溶液 称取60g 氢氧化钠
冷却后移入聚乙烯细口瓶中
而后吸取上层澄清溶液1.4mL
此溶液约为0.01mol/L
标定方法如下
烘至恒重每份约0.1g(称准至0.0001g)加入100mL 水
然
后加入4滴酚酞指示剂记下氢氧化钠标准溶
液的用量(mL)
c = G V 式中 V 滴定时氢氧化钠标准溶液用量(mL)
204.22邻苯二甲酸氢钾(KH 4C 4H 4O 4)摩尔质量(g/mol)
25mL
4.2 无分度吸管为了在量取水样时不致于损失游离二氧化碳
量取水样时
待水样灌满吸管取下吸管待吸管中水样
到达刻度处
图1 隔绝CO2的滴定管装置
图2 隔绝CO2的移液管装置
4.3 锥形瓶 5 操作步骤
按图2用虹吸法移取水样100mL
加入4滴酚酞指示剂
小心振荡均匀
则说水样中不
含CO 2
即迅速向滴定管中加入氢氧化钠标准溶液进行滴定
即为滴定终点)
6 结果计算
游离二氧化碳(CO 2c 44
c 氢氧化钠标准溶液浓度(mol/L)
V
滴定时所取水样体积(mL)
7 精密度和准确度
本方法用于河水(黄河福建省区河水)水库水
矿泉水
测得其浓度范围
室内
标准偏差0.06~8.39
注意事项
移取和滴定时操作尽量快速以免引起误差
选用不同浓度的氢氧化钠标准溶液
宜用0.01mol/L氢氧化钠标准溶液应采用0.05mol/L氢氧化钠标准溶液
发现有浑浊现象或含大量铝离子可另取水样于滴定前加入中性酒石酸钾钠溶液1mL
(4) 分析中均采用无二氧化碳水
水和废水监测分析方法水和废水监测分析方法
中国环境科学出版社1997
3。
