钯催化的偶联反应
钯催化胺化偶联反应(一):溴代芳烃的胺化
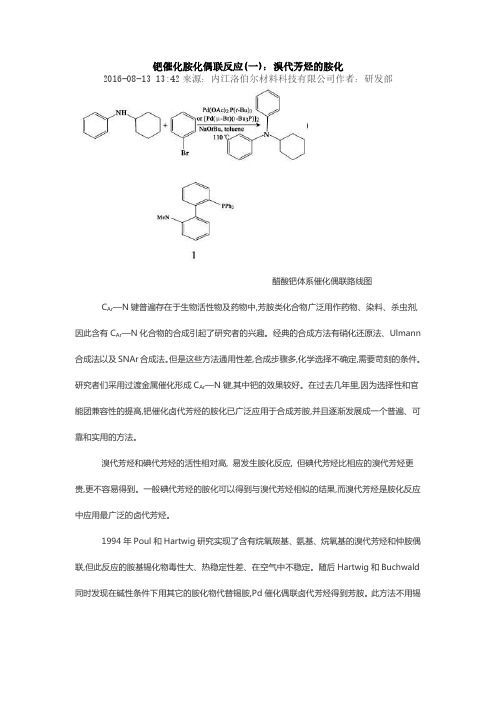
钯催化胺化偶联反应(一):溴代芳烃的胺化2016-08-13 13:42来源:内江洛伯尔材料科技有限公司作者:研发部醋酸钯体系催化偶联路线图C Ar—N键普遍存在于生物活性物及药物中,芳胺类化合物广泛用作药物、染料、杀虫剂,因此含有C Ar—N化合物的合成引起了研究者的兴趣。
经典的合成方法有硝化还原法、Ulmann 合成法以及SNAr合成法。
但是这些方法通用性差,合成步骤多,化学选择不确定,需要苛刻的条件。
研究者们采用过渡金属催化形成C Ar—N键,其中钯的效果较好。
在过去几年里,因为选择性和官能团兼容性的提高,钯催化卤代芳烃的胺化已广泛应用于合成芳胺,并且逐渐发展成一个普遍、可靠和实用的方法。
溴代芳烃和碘代芳烃的活性相对高, 易发生胺化反应, 但碘代芳烃比相应的溴代芳烃更贵,更不容易得到。
一般碘代芳烃的胺化可以得到与溴代芳烃相似的结果,而溴代芳烃是胺化反应中应用最广泛的卤代芳烃。
1994年Poul和Hartwig研究实现了含有烷氧羰基、氨基、烷氧基的溴代芳烃和仲胺偶联,但此反应的胺基锡化物毒性大、热稳定性差、在空气中不稳定。
随后Hartwig和Buchwald 同时发现在碱性条件下用其它的胺化物代替锡胺,Pd催化偶联卤代芳烃得到芳胺。
此方法不用锡试剂,扩展了反应底物的范围,对芳胺化学的发展起到了重要作用,也因此确定了碱存在下胺和卤代芳烃的催化偶联这一基本要素。
P(o-tolyl)3是最早使用的有效配体,但它是单膦配体,其中间化合物易与伯胺发生β-H消除,产生芳烃副产物,因此不适用于溴代芳烃与伯胺的反应。
而双齿二膦配体BINAP能减少β-H消除,它与Pd2(dba)3的络合物对于伯胺和溴代芳烃的偶联具有很高的活性。
电中性、缺电性,甚至是邻位有取代基的富电子溴代芳烃都能与伯胺偶联,如4-溴-3-甲基苯甲醚与n-己烷的胺化反应。
三芳基膦配体Xanphos也能有效催化缺电子和富电子的溴代芳烃与伯链胺的偶联。
钯催化suzuki反应的应用

钯催化suzuki反应的应用全文共四篇示例,供读者参考第一篇示例:钯催化Suzuki反应是有机合成领域中一种重要的反应。
它的原理是通过钯催化剂将芳基卤代烃和烯基硼酸酯在碱性条件下偶联成为一个新的芳烃产物,并且在反应中不需要高温条件。
钯催化Suzuki反应的重要性在于其高效性、高选择性和较温和的条件。
这种反应通常在水溶液中进行,无需特殊的溶剂,也不产生过多的副反应产物。
它在有机合成中具有广泛的应用前景。
钯催化Suzuki反应在药物合成领域中得到了广泛的应用。
因为其反应条件温和,适用于多种官能团和取代基的底物,使得其在制备药物中得到了广泛的运用。
盐酸多沙酮是一种镇痛药物,它的合成就可以通过Suzuki反应来进行反应。
这种反应可以在较低温度下实现,避免了不必要的副反应,保证了产物的纯度和收率。
钯催化Suzuki反应在材料科学领域也有着重要的应用。
如现在许多有机光电材料的合成中,往往需要进行取代基的控制,以调控其电荷传输和光学性质。
而Suzuki反应由于其高效性和高选择性,成为了制备这类材料的理想选择。
比如多芳基硼酸酯与卤代芳烃的Suzuki反应可以用于合成聚合物和有机光电材料。
钯催化Suzuki反应在农药和化工领域也被广泛应用。
许多农药和化工原料都是通过有机合成来得到的,而Suzuki反应因其高效、高选择性的特点,成为了这些产物合成中的一种重要方法。
比如一些农药的前体物合成中,就需要用到Suzuki反应。
一些高端化工产品的合成中,也离不开Suzuki反应的帮助。
钯催化Suzuki反应是一个非常重要的有机反应,它的应用范围涵盖了许多领域。
它的高效性、高选择性和温和条件使得它成为了有机合成领域中不可或缺的工具。
随着有机化学和材料科学的发展,相信Suzuki反应会有更广泛的应用,并为人类的生活和科学研究带来更多的帮助。
第二篇示例:钯催化Suzuki反应是一种重要的有机合成方法,广泛应用于药物合成、材料科学和化学生物学等领域。
有机合成钯催化交叉偶联反应

有机合成中钯的催化交叉偶联反应20102401046吴健华摘要:2010年诺贝尔化学奖授予给美国化学家理查德·赫克、日本化学家根岸英一和铃木章,以表彰其发现的钯催化交叉偶联反应,更有效的连接碳原子以构建复杂分子。
钯催化交叉偶联反应,用于碳碳键形成的重要化学反应,因其反应条件温和,化学选择性高,副产品少,在有机合成领域中应用广泛。
本文综合概述了钯催化交叉偶联反应机理与发展,并对其应用领域及发展前景作简单介绍。
关键词:钯催化;交叉偶联反应;反应机理;碳碳键;有机合成;引言:碳是构成生命体的重要组成物质,而这些物质是以C-C单键或双键为基础,形成各种形式的碳胳化合物,组成生命体的各个部分。
而经过多年来的探究与改进,美国化学家理查德·赫克、日本化学家根岸英一及铃木章在有机合成中取得重大贡献与研究进展,发现钯催化交叉偶联反应,有效地连接碳原子,为构造更复杂的分子提供反应方法。
因此于2010年,诺贝尔化学奖颁发给他们三位在有机合成中杰出并取得重大贡献的有机化学家,以表彰他们在有机合成领域中所取得的卓越成就。
钯催化交叉偶联反应,作为五个被授予诺贝尔化学奖反应之一,其重要性则不言而喻。
前四个反应分别是Grignard反应(格氏反应,1912年),Diels-Alder反应(迪尔斯-阿尔德反应,1950年),Wittig反应(叶立德、维蒂斯反应,1979年)和Olefinmetathesis反应(烯烃的转位反应,2005年)。
在钯催化的交叉偶联反应中,反应步骤缩短,所需条件温和,副产品少,且可使大量的官能团在进程中得以保留而不被破坏,是一种可靠、实用的工具,广泛应用于精细化学及制药工业中, 对有机合成具有长久和深远的影响力,得到合成化学者的普遍应用。
一、钯催化交叉偶联反应机理与发展1.格氏试剂——拉开钯催化交叉偶联反应的序幕有机合成化学所构造出来的物质大部分都是以碳胳为骨架所构建起来的,然而碳原子本身十分稳定,在化学反应中并不活泼。
hiyama交叉偶联反应

hiyama交叉偶联反应Hiyama交叉偶联反应是一种重要的有机合成方法,可以用于构建碳-碳键和碳-硅键。
该反应以有机卤化物和有机硅试剂为底物,在催化剂的作用下进行反应,生成交叉偶联产物。
本文将介绍Hiyama交叉偶联反应的原理、应用和研究进展。
一、Hiyama交叉偶联反应的原理Hiyama交叉偶联反应是由日本化学家Hiyama于1988年首次报道的。
该反应属于钯催化的交叉偶联反应,以有机卤化物和有机硅试剂为反应底物,在钯催化剂的作用下,发生碳-硅键的形成。
催化剂通常采用钯配合物,如[Pd(PPh3)4]、Pd2(dba)3和[PdCl2(dppf)]等。
有机硅试剂可以是硅醚、硅酮、硅酸酯等。
在反应中,有机卤化物首先与钯催化剂形成配合物,然后发生氧化加成,生成中间产物。
接着,有机硅试剂与中间产物发生还原消除,生成交叉偶联产物。
整个反应过程中,钯催化剂起到了关键的催化作用,促进了反应的进行。
二、Hiyama交叉偶联反应的应用Hiyama交叉偶联反应在有机合成中具有广泛的应用价值。
首先,该反应可以用于构建碳-碳键。
有机卤化物可以是烷基卤化物、芳基卤化物等,有机硅试剂可以是芳基硅试剂、烷基硅试剂等。
通过Hiyama交叉偶联反应,可以将不同的有机基团连接在一起,构建复杂的有机分子骨架。
Hiyama交叉偶联反应还可以用于构建碳-硅键。
有机硅试剂可以是含有硅醚、硅酮等官能团的化合物,通过与有机卤化物的反应,可以在分子中引入硅基团。
硅基团在有机合成中具有重要的应用,可以参与到后续的反应中,进一步改变分子的性质。
Hiyama交叉偶联反应还可以用于天然产物的合成。
很多天然产物中含有复杂的碳-硅键结构,通过Hiyama交叉偶联反应,可以高效地合成这些天然产物的类似物。
这对于药物研究和化学生物学研究具有重要意义。
三、Hiyama交叉偶联反应的研究进展近年来,研究人员对Hiyama交叉偶联反应进行了深入的研究,不断改进反应条件和催化剂体系,提高反应的效率和选择性。
钯催化的反应总结

钯催化的反应总结引言钯(Palladium,Pd)是一种常见的过渡金属催化剂,它在有机合成中有着广泛的应用。
由于钯具有良好的催化活性、选择性和功能多样性,钯催化反应已成为有机合成领域备受关注的重要研究方向之一。
本文将对钯催化的一些重要反应进行总结,以便更好地了解和应用这些反应。
催化剂的选择在钯催化反应中,催化剂的选择起着至关重要的作用。
常见的钯催化剂包括[Pd(PPh3)4]、Pd(PPh3)2Cl2、Pd(OAc)2等,这些催化剂具有良好的催化性能和稳定性。
此外,还可以通过对催化剂进行配体修饰来改变其催化性能,如引入膦配体、氨基配体等。
钯催化的碳-碳键形成反应1. Heck反应Heck反应是钯催化的一个重要的碳-碳键形成反应,它通过亲电性或亲核性的烷基化试剂与不饱和化合物间的交叉偶联,在构建碳-碳键的同时保留官能团的特点。
通常情况下,该反应需要碱的存在,并在乙酸盐氛围中进行。
Heck反应适用于合成各类芳香烃、乙烯烃、酮类等化合物。
2. Suzuki-Miyaura偶联反应Suzuki-Miyaura偶联反应是钯催化的另一个重要的碳-碳键形成反应。
该反应利用有机硼酸酯与卤代化合物在碱的存在下进行交叉偶联,生成对应的芳香烃。
Suzuki-Miyaura偶联反应具有底物宽容性和功能团兼容性高的优点,被广泛应用于有机合成中。
钯催化的碳-氮键形成反应1. Buchwald-Hartwig氨基化反应Buchwald-Hartwig氨基化反应是钯催化的一种重要的碳-氮键形成反应,可以将芳香或烯丙基溴化物与氨或胺类化合物发生反应,生成相应的胺化物。
该反应具有反应条件温和、底物宽容性好的特点,被广泛应用于药物合成和天然产物的合成等领域。
2. Sonogashira偶联反应Sonogashira偶联反应是钯催化的一种重要的碳-氮键形成反应,它通过芳香溴化物或卤代烯烃与炔烃发生偶联反应,生成相应的炔烃衍生物。
Sonogashira偶联反应具有底物宽容性好、反应条件温和的特点,被广泛应用于有机合成中。
浅议钯催化的偶联反应

图 3 Suzuki 偶联及其反应机理
由于 Suzuki 偶联反应条件温和,可以在水中进 行,原料低毒易得,区域选择性好等诸多优点,该反 应获得了广泛的认同和应用,随着水相反应、微波合 成、固相合成等绿色合成方法的发展,该反应在材料 合成及 天 然 产 物 的 合 成 中 获 得 了 更 为 广 泛 的 应 用[5]。 3 Negishi 偶联反应
参考文献
[1] HeckR F . Acylation ,methylation ,and carboxyalkylation of olefins by group VIII metal derivatives [J ]. J Am Chem Soc,1968,90 ( 20) : 5518 - 5526.
( 本文文献格式: 何 林,杜广芬,顾承志,等. 浅议 钯催化的偶联反应[J]. 山东化工,2011,40( 11) : 55 - 58. )
Heck 偶联、Suzuki 偶联、Negishi 偶联反应是有 机合成中最常用的碳 - 碳键形成反应,经过几十年 的发展,这类钯催化的偶联反应适用范围广,用途广 泛,将诺贝尔化学奖授予钯催化偶联反应的重要发 现者,也充分说明了这类反应的重要意义。当然,钯 催化的反应还有很多工作要做,比如活泼性差的羧 酸酯参与的偶联反应,最近北大施章杰小组已经取 得重要进展[10],再如活泼性差的氯代烃参与的偶联 及不对称偶联反应,还需要做大量的工作。
图 4 Negishi 偶联反应
Negishi 偶联反应的机理与 Suzuki 偶联反应极 其类似,同样经过氧化加成、转金属化、还原消除三 个主要的步骤。与 Heck 偶联和 Suzuki 偶联不同的
Pd催化的偶联反应-MA070818

反应完后通常加入稀盐酸酸化直接高收率地得到芳基硼酸酯。
RLi
+
B(OPri)3
HCl
ArB(OPri)2
7
2. 有机硼试剂的合成
通过Grinard试剂制备单取代芳基硼酸示例
F Mg F F Br Et2O THF F Patent EP1191008 A1 B(OMe)3 F B(OH)2 F
通过有机锂试剂制备单取代芳基硼酸示例
MeOOC N Br + O2N B(OH)2 Pd(PPh3)4 aq. Na2CO3 benzene N J . Org. Chem. 1984, 49, 5237. MeOOC
NO2
3-吡啶基二乙基硼烷是一个对空气和水份稳定的化合物, 可以用来作杂环的芳化反应。
MeOC N Br + N BEt2 Pd(PPh3)4 aq. NaOH,/ Bu4NCl THF Synthesis 1984, 936. MeOC N N
19
3. Suzuki偶联的应用
3.5 烷基硼酸参与Suzuki偶联反应
对于芳基卤和甲基硼酸(酯)参与的Suzuki反应, 收率一般都很 低。一个改进的方法是用剧毒的TlOH或Tl2CO3作碱, Suzuki反应 的收率有所提高。近来有报道用甲基三氟硼酸钾代替甲基硼酸, 取得了较好的结果。这种方法突出的优点是试剂易于制备, 对空 气稳定, 并且用于Suzuki偶联反应一般可以得到较好的结果。
OH Br MeO2 C F B OH Pd(dppf)Cl2 Na2CO3, DCM, reflux MeO2C Patent; US2002/55631 A1 (2002/05/09) F
18
3. Suzuki偶联的应用
heck偶联反应条件

heck偶联反应条件
"偶联反应"是指两个或多个有机分子通过一个键的形成或破坏
相互连接在一起的化学反应。
常用的偶联反应有Suzuki 偶联、Stille 偶联、Heck 偶联等。
Heck 偶联是指芳香卤代烃与烯烃通过钯催化产生芳香烃的反应。
Heck 偶联反应的条件如下:
1. 反应物:通常需要有一个芳香卤代烃和一个烯烃作为反应物。
2. 催化剂:常用的催化剂是钯(Pd)催化剂,如PdCl2(PPh3)2、Pd(OAc)2等。
3. 配体:在钯催化剂中,常需添加配体,如三苯基膦(triphenylphosphine)。
4. 碱:碱的添加可以提高反应速率,常用碱有碳酸钠
(Na2CO3)、碳酸钾(K2CO3)等。
5. 溶剂:反应通常在有机溶剂中进行,如二甲基甲酰胺(DMF)、乙酸乙酯(EtOAc)等。
6. 温度和时间:具体的反应条件可根据反应物的性质和反应类型进行调控,一般情况下室温至高温(50-100°C)下反应2-24小时。
需要注意的是,不同的反应物和催化剂可能需要不同的反应条
件。
因此,在进行Heck 偶联反应时,需要具体的实验条件和参考文献。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
AgNO3/KF作用下的Pd催化2-溴噻吩S原子邻位上的C-H键选择性偶联反
应
摘要:
溴噻吩的衍生物与芳基碘在加入了钯的硝酸银/氟化钾催化剂的催化下发生C—H键的偶联反应,而C—Br键未发生变化。
这些含有C —Br键的偶联产物在钯的进一步催化下使溴噻吩和芳基碘的C—C键相连接从而得到理想的产量。
引言:
狭义上的偶联反应是涉及由基金属催化剂的C-C键生成的反应,根据类型不同,可分为交叉偶联反应和自身偶联反应。
交叉偶联反应是一个有机分子与另一有机分子发生的不对称偶联反应。
例如:烯丙基锂与2-氯辛烷可以发生交叉偶联反应生成4-甲基-1-癸烯。
格利雅试剂、有机铝、有机锌、有机锡、有机铜、有机铅、有机汞等多种有机金属化合物也都可以与卤化烷等烃基化试剂发生交叉偶联反应,生成相应的不对称烃,是合成不对称烃,特别是单烷基芳烃和含有三级碳原子的链烃的有效方法。
交叉偶联反应的范围很广,像芳烃重氮盐与苯酚或N,N-二甲基苯胺的偶联反应,也属于交叉偶联反应。
正文:
芳香族化合物与有机卤化物的C-H键取代反应和那些含金属试剂与相同的有机卤化物的偶联反应相比,在有机合成中更有前景。
【1】相比之下,C-H键上的直接反应将有利于含有不同种类的官能团的衍生物的合成,并且,反应也会加强合成中原子的效应。
我们注意到噻吩衍生物的偶联反应是发生在C-H键上,从而形成了联噻吩。
在添加了AgF后,反应效率得到了提高。
【2】当噻吩与2-溴噻吩反应生成正联溴噻吩时,仍然是C-H键发生偶联,而C-Br键未发生变化。
我们的注意力集中到溴噻吩衍生物C-H键的交叉耦合上,来介绍噻吩环上的取代基。
【3】溴噻吩上的C-H键偶联,如果可以通过C-Br键的反应而进一步改变偶联产物,那么C-H键和C-Br键的偶联反应的相互结合将得到一种新的合成取代噻吩的方法。
这将把人们的注意力都吸引到设计更先进的有机金属材料来揭示液晶、光发射和有机半导体的特点。
【4】在此,我们报告一个新的催化剂系统—AgNO3/KF,它有助于提高钯催化下溴噻吩衍生物C-H键的取代反应发的效率。
2-溴噻吩与对甲氧基碘苯的反应在添加了钯催化剂的含AgF的条件下进行。
在60℃的条件下搅拌5小时后,将得到占总产物50%的正偶联产物。
类似的反应如用AgNO3/KF来替代AgF,将会得到占总产物42%的上述产物。
值得注意的是尽管最后的终产物是适度的,我们并没有发现C-Br键上有反应发生,而是在溴噻吩的与S原子相邻的C-H 键上有反应发生。
噻吩衍生物的芳基化反应是在钯和体积较大的磷化氢配合基的混合物催化下在150℃利用Cs2CO3作为碱的反应条件下
进行的。
【5】然而,含有芳环的噻吩衍生物上的C-Br键是无法在这种反应条件下稳定存在的。
1.
尽管人们想通过提高的反应温度和加长反应周期来提高产量,但是效果并不明显,2-溴-5-(4-甲氧基苯)噻吩的产量并未得到提高。
但是,假如大量的AgNO3 显著地提高产量。
实际上,2,3-2溴噻吩和对甲氧基碘苯反应,当AgNO3/KF以1:2的比例分4次加入时,并且每次搅拌2小时,反应产量将提升到83%。
进一步的优化显示,当AgNO3/KF以1:4的比例分5次加入时,并且每次搅拌1小时,将得到占总产物87%的终产物。
此外,加入TBAF作为DMSO的溶剂5小时以上,产率将得到提高。
由以上及结果我们可以知道,AgNO3和KF反应生成的AgF被光或者热降解。
因此,如果反应不能在一个合理的反应速率和反应条件下进行,较长的反应时间并不能得到较多的产物。
表1. 2-溴噻吩,2,3-2溴噻吩和对甲氧基碘苯的反应
我们通过研究芳香族化合物的反应来研究某些溴噻吩衍生物。
结果如表2.所示。
研究发现2-溴噻吩和2,3-2溴噻吩与许多含给电子基或吸电子基取代物的碘代芳香烃反应可以得到最理想的产量。
除此之外,3-甲基-2-溴噻吩,5-溴-2,2’-噻吩以及2,4-2溴噻吩也可以进行上述反应。
当反应没有有效地进行时,AgNO3 的部分加成同样可以提高C-H键的取代反应的产量。
当与含有吸电子基的碘代芳香烃例如4-氰基碘苯烷反应可以得到较理想的产量。
2-碘萘同样可以发生偶联反应,可以得到理想的产物。
表2.
AgNO3/KF催化系统以及它的部分加成,被发现对自偶联反应同样有效。
2—溴噻吩在含有钯催化剂和AgNO3/KF的条件下,可以得到81%产量的并噻吩,其中AgNO3/KF是分两次加入的。
与直接加入AgF相比,使用成本较低的AgNO3和KF混合试剂,对进行高效的自偶联反应来说,效果更加显著。
(图2.)
图2.
尽管自偶联反应和交叉偶联反应在芳基碘的存在下,两者是相互竞争的。
在表2.A方法的条件下,溴噻吩和芳基碘发生反应,并没有观察到自偶联现象。
正如我们之前所说的,尽管加入了相同的试剂,这些反应是完全不同的。
AgNO3/KF在自偶联反应中提供了Ag,而AgI是在交叉偶联反应中得到的。
钯与芳基碘反应形成芳基-钯-碘的速率快于钯与AgF 反应生成PdF2的速率。
用2-乙醇胺【6】作为活化剂的1-辛炔进行的Sonogashira偶联反应得到较为理想的产物5和与进行Mizoroki-Heck【7】反应的丙烯酸乙酯得到的产物6如图3所示。
图3.
Pd/Cu混合催化剂催化的末端炔烃与sp2型碳的卤化物之间的交叉偶联反应通常被称之为Sonogashira 反应,是一个很重要的人名反应。
赫克反应(Heck反应)也称沟吕木-赫克反应(Mizoroki-Heck反应),是不饱和卤代烃(或三氟甲磺酸酯)与烯烃在强碱和钯催化下生成取代烯烃的偶联反应。
它得名于美国化学家理查德•赫克和日本人沟吕木勉,赫克凭借此贡献得到了2010年诺贝尔化学奖。
结论:
钯催化的溴噻吩衍生物的芳基化反应,是在与S原子相邻的 C-H 键上所发生的,而C-Br键上根本不会发生偶联反应。
这种不影响Br 官能团的C—H键的芳基化反应,是由钯所催化完成的。
与其他形式的C-H键芳基化反应相比,该反应使用到了AgNO3/KF混合物来促进反应进行。
因为最后的终产物仍然含有C-Br键,进一步的过渡态金属催化的成键反应,例如与主族试剂、端炔烃、活化或非活化双键发生交叉偶联反应,这些都是可行的。
引用文献:
【1】:Metal-Catalyzed Cross-Coupling Reactor; Diederich, F,.Stang, P. Jed’s; Wiley-VCH
【2】:Maria; Sekiguchi Am Chem. Soc.2003, 125, 1700 【3】:Masui, K; Mori, A Am. Chem.Soc.2004. 126, 5074 【4】:Masui, K; Mori, A; Okano,K; . Lett. 2004, 6, 2011 【5】:Yokooji,A.; Satoh, T.; M.Tetradron 2004 60, 6757 【6】:Mohamed Ahmed, M.S A.Bull. Chem. Soc. Jpn.2005 78, 160 【7】:Mizoroki, T. Bull. Chem. Soc. Jpn.1971 44, 581; Heek, R.F J. Org. Chem.1972, 37, 2320。
