武汉大学版无机化学课后习题答案--14氮族元素
氮族元素习题及答案

第十五章氮族元素一选择题 1. 氮气制备的方法是() A.将硝酸氨NHNO加热 B. 将亚硝酸氨NHNO加热 4342 C.将氯气与氨气混合 D. B和C 2. 下列化合物中与水反应放出HCl的是() A. CCl B. NCl C. POCl D.ClO 433273. NO溶解在NaOH溶液中可得到() 2A. NaNO和HO B. NaNO、O和HO 22222C. NaNO、NO和HO D. NaNO、NaNO和HO 3252322 4. 硝酸盐加热分解可以得到单质的是() A. AgNO B. Pb(NO) C. Zn(NO) D. NaNO 332323 5. 下列分子中具有顺磁性的是()A. NOB. NOC. NOD. NO 22234 6. 下列分子中,不存在离域键的是() (吉林大学《无机化学例题与习题》) 3 A. HNO B. HNO C. NO D. N322 3 7.分子中含d—p反馈键的是() (吉林大学《无机化学例题与习题》) A. HNO B. HNO C. HPO D. NH 32323 8. 下列物质中酸性最强的是() A. NH B. NHOH C. NH D. HN 242 33 9. 下列酸中为一元酸的是() (吉林大学《无机化学例题与习题》) A. HPO B. HPO C. HPOD. HPO 427323334 10. 下列各物质按酸性排列顺序正确的是()(吉林大学《无机化学例题与习题》) A. HNO>HPO>HPO B. HPO>HPO>HNO 234427427342C. HPO>HNO>HPO D. HPO>HPO>HNO 427234344272 11. 下列物质中,不溶于氢氧化钠溶液的是()(吉林大学《无机化学例题与习题》) A.Sb(OH) B. Sb(OH) C. HAsO D. Bi(OH) 35343 12. 加热分解可以得到金属单质的是() (吉林大学《无机化学例题与习题》) A. Hg(NO) B. Cu(NO) C. KNO D. Mg(NO) 323233213. NHNO受热分解产物为() 43 A. NH+HNO B. N+H OC. NO+HOD. NO+HO 3222222 14. 下列物质中受热可得到NO的是() 2A. NaNO B. LiNO C. KNO D. NHNO 33343 15. 下列氢化物中,热稳定性最差的是() A. NH B. PH C. AsH D. SbH 3333 16. 遇水后能放出气体并有沉淀生成的是()(吉林大学《无机化学例题与习题》) A.Bi(NO) B. MgN C. (NH)SO D. NCl 32324243 17. 下列物质均有较强的氧化性,其中强氧化性与惰性电子对有关的是()A. KCrO B. NaBiO C. (NH)SO D. HIO 2273422856 18. 下列化合物中,最易发生爆炸反应的是() A.Pb(NO) B. Pb(N) C. PbCOD. KCrO 32323 24 19. 欲制备NO气体,最好的实验方法是() A. 向酸化的NaNO溶液中滴加KI溶液 2 B. 向酸化的KI溶液中滴加NaNO溶液 2-3C.Zn粒与2mol·dmHNO反应 3 D. 向双氧水中滴加NaNO溶液220. N和CH分子中都含有键,但的化学性质不活泼。
第十六章氮族元素课后习题参考答案

第十六章氮族元素课后习题参考答案1解:(1)由于N的原子半径太小,其平均负电密度(电子云带负电)大,则N与N原子之间斥力增大使得N-N键键长增长,键能减小而小于P-P键。
形成三键时,因N原子半径小,则两个N原子的P轨道肩并肩重叠比磷原子的更有效,所以N≡N三键键能高于P≡P三键。
(2)由于N原子半径小,且最外层只有四条价轨道,最多只能形成四个共价键,所以无五卤化物存在。
(3)根据分子轨道理论,NO分子最后一个电子填充在反键的π*2py轨道上,其轨道能量相对较高,比较容易失去电子,第一电离能小。
而N原子的结构为1s22s22p3,属于半满状态,失去电子会较困难,所以第一电离能就较高。
2解:(1)把混合气体通过装有P2O5的干燥器(或浓H2SO4),则NH3会被吸收而得到纯氮气;而把混合气体通过装有CaO(或KOH)的干燥器,(但不能使用CaCl2)则可除去水气而得到干燥的氨气。
(2)为除去NO中微量的NO2,可把该气体通过水(或者碱液),则NO2被吸收,然后再通过浓H2SO4,则可获得干燥的NO气体;为除去N2O中少量的NO,可把该气体通过FeSO4溶液,则NO可被吸收除去。
3解:由反应:NH3 + H2O == NH4+ + OH-说明NH3与H+结合的能力强于H2O。
对于反应:HAc + H2O == H3O+ + Ac-(2)HAc + NH3 == NH4+ + Ac-(3)因NH3与H+结合的能力强,所以反应3更易向右进行,使得HAc完全解离成为强酸。
而H2O结合H+的能力弱,所以HAc在水中只部分解离成为弱酸。
4解:碱性大小排序为: NH3 > N2H4 > NH2OH > HN3它们均为路易斯碱,则孤对电子越容易被提供出去,碱性就越强。
二这主要由两个方面产生影响。
一是配位原子的负电性越高,则越易提供孤对电子,另一个是空间位阻因素。
如果孤对电子周围空间阻碍越大,则越难提供电子。
氮族元素-高一下(附答案)

氮族元素一、选择1. 以下说法中错误的是()A. 通常状况下N2不易和其他物质发生化学反应,是因为N2分子中两个原子间形成的共价键的键能很大B. N2可用作制氮肥和硝酸的原料C. N2的化学性质不活泼,工业上常用氮气来代替稀有气体,做焊接金属的保护气D. 氮元素的非金属性比磷强,所以氮气比白磷活泼,易燃烧2. 下列变化属于氮的固定的是()两项A. 植物从土壤中吸收含氮的养料B. 豆科植物的根瘤菌吸收空气中的氮气使之转化成植物蛋白质C. 工业上将氨转化成硝酸和其他氮的氧化物D. 雷雨时空气中的氮气转化成氮的氧化物3. 下列制氮气方法中,不合理的是()A. 分离液态空气B. 加热使氨分解C. 将热空气通过灼热铜网D. 镁在空气中燃烧4. 空气中含有大量的氮气和氧气,按在通常情况下氮气和氧气和睦相处,并不发生反应,原因在于氮气很稳定。
下列用途中,与氮气的稳定性无关的是()A. 充入粮仓中贮存粮食B. 充入灯泡中保护钨丝C. 工业合成氨时需要高温、高压和催化剂D. 氮气和氢气反应生成氨气5. 氮是蛋白质的基本组成元素之一,所有生物体均含有蛋白质,氮循环涉及到生物圈的全部领域,以下关于生物体的吸收氮的途径正确的是()①氮在大气中高达78%,而被生物体直接利用②通过高能固氮可将空气中游离的氮转化为化合态的氮,而被植物所吸收③所有植物都具有生物固氮作用,其根部的根瘤菌可使氮气转变成硝酸盐而被作物吸收④动物以植物为食而获得氮并转化为动物蛋白⑤动植物死亡后,遗骸中的蛋白质被微生物分解成NH4+、NO3-、NH3,又回到土壤和水中,被植物再次吸收A. ①⑤B. ③⑤C. ②④⑤D.②④①6. 下列说法,违反科学原理的是()A. 碘化银可用于人工降雨B. 闪电时空气中的N2可变为氮的化合物C. 添加少量某物质可将水变成燃料油D. 在一定温度、压强下石墨可变成金刚石7 氨气的喷泉实验体现了氨的哪些性质()A. 还原性B. 极易溶于水C. 与水反应生成碱性物质D. 氧化性8. 关于氨水的叙述中,错误的是()A. 氨水的溶质是NH3·H2OB. 氨水可使酚酞指示剂变红C. 氨水中含三种分子和三种离子D. 氨水中溶质的质量分数越大,溶液密度越小9. 可用来干燥氨气的有()A. 浓硫酸B. 碱石灰C. 氯化钙D. 五氧化二磷10. 氨是一种重要的致冷剂,这是因为()A. 它在常温下是一种气体B. 氨极易溶于水C. 液氨气化时吸收大量的热量D. 氨的化合价为-3价11. 室温时,在体积相同的容器内混合下列气体,混合后压强最小的是()A. 100mL H2和50mL O2B. 100mL HCl和100mL NH3C. 100mL NO和100mL O2D. 100mL N2和200mL H212. 为了更简便制取干燥氨气,下列方法中适合的是()A. NH4Cl固体和H2SO4混合加热,生成的气体用碱石灰干燥B. N2和H2化合,用烧碱干燥C. 加热浓氨水,气体用碱石灰干燥D. 加热NH4HCO3,气体用P2O5干燥13. 下面是实验室制取氨气的装置和选用的试剂,其中错误的是()两项14. 在标准状况下,3.36L氨气溶于1L水中,所得溶液中溶质的物质的量浓度为()A. 33.6mol/LB. 1.5mol/LC. 15mol/LD. 无法判断15. 已知气体的摩尔质量越小,扩散速度越快。
大学无机化学第十四章试题及答案修订稿

大学无机化学第十四章试题及答案集团文件发布号:(9816-UATWW-MWUB-WUNN-INNUL-DQQTY-第十五章 氮族元素总体目标:1.掌握氮和磷单质、氢化物、卤化物、氧化物、含氧酸及其盐的结构、性质、制备和用途2.了解砷、锑、铋单质及其化合物的性质递变规律 各节目标: 第一节 氮的单质掌握N 2的结构;氮与非金属、金属的反应;氮气的实验室制法和工业制法 第二节 氮的成键特征通过氮的价层电子结构,了解它的成键特征 第三节 氮的氢氧化物1.掌握NH 3的工业制法和实验室制法以及它的结构2.了解NH 3的物理性质;掌握它的配位反应、取代反应、氨解反应和氧化反应以及用途;铵盐的水解性和热稳定性。
3.了解联氨、羟胺、叠氨酸的结构和性质 第四节 氮的氧化物1.掌握氮元素的自由能—氧化图2.掌握氮的氧化物(N 2O 、NO 、N 2O 3、NO 2、N 2O 4、N 2O 5)的结构和重要性质3.了解HNO 2及其盐的制备、结构、性质4.掌握HNO 3及其盐的结构和性质;硝酸盐热分解的一般规律;王水的成分和性质5.掌握硝酸盐和亚硝酸盐的鉴别方法 第五节 磷单质1.掌握磷原子的价电子层结构;磷的成键特征2.掌握磷的工业制法、同素异形体、化学性质及用途 第六节 磷的化合物1.掌握磷化氢的制备方法和性质2.掌握P 4O 6、P 4O 10和H 3PO 4的结构、制备、性质和用途;磷酸盐的溶解性3.了解次磷酸、亚磷酸、焦磷酸、偏磷酸化学式的书写、命名和主要性质;卤化磷、硫化磷的重要性质 第七节 砷、锑、铋了解砷、锑、铋单质及其化合物的性质递变规律 习题 一 选择题1. 氮气制备的方法是( )A. 将硝酸氨NH 4NO 3加热B. 将亚硝酸氨NH 4NO 2加热C. 将氯气与氨气混合D. B 和C 2. 下列化合物中与水反应放出HCl 的是( )A. CCl 4B. NCl 3C. POCl 3D. Cl 2O 7 3. NO 2溶解在NaOH 溶液中可得到( )A. NaNO 2和H 2OB. NaNO 2、O 2和H 2OC. NaNO 3、N 2O 5和H 2OD. NaNO 3、NaNO 2和H 2O 4. 硝酸盐加热分解可以得到单质的是( )A. AgNO 3B. Pb (NO 3)2C. Zn (NO 3)2D. NaNO 3 5. 下列分子中具有顺磁性的是( )A. N 2OB. NOC. NO 2D. N 2O 3 6. 下列分子中,不存在43π离域键的是( ) (吉林大学《无机化学例题与习题》)A. HNO 3B. HNO 2C. N 2OD. -3N7. 分子中含d —p 反馈 键的是( ) (吉林大学《无机化学例题与习题》)A. HNO 3B. HNO 2C. H 3PO 2D. NH 3 8. 下列物质中酸性最强的是( )A. N 2H 4B. NH 2OHC. NH 3D. HN 39. 下列酸中为一元酸的是( ) (吉林大学《无机化学例题与习题》)A. H 4P 2O 7B. H 3PO 2C. H 3PO 3D. H 3PO 4 10. 下列各物质按酸性排列顺序正确的是( ) (吉林大学《无机化学例题与习题》)A. HNO 2>H 3PO 4>H 4P 2O 7B. H 4P 2O 7>H 3PO 4>HNO 2C. H 4P 2O 7>HNO 2>H 3PO 4D. H 3PO 4>H 4P 2O 7>HNO 211. 下列物质中,不溶于氢氧化钠溶液的是( ) (吉林大学《无机化学例题与习题》)A. Sb(OH)3B. Sb(OH)5C. H 3AsO 4D. Bi(OH)3 12. 加热分解可以得到金属单质的是( ) (吉林大学《无机化学例题与习题》)A. Hg(NO 3)2B. Cu(NO 3)2C. KNO 3D. Mg(NO 3)2 13. NH 4NO 3受热分解产物为( )A. NH 3+HNO 2B. N 2+H 2OC. NO+H 2OD. N 2O+H 2O 14. 下列物质中受热可得到NO 2的是( )A. NaNO 3B. LiNO 3C. KNO 3D. NH 4NO 315. 下列氢化物中,热稳定性最差的是( )A. NH 3B. PH 3C. AsH 3D. SbH 3 16. 遇水后能放出气体并有沉淀生成的是( ) (吉林大学《无机化学例题与习题》)A. Bi(NO 3)2B. Mg 3N 2C. (NH 4)2SO 4D. NCl 3 17. 下列物质均有较强的氧化性,其中强氧化性与惰性电子对有关的是( )A. K 2Cr 2O 7B. NaBiO 3C. (NH 4)2S 2O 8D. H 5IO 6 18. 下列化合物中,最易发生爆炸反应的是( )A. Pb(NO 3)2B. Pb(N 3)2C. PbCO 3D. K 2CrO 4 19. 欲制备NO 气体,最好的实验方法是( ) A. 向酸化的NaNO 2溶液中滴加KI 溶液 B. 向酸化的KI 溶液中滴加NaNO 2溶液 C. Zn 粒与2moldm -3HNO 3反应 D. 向双氧水中滴加NaNO 2溶液20. N 2和C 2H 2分子中都含有 键,但的化学性质不活泼。
《无机化学》习题解析和答案

1、教材《无机化学》北京师范大学、华中师范大学、南京师范大学无机化学教研室编,高等教育出版社,2002年8月第4版。
2、参考书《无机化学》北京师范大学、华中师范大学、南京师范大学无机化学教研室编,高等教育出版社,1992年5月第3版。
《无机化学》邵学俊等编,武汉大学出版社,2003年4月第2版。
《无机化学》武汉大学、吉林大学等校编,高等教育出版社,1994年4月第3版。
《无机化学例题与习题》徐家宁等编,高等教育出版社,2000年7月第1版。
《无机化学习题精解》竺际舜主编,科学出版社,2001年9月第1版《无机化学》电子教案绪论(2学时)第一章原子结构和元素周期系(8学时)第二章分子结构(8学时)第三章晶体结构(4学时)第四章配合物(4学时)第五章化学热力学基础(8学时)第六章化学平衡常数(4学时)第七章化学动力学基础(6学时)第八章水溶液(4学时)第九章酸碱平衡(6学时)第十章沉淀溶解平衡(4学时)第十一章电化学基础(8学时)第十二章配位平衡(4学时)第十三章氢和稀有气体(2学时)第十四章卤素(6学时)第十五章氧族元素(5学时)第十六章氮、磷、砷(5学时)第十七章碳、硅、硼(6学时)第十八章非金属元素小结(4学时)第十九章金属通论(2学时)第二十章s区元素(4学时)第二十一章p区金属(4学时)第二十二章ds区元素(6学时)第二十三章d区元素(一)第四周期d区元素(6学时)第二十四章d区元素(二)第五、六周期d区金属(4学时)第二十五章核化学(2学时)1 .化学的研究对象什么是化学?●化学是研究物质的组成、结构、性质与变化的一门自然科学。
(太宽泛)●化学研究的是化学物质(chemicals) 。
●化学研究分子的组成、结构、性质与变化。
●化学是研究分子层次以及以超分子为代表的分子以上层次的化学物质的组成、结构、性质和变化的科学。
●化学是一门研究分子和超分子层次的化学物种的组成、结构、性质和变化的自然科学。
武汉大学、吉林大学《无机化学》(第3版)笔记和课后习题(含考研真题)详解-氮族元素(圣才出品)

(1)分布:主要以单质存在于空气中。土壤中含一些铵盐、硝酸盐,也是组成动植物
体中蛋白质的重要元素。
(2)N2 分子结构:∶N≡N∶,分子轨道式为 KK(σ2s )2 (σ2*s )2 (π2 py )2 (π2 pz )2 (σ2 p )2 ,由
于氮分子具有 3 个强的成键轨道所以它有很大的稳定性,将它分解为原子需要吸收 941.69
4 / 29
圣才电子书 十万种考研考证电子书、题库视频学习平台
(1)铵盐均有一定程度的水解,
(2)热稳定性差
NH4+ + H2O⎯⎯⎯⎯→NH3 H2O + H+
受热分解为氨和相应的酸:
NH4Cl = NH3↑+ HCl↑
NH4HCO3 = NH3↑+CO2↑+ H2O
与ⅡA 元素在赤热温度下反应:3Ca+N2=Ca3N2
与 B 和 Al 在白热温度下反应:2B+N2=2BN(大分子化合物)
(4)制备
工业上:分馏液态空气,少量的 O2 可通过红热的铜丝或 CrCl2 除去,痕量水用 P2O5 吸
收。
实验室:基本原理是用适当的氧化剂将氨或铵盐氧化,最常用的是加热亚硝酸铵溶液:
NH4NO2 = N2↑+ 2H2O(煮沸)
此外可以用来制取氮气的反应还有:
(NH4)2Cr2O7 = N2↑+ Cr2O3 + 4H2O (加热)
8NH3 + 3Br2(aq) = N2↑+ 6NH4Br
3.氨 (1)制备:工业上氨的制备是利用氢和氮直接反应:
N2 + 3H2 ⎯高⎯温 催⎯ 、 化高 剂⎯压→2NH3
实验室中常利用铵盐和强碱的反应来制备少量氨气: (NH4)2SO4 + CaO = CaSO4 + 2NH3↑+ H2O(加热)
武汉大学、吉林大学《无机化学》(第3版)(下册)课后习题(氧族元素)【圣才出品】
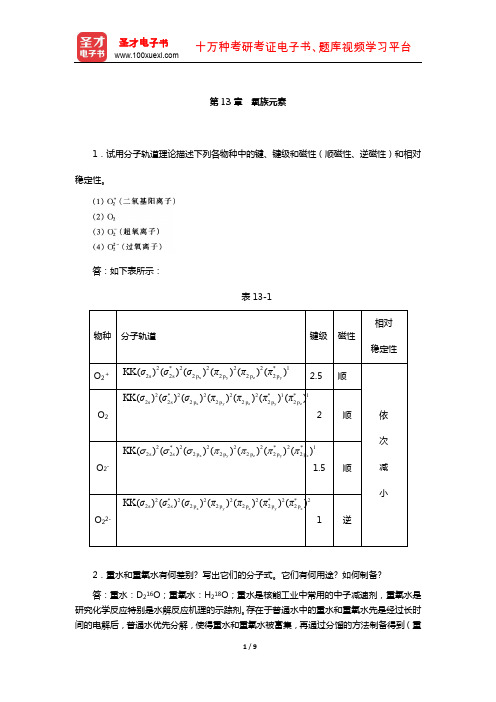
第13章氧族元素1.试用分子轨道理论描述下列各物种中的键、键级和磁性(顺磁性、逆磁性)和相对稳定性。
答:如下表所示:表13-12.重水和重氧水有何差别? 写出它们的分子式。
它们有何用途? 如何制备?答:重水:D216O;重氧水:H218O;重水是核能工业中常用的中子减速剂,重氧水是研究化学反应特别是水解反应机理的示踪剂。
存在于普通水中的重水和重氧水先是经过长时间的电解后,普通水优先分解,使得重水和重氧水被富集,再通过分馏的方法制备得到(重水和重氧水的沸点都高于普通水)。
3.解释为什么O 2分子具有顺磁性,O 3具有反磁性?答:O 2的分子轨道式为:2*2222*1*12222222()()()()()()()x y z y z s s p p p p p KK σσσππππ,可见O 2分子中有2个单电子,因而具有顺磁性。
O 3分子中没有单电子,只存在大π键43Π,因而具有反磁性。
4.在实验室怎样制备O 3? 它有什么重要性?答:在实验室里制备臭氧主要靠紫外光(<185 nm )照射氧或使氧通过静电放电装置而获得臭氧与氧的混合物,臭氧的含量可达10%,反应方程式为:3O 2=2O 3(放电条件下)。
O 3是大气层中主要的吸收紫外线的物质,使人类避免受到紫外线照射的伤害。
5.油画放置久后为什么会发暗、发黑? 为什么可用H 2O 2来处理? 写出反应方程式。
答:油画放置久后会变黑,发暗,原因是油画中的白色颜料中含有PbSO 4,遇到空气中的H 2S 生成黑色的PbS 造成的,反应方程式为:PbSO 4 +H 2S = PbS (黑)+ H 2SO 4。
用H 2O 2处理又重新变白,是因为发生以下反应:2242PbS 4H O PbSO 4H O +=+。
6.比较氧族元素和卤族元素氢化物在酸性、还原性、热稳定性方面的递变规律。
答:氧族元素的氢化物有H 2O ,H 2S ,H 2Se 和H 2T e 。
无机化学 第15章 氮族元素习题解答 20120319
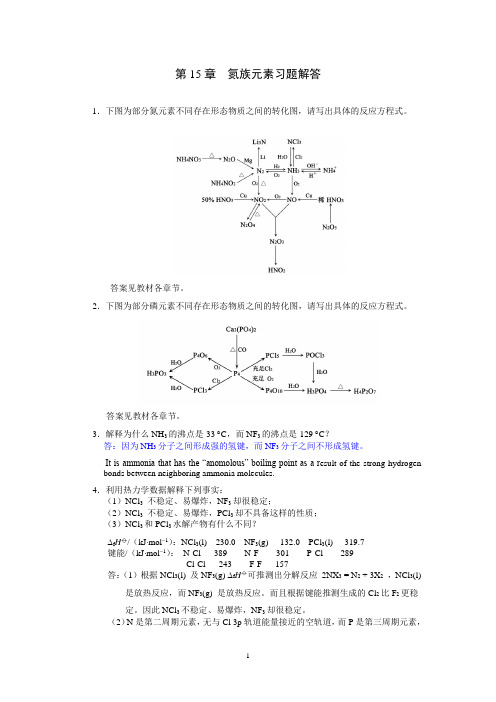
第15章氮族元素习题解答1.下图为部分氮元素不同存在形态物质之间的转化图,请写出具体的反应方程式。
答案见教材各章节。
2.下图为部分磷元素不同存在形态物质之间的转化图,请写出具体的反应方程式。
答案见教材各章节。
3.解释为什么NH3的沸点是-33 ︒C,而NF3的沸点是-129 ︒C?答:因为NH3分子之间形成强的氢键,而NF3分子之间不形成氢键。
It is ammonia that has the “anomolous” boiling point as a r esult of the strong hydrogen bonds between neighboring ammonia molecules.4.利用热力学数据解释下列事实:(1)NCl3不稳定、易爆炸,NF3却很稳定;(2)NCl3不稳定、易爆炸,PCl3却不具备这样的性质;(3)NCl3和PCl3水解产物有什么不同?∆f H/(kJ⋅mol-1):NCl3(l) 230.0 NF3(g) -132.0 PCl3(l) -319.7键能/(kJ⋅mol-1):N-Cl 389 N-F 301 P-Cl 289Cl-Cl 243 F-F 157答:(1)根据NCl3(l) 及NF3(g) ∆f H可推测出分解反应2NX3 = N2 + 3X2,NCl3(l) 是放热反应,而NF3(g) 是放热反应。
而且根据键能推测生成的Cl2比F2更稳定。
因此NCl3不稳定、易爆炸,NF3却很稳定。
(2)N是第二周期元素,无与Cl 3p轨道能量接近的空轨道,而P是第三周期元素,最低空轨道是3d轨道,与Cl的3p轨道能量接近,形成的PCl3中的P-Cl键除σ键以外,还有p-d 反馈π键,使P-Cl 键键级大于1,相对稳定。
所以NCl3不稳定、易爆炸,PCl3却不具备这样的性质。
(3)NCl3水解是亲电水解,产物是NH3和HOCl;PCl3水解是亲电加亲核水解,产物H3PO3和HCl。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第十四章氮族元素1.用MO理论讨论N2和NO分子中的成键情况,并指出两者键级是多少?答:N2:2222222*222pppssKKσππσσ键级3NO:1*22222222*222ppppssKKπσππσσ键级2.5。
2.解释下列问题:(1)虽然氮的电负性比磷高,但是磷的化学性质比氮活泼?(2)为什么Bi(V)的氧化能力比同族其他元素强?答:(1) 氮的电负性比P高,但氮不如P活泼,这是由俩者单质的结构不同决定的。
N的半径很小,但N原子间形成三重键,叁键的键能很高,难以断开,因而N2很不活泼。
P原子半径很大,而使P原子间的p轨道重叠很小,不能形成多重键。
P-P单键键能很小,很容易断开。
特别白磷的P-P-P键角小张力大,更活泼。
(2) Bi(v)的氧化能力比同族其他元素强的多,出现了充满4f、5d,而4f、5d对电子的屏蔽作用较小,而6s具有较大的穿透能力,所以6s电子能级显著降低,不易失去,有“惰性电子对效应”。
失去2 个6s电子的Bi(v 更倾向于得到2个电子形成更稳定的Bi3+。
3.试从分子结构上比较NH3、HN3、N2H4和NH2OH等的酸碱性。
答:NH3结构见书648HN3结构见书658N2H4结构见书655NH2OH结构见书658得出酸性HN3> NH2OH > N2H4> NH3碱性相反。
4.试比较下列化合物的性质:(1)NO-3和NO-2的氧化性;(2)NO2、NO和N2O在空气中和O2反应的情况;(3)N2H4和NH2OH的还原性。
答:(1) 氧化性NO2->NO3-;(2) NO2不与空气反应;NO与空气在常温下即可反应,产生红棕色烟雾。
N2O也不与空气反应。
(3)还原性:N2H4 >NH2OH5.硝酸铵可以有下列两种热分解方式:NH4NO3(s)=NH3(g)+HNO3(g) ΔHθ=171kJ·mol-1NH4NO3(s)= N2O(g)+2 H2O(g) ΔHθ=-23 kJ·mol-1根据热力学的观点,硝酸铵固体按照哪一种方式分解的可能性较大。
答:按后者分解方式可能性大;因为ΔG=ΔH-T ΔS ,可知,反应的方向性主要决定于ΔH 。
6.如何除去:(1) 氮中所含的微量氧;(2) 用熔融NH 4NO 3热分解制得的NO 2中混有少量的NO ;(3) NO 中所含的微量NO 2;(4) 溶液中微量的NH +4离子。
答: (1)使气体通过炽热的铜屑:O 2+2Cu=2CuO(2)使气体通过FeSO 4溶液除去NONO+FeSO 4=Fe (NO )SO 4(3)使气体通过水除去NO 22NO 2+H 2O=2HNO 3+NO(4) 溶液中加少量的NaNO 2后加热除去NH 4+NH 4++NO 2-=N 2+H 2O7.写出下列物质加热时的反应方程式:(1)3NaNO (2)34NO NH (3)24 NaNO Cl NH 和的混合物(4)O H CuSO 245. (5)O H NO Cu 2232.)( (6)3NaN答:↑+−→−+↑−→−+↑+↑−→−+−→−++−→−+−→−+↑−→−+↑−→−↑+−→−∆∆∆∆∆∆∆∆∆23323222333233223242422242234223643)6(244)(2)(3.)()5(55.)4()3(2)2(22)1(N Na N Na NNa N NaN OH O NO HNO HNO CuO NO OH Cu O H HNO NO OH Cu O H NO Cu OH CuSO O H CuSO OH N NO NH OH O N NO NH O NaNO NaNO8.从下列物质中选出那些互为等电子体:C -22,O 2,O -2,O -22, N 2,NO ,NO +,CN -和N 2H -3, 并讨论它们氧化能力得强弱和酸碱强度。
答:互为电子体的有:C 22- ,N 2,NO +,CN -;O 22-,N 2H 3-9.完成下列反应:242HNO H N + −→−24HNO Cl NH + −→−∆2HNO KI +−→−23HNO KClO + −→−∆24HNO KMnO + −→−∆答:OH NO Mn H HNO MnO H NO Cl HNO ClO OH NO I HNO KI HClO H N HNO NH OH HN HNO H N 232224323222222423242352523332222-+∆+-+--∆-∆∆+−→−++++−→−++↑+−→−+++↑−→−++−→−+10.从硝酸钠出发,写出制备亚硝酸的反应方程式。
答:2NaNO 3=2NaNO 2+O 2NaNO 2+HCl=HNO 2+NaCl11.解释下列反应现象:(1) 为什么NaNO 2会加速铜和硝酸的反应速度?(2) 为什么磷和KOH 溶液反应生成的的PH 3气体遇空气冒白烟?(3) 向NaH 2PO 4或Na 2HPO 4溶液中加入AgNO 3溶液会析出黄色Ag 3PO 4沉淀?答:(1)NaNO 2与硝酸反应有NO 2生成,NO 2作为反应的催化剂起电子传递作用,而使硝酸与铜的反应速率加快。
--+-→++=++2222232NO e NO OH NO H NO HNO可见,通过NO 2获得还原剂Cu 的电子,而使反应速率加快。
2NO 2+Cu=2NO 2-+Cu 2+(2)磷和KOH 溶液反应生成的PH 3气体中含有少量的P 2H 4,P 2H 4在空气中易自燃生成P 2O 3而冒白烟。
(3)Ag 3PO 4的溶度积常数比AgH 2PO 4和Ag 2HPO 4都小得多,即Ag 3PO 4的溶解度更小,而易从溶液中析出。
12.完成下列反应(a) 34HNO P +−→−(b) O H AsCl 23+−→− (c) O H POCl 23+−→−(d) O H O P 2104+−→− (e) O H O P 264+−→−(f) ) 稀HCl(P Zn 23+−→−答:23233326443ΔHNO 210443233323432343ZnCl PH ) 稀6HCl(P (f)Zn PO 4H O 6H O (e)P PO 4H O 6H O (d)P 3HClPO H O 3H (c)POCl 3HClAsO H O 3H (b)AsCl 20NOPO 12H O 8H 20HNO a)3P (3+=+=+−−→−++=++=++=++13.试说明为什么氮可以生成二原子分子N 2,而同族其它元素不能生成二原子分子的原因。
答:N 的半径很小,但N 原子间形成三重键,叁键的键能很高,难以断开,因而N 2很不活泼。
P 原子半径很大,而使P 原子间的p 轨道重叠很小,不能形成多重键。
14.指出下列各种磷酸中P 的氧化数。
H 3PO 4, H 4P 2O 7, H 5P 3O 10, H 6P 4O 13, H 3P 3O 9, H 4P 4O 12, H 4P 2O 6, H 2PHO 3, HPH 2O 2, H 3PO 5, H 4P 2O 8,答:+5,+5,+5,+5,+5,+5,+4,+3,+1,+7,+6。
15.说明NO -3,PO -34,Sb(OH)-6的结构。
答:NO 3-:平面三角形;PO 43-:正四面体;Sb (OH )-6:正八面体16. P 4O 10,中P-O 键长有两种分别为139pm 和162pm ,试解释不同的原因。
答: P 4O 10分子中有两种P-O 键,一种是-P=O ,此键键长短,仅为139pm ,还有一种为P-O-P ,此键键长为162pm 。
17.如何鉴别下列各组物质:(1)Cl NH 4和34NO NH ;(2)34NO NH 和24NO NH ;(3)43PO Na 和722O P Na ;(4)33PO H 和43PO H ;(5)33AsO H 和43AsO H ;(6)+3As 、+3Sb 和+3Bi 。
答:(1)用AgNO 3鉴别。
(2)用淀粉碘化钾试纸(3)用AgNO 3鉴别。
(4)用AgNO 3鉴别。
(5)用淀粉碘化钾试纸(6)用Na 2S 溶液18.写出下列含氧酸盐的热分解产物;(1) Na 2SO 4·10H 2O(2) Ca(ClO 4)2·4 H 2O(3) Cu(NO 3)2·3 H 2O(4) Al 2(SO 4)3(5) NaHSO 4(6) (NH4)2Cr 2O 7(7) AgNO 2(8) Na 2SO 3(9) KClO 3答:(1)Na 2SO 4,H 2O ;(2)CaCl 2,O 2,H 2O (3)CuO ,NO 2,H 2O ;(4)(5)(6)N 2,Cr 2O 3,(7)Ag ,NO 2;(8)Na 2S ,Na 2SO 4(9)KCl ,O 219.比较As 、Sb 、Bi 的硫化物和氧化物的性质。
答:As 、Sb 、Bi 的硫化物:As 2S 3 As 2S 5 Sb 2S 3 Sb 2S 5 Bi 2S 3(1)酸碱性 两性偏酸 酸 两性 两性 碱(2)溶解性(浓盐酸)不溶 不溶 溶解 溶解 溶解(NaOH) 溶 溶 溶 溶 不溶(硫化钠)溶 溶 溶 溶 不溶(Na 2S X ) 溶 不溶 溶 不溶 不溶As 、Sb 、Bi 的氧化物:As 4O 6 Sb 4O 6 Bi 2O 3(水) 微溶 难溶 极难溶(酸)溶解 难溶 极难溶(碱)易溶 溶解 难溶20.写出在碱性介质中Cl 2氧化Bi(OH)3的反应方程式,并用ϕθ解释反应发生的原因。
答:O H NaCl NaBiO NaOH OH Bi Cl 2332323)(++↓=++因为)(//2OH Bi BiO Cl Cl >-ϕφθ,所以该反应能向右进行。
21.如何解释As 2O 3在盐酸中的溶解度随酸的浓度增大而减小后有增大的原因。
答:当酸的浓度非常低时,存在以下平衡:As 2O 3+3H 2O=2As (OH )3酸的浓度的加大,不利于水解反应。
酸的浓度增大后,存在以下反应:As 2O 3+8HCl=2H[AsCl 4]+3H 2O ;增大盐酸的浓度,有利于反应向右进行。
22.化合物A 是白色固体,不溶于水,加热剧烈分解,产生一固体B 和气体C 。
固体B 不溶于水或HCl ,但溶于热的稀HNO 3,得一溶液D 及气体E 。
E 无色,但在空气中变红。
溶液D 以HCl 处理时,得一白色沉淀F 。
气体C 与普通试剂不起作用,但与热得金属镁作用生成白色固体G 。
G 与水作用得到另一种白色固体H 及一气体J 。
气体J 使湿润得红色石蕊试纸变蓝,固体H 可溶于稀H 2SO 4得溶液I 。
