武汉大学版无机化学课后习题答案(第三版)(下册)
武汉大学版无机化学课后习题答案(第三版)第13章 配位化学原理

配位化学基础1.某物质的实验式为PtCl 4・2NH 3,其水溶液不导电,加入AgNO 3亦不产生沉淀,以强碱处理并没有NH 3放出,写出它的配位化学式。
解[Pt(NH 3)2Cl 4]2. 下列化合物中哪些是配合物?哪些是螯合物?哪些是复盐?哪些是简单盐?(1)CuS0”・5HQ (2)KPtCl4226(3)Co(NH 3)6Cl 3(4)Ni(en)2Cl 2(5)(NH )o S0/FeS0/6HQ (6)Cu (NHCHCOO )o42442222(7)Cu (OOCCH 3)2(8)KClMgCl 2・6H 2O 解配合物:K 2PtCl 6,C O (NH 3)6C13,C U SO 4・5H 2O螯合物:Ni(en)2Cl 2,Cu(NH 2CH 2COO)2复盐:(NH 4)2SO 4・FeSO 4・6H 2OKClMgCl^^O 简单盐:Cu(OOCH 3)2(3) 三氯化三(乙二胺)合钻(III ) (4) 氯化二氯•四水合钻(III ) (5) 二水合溴化二溴•四水合钻(III ) (6) 羟・水•草酸根•乙二胺合铬(III ) (7) 六硝基合钻(III )配阴离子 (8) 氯•硝基•四氨合钻(III )配阳离子(9)三氯•水•二吡啶合铬(III )(10)二氨•草酸根合镍(II )3. 命名下列各配合物和配离子:(1)(NH 4)3[SbCl 6] (3)[Co (en )3]Cl 3(5)[Cr (H 2O )4Br 2]Br.2H 2O (7)Co (NO 2)6]3 (9)[Cr (Py )2(H 2O )Cl 3] 解(1)六氯合锑(III )酸铵(2)四氢合铝(III )酸锂(2)Li[AlH 4] (4)[Co (H 2O )4Cl 2]Cl6)[Cr (H 2O )(en )(C 2O 4)(OH )2248)[Co (NH 3)4(NO 2)C]+ 10)[Ni (NH 3)2(C 2O 4)]4. 指出下列配合物的空间构型并画出它们可能存在的立体异构体:1)[Pt (NH 3)2(NO 2)Cl] 3)Pt (NH 3)2(OH )2Cl 2] 5)[Co (NH 3)3(OH )3] 7)[Cr (en )2(SCN )2]SCN 9)[Co (NH 3)(en )Cl 3](2)Pt (Py )(NH 3)ClBr] (4)NH 4[Co (NH 3)2(NO 2)4] (6)[Ni (NH 3)2Cl 2] (8)[Co (en )3]Cl 310)[Co (en )2(NO 2)2]Cl 2解(1)[Pt (NH 3)2(NO 2)Cl]平面正方形2种异构体H 3NH 3N3)[Pt(NH 3)2(OH)2Cl 2]八面体5种异构体H 3N 2)OHHOHONH 3210)[Co(en)2(NO 2)2]Cl 2ClNH 3 HOOH八面体7) 8) [Co(NH 3)3(OH)3]八面体 H 3NOH[Ni(NH 3)2Cl 2] 无异构体[Cr(en)2(SCN)2]SCN[Cr(en)2(SCN)2]-八面体 [Co(en)3]Cl 3[Co(en)3]3+ 八面体2种异构体[Co(NH 3)(en)Cl 3]八面体2种异构体5) 4)[Co(NH 3)2(NO 2)4]-NH 32种异构体NO 2NH3四面体 2种异构体NH 3SCNNCS2种异构体en24.90B.M 。
武汉大学版无机化学课后习题答案(第三版)第09章 化学反应的速率

化学反应的速率1. 什么是化学反应的平均速率,瞬时速率?两种反应速率之间有何区别与联系?答:平均速率是指在时间间隔Δt 内,反应物或生成物浓度的变化量。
而瞬时速率是指某一时刻的反应速率;前者是一个平均概念,相对于一个时间段而言,而后者是一个瞬时概念,是相对于某一时刻而言。
2. 分别用反应物浓度和生成物浓度的变化表示下列各反应的平均速率和瞬时速率,并表示出用不同物质浓度变化所示的反应速率之间的关系。
这种关系对平均速率和瞬时速率是否均适用?(1) N 2 + 3H 2 → 2NH 3(2) 2SO 2 + O 2 →2SO 3(3) aA + Bb → gG + hH解 (1)V =tN △△][2= t H △△][2=t NH △△][3 V 瞬=0lim →t △t N △△][2 = 0lim →t △t H △△][2 =0lim →t △t NH △△][3 V 2N =31V 2H =21V 3NH 两种速率均适用。
(2)(3)同(1)。
3. 简述反应速率的碰撞理论的理论要点。
答:碰撞理论认为:(1)、反应物分子之间的相互碰撞是反应进行的先决条件,碰撞频率越高,反应速率越大。
(2)、碰撞中能发生反应的一组分子首先必须具备足够的能量,以克服分子无限接近时,电子云之间的斥力,从而导致分子中原子的重排,即发生化学反应。
(3)、能量是有效碰撞的一个必要条件,但不充分,只有当活化分子组中的各个分子采取合适的取向进行碰撞时,反应才能发生。
(4)、活化能:发生有效碰撞的最低能量。
4. 简述反应速率的过渡状态理论的理论要点。
答:过渡状态理论认为:(1)、当两个具有足够的平均能量的反应物分子相互接近时,分子中的化学键要经过重排,能量要重新分配。
在反应过程中,要经过中间的一个过渡状态,即反应物分子要先形成活化配合物。
(2)。
反应速率与下列三个因素有关:活化配合物的浓度,活化配合物分解的几率,活化配合物的分解速率。
武汉大学版无机化学课后习题答案(第三版)(下册)

16.完成并配平下列反应式:(1)H2S+H2O2→(2)H2S+Br2→(3)H2S+I2→(4)H2S+O2→(5)H2S+ClO-+H+→3(6)Na2S+Na2SO3+H+→(7)Na2S2O3+I2→(8)Na2(9)SO2(10)H2(11)Na(12)KO(13)(14)K2(15)H2答:(1)H(2)H2H(1(2(3(4(5(6(7(8(9)2Na2O2+2CO2=2Na2CO3+O2(10)2KO2+2H2O=2KOH+O2+H2O2(11)4Fe(OH)2+O2+2H2O=4Fe(OH)3(12)5S2O82-+2Mn2++8H2O=10SO42-+2MnO4-+16H+(13)H2SeO3+H2O2=H2SeO4+H2O17.在标准状况下,50cm3含有O3的氧气,若其中所含O3完全分解后,体积增加到52cm3。
如将分解前的混合气体通入KI溶液中,能析出多少克碘?分解前的混合气体中O3的体积分数是多少?解:5.68mg,8.1%溶液退色,求碘溶液的浓度?18.每升含12.41克Na2S2O3·5H2O的溶液35.00cm3,恰好使50.00cm3的I-3解:I 3-+2S 2O 32-=S 4O 62-+3I -1.75×10-2mol/L19.下述反应在298K 时的△H θm 为284.5kJ ·mol -13O 22O 3已知此反应平衡常数为10-54,试计算该反应的△G θm 和△S θm 。
解:307.97kJ/mol,-78.76k -1.J.mol -120.利用电极电势解释在H 2O 2中加入少量Mn 2+,可以促进H 2O 2分解反应的原因。
答:θϕMnOH 2O 2H 2O 2H 2O 2H 2O 2第十四章1. 用答:2(1(2答:(1)N P 原子半径很大,而使P 原子间的p 轨道重叠很小,不能形成多重键。
P-P 单键键能很小,很容易断开。
武大吉大第三版无机化学教材课后习题答案

第十二章1.卤素中哪些元素最开朗?为何有氟至氯开朗性变化有一个突变?答:单质的开朗性序次为:F2>>Cl 2>Br 2>I 2—从 F2到 Cl 2开朗性突变,其原由归纳为 F 原子和 F 离子的半径特别小。
r/pmF Cl Br I F64 99 114 133 136181—Cl —195216Br—I—(1)因为 F 的原子半径特别小,F—F原子间的斥力和非键电子对的斥力较大,使解离能( 155KJ/mol )远小于Cl 2的解离能( 240KJ/mol )。
F2的(2)因为 F-离子半径特别小,所以在形成化合物时,氟化物的离子键更强,键能或晶格能更大。
因为 F-离子半径特别小,F-的水合放热比其余卤素离子多。
2.举例说明卤素单质氧化性和卤离子X-复原性递变规律,并说明原由。
答:氧化性次序为:F2> Cl 2 >Br2>I 2; 复原性次序为:I ->Br- >Cl - >F- .只管在同族中氯的电子亲合能最高,但最强的氧化剂倒是氟卤素单质是很强的氧化剂, 跟着原子半径的增大, 卤素的氧化能力挨次减弱。
只管在同族中氯的电子亲合能最高, 但最强的氧化剂倒是氟。
一种氧化剂在常温下, 在水溶液中氧化能力的强弱 , 可用其标准电极电势值来表示,值的大小和以下过程相关(见课本P524)3.写出氯气与钛、铝、氢、水和碳酸钾作用的反响式,并注明必需的反响条件。
答:( 1) 2Cl 2+Ti =TiCl4( 2) 3Cl 2+2Al =2AlCl3( 3) Cl 2+H2 =2HCl( 4) 3Cl 2+2P(过度 )=2PCl 35Cl 2( 过度 )+2P=2PCl 5加热,干燥加热,干燥点燃干燥干燥(5) Cl 2+H2O=HClO +HCl(6)Cl 2+2KCO3+H2O=KCl+KClO+2KHCO34.试解说以下现象:( 1)I 2溶解在 CCl4中获取紫色溶液,而I 2在乙醚中倒是红棕色。
无机化学第三版下册答案第二十一章第十七章_碱金属和碱土金属

第十七章碱金属和碱土金属1.试根据碱金属和碱土金属元素的电子层构型说明它们化学活泼性的递变规律。
答:碱金属元素的价层结构为ns1,自上而下,随着原子序数的增加,半径增大,第一电离势减小,电负性变小,金属的活泼性依次增强。
2.试比较锂和钾;锂和镁的化学性质有哪些相似点和区别。
答:锂和钾的相似性:都是活泼金属。
不同点更多:在空气中加热的产物MOH M2CO3MNO3受热MOH受热锂:Li3N,Li2O 溶解性差热稳定性差Li2O,NO2,O2Li2O钾:KO2 易溶稳定KNO2,O2不分解锂与镁有对角线相似性:锂镁在O2中加热:Li2O MgO氢氧化物受热:Li2O MgO碳酸盐受热:Li2O+CO2MgO+CO2难溶于水的盐:LiF,Li2CO3,Li3PO4 MgF2,MgCO3,Mg3(PO4)2硝酸盐受热:Li2O,NO2,O2 MgO,NO2,O2镁的水合氯化物受热生成碱式盐。
区别:锂与冷水反应,但渐慢(因为生成溶解性差的LiOH);镁与冷水不反应。
3.金属钠是强还原剂,试写出它与下列物质的反应方程式:H2O,NH3,C2H5OH,Na2O2,NaOH2,NaNO2,MgO,TiCl4答:2Na + 2H2O =2NaOH + H2↑2Na + 2NH3 = 2NaNH2 + H2↑2Na + 2C2H5OH = 2NaOC2H5 + H2↑2Na + Na2O2 = 2Na2ONaH催化无水,450℃2Na + 2NaNO2(s) 4Na2O + N2Na + MgO = Mg + Na2O2Na + TiCl4 = Ti +4NaCl4.写出过氧化钠和下列物质的反应式:NaCrO 2,CO 2,H 2O ,H 2SO 4答:2NaCrO 2+3Na 2O 2 +2H 2O = 2Na 2CrO 4 + 4NaOH3Na 2O 2 +2CO 2 = 2Na 2CO 3 +3O 2Na 2O 2 + H 2O H 2O 2 + 2NaOH 冷2Na 2O 2 + 2H 2O 4NaOH +ONa 2O 2 + H 2SO 4冷Na 2SO 4 + H 2O 2 5.写出氢氧化钠和氢氧化钙的主要化学性质和用途。
武汉大学、吉林大学《无机化学》(第3版)(下册)课后习题(氧族元素)【圣才出品】
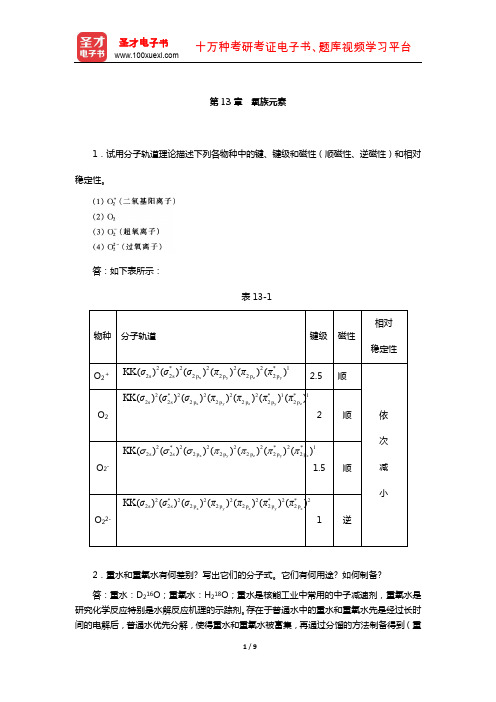
第13章氧族元素1.试用分子轨道理论描述下列各物种中的键、键级和磁性(顺磁性、逆磁性)和相对稳定性。
答:如下表所示:表13-12.重水和重氧水有何差别? 写出它们的分子式。
它们有何用途? 如何制备?答:重水:D216O;重氧水:H218O;重水是核能工业中常用的中子减速剂,重氧水是研究化学反应特别是水解反应机理的示踪剂。
存在于普通水中的重水和重氧水先是经过长时间的电解后,普通水优先分解,使得重水和重氧水被富集,再通过分馏的方法制备得到(重水和重氧水的沸点都高于普通水)。
3.解释为什么O 2分子具有顺磁性,O 3具有反磁性?答:O 2的分子轨道式为:2*2222*1*12222222()()()()()()()x y z y z s s p p p p p KK σσσππππ,可见O 2分子中有2个单电子,因而具有顺磁性。
O 3分子中没有单电子,只存在大π键43Π,因而具有反磁性。
4.在实验室怎样制备O 3? 它有什么重要性?答:在实验室里制备臭氧主要靠紫外光(<185 nm )照射氧或使氧通过静电放电装置而获得臭氧与氧的混合物,臭氧的含量可达10%,反应方程式为:3O 2=2O 3(放电条件下)。
O 3是大气层中主要的吸收紫外线的物质,使人类避免受到紫外线照射的伤害。
5.油画放置久后为什么会发暗、发黑? 为什么可用H 2O 2来处理? 写出反应方程式。
答:油画放置久后会变黑,发暗,原因是油画中的白色颜料中含有PbSO 4,遇到空气中的H 2S 生成黑色的PbS 造成的,反应方程式为:PbSO 4 +H 2S = PbS (黑)+ H 2SO 4。
用H 2O 2处理又重新变白,是因为发生以下反应:2242PbS 4H O PbSO 4H O +=+。
6.比较氧族元素和卤族元素氢化物在酸性、还原性、热稳定性方面的递变规律。
答:氧族元素的氢化物有H 2O ,H 2S ,H 2Se 和H 2T e 。
武汉大学版无机化学课后习题答案第三版分子结构

武汉大学版无机化学课后习题答案第三版分子结构Document number【SA80SAB-SAA9SYT-SAATC-SA6UT-SA18】分子结构1. 试用离子键理论说明由金属钾和单质氯反应,形成氯化钾的过程如何理解离子键没有方向性和饱和性答:KCl 的形成表示如下: K(s)?K +(g)+e12Cl 2?Cl(g)Cl (g) +e ? Cl -(g) K +(g) + Cl -(g) =KCl (s)离子键的本质是静电作用力,由于离子的电荷分布是球形对称的,因此它对异号离子的引力可以是任何方向,也就是没有方向性;一个离子的周围,能容纳多少个异离子,是随离子的半径变化而变化的,它没有固定的配位数,所以说离子键没有饱和性。
2.用下列数据求氢原子的电子亲和能。
答:电子亲和能为下列反应的焓变,它由(5)-(4)-(3)-(2)-(1)得到:3. ClF 的解离能为1246kJ mol -⋅,ClF 的生成热为-56kJ/mol-1,Cl 2的解离能为238kJ/mol -1,试计算F 2(g)的解离能。
解:据题意:(1) ClF(g) = Cl(g) +F(g) ΔH 1 = 246 kJ ·mol -1 (2)12Cl 2(g) +12F 2(g) = ClF(g) ΔH 2 = -56kJ/mol -1(3)Cl 2(g) = 2Cl(g) ΔH 3 = 238kJ/mol -12?(1)+2?(2)-(3)得F 2 (g) = 2 F (g) ΔH =2 ΔH 1+2ΔH 2-ΔH 3=2?246-2?56-238=142 kJ / mol -14. 试根据晶体的构型与半径比的关系,试判断下列AB 型离子化合物的晶体构型: BeO NaBr CaS RbI BeS CsBr AgCl 解:查表求各离子的Pauling 半径如下表: Pauling 半径(pm)计算各物质的正负离子半径比以及相应晶体构型如下表:5.试从电负性数据,计算下列化合物中单键的离子性百分数各为多少NaF AgBr RbF HI CuI HBr CsCl解:查表求出各元素的Pauling 电负性数据如下表: 各物质的电负性差和相应的离子性百分数如下表:6. 如何理解共价键具有方向性和饱和性解:共价键是指两个原子间的化学键力通过共享电子而达到的稳定饱和结构的结合力。
武汉大学、吉林大学《无机化学》(第3版)(下册)课后习题(卤素)【圣才出品】

第12章 卤 素1.卤素中哪种元素最活泼? 为什么由氟至氯活泼性的变化有一个突变? 答:单质的活泼性次序为:F 2>Cl 2>Br 2>I 2从F 2到Cl 2活泼性突变,其原因归结为F 原子和F -离子的半径特别小。
F Cl Br I F - Cl - Br - I -r/pm 64 99 114 133 136 181 195 216(1)由于F 的原子半径非常小,F -F 原子间的斥力和非键电子对的斥力较大,使F 2的解离能(155 kJ/mol )远小于Cl 2 的解离能(240 kJ/mol )。
(2)由于F -离子半径特别小,因此在形成化合物时,氟化物的离子键更强,键能或晶格能更大。
(3)由于F -离子半径特别小,F - 的水合放热比其他卤素离子多。
2.举例说明卤素单质氧化性和卤离子X - 还原性递变规律,并说明原因。
答:氧化性顺序为:F 2>Cl 2>Br 2>I 2;还原性顺序为:I ->Br ->Cl ->F -。
卤素随原子半径的增大,X 原子夺取电子的能力依次减弱,因此表现出卤素氧化性递减规律。
而氧化态的氧化能力越强,其还原态的还原能力越弱,因此卤离子的还原能力随半径增大而减小。
3.写出氯气与钛、铝、氢、磷、水和碳酸钾作用的反应式,并注明必要的反应条件。
答:各物质与氯气的反应方程式为:(1)242Cl Ti TiCl += 加热,干燥(2)3Cl 2+2Al = 2AlCl 3 加热,干燥(3)Cl 2+H 2 = 2HCl 点燃(4)3Cl 2+2P (过量) = 2PCl 3 干燥5Cl 2(过量)+2P = 2PCl 5 干燥(5)Cl 2+H 2O = HClO +HCl(6)Cl 2+2K 2CO 3+H 2O = KCl +KClO +2KHCO 34.试解释下列现象:(1)I 2溶解在CCl 4中得到紫色溶液,而I 2在乙醚中却是红棕色。
(2)I 2难溶于水却易溶于KI 溶液中。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
16. 完成并配平下列反应式:(1)H2S+H2O2→(2)H2S+Br2→(3)H2S+I2→(4)H2S+O2→+H+→(5)H2S+ClO-3(6)Na2S+Na2SO3+H+→(7)Na2S2O3+I2→(8)Na2S2O3+Cl2→(9)SO2+H2O+Cl2→(10)H2O2+KMnO4+H+→(11)Na2O2+CO2→(12)KO2+H2O→(13)Fe(OH)2+O2+OH-→→(14)K2S2O8+Mn2++H++NO-3(15)H2SeO3+H2O2→答:(1)H2S+H2O2=S+2H2OH2S+4H2O2(过量)=H2SO4+4H2O(2)H2S+Br2=2HBr+SH2S+4Br2(过量)+4H2O=8HBr+H2SO4(1)H2S+I2=2I-+S+2H+(2)2H2S+O2=2S+2H2O(3)3H2S+ClO3-=3S+Cl-+3H2O(4)2S2-+SO32-+6H+=3S+3H2O(5)2Na2S2O3+I2=Na2S4O6+2NaI(6)Na2S2O3+4Cl2+5H2O=Na2SO4+H2SO4+8HCl(7)SO2+Cl2+2H2O=H2SO4+2HCl(8)5H2O2+2MnO4-+6H+=2Mn2++5O2+8H2O(9)2Na2O2+2CO2=2Na2CO3+O2(10)2KO2+2H2O=2KOH+O2+H2O2(11)4Fe(OH)2+O2+2H2O=4Fe(OH)3(12)5S2O82-+2Mn2++8H2O=10SO42-+2MnO4-+16H+(13)H2SeO3+H2O2=H2SeO4+H2O17.在标准状况下,50cm 3含有O 3的氧气,若其中所含O 3完全分解后,体积增加到52 cm 3。
如将分解前的混合气体通入KI 溶液中,能析出多少克碘?分解前的混合气体中O 3的体积分数是多少?解:5.68mg ,8.1%18.每升含12.41克Na 2S 2O 3·5 H 2O 的溶液35.00 cm 3,恰好使50.00 cm 3的I -3溶液退色,求碘溶液的浓度?解:I 3-+2S 2O 32-=S 4O 62-+3I -1.75×10-2mol/L19.下述反应在298K 时的△H θm 为284.5kJ ·mol -13O 22O 3已知此反应平衡常数为10-54,试计算该反应的△G θm 和△S θm 。
解:307.97kJ /mol, -78.76k -1.J.mol -120.利用电极电势解释在H 2O 2中加入少量Mn 2+,可以促进H 2O 2分解反应的原因。
答:θϕ+22/Mn MnO= 1.23VH 2O 2作为氧化剂时θϕO H O H 222/=1.776VH 2O 2能氧化Mn 2+ Mn 2+ + 2H 2O 2 == MnO 2 + 2H 2OH 2O 2作为还原剂θϕ222/O H O = 0.68V 〈 1.23V H 2O 2能还原MnO 2 MnO 2 + 2H 2O 2 == Mn 2+ + O 2 + 2H 2O 总反应式为 2H 2O 2 O 2 ↑ + 2H 2O第十四章1. 用MO 理论讨论N 2和NO 分子中的成键情况,并指出两者键级是多少?答:N 2 :2222222*222p p p s s KK σππσσ 键级3NO :1*22222222*222p p p p s s KK πσππσσ 键级2.5。
2.解释下列问题:(1)虽然氮的电负性比磷高,但是磷的化学性质比氮活泼? (2)为什么Bi(V)的氧化能力比同族其他元素强? MnO 2答:(1) 氮的电负性比P高,但氮不如P活泼,这是由俩者单质的结构不同决定的。
N的半径很小,但N原子间形成三重键,叁键的键能很高,难以断开,因而N2很不活泼。
P原子半径很大,而使P原子间的p轨道重叠很小,不能形成多重键。
P-P单键键能很小,很容易断开。
特别白磷的P-P-P键角小张力大,更活泼。
(2) Bi(v)的氧化能力比同族其他元素强的多,出现了充满4f、5d,而4f、5d对电子的屏蔽作用较小,而6s具有较大的穿透能力,所以6s电子能级显著降低,不易失去,有“惰性电子对效应”。
失去2 个6s电子的Bi(v 更倾向于得到2个电子形成更稳定的Bi3+。
3.试从分子结构上比较NH3、HN3、N2H4和NH2OH等的酸碱性。
答:NH3结构见书648HN3结构见书658N2H4结构见书655NH2OH结构见书658得出酸性HN3> NH2OH > N2H4> NH3碱性相反。
4.试比较下列化合物的性质:(1)NO-3和NO-2的氧化性;(2)NO2、NO和N2O在空气中和O2反应的情况;(3)N2H4和NH2OH的还原性。
答:(1) 氧化性NO2->NO3-;(2) NO2不与空气反应;NO与空气在常温下即可反应,产生红棕色烟雾。
N2O也不与空气反应。
(3)还原性:N2H4 >NH2OH5.硝酸铵可以有下列两种热分解方式:NH4NO3(s)=NH3(g)+HNO3(g) ΔHθ=171kJ·mol-1NH4NO3(s)= N2O(g)+2 H2O(g) ΔHθ=-23 kJ·mol-1根据热力学的观点,硝酸铵固体按照哪一种方式分解的可能性较大。
答:按后者分解方式可能性大;因为ΔG=ΔH-TΔS,可知,反应的方向性主要决定于ΔH。
6.如何除去:(1)氮中所含的微量氧;(2)用熔融NH4NO3热分解制得的NO2中混有少量的NO;(3)NO中所含的微量NO2;(4)溶液中微量的NH+4离子。
答:(1)使气体通过炽热的铜屑:O2+2Cu=2CuO(2)使气体通过FeSO4溶液除去NONO+FeSO4=Fe(NO)SO4(3)使气体通过水除去NO22NO 2+H 2O=2HNO 3+NO(4) 溶液中加少量的NaNO 2后加热除去NH 4+ NH 4++NO 2-=N 2+H 2O7.写出下列物质加热时的反应方程式:(1)3NaNO (2)34NO NH (3)24 NaNO Cl NH 和的混合物 (4)O H CuSO 245. (5)O H NO Cu 2232.)( (6)3NaN 答:↑+−→−+↑−→−+↑+↑−→−+−→−++−→−+−→−+↑−→−+↑−→−↑+−→−∆∆∆∆∆∆∆∆∆23323222333233223242422242234223643)6(244)(2)(3.)()5(55.)4()3(2)2(22)1(N Na N Na N Na N NaN O H O NO HNO HNO CuO NO OH Cu O H HNO NO OH Cu O H NO Cu OH CuSO O H CuSO O H N NO NH O H O N NO NH O NaNO NaNO 8.从下列物质中选出那些互为等电子体:C-22,O 2,O -2,O-22, N 2,NO ,NO +,CN -和N 2H -3, 并讨论它们氧化能力得强弱和酸碱强度。
答:互为电子体的有:C 22- ,N 2,NO +,CN -;O 22-,N 2H 3-9.完成下列反应:242HNO H N + −→−24HNO Cl NH + −→−∆2HNO KI +−→−23HNO KClO + −→−∆ 24HNO KMnO + −→−∆答:OH NO Mn H HNO MnO H NO Cl HNO ClO OH NO I HNO KI HClO H N HNO NH O H HN HNO H N 232224323222222423242352523332222-+∆+-+--∆-∆∆+−→−++++−→−++↑+−→−+++↑−→−++−→−+10.从硝酸钠出发,写出制备亚硝酸的反应方程式。
答:2NaNO 3=2NaNO 2+O 2NaNO 2+HCl=HNO 2+NaCl11.解释下列反应现象:(1) 为什么NaNO 2会加速铜和硝酸的反应速度?(2) 为什么磷和KOH 溶液反应生成的的PH 3气体遇空气冒白烟?(3) 向NaH 2PO 4或Na 2HPO 4溶液中加入AgNO 3溶液会析出黄色Ag 3PO 4沉淀? 答:(1)NaNO 2与硝酸反应有NO 2生成,NO 2作为反应的催化剂起电子传递作用,而使硝酸与铜的反应速率加快。
--+-→++=++2222232NO e NO OH NO H NO HNO可见,通过NO 2获得还原剂Cu 的电子,而使反应速率加快。
2NO 2+Cu=2NO 2-+Cu 2+(2)磷和KOH 溶液反应生成的PH 3气体中含有少量的P 2H 4,P 2H 4在空气中易自燃生成P 2O 3而冒白烟。
(3)Ag 3PO 4的溶度积常数比AgH 2PO 4和Ag 2HPO 4都小得多,即Ag 3PO 4的溶解度更小,而易从溶液中析出。
12.完成下列反应(a) 34HNO P +−→−(b) O H AsCl 23+−→− (c) O H POCl 23+−→−(d) O H O P 2104+−→− (e) O H O P 264+−→−(f) ) 稀HCl(P Zn 23+−→− 答:23233326443ΔHNO 210443233323432343ZnCl PH ) 稀6HCl(P (f)Zn PO 4H O 6H O (e)P PO 4H O 6H O (d)P 3HClPO H O 3H (c)POCl 3HCl AsO H O 3H (b)AsCl 20NO PO 12H O 8H 20HNO a)3P (3+=+=+−−→−++=++=++=++13.试说明为什么氮可以生成二原子分子N 2,而同族其它元素不能生成二原子分子的原因。
答:N 的半径很小,但N 原子间形成三重键,叁键的键能很高,难以断开,因而N 2很不活泼。
P 原子半径很大,而使P 原子间的p 轨道重叠很小,不能形成多重键。
14.指出下列各种磷酸中P 的氧化数。
H 3PO 4, H 4P 2O 7, H 5P 3O 10, H 6P 4O 13, H 3P 3O 9, H 4P 4O 12, H 4P 2O 6, H 2PHO 3, HPH 2O 2, H 3PO 5, H 4P 2O 8,答:+5,+5,+5,+5,+5,+5,+4,+3,+1,+7,+6。
15.说明NO -3,PO-34,Sb(OH)-6的结构。
答:NO 3-:平面三角形;PO 43-:正四面体;Sb (OH )-6:正八面体16. P 4O 10,中P-O 键长有两种分别为139pm 和162pm ,试解释不同的原因。
