酰胺缩合剂在制药合成工业中的大规模应用
酰胺缩合碱的作用

酰胺缩合碱的作用哎,说到酰胺缩合碱的作用,这可真是个有意思的话题。
咱们平时可能不太会注意到它,但它在化学世界里,那可是个举足轻重的角色。
今儿个,我就好好跟大家唠唠这酰胺缩合碱的事儿,希望能让你们对这个小东西有个更深入的了解。
酰胺缩合碱,听起来挺高大上的吧?其实啊,它就是一类在化学合成中经常用到的试剂。
它的作用嘛,简单来说,就是帮助酰胺分子之间发生缩合反应,形成新的化学键。
这个过程,就像是给化学分子搭积木,酰胺缩合碱就是那个能把积木搭得稳稳当当的“胶水”。
在实验室里,我第一次接触到酰胺缩合碱的时候,心里还挺忐忑的。
毕竟,化学这东西,一不小心就可能出岔子。
但当我小心翼翼地按照步骤操作,看到那些原本独立的酰胺分子在酰胺缩合碱的作用下,慢慢地“手拉手”聚在一起,形成新的化合物时,那种成就感,简直无法用言语来形容。
酰胺缩合碱的作用,可不仅仅是让酰胺分子“拉拉手”那么简单。
它还能在药物合成、高分子材料制备等领域发挥重要作用。
比如说,在药物合成中,很多药物的有效成分都是通过酰胺缩合反应合成的。
没有酰胺缩合碱,这些药物可能就无法被制造出来,我们的健康也就可能因此受到威胁。
记得有一次,我们实验室正在合成一种新型药物的前体。
这个前体需要通过酰胺缩合反应来制备,而酰胺缩合碱就是关键。
当时,我们试了好几种不同的酰胺缩合碱,但效果都不太理想。
不是反应速度太慢,就是产物纯度不高。
这可把我们急坏了,毕竟,时间紧迫,任务繁重啊。
就在我们一筹莫展的时候,一位经验丰富的老师傅走了进来。
他看了看我们的实验记录,又闻了闻反应液的气味,然后笑眯眯地说:“试试这种酰胺缩合碱吧,它可能更适合你们的反应体系。
”我们半信半疑地按照他的建议操作,结果,奇迹真的发生了!反应速度大大加快,产物纯度也提高了很多。
那一刻,我们简直要欢呼雀跃了。
这次经历让我深刻体会到了酰胺缩合碱的重要性。
它不仅仅是化学合成中的一个工具,更是我们解决科学问题、创造新价值的有力武器。
酰胺、腈的合成反应研究

酰胺、腈的合成反应研究一、本文概述酰胺和腈是化学领域中两种重要的有机化合物,它们在工业、医药、农药等多个领域有着广泛的应用。
酰胺是一类含有羰基和氨基的化合物,具有良好的水解稳定性和生物活性,因此在药物合成、塑料制造和农药研发等方面发挥着重要作用。
而腈则是一类含有氰基的化合物,具有高的反应活性和选择性,常被用于合成各种含氮有机物。
本文旨在深入研究酰胺和腈的合成反应,探讨其反应机理、影响因素以及优化方法。
通过综述相关文献和实验数据,本文将系统总结酰胺和腈的合成方法,分析不同合成路线的优缺点,以期为提高酰胺和腈的合成效率、降低生产成本提供理论支持和实践指导。
本文还将关注酰胺和腈合成反应的绿色化、环保化发展趋势,以期为推动可持续化学工业的发展做出贡献。
二、酰胺的合成反应酰胺是一类重要的有机化合物,广泛存在于自然界和人工合成产物中。
酰胺的合成反应是有机化学中的一个重要研究领域,对于理解酰胺的化学性质以及开发新的合成方法具有重要意义。
酰胺的合成主要通过羧酸或其衍生物的酰化反应实现,包括酸酐、酯和酰胺的自身缩合等。
羧酸与胺的酰化反应是合成酰胺的最直接方法。
在适当的条件下,羧酸与胺发生脱水反应,生成相应的酰胺和水。
这个反应通常需要加热或在催化剂的存在下进行。
催化剂可以是无机酸如盐酸、硫酸,也可以是有机酸如乙酸、甲酸等。
反应还可以在溶剂如甲醇、乙醇或二甲基甲酰胺中进行。
酸酐是羧酸的衍生物,与胺反应也可以生成酰胺。
与羧酸相比,酸酐的反应活性更高,因此可以在较温和的条件下进行。
酸酐与胺的反应通常不需要催化剂,但在某些情况下,加入少量的催化剂可以加速反应。
溶剂的选择对反应速率和产物纯度也有重要影响。
酯在适当的条件下也可以与胺反应生成酰胺。
这个反应通常需要较高的温度和压力,并且需要催化剂的存在。
常用的催化剂包括氢氧化钠、氢氧化钾等碱性物质。
溶剂的选择也对反应速率和产物纯度有重要影响。
酰胺分子内的羰基和氨基之间也可以发生缩合反应,生成更大的酰胺分子。
羧酸与胺地缩合酰化反应.解析汇报

羧酸与胺的缩合酰化反应王露化工与制药专业 1105班学号110150151指导教师刘雪凌老师摘要合成是制药的基本方法,也是很重要的方法,人类对药物的需求很大,要不断的创新、研发新药,合成是其中必不可少的方法,本文介绍了常见合成酰胺的方法,合成酰胺通用的方法是先活化羧基,然后再与胺反应得到酰胺。
其中羧酸与胺的反应是合成酰胺的重要方法【5】。
这一反应是一个平衡反应,采用过量的反应物之一或除去反应中生成的水,均有利于平衡向产物方向转移。
除去水的方法通常是在反应物中加入苯或甲苯进行共沸蒸馏【1】。
关键词:合成酰化活化前言药物对于我们任何一个人来说都不陌生,而且离不开。
现在药物的种类有很多,但还是有一些疾病无法治疗,所以我们需要不断的研发新药,而合成又是制药的基本领域和方法,所以我们需要学习、了解具体的合成方法【3】。
常见合成酰胺的方法羧酸与胺的缩合酰化反应氨或胺与酰卤的酰化反应氨或胺与酸酐的酰化反应其他缩合方法酯交换为酰胺氰基转化为酰胺羧酸与胺的缩合酰化反应1羧酸和胺的直接缩合反应羧酸与胺的反应是合成酰胺的重要方法: 这一反应是一个平衡反应,采用过量的反应物之一或除去反应中生成的水,均有利于平衡向产物方向转移。
除去水的方法通常是在反应物中加入苯或甲苯进行共沸蒸馏。
例如将a-羟基乙酸及苄胺于90℃共热,并蒸出生成的水及过量的苄胺,则生成a-羟基乙酰基苄胺【7】:90o C1.1混合酸酐法1.1.1混合酸酐法(一)氯甲酸酯法:主要应用羧酸与氯甲酸乙酯或异丁酯反应生成混合酸酐,而后再与胺反应得到相应的酰胺。
这一反应如果酸的a-位位阻大或者连有吸电子基团,有时会停留在混合酸酐这一步。
但加热可以促使其反应;这一反应也可用于无取代酰胺的合成。
ClCOOEt, NEt3 CHCl3, -20~5o C, 1.5h NH3 (gas) rt, 30min91%NMM, DMFr.t.33%1.1.2混合酸酐法 (二)羰基二咪唑:应用羰基二咪唑(CDI)与羧酸反应得到活性较高的酰基咪唑,许多酰基咪唑有一定的稳定性,有时可以分离出来。
(整理)羧酸与胺的缩合酰化反应

羧酸与胺的缩合酰化反应王露化工与制药专业 1105班学号110150151指导教师刘雪凌老师摘要合成是制药的基本方法,也是很重要的方法,人类对药物的需求很大,要不断的创新、研发新药,合成是其中必不可少的方法,本文介绍了常见合成酰胺的方法,合成酰胺通用的方法是先活化羧基,然后再与胺反应得到酰胺。
其中羧酸与胺的反应是合成酰胺的重要方法【5】。
这一反应是一个平衡反应,采用过量的反应物之一或除去反应中生成的水,均有利于平衡向产物方向转移。
除去水的方法通常是在反应物中加入苯或甲苯进行共沸蒸馏【1】。
关键词:合成酰化活化前言药物对于我们任何一个人来说都不陌生,而且离不开。
现在药物的种类有很多,但还是有一些疾病无法治疗,所以我们需要不断的研发新药,而合成又是制药的基本领域和方法,所以我们需要学习、了解具体的合成方法【3】。
常见合成酰胺的方法➢羧酸与胺的缩合酰化反应➢氨或胺与酰卤的酰化反应➢氨或胺与酸酐的酰化反应➢其他缩合方法➢酯交换为酰胺➢氰基转化为酰胺羧酸与胺的缩合酰化反应1羧酸和胺的直接缩合反应羧酸与胺的反应是合成酰胺的重要方法: 这一反应是一个平衡反应,采用过量的反应物之一或除去反应中生成的水,均有利于平衡向产物方向转移。
除去水的方法通常是在反应物中加入苯或甲苯进行共沸蒸馏。
例如将a-羟基乙酸及苄胺于90℃共热,并蒸出生成的水及过量的苄胺,则生成a-羟基乙酰基苄胺【7】:90o C1.1混合酸酐法1.1.1混合酸酐法(一)氯甲酸酯法:主要应用羧酸与氯甲酸乙酯或异丁酯反应生成混合酸酐,而后再与胺反应得到相应的酰胺。
这一反应如果酸的a-位位阻大或者连有吸电子基团,有时会停留在混合酸酐这一步。
但加热可以促使其反应;这一反应也可用于无取代酰胺的合成。
ClCOOEt, NEt3 CHCl3, -20~5o C, 1.5h NH3 (gas) rt, 30min91%NMM, DMFr.t.33%1.1.2混合酸酐法 (二)羰基二咪唑:应用羰基二咪唑(CDI)与羧酸反应得到活性较高的酰基咪唑,许多酰基咪唑有一定的稳定性,有时可以分离出来。
草酰胺用途

草酰胺用途草酰胺是一种重要的有机化合物,具有广泛的应用领域。
本文将介绍草酰胺的几个主要应用。
草酰胺在农业领域具有重要作用。
它作为一种高效的氮肥添加剂,可供给作物所需的氮元素。
草酰胺能够迅速溶解于水中,并且能够被作物根系迅速吸收利用,提高作物的产量和品质。
同时,草酰胺还能起到抑制杂草生长的作用,减少对农作物的竞争,提高农作物的光合效率。
因此,在现代农业生产中,草酰胺被广泛应用于作物的种植和养殖。
草酰胺在医药领域也有重要的应用。
它是合成多肽和蛋白质的重要原料。
通过反应生成的草酰胺基团可以与氨基酸分子进行缩合反应,从而构建多肽链和蛋白质结构。
草酰胺作为一种有效的缩合剂,被广泛应用于药物合成和生物技术领域。
它可以用于合成各种具有生物活性的多肽药物,如抗癌药物、抗生素等,为人类健康事业做出了巨大贡献。
草酰胺还在化工工业中具有广泛的应用。
它是合成聚酰胺类高分子材料的重要原料。
草酰胺可以与二元或多元酸反应,形成聚酰胺链,从而合成出具有优异性能的高分子材料。
这些高分子材料在工程塑料、纤维、涂料、胶粘剂等领域具有广泛的应用。
例如,聚酰胺纤维具有很高的强度和耐磨性,被广泛用于制作绳索、织物和防弹材料等。
草酰胺还可以用于水处理领域。
草酰胺作为一种优良的沉淀剂和絮凝剂,能够有效地去除水中的悬浮物、浑浊物和有机物。
草酰胺能够与水中的污染物发生反应,形成沉淀物或凝聚物,并通过过滤等方式将其从水中分离出来,从而实现水的净化和处理。
因此,在水处理领域,草酰胺被广泛应用于供水、废水处理、污水处理等环境保护工程中,起到了非常重要的作用。
草酰胺作为一种重要的有机化合物,具有广泛的应用领域。
它在农业、医药、化工和水处理等领域都发挥着重要作用,为各行各业的发展做出了积极贡献。
未来,随着科学技术的不断发展,草酰胺的应用领域还将进一步拓展,为人类社会的进步和发展做出更大的贡献。
酰胺键缩合剂

酰胺键缩合剂是一种在化学合成中常用的试剂,用于在两个或更多的分子之间形成酰胺键(amide bond)。
酰胺键是一种重要的化学键,广泛存在于生物分子、药物和聚合物中。
常见的酰胺键缩合剂包括有机化合物如碳酰二氯化物(例如:硫酰氯(thionyl chloride)、肟类(例如:2-羟基-4',4-二甲基二吡咯酮、O-(1H-苯并咪唑-1-酰)-N,N-二甲甲酰肟等)以及添加剂如焦磷酸三酯(phosphorous oxychloride)等。
这些试剂能够与氨基化合物或胺类反应生成酰胺键。
酰胺键缩合剂的使用使得有机合成中可以有效地在分子中引入酰胺键,广泛应用于制药、高分子材料等领域。
酰胺键缩合剂在有机合成中的应用十分广泛,下面列举一些常见的应用:
1. 肽合成:酰胺键缩合剂可以将氨基酸或肽片段连接起来形成多肽链。
常见的酰胺键缩合剂包括碳酰二氯化物(如二氯酸)和肟类(如二噁烷酮和取代吡咯肟)。
这种方法常用于制备肽类药物和生物活性多肽。
2. 聚酰胺合成:酰胺键缩合剂可以用于合成聚酰胺类高分子
材料。
通过反应中的缩合剂与二胺或二酸反应,可以形成聚酰胺链。
聚酰胺具有良好的机械性能、热稳定性和化学稳定性,广泛应用于纺织品、涂料、塑料和胶粘剂等领域。
3. 缩合反应:酰胺键缩合剂在有机合成中经常用于缩合反应,将两个分子通过酰胺键连接起来。
这种反应在合成天然产物、药物、农药和功能分子中经常使用。
总的来说,酰胺键缩合剂在有机化学中扮演着重要的角色,可以在化学反应中引入酰胺键,扩展了分子设计和合成的范围,为制药、高分子材料以及其他化学应用提供了便利和创新的途径。
酰胺缩合剂在制药合成工业中的大规模应用(二)-1118分析
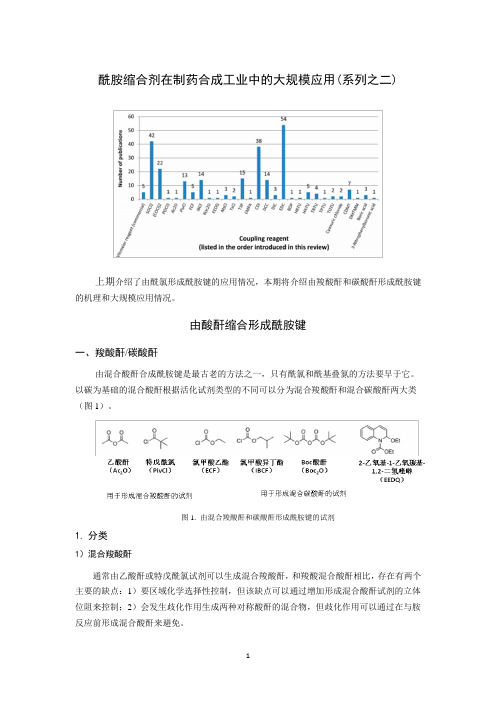
酰胺缩合剂在制药合成工业中的大规模应用(系列之二)上期介绍了由酰氯形成酰胺键的应用情况,本期将介绍由羧酸酐和碳酸酐形成酰胺键的机理和大规模应用情况。
由酸酐缩合形成酰胺键一、羧酸酐/碳酸酐由混合酸酐合成酰胺键是最古老的方法之一,只有酰氯和酰基叠氮的方法要早于它。
以碳为基础的混合酸酐根据活化试剂类型的不同可以分为混合羧酸酐和混合碳酸酐两大类(图1)。
图1. 由混合羧酸酐和碳酸酐形成酰胺键的试剂1.分类1)混合羧酸酐通常由乙酸酐或特戊酰氯试剂可以生成混合羧酸酐,和羧酸混合酸酐相比,存在有两个主要的缺点:1)要区域化学选择性控制,但该缺点可以通过增加形成混合酸酐试剂的立体位阻来控制;2)会发生歧化作用生成两种对称酸酐的混合物,但歧化作用可以通过在与胺反应前形成混合酸酐来避免。
2)混合碳酸酐羧酸和氯甲酸酯或EEDQ反应可以得到混合碳酸酐,这些底物的两个羰基是不等价的,胺通常会加成到所需要的羰基上,这是由于不希望的那个羰基(如,碳酸盐)亲电性差的原因。
这也是氯甲酸乙酯对酰胺键有较好的选择性的原因,尽管它没有大的立体位阻。
通常将制备这些混合酸酐的试剂加到酸溶液中,反应中要加碱,如,N-甲基吗啉(NMM)或N-甲基哌啶,这些混合酸酐通常不需要分离就直接跟胺发生缩合反应。
2.应用比较1)乙酸酐乙酸酐(Ac2O)作为一种亲电试剂,常常大规模应用于胺的酰化。
但在酰胺缩合反应中,它很少作为酸的活化试剂,因为形成的混合酸酐在与胺反应时区域选择性较差。
2)特戊酰氯特戊酰氯(PivCl)或三甲基乙酰氯在酰胺缩合中常常被大规模应用于酸活化。
特戊酰氯形成的混合酸酐具有较大的空间位阻,和胺反应有利于区域选择性。
PivCl是手性胺助剂(噁唑烷酮类化合物或者伪麻黄碱)在工业规模上酰化的首选缩合剂。
PivCl用于大规模的好处在于它的价廉、应用广泛,且经处理后得到的副产物特戊酸是无毒的。
但作为一个酰氯,它有刺激性,皮肤接触后会导致化学灼伤,大量应用时要保持良好的通风。
酰胺化反应方法研究进展

酰胺化反应方法研究进展作者:何永富来源:《中国化工贸易·上旬刊》2017年第01期摘要:酰胺合成的反应是有机合成中一类重要的反应,酰胺键广泛存在于医药中间体和生化物质中,本文总结现有酰胺合成的主要方法,以及探索寻找新的合成方法。
关键词:酰胺;酰胺合成;酰胺键酰胺合成的反应是有机合成中一类重要的反应,酰胺键广泛存在于医药中间体和生化物质中。
酰胺的合成有多种方法,如酸胺缩合,胺酯交换,与酰氯或者酸酐反应等,本文主要总结现有酰胺的合成方法,以及探索寻找新的合成方法。
1 酰胺的常见合成方法酰胺键的形成是有机合成中最常见,也是最重要的合成反应之一。
合成酰胺键的基本方法是先活化羧基,将其制备成酰氯,酯,酸酐,叠氮化物等,然后再与胺反应形成酰胺碱。
1.1 羧酸与胺的直接缩合酰化羧酸与胺的直接缩合是合成酰胺的方法之一。
该反应是一个可逆反应,通常采用加入过量的反应物或者在过程中除水的方法,以此来提高收率。
除水的方法有在反应物中加入甲苯进行共沸蒸馏或者加入脱水剂,常用脱水剂有三氯氧磷、五氧化二磷、三氯化磷等。
例如羧酸先与碳酸氢铵生成酰胺的反应[1](图1)。
图1. 苯甲酰胺的合成1.2酰氯法酰卤与氨或胺反应合成酰胺是最简便的方法。
酰卤可分为酰氟、酰氯、酰溴和酰碘,其中酰氯是最为常用的酰化试剂。
酰氯的制备存在多种方法,一般情况下SOCl2、POCl3、PCl5、(COCl)2等试剂被用来与相应的羧酸作用形成酰氯。
一般的酸在二氯亚砜回流数小时后,蒸掉过量的二氯亚砜及溶剂后,再用些甲苯带一下残余的二氯亚砜即可用于下步反应。
酰氯与胺的反应需要在冰水浴下进行,有些反应需要加入DMAP或者DMF来催化,此外为防止反应产生的卤化氢与胺成盐,需要加入碱如三乙胺、吡啶、Na2CO3、 NaHCO3、K2CO3、NaOH、 KOH等来去除卤化氢(图2)。
1.3 活性酯法该方法早期主要应用与混合酸酐的制备,然后再用来与胺反应形成酰胺(图3)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
缩合剂在合成制药工业酰胺化反应中的大规模应用酰胺键的形成是药物化学研究中应用最广泛的一类化学反应。
与以往的文章不同,本文主要评价各类酰胺缩合剂在候选药物合成中由酸和胺缩合成酰胺的大规模应用,突出了每个缩合剂在工业规模上应用的优点及不足。
酰胺键常常存在于活性药物成分(API)结构中。
实际上,酰胺键的形成在制药工业中是最普遍的反应之一,在所有药物化学实验室开展的化学反应中占16%。
然而,酰胺合成最理想的方法,如,羧酸和胺直接缩合成酰胺,同时生成一当量的水,这是唯一的副产物,也是最理想的方法。
这个理想的方法不可行是因为在缩合反应物之间会发生质子交换而形成羧酸铵盐,只有在较强反应条件下(如,高温和微波照射)才能发生缩合反应,显然这和目前候选药物的化学复杂性是不相适应的。
酸活化能促进其与胺的缩合,因此发展在工业规模上活化酸并进而与胺缩合的安全、有效的方法是至关重要的。
在工业生产上选择酰胺缩合剂需要考虑许多方面,理想的试剂应该是价廉、无毒、安全、处理简单、广泛使用、易从反应混合物中除去、仅导致最小量的废水,而且在生产路线快结束形成酰胺键的同时,副产物的检测和清除在监管限制内是优先考虑的事项。
当然,对于一个给定的酸和胺而言,不是所有的缩合剂都表现得一样好,上述过程及酰胺反应条件要同时考虑,以获得高的收率和选择性,好的重复性,在底物有手性中心的情况下,产生较低的差向异构化。
图1描述了2015年6月主流文献中在100 mmol规模以上应用的缩合剂报道的文献数量,基于这些文献的数量,大规模活化羧酸的首选方法依次为:(1)用碳二亚胺类形成活性酯(71例),EDC和DCC作为第一选择;(2)形成酰氯(70例),氯化亚砜和草酰氯是首选试剂;(3)CDI作缩合剂(38例)。
其他引起关注的是用于混合酸酐制备的缩合剂,如特戊酰氯(PivCl)、氯甲酸异丁酯(IBCF)和正丙基磷酸酐(T3P)。
图1. 2015年6月缩合剂应用的参考文献数量,酰胺键生成规模在100 mmol以上后续将对酰胺化反应中缩合剂的应用作一个系列报道,每期介绍一类酰胺键形成所用试剂的情况、作用机理及其大规模应用实例。
本期介绍从酰氯缩合形成酰胺键。
酰氯法缩合形成酰胺键将羧酸转化成相应的酰氯,随后与胺反应是酰胺键形成最古老的方法之一。
酰氯对于胺的高反应活性一般会导致快速偶合,这对于有立体位阻的底物特别有用。
然而,如果酸含有一个α-手性中心的话,会通过乙烯酮或吖内酯中间态异构化,这是酰氯法潜在的一个问题。
大规模制备酰氯常用到几种试剂有:氯化亚砜(SOCl2)、草酰氯((C OCl)2)、三氯氧磷(POCl3)和Vilsmeier试剂(图2),其中SOCl2和(C OCl)2是目前为止应用最广的试剂。
这些方法的缺点是酰氯会产生HCl的副产物,这个可能会导致对酸敏感基团的破坏。
图2. 由酰氯形成酰胺键的试剂结构1. 作用机理对于试剂,如,氯化亚砜(SOCl2)、草酰氯((C OCl)2)和三氯氧磷(POCl3),常常会加入少量的DMF,作为形成酰氯的催化剂。
Scheme 1详细描述了从SOCl2和DMF催化形成酰氯的作用机理,通过形成Vilsmeier-Haack中间体(Vilsmeier 试剂)和重新产生DMF 而得到所需的酰氯。
Vilsmeier 试剂是一个稳定、自由流动的结晶固体,且可以市售的试剂,通过购买可以避免制备以及处理SOCl2或(C OCl)2带来的安全隐患。
但是,市售的Vilsmeier 试剂相对于要制备的酰胺键而言价格较贵,这限制了作为首选试剂的使用。
Scheme 1. 用SOCl2和DMF催化形成酰氯的机理酰氯和胺的反应可以通过使用有机碱,如TEA,DIEA,或吡啶作为缚酸剂,在无水条件下进行,有机碱用来中和HCl副产物。
尽管对水很敏感,酰氯也可以在碱水溶液(NaOH, NaHCO3, K2CO3, K3PO4)存在下在Schotten-Baumann条件下和胺反应。
二氯亚砜是转化酸为酰氯最常见的试剂,一个最主要的原因是成本,该试剂价廉,是制备酰氯最经济有效的方式。
但其缺点是,当它和DMF催化剂一起使用时能形成潜在的二甲氨基甲酰氯,后者在动物模型中是一致癌物质。
形成该副产物的机理见Scheme 2.Scheme 2. 二甲氨基甲酰氯的形成机理2. 应用比较用SOCl2形成酰氯一般常用的溶剂有甲苯、THF、正庚烷、MeCN和甲醚(DME)。
有时SOCl2既作反应物,也作反应溶剂。
反应结束后,过量的SOCl2在分离酰氯前可以通过蒸馏除去,或者直接将此反应混合物用作后续的酰胺化反应。
草酰氯也是制备酰氯常用的试剂,该试剂相比SOCl2有以下几个优点:(1)它的沸点(2)不同于SOCl2/DMF组合,(C OCl)2/DMF 低(分别为61 ℃和75 ℃),更容易通过蒸馏除去;不会形成二甲氨基甲酰氯。
但是会产生当量的CO2和剧毒的CO副产物,这就需要有足够的安全和工程控制来吸收气体。
由(C OCl)2形成酰胺键可以在一些溶剂中按比例缩放,如甲苯,THF,EtOAc,DIEA或MeCN。
反应结束后,可通过蒸馏除去过量的(C OCl)2,这样获得的酰氯一般不经分离,直接和相应的胺反应生成酰胺。
三氯氧磷在大规模酰胺化反应中较少应用,虽然这个试剂可以大量获得,并且与SOCl2一样价格低廉。
而PCl3或PCl5虽然也可以大量市售且在价格上有竞争力,但其用于酰氯的大规模制备在同行评议的文献中还没有实例。
总之,通过市售的酰氯的作为酰胺化试剂用来大规模制备酰胺是可行的,且不需要预先对羧酸进行活化。
需要指出的是,酰溴在使用上有限,主要因为其较高的价格和更少的选择性。
3.实例应用1)二氯亚砜Scheme 3. 活性化合物4合成过程中酰胺键的形成雅培实验室(Abbott Laboratories)的Stone 及其合作者报道了HIV 蛋白酶抑制剂4的制备(Scheme 3),最后一步涉及到酸1和胺3的缩合。
最初药物合成组采用EDC/HOBt进行缩合,但EDC的高成本和有限的供货以及HOBt在处理过程中的危险性,促使他们寻找更适合于大规模生产的缩合方法;另外胺3希望是完全消耗掉,否则4的分离会比较困难。
用T3P/NMM只能得到部分转化且有降解的副产物,然而通过草酰氯或氯甲酸酯得到的活性酯(NHS,或HOBt酯)收率较低,还存在由酸1衍生而来的聚合副产物。
酸1与SOCl2或POCl3反应可以得到酰氯2。
该酰氯是一个可以分离的固体。
为了完全转化得到想要的活性化合物4,作者分别考察了有机碱(吡啶,DMAP,NMM,咪唑)和无机碱(Na2CO3,NaHCO3)作为缚酸剂,发现咪唑是最佳的选择。
在实验室的规模上,酸1溶于THF后用1.25当量的SOCl2处理,0 ℃搅拌1 h,浓缩后残余物溶解在DMF中,随后在0 ℃下加入胺3和咪唑的乙酸乙酯溶液,室温搅拌过夜,反应液处理后用正庚烷/乙酸乙酯结晶,分离得到酰胺4,收率为92%。
(Stoner, E.J.;Stengel, P.J.;Cooper,A. J. Org. Proc. Res. Dev., 1999, 3, 145.)2)草酰氯Scheme 4. 活性化合物32最后一步合成过程中酰胺键的形成礼来公司(Eli Lilly)的Magnus及其同事报道了葡萄糖激酶激活剂32的合成(用于II型糖尿病的治疗)。
其最后一步是羧酸29和2-氨基吡嗪30缩合形成酰胺(Scheme 4)。
在早期的合成路线中,将氨基吡嗪在-45 ℃下加入酰氯30中,会导致多酰化的产物,但通过改变投料顺序可以阻止这些杂质的生成。
因此,酸29与草酰氯和催化量的DMF在THF中于30 ℃以下反应,生成酰氯30,再将酰氯30加入到氨基吡嗪和吡啶的溶液中,维持反应液温度在30 ℃以下。
反应1 h,吡啶盐酸盐副产物可以通过过滤除去,加水除去过量的吡啶,酸碱萃取,用甲醇重结晶得到活性化合物32,收率为74%。
尽管酸分子中存在手性中心,这个方案可以避免消旋化,化合物32最后ee值可达到99%以上。
(Magnus,N.A.; Braden,T.M.; Buser,J.Y.; et al. Org. Proc. Res. Dev., 2012, 16, 830.)3)三氯氧磷Scheme 5. 化合物45用POCl3形成酰胺键的合成路线大塚制药(Otsuka Pharmaceutical)的科学家们在制备候选药物45的过程中运用三氯氧磷来形成酰胺键(Scheme 5),化合物45是用于治疗缺血和炎症过程中超氧化物阴离子产生的抑制剂。
在吡嗪环合之前,羧酸41要先形成酰胺键。
该酰胺键就是通过POCl3和催化的DMF活化羧酸生成酰氯42,同时用K2CO3游离出胺43。
将酰氯加入胺43中,维持温度为4-19 ℃,反应结束后经过后处理,用异丙醇/水重结晶得到酰胺44,收率为88%,该方法可以达到公斤级的规模。
(Tone, H.; Matoba, K.; Goth, F.; et al. Org. Proc. Res. Dev., 2000, 4, 312.)4)市售Vilsmeier 试剂Scheme 6. 化合物50通过Vilsmeier 试剂活化酸形成酰胺键的合成路线瑞士诺华制药公司(Novartis)的研究人员在制备抗炎候选药物50的过程中就运用了Vilsmeier 试剂(Scheme 6)。
药物化学组开始运用EDC/DMAP来缩合酸46和L-tert-亮氨酸-N-甲基酰胺48,但会产生差向异构化(>5%)。
随后他们就考察替代的缩合剂,用氯甲酸异丁酯(IBCF)形成混合酸酐,但会导致大量酸46复原,这是由于胺可以竞争性地加成到混合酸酐的不期望的羰基中。
其他的试剂,如CDI和CDMT得到的结果也不理想。
然而,市售的Vilsmeier 试剂却能得到较好的缩合,没有检测到差向易购化。
在实验室规模上,酸46在THF中和1.5当量的Vilsmeier 试剂反应得到酰氯47,反应液在0 ℃下搅拌1 h,依次加入NMM,胺48的THF溶液和催化量的DMF,得到大约50 g酰胺49(收率98%)。
(Koch,G.; Kottirsch, G.; Wietfeld, B.; et al. Org. Proc. Res. Dev.2002,6, 652.)。
