最新红外吸收光谱特征峰特别整理版
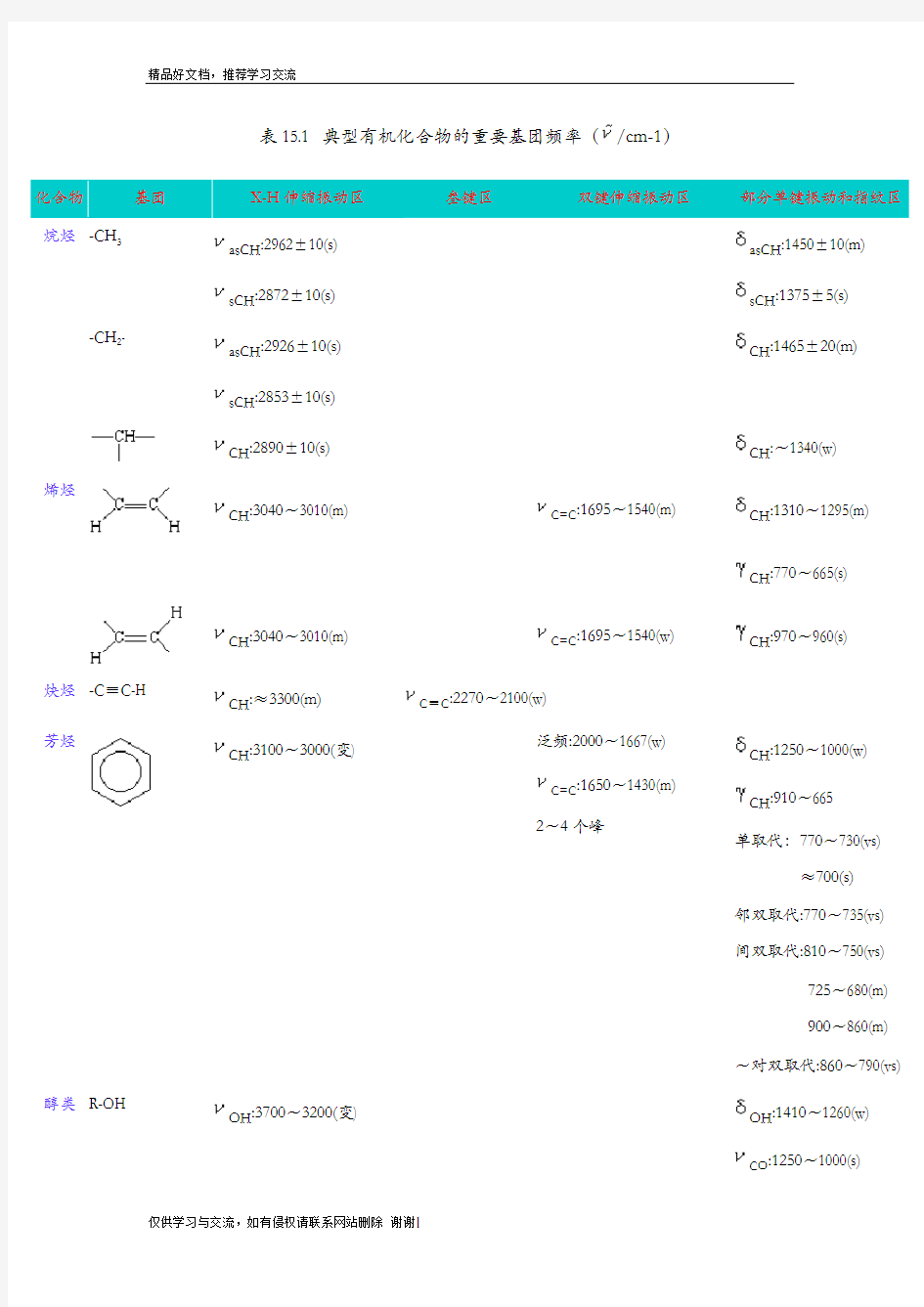

表15.1 典型有机化合物的重要基团频率(/cm-1)
化合物基团X-H伸缩振动区叁键区双键伸缩振动区部分单键振动和指纹区烷烃-CH3
asCH:2962±10(s) asCH:1450±10(m)
sCH:2872±10(s)sCH:1375±5(s)
-CH2-
asCH:2926±10(s)CH:1465±20(m)
sCH:2853±10(s)
CH:2890±10(s)CH:~1340(w)
烯烃
CH:3040~3010(m) C=C:1695~1540(m) CH:1310~1295(m)
CH:770~665(s)
CH:3040~3010(m) C=C:1695~1540(w) CH:970~960(s)
炔烃-C≡C-H
CH:≈3300(m)C≡C:2270~2100(w)
芳烃
CH:3100~3000(变)
泛频:2000~1667(w)
C=C:1650~1430(m)
2~4个峰
CH:1250~1000(w) CH:910~665
单取代:770~730(vs)
≈700(s)
邻双取代:770~735(vs) 间双取代:810~750(vs)
725~680(m)
900~860(m) ~对双取代:860~790(vs)
醇类R-OH
OH:3700~3200(变) OH:1410~1260(w)
CO:1250~1000(s)
OH:750~650(s) 酚类Ar-OH
OH:3705~3125(s) C=C:1650~1430(m) OH:1390~1315(m)
CO:1335~1165(s) 脂肪醚 R-O-R'CO:1230~1010(s)
酮
C=O:≈1715(vs)
醛
CH:≈2820,≈2720(w)
双峰
C=O:≈1725(vs)
羧酸
OH:3400~2500(m) C=O:1740~1690(m) OH:1450~1410(w)
CO:1266~1205(m)
酸酐
C=O:1850~1880(s)
C=O:1780~1740(s)
CO:1170~1050(s)
酯泛频
C=O:≈3450(w)C=O:1770~1720(s) COC:1300~1000(s)
胺-NH2
NH2:3500~3300(m)
双峰NH:1650~1590(s,m) CN(脂肪):1220~
1020(m,w)
CN(芳香):1340~
1250(s)
-NH
NH:3500~3300(m) NH:1650~1550(vw) CN(脂肪):1220~
1020(m,w)
CN(芳香):1350~
1280(s)
酰胺
asNH:≈3350(s)C=O:1680~1650(s) CN:1420~1400(m)
sNH:≈3180(s)NH:1650~1250(s) NH2:750~600(m)
NH
:≈3270(s)
C=O :1680~1630(s)
NH +CN :1750~1515(m)
CN +NH :1310~1200(m)
C=O
:1670~1630 酰卤
C=O
:1810~1790(s)
腈
-C≡N
C≡N :2260~2240(s)
硝基 化合物
R-N02
NO2:1565~1543(s)
NO2:1385~1360(s) CN :920~800(m)
Ar-NO2 NO2:1550~1510(s) NO2:1365~1335(s) CN :860~840(s)
不明:≈750(s)
吡啶类
CH :≈3030(w)
C=C 及
C=N : 1667~1430(m)
CH :1175~1000(w) CH :910~665(s) 嘧啶类
CH :3060~3010(w)
C=C 及
C=N :
1580~1520(m)
CH :1000~960(m) CH :825~775(m)
* 表中vs,s,m,w,vw 用于定性地表示吸收强度很强,强,中,弱,很弱。
中红外光谱区一般划分为官能团区和指纹区两个区域,而每个区域又可以分为若干个波段。
官能团区
官能团区(或称基团频率区)波数范围为4000~1300cm -1, 又可以分为四个波段。 ★
4000~2500cm -1 为含氢基团x —H (x 为O 、N 、C )的伸缩振动区,因为折合质量小,所以波数高,主要有以下五种基团吸收
● 醇、酚中O —H :3700~3200cm -1, 无缔合的O —H 在高 一侧,峰形尖锐,
强度为s
缔合的O —H 在低
一侧, 峰形宽钝, 强度为s
● 羧基中O —H : 3600~2500
cm -1, 无缔合的O —H 在高 一侧,峰形尖
锐,
强度为s
缔合可延伸至2500 cm -1,峰非常宽钝, 强度为s
● N —H : 3500~3300 cm -1, 伯胺有两个H ,有对称和非对称两个峰, 强度为s—m
叔胺无H ,故无吸收峰
●
C —H : <3000 cm -1为饱和C :
~2960 cm -1 (),~2870 cm -1
()
强度为m-s
~2925 cm -1 (),~2850 cm -1 (
) 强度为m-s
~2890 cm -1
强度为w
>3000 cm -1为不饱和C : (及苯环上C-H)3090~3030
cm -1
强度为m
~3300 cm -1
强度为m
● 醛基中C —H :~2820及~2720两个峰
强度为m-s
★
2500~2000 cm -1 为叁键和累积双键伸缩振动吸收峰,主要包括-C≡C -、-C≡N 叁键的伸缩振动及
、
等累积双键的非对称伸缩振动,呈现中等强
度的吸收。在此波段区中,还有S —H 、Si —H 、P —H 、B —H 的伸缩振动。
★2000~1500 cm-1为双键的伸缩振动吸收区,这个波段也是比较重要的区域,主要包括以下几种吸收峰带。
●C=O伸缩振动,出现在1960~1650 cm-1,是红外光谱中很特征的且往往是最强的吸
收峰,以此很容易判断酮类、醛类、酸类、酯类、酸酐及酰胺、酰卤等含有C=O的有机化合物。
●C=N、C=C 、N=O的伸缩振动,出现在1675~1500 cm -1。在这波段区中,单核芳烃
的C=C骨架振动(呼吸)呈现2~4个峰(中等至弱的吸收)的特征吸收峰,通常分为两组,分别出现在1600 cm-1和1500 cm-1左右,在确定有否芳核的存在时具有重要意义。
●苯的衍生物在2000~1670 cm-1波段出现C—H面外弯曲振动的倍频或组合数。由于
吸收强度太弱,应用价值不如指纹区中的面外变形振动吸收峰,如图15.9所示。如在分析中有必要,可加大样品浓度以提高其强度。
图15.9 苯环取代类型在2000~1667cm-1和
900~600cm-1的谱形
★1500~1300 cm-1饱和C—H变形振动吸收峰,—CH3出现在1380及1450 cm-1两个峰,出现在1470 cm-1,出现在1340 cm-1。这些吸收带强度均为m至w 。
指纹区
指纹区:波数范围为1300~600cm-1。
指纹区可以分为两个波段:
★1300~900cm-1这个波段区的光谱信息很丰富,较为主要的有如下几种:
●几乎所有不含H的单键的伸缩振动,如C—O、C—N、C—S、C—F、C—P、Si—O、
P—O等,其中C—O的伸缩振动在1300~1000cm-1,是该区吸收最强的峰,较易识别。
●部分含H基团的弯曲振动,如RCH=CH2,端烯基C—H弯曲振动为990、910cm-1
的两个吸收峰;RCH=CHR反式结构的C—H吸收峰为970 cm-1(顺式为690 cm-1)
等。
●某些较重原子的双键伸缩振动,如C=S、S=O、P=O等。此外,某些分子的整体骨
架振动也在此区产生吸收。
★900~600cm-1这波段中较为有价值的两种特征吸收:
●长碳链饱和烃,,n≥4时,呈现722cm-1有一中至强的吸收峰,n减小时,
变大;
●苯环上C—H面外变形振动吸收峰的变化,可以判断取代情况,此区域的吸收峰比
泛频带2000~1670cm-1灵敏,因此更具使用价值,见图15.9所示。其吸收峰位置为:无取代的
6个C—H,670~680cm-1,单吸收带;
苯:
单取代苯:5个C—H,690~700cm-1,740~750cm-1,两个吸收带;
邻位双取代
4个C—H,740~750cm-1,单吸收带;
苯:
间位双取代
3个C—H,690~700cm-1,780~800cm-1,两个吸收带;
苯:
另一个C—H,~860cm-1,弱带,供参考;
对位双取代
2个C—H,800~850cm-1,单吸收带。
苯:
这些吸收带的强度为中等(有时强)
编号:710
章节实验二试题:
实验中芦丁和槲皮素的层析检识选用了何种担体?分离原理是什么?
此种担体较常用的移动相是什么?
为何选用AlCl3作显色剂?
写出槲皮素结构式。
【答案】
1.聚酰胺
2.原理是氢键吸附。
3.常用水—乙醇不同比例为移动相。
4.芦丁与槲皮素为黄酮类,且都有5-OH、邻二酚羟基,槲皮素还有3-OH,与AlCl3反应可显黄绿色荧光。编号:716
章节2.1试题:
简述中药化学成分划分概况。(写出五种类型)
题号868
【答案】
一.按物质基本类型:有无机成分、有机成分。
二.按化学结构母核或骨架:甙、黄酮、甾类、萜类、醌类等。
三.按酸碱性:酸性、中性、碱性成分。
四.按极性程度:亲脂性(非极性)、中等极性、亲水性(极性)。
五.有无活性:有效(有活性)成分、无效成分。
六.按物质代谢有一级代谢产物、二级代谢产物。
编号:718
章节2.2试题:
某氯仿或乙醚中含有机酸、酚性成分、中性成分、碱性成分,如何用萃取法将它们分离。可用流程表示。
编号:722
章节4.3试题:
在羟基蒽醌中,羟基位置与酸性强弱有何关系?为什么?对碱的溶解性有何不同?
题号874
【答案】
β-OH酸性较强,α-OH酸性较弱。
1.受羰基及p-π共轭效应的影响使β-OH酸性增强可溶于Na2CO3;
2.与羰基形成分子内氢键使α-OH酸性降低,不溶于Na2CO3,可溶于NaOH。
编号:723
章节4.6试题:
羟基蒽醌乙酰化时,乙酰化试剂有哪些种?欲保护α-OH,须用什么方法?为什么?
题号875
【答案】
1.有冰乙酸、醋酐、醋酐+硼酸、醋酐+硫酸、醋酐+吡啶。
2.可用醋酐/硼酸作为乙酰化试剂。
3.硼酸可与α-OH络合形成络合物,并且该络合物不稳定,加水可分解,恢复原结构。
编号:725
章节4.3试题:
羟基蒽醌的酸性与结构有什么关系?
