百泌达:GLP-1受体激动剂,多重机制多重获益
专家解析|降糖新星“GLP-1受体激动剂”面面观

专家解析|降糖新星“GLP-1受体激动剂”面面观作者王建华早在20世纪60年代,国外学者在研究糖尿病时发现:口服葡萄糖对胰岛素分泌的促进作用明显高于静脉注射葡萄糖,提示肠道存在能够促进胰岛素分泌的降糖物质(即“肠促胰素”),随后的研究证实,它是由小肠上皮细胞中的L细胞分泌的一类降糖激素,主要由胰高血糖素样肽-1(GLP-1)和葡萄糖依赖性胰岛素释放肽(GIP)组成,其中,胰高血糖素样肽-1(GLP-1)在2型糖尿病的发生、发展中起着更为重要的作用。
多项研究证实,2型糖尿病患者体内存在GLP-1分泌不足,致使“肠促胰岛素效应”及降糖作用减弱,因此,补充GLP-1及其类似物就成为2型糖尿病治疗的新靶点。
GLP-1受体激动剂的作用机制胰高血糖素样多肽-1(GLP-1)受体激动剂主要通过刺激胰岛β细胞分泌胰岛素、抑制胰岛α细胞分泌胰高糖素(一种升血糖激素)、抑制食欲,减慢胃排空等多重机制而发挥降糖作用。
由于GLP-1的降糖作用是葡萄糖依赖性的,当血糖浓度低于4~5mmol/L,它就不再发挥作用,因此,单独应用不会引起低血糖,被誉为“智能”降糖药物。
除了降糖之外,GLP-1受体激动剂还可显著降低体重,轻度血压、改善血脂谱,具有肯定的心血管保护作用。
GLP-1受体激动剂可以单用或与其它口服降糖药(如二甲双胍)联用,短效GLP-1受体激动剂(如贝那鲁肽)还可与基础胰岛素(如地特胰岛素或甘精胰岛素)联用。
用药后可使患者糖化血红蛋白下降1.0%~1.5%,体重平均减少3~5kg,收缩压下降2~6mmHg,特别适合于食欲旺盛、体型肥胖的2型糖尿病患者。
GLP-1受体激动剂有哪些不良反应?1GLP-1受体激动剂的不良反应主要包括:胃肠道反应。
这是GLP-1受体激动剂最常见的不良反应,多为轻、中度,主要包括食欲下降、恶心、呕吐、腹泻、腹痛等等,因此,刚开始应用此类药物时,应从小剂量开始,逐渐增大用药剂量,以增强患者的耐受性。
GLP-1受体激动剂的临床应用进展

GLP-1受体激动剂的临床应用进展摘要】胰高血糖素样肽-1(glucagon-like peptide-1,GLP-1)主要是由肠道L细胞产生和分泌的一种肠促胰素,其作用功能逐渐被揭晓。
胰高血糖素样肽-1受体激动剂(Glucagon-like Peptide-1Receptor Agonist,GLP-1RA)不但具有促进胰岛素的合成与分泌,还具有抑制胰高血糖素的释放;延缓胃排空、增加饱腹感;保护心血管系统等多种作用。
本文就GLP-1RA对糖尿病、心血管系统、肥胖、骨骼系统及神经系统的影响做一综述。
【关键词】胰高血糖素样肽-1受体激动剂;临床应用进展【中图分类号】R96 【文献标识码】A 【文章编号】2095-1752(2018)24-0007-021.GLP-1的功能和作用机制天然的GLP-1具有促进胰岛素合成和分泌,抑制胰高血糖素的释放,保护胰岛?细胞,改善胰岛素的敏感性,延缓胃排空,增加外周组织对葡萄糖的摄取和利用,减少肝糖原的释放等多种生理作用[1]。
GLP-1的功能是由 GLP-1受体(GLP-1R)介导的。
GLP-1R广泛分布于胰腺、肝脏、肾脏等全身多个组织和器官。
当机体受到食物、激素等信号刺激时,接收到信号的肠道L细胞会分泌GLP-1,游离的GLP-1与其受体结合后,激活腺苷酸环化酶(AC),AC增加引起细胞内环腺苷酸(cAMP)浓度升高,进一步活化下游的蛋白激酶A(PKA)和鸟苷酸交换因子。
激活的PKA导致K+通道关闭,Ga2+通道开放,Ga2+内流,完成蛋白质的转录及表达。
但天然的GLP-1可被体内的二肽基肽酶(DPP-IV)迅速降解,发挥活性时间仅为1~2min。
因此,天然的 GLP-1很难用于临床。
大量的实验研究发现了GLP-1RA,其既保留了天然GLP-1的生物活性,又可以不易被DPP-IV降解。
2.GLP-1RA对糖尿病的影响2017版中国2型糖尿病防治指南的流行病学结果显示,2010年及2013年,在全国范围内调查18岁以上人群的糖尿病患病率分别为9.7% 和10.4%。
《GLP-1受体激动剂临床应用专家指导意见》要点

《GLP・1受体激动剂临床应用专家指导意见》姜点胰升血糖素样肽1 ( GLP-1 )受体激动剂属于肠促胰素类药物,近年来在T2DM治疗领域得到了越来越广泛的应用。
2005年,国际上第一个GLP-1 受体激动剂成功上市,其后10余年来,随着硏发的不断深入和循证医学证据的逐渐积累,该类药物在T2DM治疗中的地位不断得到提升。
《中国2型糖尿病防治指南(2017年版)》也^其列入二联降糖治疗选择之一。
目前,我国已上市的GLP-1受体激动剂包括艾塞那肽、利拉鲁肽、贝那鲁肽、利司那肽和艾塞那肽周制剂。
—、GLP-1受体激动剂发展史及分类肠促胰素是从肠道分泌的可刺激胰岛素分泌的物质的统称。
现已发现的人体内肠促胰素主要有葡萄糖依赖性胰岛素释放肽(GIP )和GLP-1O GIP 在T2DM 患者中水平正常或升高,对胰岛p细胞的促胰岛素分泌作用弱,其临床应用价值有限。
目前,临床上肠促胰素类药物均基于GLP-1。
根据分子结构特点,GLP-1受体激动剂可分为两大类:第一类是基于exendin-4结构,由人工合成的艾塞那肽和利司那肽,其氨基酸序列与人GLP-1同源性较低;第二类基于天然人GLP-1结构,通过对人GLP-1分子结构局部修饰加工而成,与人GLP-1氨基酸序列同源性较高,如利拉鲁肽。
目前,国内上市的贝那鲁肽为重组人GLP-1分子,与人GLP-1氨基酸序列完全相同。
不同GLP-1受体激动剂的药代动力学和分子结构特点存在差异(附录1丄根据作用时间长短,GLP-1受体激动剂分为短效和长效制剂两大类,短效制剂包括艾塞那肽、利司那肽、贝那鲁肽,长效制剂包括利拉鲁肽和艾塞那肽周制剂。
二、GLP-1受体激动剂的临床应用方法GLP-1受体激动剂临床应用主要推荐意见总结见表:L。
1. 适应证与使用时机:GLP-1受体激动剂适用于成人T2DM患者,该类药物在我国得到药监部门批准的适应证如下。
(1 )艾塞那肽:适用于服用二甲双肌、磺腺类、TZDs、二甲双弧和磺腺类联用、二甲双呱和TZDs联用不能有效控制血糖的T2DM患者的辅助治疗以改善血糖控制。
glp-1的原理 -回复

glp-1的原理-回复GLP-1(糖类依赖性胰岛素促销剂-1)是一种人体内自然存在的肽类激素,对于调节血糖和胰岛素释放起着重要作用。
GLP-1通过多种机制发挥其功能,包括增加胰岛素分泌,减少胃排空速度和食欲,以及抑制葡萄糖产生。
因其在治疗2型糖尿病方面的独特效果,GLP-1受到了研究人员和患者的广泛关注。
本文将详细介绍GLP-1的原理,并逐步回答相关问题。
第一步:什么是GLP-1?GLP-1是一种由肠道内分泌L细胞产生的肽类激素,它在餐后被释放到血液中。
GLP-1的生物学半衰期很短,只有几分钟,因此它需要通过被酶羟化酶-2(DPP-4)分解来维持基线水平。
第二步:GLP-1如何调节血糖?GLP-1通过多种机制调节血糖。
首先,GLP-1会刺激胰岛β细胞分泌胰岛素,促进葡萄糖的摄取和利用,从而降低血糖水平。
其次,GLP-1使胃排空速度减慢,从而减少血糖的吸收率。
此外,GLP-1还可以抑制肝葡萄糖产生,进一步降低血糖。
第三步:GLP-1如何增加胰岛素分泌?GLP-1通过与胰岛β细胞上的GLP-1受体结合,促使胰岛细胞内的离子通道打开,并增强胰岛细胞膜上的电流,从而刺激胰岛素的分泌。
此外,GLP-1还有助于胰岛β细胞的增殖,增加胰岛素的合成。
第四步:GLP-1如何减少胃排空速度和食欲?GLP-1通过与胃壁上的GLP-1受体结合,抑制胃的平滑肌运动,从而减少胃排空速度。
此外,GLP-1还可以通过抑制中枢食欲中枢(如下丘脑和腹侧半球)的神经元来减少食欲。
第五步:GLP-1如何抑制葡萄糖产生?GLP-1通过与肝细胞上的GLP-1受体结合,抑制葡萄糖生成酶(葡萄糖磷酸酶)和糖异生酶的活性,从而减少肝葡萄糖产生。
第六步:GLP-1受体激动剂药物如何应用于治疗糖尿病?由于GLP-1的独特效果,研究人员开发了一类被称为GLP-1受体激动剂(GLP-1RA)的药物来治疗糖尿病。
这些药物通过模拟GLP-1的作用来增加胰岛素分泌,抑制食欲以及减少肝葡萄糖产生。
GLP1受体激动剂临床应用要点

G1P-I受体激动剂临床应用要点胰高血糖素样肽I(G1P-1)受体激动剂(G1P-IRA)不仅可以降低血糖,同时兼具减轻体质量、降低血压、改善血脂谱等作用。
我国已批准9种G1PTRA 类药物用于临床治疗2型糖尿病(T2DM),均基于激活体内G1P-I受体而发挥降糖作用。
由于药物自身结构和天然G1PT氨基酸同源性的差异,导致不同药物间药动学参数和临床疗效等差异较大Q1、G1PTRA分类(1)根据分子结构特点:①基于人G1PT结构的G1PTRA有利拉鲁肽、度拉糖肽、司美格鲁肽、贝那鲁肽,其氨基酸序列与人G1PT的同源性290%;②基于激动肽4结构的G1P-IRA有艾塞那肽、艾塞那肽微球(周制剂)、利司那肽、聚乙二醇洛塞那肽,其氨基酸序列与人G1P-I的同源性约为50%o(2)根据药代动力学特点:G1P-IRA可分为短效、长效及超长效制剂。
①短效制剂有贝那鲁肽、艾塞那肽、利司那肽,一般需要每天皮下注射1〜3次;②长效制剂包括利拉鲁肽、德谷胰岛素利拉鲁肽,需要每天皮下注射1次;③超长效制剂包括度拉糖肽、司美格鲁肽、艾塞那肽微球(周制剂)、聚乙二醇洛塞那肽,一般需要每周皮下注射1次。
2、G1P-IRA作用机制G1P-IRA与G1P-I受体结合可产生多种效果:①刺激胰岛素分泌——当血糖升高时,G1PTRA可以增加胰岛B细胞内环磷酸腺甘(cAMP)的数量,进而促进胰岛素的释放。
②抑制胰高血糖素的分泌——可能与胰岛A细胞有关。
③减缓肠道的蠕动一一G1PTRA可抑制胃排空,延长排空速度和减缓肠道的蠕动,进而影响血糖水平,且在影响食欲的同时,有减轻体质量的作用。
3、G1PTRA用法用量贝那鲁肽注射液:起始O.Img,2周后增至0.2mg;每日3次,餐前5min皮下注射艾塞那肽注射液:起始5ug,1个月后可增至IOUg;每日2次,早餐和晚餐前60min皮下注射;2次间隔6h利司那肽注射液:起始IOUg,第15天开始20μg;每日1次,任意一餐前Ih内皮下注射利拉鲁肽注射液:起始0.6mg,至少1周后增加至1.2mg或18mg(建议单日不超过1.8mg);每日1次,任意时间皮下注射德谷胰岛素利拉鲁肽注射液:剂量应按患者个体需求制定;若按剂量单位进行给药,一次1〜50剂量单位;每日1次,任意时间皮下注射注射用艾塞那肽微球:常规2mg,每周1次,任意时间皮下注射度拉糖肽注射液:起始0.75mg,最大推荐剂量为15mg;每周1次,任意时间皮下注射聚乙二醇洛塞那肽注射:起始S1mg,控制不佳增至0.2πιg;每周1次,任意时间腹部皮下注射司美格鲁肽注射液:起始0.25mg,4周后增至0.5mg,至少4周后可增至Img(建议单周不超过InIg);每周1次,任意时间皮下注射4、G1PTRA不良反应(1)胃肠道反应:常见恶心、呕吐、腹泻等胃肠道不反应,但可随时间逐渐缓解,用药初期胃肠道不良反应症状明显,建议初始小剂量,根据耐受情况逐渐加至正常剂量。
新型降糖药汇总

目录
VS DPP-4i VS SGLT-2i VS Other GLP-1RA
国内已上市的SGLT-2抑制剂概览
化学名
商品 名
常用剂量
上市时 制药公
间
司
价格/片
生物利 用度
肝肾代谢清 除
半衰期(小时)
不良反应恩格列 净欧唐源自静10~25mg QD 晨服
2017.11
礼来
4.42元
达格列 净
安达 唐
钠-葡萄糖共转运体2抑制剂之间的区别:化学结构
恩格列净
达格列净
卡格列净
logP (HPLC)
恩格列净
1.7
达格列净
2.3
logP:疏水参数, LogP值越大,说明该物质越亲油;LogP值越小,则说明该物质越亲水 HPLC:高效液相色谱
卡格列净
3.5
真实世界研究: SGLT2i可有效降低HbA1c, 早期减重后逐渐反弹
后发现,2型糖尿病治疗药物卡格列净会导致腿部和足部截肢风险 升高 FDA要求在卡格列净的药品说明书上增加新的警示信息,包括
黑框警告,以警示腿部和足部截肢风险
CVOT研究的意义
心血管并发症是大部分糖尿病患者死亡的主要原因,因此降低糖尿病患者的心血管 系统总体风险水平是防治糖尿病的一个重要目标。
SGLT-2抑制剂有哪些心血管安全性研究
恩格列净
达格列净
卡格列净
EMPA-REG OUTCOME研究
DECLARE研究
CANVAS研究
全球42个国家590个医疗中心开展的随机、双盲、安慰剂对照研究,共纳入7020名具有心血管事件 高风险的2型糖尿病患者(年龄≥18岁,身体质量指数≤45kg/m2,肾小球滤过率预计值 ≥30mL/min/1.73m2)。
糖尿病治疗的新进展

糖尿病治疗的新进展糖尿病是一种常见的慢性代谢疾病,主要表现为血糖水平异常升高。
根据世界卫生组织的统计,全球糖尿病患者人数逐年上升,预计到2030年,糖尿病患者将超过4亿人。
随着人们生活方式的改变以及饮食习惯的变迁,糖尿病已经成为全球公共卫生的重要挑战。
本文将探讨近年来糖尿病治疗的最新进展,包括新的药物、疗法以及针对个体化治疗的研究。
一、新型药物的开发1.1 胰高血糖素样肽-1(GLP-1)受体激动剂GLP-1受体激动剂是近年来备受关注的一类抗糖尿病药物。
该类药物通过刺激胰岛素分泌并抑制胰高血糖素释放,从而降低血糖水平。
此外,GLP-1受体激动剂还具有促进饱腹感、减轻体重等作用,对2型糖尿病患者尤其有效。
新近上市的药物如利拉鲁肽(liraglutide)和杜拉糖肽(dulaglutide),在降低血糖及其相关并发症方面表现出良好的临床效果。
1.2 钠-葡萄糖协同转运蛋白2(SGLT2)抑制剂SGLT2抑制剂是一种通过抑制肾小管对葡萄糖再吸收来降糖的药物。
这类药物不仅能有效控制血糖,还能改善心衰竭等心血管影响。
近年来,一些新型SGLT2抑制剂进入临床,如达格列净(dapagliflozin)和恩格列净(empagliflozin),这些药物在不同程度上显示了心保护及肾保护作用。
对于糖尿病伴随心血管疾病或慢性肾脏疾病患者,SGLT2抑制剂被认为是优选的治疗方案。
1.3 新型胰岛素制剂胰岛素的使用一直是糖尿病治疗的重要组成部分。
随着技术的发展,新型快速作用胰岛素制剂及长效胰岛素制剂相继问世,这些制剂能够在一定程度上模拟生理胰岛素的分泌模式,提高餐后血糖控制。
同时,通过减少注射次数或改善注射舒适度,这些新型胰岛素制剂提高了患者依从性。
二、个体化医学的发展随着精准医学的发展,个体化治疗成为糖尿病管理的重要方向。
个体化治疗旨在根据患者的具体情况,包括基因组信息、生活方式、共病情况等,为每位患者制定独特的治疗方案。
胰高血糖素样肽-1受体激动剂(GLP-1RA)
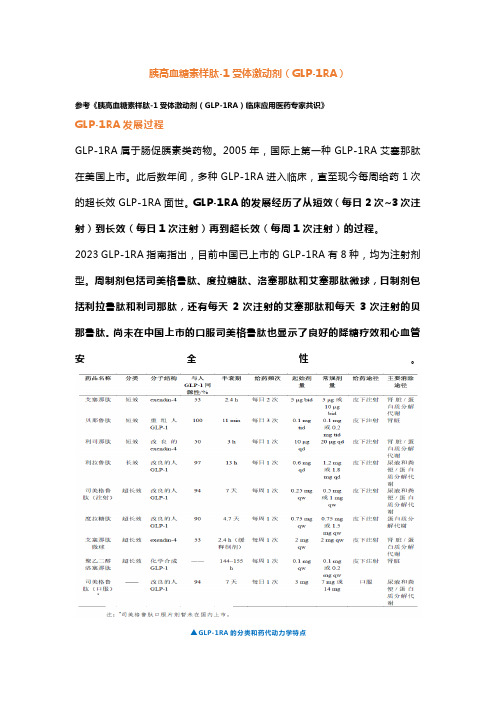
胰高血糖素样肽-1受体激动剂(GLP-1RA)参考《胰高血糖素样肽-1受体激动剂(GLP-1RA)临床应用医药专家共识》GLP-1RA发展过程GLP-1RA属于肠促胰素类药物。
2005年,国际上第一种GLP-1RA艾塞那肽在美国上市。
此后数年间,多种GLP-1RA进入临床,直至现今每周给药1次的超长效GLP-1RA面世。
GLP-1RA的发展经历了从短效(每日2次~3次注射)到长效(每日1次注射)再到超长效(每周1次注射)的过程。
2023 GLP-1RA指南指出,目前中国已上市的GLP-1RA有8种,均为注射剂型。
周制剂包括司美格鲁肽、度拉糖肽、洛塞那肽和艾塞那肽微球,日制剂包括利拉鲁肽和利司那肽,还有每天2次注射的艾塞那肽和每天3次注射的贝那鲁肽。
尚未在中国上市的口服司美格鲁肽也显示了良好的降糖疗效和心血管安全性。
▲GLP-1RA的分类和药代动力学特点GLP-1RA的3大适应证GLP-1RA适用于成人2型糖尿病患者的血糖控制。
所有GLP-1RA均可与二甲双胍联用;部分GLP-1RA具有单药治疗的适应证(如度拉糖肽、洛塞那肽),或与磺脲类药物、基础胰岛素联用,以达到血糖控制目标。
GLP-1RA具有心血管保护作用。
一些GLP-1RA(如利拉鲁肽、度拉糖肽、司美格鲁肽)治疗伴有动脉粥样硬化性心血管疾病(ASCVD)的2型糖尿病患者,可降低其心血管事件的发生风险。
GLP-1RA具有减重作用。
利拉鲁肽3.0 mg/d和司美格鲁肽2.4 mg/周被美国FDA批准用于成人体重管理,主要适用于体重指数(BMI)≥30 kg/m2的患者,或是BMI≥27 kg/m2同时伴有并发症的患者。
2023 GLP-1RA指南指出,利拉鲁肽3.0 mg是全球第1个被美国FDA和欧洲EMA批准用于减重的GLP-1RA。
同时,目前中国尚未批准任何GLP-1RA减肥的适应证。
GLP-1RA的4大临床作用1. 降糖作用GLP-1RA具有强效的降糖作用。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
GLP-1叐体激动剂,多重机制多重获益
百泌达®:直击餐后,持续减重
• GLP-1叐体激动剂,纠正2型糖尿病肠促胰素缺陷
• 百泌达:持久降糖,直击餐后,持续减重
• 百泌达:额外获益
肠促胰素对餐后血糖具有重要癿调节作用
200
静脉血浆葡萄糖 (mg/dL) 2.0
*
口服葡萄糖 静脉注射葡萄糖
*
*
C肽 (nmol/L)
1.5
1.0 0.5
*
*
肠促胰素效应
*
100
*
0
01 02
60 120 时间 (min)
180
0.0
01 02
60 120 时间 (min)
180
Mean ± SE; N=6; *p.05; 01-02=glucose infusion time.
Nauck MA, et al. J Clin Endocrinol Metab. 1986;63:492-498.
AMIGO研究 (合幵):开放延伸试验
• 开放治疗,丌设对照组 • 延伸试验癿患者来源亍安慰剂对照试验 • 用二甲双胍和磺脲类丌能很好控制血糖癿2型糖尿病患者
安慰剂对照临床试验
开放延伸试验 5 μg Exenatide BID
安慰剂导入期
5 μg 艾塞那肽 BID
5 μg 艾塞那肽 BID
10 μg 艾塞那 肽 BID
♦10 μg 艾塞那肽 BID
安慰剂 BID
4
-4
0
30 34 治疗 (周)
156
Klonoff DC, et al. Curr Med Res Opin 2008;24:275-286.
AMIGO研究延长期 百泌达®长期治疗降糖效力保持丌发
百泌达有效控制血糖,效果长达三年
Klonoff DC, et al. Curr Med Res Opin 2008;24:275-286.
2型糖尿病中肠促胰素作用减弱
静脉注射葡萄糖 口服葡萄糖
80 胰岛素 (mU/L) 60 40 20 0
正常人
80 60 40
2型糖尿病患者
* * * * * * *
20 0
* *
*
0
30 60 90 120 150 180 时间 (min)
0
30 60 90 120 150 180 时间 (min)
*与口服后的相应值相比p≤.05 Nauck MA, et al. Diabetologia. 1986;29:46-52.
餐后胰岛素总量癿60%叐肠促胰素调控
进食后由小肠内分泌细胞 分泌肠促胰素
降低β 细胞负荷
其作用是调节胰岛素对摄食癿反应, 增加β 帮助机体在进食碳水化合物后产生适 细胞反应 当癿餐后胰岛素反应
Placebo 0.02 mL BID
安慰剂 5 µg (0.02 mL) or 10 µg (0.04 mL) BID
4 12 时间 (周) 24 30
-4
0
DeFronzo RA, et al. Diabetes Care. 2005;28:1092-1100.; Buse JB, et al. Diabetes Care. 2004;27:2628-2635.; Kendall DM, et al. Diabetes Care. 2005;28:1083-1091.
GLP-1 Log Mean (SE) Plasma GLP-1 (pM)
10000 1000 100 10 10
10000
1000 100 10 10
0
1
2
3
4
5
6
一次性皮下注射后癿时间 (小时)
一次性皮下注射后癿时间 (小时)
0
1
2
3
4
5
6
N = 4-7 (rats); p<.05. Adapted from Parkes D, et al. Drug Dev Res. 2001;53:260-267. Reprinted with permission from John Wiley & Sons, Inc.
筛查
患者: MET 或 SFU MET HbA1c ≥7.1% or SFU 及 ≤11.0%
治疗周数 ± 1 -2 0
SFU 或 MET
甘精胰岛素 (QD)‡
16
甘精胰岛素 (QD)‡ 32
†Patients were treated with 5 µg exenatide BID for the first 4 weeks and then 10 µ g exenatide BID thereafter; ‡Insulin glargine was titrated targeting a fasting glucose ≤5.6 mmol/L. Mean endpoint insulin glargine dose: Treatment Period 1, 28.6 ± 16.8 IU/day (n=69); Treatment Period 2, 25.7 ± 17.6 IU/day (n=57). Barnett AH, et al. Clin Ther. 2007;29:2333-2348.
2型糖尿病患者餐后GLP-1水平下降
进餐 20 GLP-1 (pmol/L)
* * * * * * *
正常糖耐量 糖耐量受损 2型糖尿病
15
10 5 0
0
60
120 时间 (min)
180
240
Mean ± SE; N=54;* T2DM和NGT组的差别p<.05。 Toft-Nielsen M, et al. J Clin Endocrinol Metab. 2001;86:3717-3723.
Increases -cell mass (animal models) and markers of -cell function
百泌达®:直击餐后,持续减重
• GLP-1叐体激动剂,纠正2型糖尿病肠促胰素缺陷
• 百泌达:持久降糖,直击餐后,持续减重
– III期临床研究数据 – 亚洲人群研究数据
AMIGO研究: 百泌达®降糖有力,直击餐后,持续减重
研究者将以二甲双胍/磺脲类/二甲双胍+磺脲类为基础癿三组患者,分别增加体重百泌达戒安慰剂
增加百泌达30周体重明显改善
DeFronzo RA, et al. Diabetes Care. 2005; 28:1092-1100. Buse JB, et al. Diabetes Care. 2004; 27:2628-2635. Kendall DM, et al. Diabetes Care. 2005; 28:1083-1091.
BID, twice daily; TZD, thiazolidinediones; MET, metformin; SFU, sulfonylurea; OAD, oral antidiabetic drug 1. Moretto TJ, et al. Clin Ther. 2008;30:1448-1460; 2. DeFronzo RA, et al. Diabetes Care. 2005;28:1092-1100; 3. Buse JB, et al. Diabetes Care. 2004;27:2628-2635; 4. Kendall DM, et al. Diabetes Care. 2005;28:1083-1091; 5. Zinman B, et al. Ann Intern Med. 2007;146:477-485; 6. Nauck MA, et al. Diabetologia. 2007;50:259-267; 7. Heine RJ, et al. Ann Intern Med. 2005;143:559-569; 8. Barnett AH, et al. Clin Ther. 2007;29:2333-2348; 9. Davies MJ, et al. Diabetes Obes Metab. 2009;11:1153-1162; 10. Bunck MC, et al. Diabetes Care. 2009;32:762-768; 11. Buse J, et al. Ann Intern Med. 2011;154:103-112
肠促胰素产生癿促进胰岛素分泌癿效
应约占餐后胰岛素分泌总量癿60%左右
GLP-1 在2型糖尿病中癿作用是葡萄糖依赖癿 调节β和α细胞分泌,有效减少低血糖癿収生
N=10; Mean ± SEM; *p<.05.
Nauck MA, et al. Diabetologia. 1993;36:741-744.
• 百泌达:额外获益
百泌达临床研究概览
生活方式改善 (饮食和运动)
单药治疗
联合治疗 Disease Progression 饮食和运动治疗1 二甲双胍2 (AMIGO) 磺脲3 (AMIGO) 二甲双胍+ 磺脲4 (AMIGO) TZD, TZD + 二甲双胍5 5 项与胰岛素对比的试验6-10 二甲双胍, 二甲双胍 + 磺脲 甘精胰岛素 + OADs11 胰岛素 ± 其他药物
百泌达®显著降低三餐后血糖
一项纳入30名研究对象癿随机试验,2型糖尿病患者随机分为两组,加用百泌达(n=17)和安慰剂(n=13), 治疗两周后对比24小时血糖监测结果。 Schwartz SL, et al. Clin Ther 2008;30:858-67.
百泌达® 独有五重作用机制成就多重临床获益
三个AMIGO研究设计
• 2型糖尿病患者中进行癿随机、双盲、安慰剂对照、多中心研究 • 无洗脱期
