高考化学高频考点专项练习专题一物质的量(含解析)
2025届高考化学一轮复习专题一物质的量1含解析新人教版

物质的量(1)1、设A N 为阿伏加德罗常数的值。
假如a g 某气体中含有的分子数为b ,则c g 该气体在标准状况下的体积是( ) A. 22.4Abc L aN B. 22.4Aab L cN C. 22.4Aac L bN D.22.4A b L acN 2、两份质量相同的4CH 和3NH 比较,下列结论错误的是( )A.它们的分子个数之比为17:16B.它们的原子个数之比为17:16C.它们的氢原子个数之比为17:12D.它们所含氢的质量比为17:123、阿伏加德罗常数约为6.02×1023mol -1,下列说法中正确的是( )A .22.4LH 2含氢分子数为6.02×1023B .32gO 2中含有的氧原子数为2×6.02×1023C .0.1mol/L NaCl 溶液中,含Na + 的数目为6.02×1022D .标准状况下,22.4L H 2O 含水分子数为6.02×10234、下列说法中正确的是( )A.标准状况下,22.4L·mol -1就是气体摩尔体积B.1mol H 2的质量只有在标准状况下才约为2gC.标准状况下,18g 水的体积为22.4LD.H 2和O 2的混合气体1mol 在标准状况下的体积约为22.4L5、下列各气体: ① 含233.0110 个O 的2CO ; ② 标准状况下6.72 L 的HCl ; ③3.4g 的3NH ; ④0.5mol He 。
四种物质所含的原子总数由少到多的正确依次是( )A.①<③<④<②B.③<①<②<④C.④<①<②<③D.④<②<①<③6、N A 表示阿伏伽德罗常数,下列说法正确的是( )A.0.1mol/L 的CaCl 2溶液中所含Cl -数为0.2N AB.7.8g Na 2O 2与足量水反应,转移电子数为0.2N AC.常温常压下,8g CH 4含有的分子数为0.5N AD.常温下,0.1mol Fe 与酸完全反应时,失去的电子数肯定为0.3N A7、设N A 代表阿伏加德罗常数的值,下列叙述正确的是( )A.1mol C 3H 8O 分子中O-H 键数目肯定为N AB.500℃时,32g SO 2和32g O 2在密闭容器中充分反应生成SO 3的分子数为0.5N AC.H 2O 2+Cl 2=2HCl+O 2反应中,每生成32g O 2,转移电子数为2N AD.将10mL 0.1mol/L FeCl 3溶液制成的Fe(OH)3胶体,胶体粒子数目为0.001N A8、用A N 表示阿伏加德罗常数的值,下列说法中正确的是( )A.1 mol 2N 所含有的原子数为A NB.标准状况下,22.4 L 水中含有的水分子数为A NC.标准状况下,22.4 L 氯化氢所含的原子数为A ND.24g 2O 分子和24g 3O 分子所含的氧原子数目均为1.5Na9、N A 代表阿伏加德罗常数。
高考化学物质的量-经典压轴题及答案解析

高考化学物质的量-经典压轴题及答案解析一、高中化学物质的量练习题(含详细答案解析)1.按要求完成下列填空。
(1)在等体积的NaCl、MgCl2、AlCl3三种溶液中,分别加入等量的AgNO3溶液,恰好都完全反应,则以上三种溶液的物质的量浓度之比为___。
(2)将3.22g芒硝(Na2SO4·10H2O)溶于水中,要使每100个水分子中溶有1个Na+,则需水的质量为__g。
(3)在干燥烧瓶中用向下排空气法收集氨气,由于空气不可能排净,所以瓶内气体对氢气的相对密度为9.5,将此瓶气体倒置于水槽中,烧瓶内液面上升的体积占烧瓶总体积的_______。
(4)100mL 0.3mol/L Na2SO4(密度为d1 g/cm3)和50mL 0.2mol/L Al2(SO4)3(密度为d2 g/cm3)混合,所得密度为d3 g/cm3的混合溶液中SO42-的浓度为___________。
(用含d1,d2, d3的式子表示)(5)已知两种碱AOH和BOH的摩尔质量之比为5:7,现将7mol AOH与5mol BOH混合后,从中取出5.6g,恰好可以中和100ml浓度为1.2mol/L的盐酸,则AOH的摩尔质量为_____。
(6)标准状况下,用一定量的水吸收HCl气体后制得浓度为1.0mol/L,密度为1.0365g/cm-3的盐酸。
请计算1体积水吸收_______体积的HCl可制得上述氨水。
【答案】6:3:2 34.2 56(或83.3%) 6d3/(10 d1+5 d2)mol/L 40g/mol 22.4【解析】【详解】(1)设NaC1、MgCl2、A1Cl3的物质的量分别为x、y、z,由分别加入等量的AgNO3溶液,恰好都完全反应,则种溶液中Cl-的物质的量相等,x=y×2=z×3,解得x:y:z=6:3:2,因溶液的体积相同,则物质的量之比等于浓度之比,所以浓度之比为6:3:2;故答案是:6:3:2;(2)3.22g芒硝的物质的量为3.22/322=0.01mol,所以溶液中n(Na+)=2n(Na2SO4·10H2O)=0.01×2=0.02mol,每100个水分子中溶有1个钠离子,所以n(H2O)=100n(Na+)=2mol,0.01mol Na2SO4·10H2O 中含有水的物质的量为0.01×10=0.1mol,所以需要的水的物质的量为2-0.1=1.9mol,所以需要水的质量为1.9mol×18g/mol=34.2g;故答案是:34.2;(3)用排气法收集氨气后,收集到的氨气气体不纯,含有空气;空气的平均相对分子质量为29,混合气体的平均相对分子质量为: 9.5×2=19;设烧瓶的容积为V L,氨气的体积为xL,空气的体积为(V-x)L,则有:[17x/V m+(29×(V-x)/V m)]÷(V/V m)=19,解之得:x=56V;将此瓶气体倒置于水槽中,进入烧瓶的液体体积为氨气体积,即56V,烧瓶内液面上升的体积占烧瓶总体积为:(56V)/V=56(或83.3%);故答案是:56(或83.3%);(4)混合液的质量为(100d1+50d2)g,混合后溶液的体积为:[(100d1+50d2)÷d3]mL=[(100d1+50d2)÷d3]×10-3L;溶液混合后n(SO42-)=(0.1×0.3×1+0.05×0.2×3)=0.06mol;根据c=n/V可知,混合溶液中SO42-的浓度为:0.06÷[(100d1+50d2)÷d3]×10-3=60 d3/(100d1+50d2)mol/L=6d3/(10d1+5d2)mol/L故答案是:6d3/(10d1+5d2)mol/L;(5)设AOH和BOH的摩尔质量分别为5x g/mol和7x g/mol,n(HCl)=n(OH-)=0.1×1.2=0.12mol;7mol AOH与5mol BOH混合物中含有n(OH-)=7+5=12,根据题意可知,5.6g混合碱中含有n(OH-)=0.12mol,则含有n(OH-)=12mol时,混合碱的质量为560g;根据7mol×5x g/mol+5mol×7x g/mol=560g可知,x=8,所以AOH的摩尔质量为40g/mol;故答案是:40g/mol;(6)假设溶液体积为1.00L,1.00L盐酸中含氯化氢的物质的量为:1L×1mol/L=1mol,V(HCl)=1×22.4=22.4L;1.00L盐酸中含水的质量为:m(H2O)=1×1.0365×103-1×36.5=1000g,V(H2O)=1L;标准状况下,1体积水吸收氯化氢的体积为V=[V(HCl)/ V(H2O)]×1L=22.4L;故答案是:22.4。
高考化学物质的量的综合热点考点难点含答案解析

高考化学物质的量的综合热点考点难点含答案解析一、高中化学物质的量练习题(含详细答案解析)1.按要求填空,已知N A为阿伏伽德罗常数的数值。
(1)标准状况下,2.24L Cl2的质量为____;有__个氯原子。
(2)含0.4mol Al3+的Al2(SO4)3中所含的SO42-的物质的量是____。
(3)阻燃剂碱式碳酸铝镁中OH-与CO32﹣质量之比为51:300,则这两种离子的物质的量之比为____。
(4)质量相同的H2、NH3、SO2、O3四种气体中,含有分子数目最少的是____。
(5)标准状况下,3.4g NH3的体积为___;它与标准状况下____L H2S含有相同数目的氢原子。
(6)10.8g R2O5中氧原子的数目为3.01×1023,则元素R的相对原子质量为___;R元素名称是___。
(7)将10mL 1.00mol/L Na2CO3溶液与10mL 1.00mol/L CaCl2溶液相混和,则混和溶液中Na+的物质的量浓度为___,混和溶液中Cl-的物质的量___(忽略混合前后溶液体积的变化)。
(8)a个X原子的总质量为b g,则X的相对原子质量可以表示为____(9)已知CO、CO2混合气体的质量共11.6g,在标准状况下的体积为6.72L,则混合气体中CO的质量为___;CO2在相同状况下的体积为___。
(10)由CH4和O2的组成的混和气体,在标况下的密度是H2的14.5倍。
则该混合气体中CH4和O2的体积比为___。
【答案】7.1g 0.2N A或1.204×1023 0.6mol 3:5 SO2 4.48L 6.72 14 氮 1mol/L0.02mol baN A或6.02×1023ba2.8g 4.48L 3:13【解析】【分析】(1)先计算标准状况下,2.24L Cl2的物质的量,再计算氯气的质量和氯原子个数;(2)由化学式计算硫酸根的物质的量;(3)由两种离子的质量比结合摩尔质量计算两种离子的物质的量之比;(4)由n=mM可知,质量相同的不同气体,气体的摩尔质量越大,物质的量越小,分子数越小;(5)先计算标准状况下,3.4g NH3的物质的量,再计算气体体积和所含氢原子的物质的量,最后依据氢原子的物质的量计算硫化氢的体积;(6)由R2O5的质量和所含氧原子个数建立关系式计算R的相对原子质量;(7)将10mL 1.00 mol/L Na2CO3溶液与10mL 1.00mol/L CaCl2溶液相混和发生反应,生成碳酸钙沉淀和氯化钠,反应过程中Na+和Cl-的物质的量不变;(8)先计算a个X原子的物质的量,再依据质量计算X的摩尔质量;(9)依据混合气体的质量和体积建立求解关系式求得一氧化碳和二氧化碳的物质的量,在分别计算一氧化碳质量和二氧化碳体积;(10)先计算混合气体的平均相对分子质量,再依据公式计算甲烷和氧气的体积比。
高考化学物质的量的综合题试题及答案解析
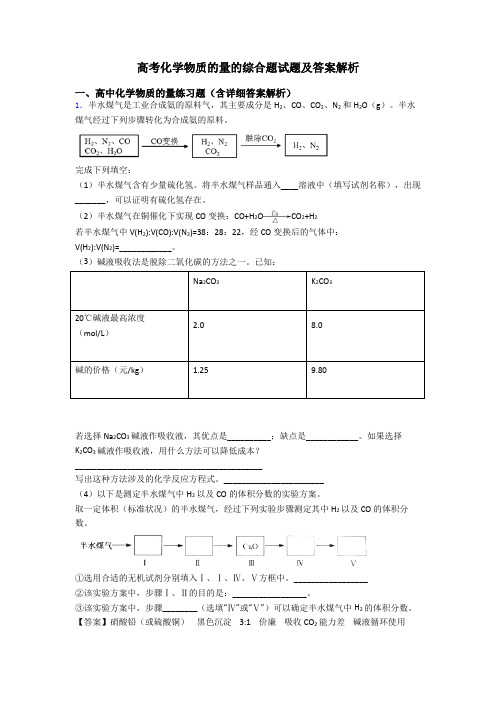
高考化学物质的量的综合题试题及答案解析一、高中化学物质的量练习题(含详细答案解析)1.半水煤气是工业合成氨的原料气,其主要成分是H2、CO、CO2、N2和H2O(g)。
半水煤气经过下列步骤转化为合成氨的原料。
完成下列填空:(1)半水煤气含有少量硫化氢。
将半水煤气样品通入____溶液中(填写试剂名称),出现_______,可以证明有硫化氢存在。
(2)半水煤气在铜催化下实现CO变换:CO+H2O CO2+H2若半水煤气中V(H2):V(CO):V(N2)=38:28:22,经CO变换后的气体中:V(H2):V(N2)=____________。
(3)碱液吸收法是脱除二氧化碳的方法之一。
已知:Na2CO3K2CO320℃碱液最高浓度(mol/L)2.08.0碱的价格(元/kg) 1.259.80若选择Na2CO3碱液作吸收液,其优点是__________;缺点是____________。
如果选择K2CO3碱液作吸收液,用什么方法可以降低成本?___________________________________________写出这种方法涉及的化学反应方程式。
_______________________(4)以下是测定半水煤气中H2以及CO的体积分数的实验方案。
取一定体积(标准状况)的半水煤气,经过下列实验步骤测定其中H2以及CO的体积分数。
①选用合适的无机试剂分别填入Ⅰ、Ⅰ、Ⅳ、Ⅴ方框中。
_________________②该实验方案中,步骤Ⅰ、Ⅱ的目的是:_________________。
③该实验方案中,步骤________(选填“Ⅳ”或“Ⅴ”)可以确定半水煤气中H2的体积分数。
【答案】硝酸铅(或硫酸铜)黑色沉淀 3:1 价廉吸收CO2能力差碱液循环使用2KHCO3→K2CO3+CO2↑+H2O除去半水煤气中的CO2(包括H2S)和H2O IV【解析】【分析】【详解】(1)硫化氢能与重金属生成沉淀,所以将半水煤气样品通入硝酸铅(或硫酸铜)溶液中,出现黑色沉淀可以证明有硫化氢存在。
高考化学专题题库∶物质的量的综合题及详细答案

高考化学专题题库∶物质的量的综合题及详细答案一、高中化学物质的量1.将一定质量的镁铝混合物投入200mL硫酸中,固体全部溶解后,向所得溶液中加入5 mol/L的NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V的变化如图所示。
(1)写出Al与NaOH溶液反应的化学方程式___________________;(2)镁和铝的总质量为________g;(3)b点溶液中的溶质为__________,硫酸的物质的量浓度为___________mol/L;(4)生成的氢气在标准状况下的体积为__________L;(5)c点溶液中通入足量的CO2的反应化学方程式为___________。
【答案】2Al+2NaOH+2H2O=2NaAlO2+3H2↑ 9 Na2SO4 2.5 10.08NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3【解析】【分析】由图象可知,从开始至加入NaOH溶液20mL,没有沉淀生成,说明原溶液中硫酸溶解Mg、Al后有剩余,溶液的溶质为H2SO4、MgSO4、Al2(SO4)3,此时发生的反应为:H2SO4+2NaOH=Na2SO4+2H2O;当V(NaOH溶液)=200mL时,沉淀量最大,此过程中Mg2+、Al3+与OH-反应生成Mg(OH)2和Al(OH)3,溶液溶质为Na2SO4;从200mL到240mL,NaOH溶解固体Al(OH)3,发生反应:OH-+ Al(OH)3=AlO2-+2H2O,据此分析解答。
【详解】(1)Al与NaOH溶液反应产生NaAlO2和H2,反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑;(2)根据图象可知Mg(OH)2和Al(OH)3的物质的量之和为0.35mol,从200mL到240 mL,NaOH溶解Al(OH)3,当V(NaOH溶液)=240mL时,沉淀不再减少,此时全部为Mg(OH)2,物质的量为0.15mol,Al(OH)3的物质的量为0.35mol-0.15mol=0.2mol,由元素守恒可知n(Al)=n[Al(OH)3]=0.20mol,n(Mg)=n[Mg(OH)2]=0.15mol,所以镁和铝的总质量为m(Al)+m(Mg)=0.20mol×27g/mol+0.15mol×24g/mol=9g;(3)沉淀量最大时为Mg(OH)2和Al(OH)3,溶液中溶质为Na2SO4,根据钠元素守恒可知此时n(Na2SO4)等于200mLNaOH溶液中含有的n(NaOH)的0.5倍,所以n(Na2SO4)=0.5×5mol/L×0.2L =0.5mol,所以H2SO4的物质的量浓度c(H2SO4)=0.50.2Lmol=2.5mol/L;(4)根据以上分析,n(Al)=0.2mol,n(Mg)=0.15mol,由于Al是+3价金属,Mg是+2价的金属,所以金属失去电子的物质的量n(e-)=3n(Al)+2n(Mg)=0.2mol×3+ 0.15mol×2=0.9mol,根据反应过程中得失电子守恒,可知反应产生氢气的物质的量n(H2)=12n(e-)=0.45mol,则在标准状况下的体积V(H2)=0.45mol×22.4L/mol=10.08L;(5)在b点时溶液中溶质为Na2SO4,沉淀量为Mg(OH)2和Al(OH)3,在b→c过程中发生反应:NaOH+Al(OH)3=NaAlO2+2H2O,至c点,该反应恰好反应完全,故c点溶液的溶质为Na2SO4、NaAlO2,由于酸性:H2CO3>Al(OH)3,所以c点溶液中通入足量的CO2,NaAlO2、CO2、H2O反应产生Al(OH)3和NaHCO3,反应的化学方程式为NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3。
高考化学-物质的量-专题练习有答案

高考化学专题练习物质的量一、选择题1.A N 为阿伏加德罗常数的值。
下列说法正确的是( ) A .18 g 2D O 和18 g 2H O 中含有的质子数均为10A N B .2 L0.5 -mol L 亚硫酸溶液中含有的H +离子数为2A NC .过氧化钠与水反应时,生成0.1 mol 氧气转移的电子数为0.2A ND .密闭容器中2 mol NO 与1 mol 2O 充分反应,产物的分子数为2A N 2.若A N 表示阿伏加德罗常数,下列说法正确的是( ) ①常温常压下,21 g 氧气和27 g 臭氧中含有的氧原子总数为3A N②含0.2 mol 硫酸的浓硫酸与足量的铜反应,转移的电子数一定小于0.2A N ③0.6 g 3CaCO 和32Mg N 的混合物中所含质子数为0.3A N ④等物质的量的2SO 和3SO 中含S 原子数均为A N A .①B .①②C .①②③D .①②③④3.A N 表示阿伏加德罗常数的值,下列叙述错误的是( )A .2 g 162D O 中含有的质子数、中子数、电子数均为A NB .78 g 22Na 0和2Na S 的混合物中含有的Na +数一定为2A NC .标准状况下,5.6 L 2O 作氧化剂时转移电子数一定为A ND .500 mL2 -mol L 23Na O 溶液中含C 微粒总数一定为A N 4.下列叙述正确的是( )A .常温常压下,4.6 g 2NO 气体约含有231.8110⨯个原子B .在标准状况下,80 g 3SO 所占的体积约为22.4 LC .常温下,0.1 mol/L 醋酸的pH 约为1D .标准状况下,22.4 L 氯气与足量氢氧化钠溶液反应,转移的电子数为2A N 5.设A N 为阿伏加德罗常数的值,下列说法正确的是( ) A .标准状况下,1.12 L 4CCL 含有C Cl -键的数目为0.2A NB .标准状况下,2.24 L 氯气中含有的3517Cl 数目一定为0.2A N C .常温常压下,4.4 g 2CO 与2N O 的混合气体中含有的原子总数为0.3A N D .80 mL10 -mol L 盐酸与足量2MnO 加热反应,产生的2Cl 分子数为0.2A N 6.用A N 表示阿伏加德罗常数的值,下列说法正确的是( ) A .1 mol OH 中含有9A N 个电子 B .28 g CO 气体中含有A N 个氧原子 C .1 L1 mol/L 3AlCl 溶液中含有A N 个3Al +D .常温常压下,11.2 L 甲烷气体中含有的分子数为0.5A N7.设A N 为阿伏加德罗常数的数值,下列说法中正确的是( )A .在密闭容器中加入1.5 mol 2H 和0.5 mol 2N ,充分反应后可得到A N 个3NH 分子B .1 mol Mg 与足量2O 或2N 反应生成MgO 或32Mg N 均失去2A N 个电子C .1.0 L0.1 -mol L 2Na S 溶液中含有的2S 数目为0.1A ND .标准状况下,22.4 L 4CCl 中含有的4CCl 分子数为A N 8.设A N 为阿伏加德罗常数的值,下列叙述正确的是( ) A .常温常压下,2.24 L 4CH 中含有0.4A N 个共价键 B .100 mL1 -mol L 2NaAlO 溶液中含有0.1A N 个2AlO - C .常温下,5.6 g Fe 与足量稀3HNO 反应,转移0.2A N 个电子 D .标准状况下,121.12L H -和220.2g H 均含有0.1A N 个质子 9.设A N 为阿伏加德罗常数的值,下列说法正确的是( ) A .1 mol 乙酸和1 mol 乙醇充分反应生成的水分子数为A N B .6.8 g 液态4KHSO 中含有0.1A N 个阳离子C .标况下的2NO 气体22.4 L ,其中含有的氮原子数为A ND .常温常压下,3.0 g 含甲醛的冰醋酸中含有的原子总数为0.4A N 10.对相同状况下的1218C O 和142N 两种气体,下列说法正确的是( ) A .若质量相等,则质子数相等 B .若原子数相等,则中子数相等 C .若分子数相等,则体积相等 D .若体积相等,则密度相等11.同温同压下,甲容器中充满352Cl ,乙容器中充满372Cl ,下列叙述不正确的是( ) A .若两种气体体积相等,则甲、乙两容器中气体密度之比为35:37 B .若两种气体体积相等,则甲、乙两容器中气体分子数之比为35:37 C .若两种气体质量相等,则甲、乙两容器中气体所含质子数之比为37:35 D .若两种气体体积相等,则甲、乙两容器中气体所含中子数之比为9:1012.一定温度和压强下,用mg 的4222CH CO O SO 、、、四种气体分别吹出四个体积大小不同的气球,下列说法中正确的是( )A .气球②中装的是2OB .气球①和气球③中气体分子数相等C .气球①和气球④中气体物质的量之比为4:1三种气体,当隔板静止时,、内的气体密度相等,下列说法不正确的是()2A C H CH CO-mol L的硫酸铜溶液,下列实验用品及实验操作都正确的是(容量瓶容积480 mL硫酸铜:480 mL胆矾:500 mL硫酸铜:500 mL胆矾:-mol L NaOH溶液的过程:该同学的错误步骤有(A4B3C2D1滴定。
高考化学物质的量的综合热点考点难点含答案解析

高考化学物质的量的综合热点考点难点含答案解析一、高中化学物质的量1.物质的量是高中化学中常用的物理量,请回答下列问题:(1)某硫酸钠溶液中含有3.01×1023个Na +,则溶液中SO 42-的物质的量是_____mol 。
(2)在标准状况下,4.48 L HCl 气体溶于水配成500 mL 溶液,其物质的量浓度为_____________。
(3)在标准状况下,1.7 g 氨气所占的体积约为_________L ,与_____mol H 2S 含有相同的氢原子数。
(4)7.8 g Na 2X 中含Na + 0.2 mol ,则X 的摩尔质量是_____________________。
(5)实验室需要0.3 mol•L -1硫酸溶液480 mL 。
①配制过程用到的玻璃仪器除烧杯、量筒、玻璃棒、胶头滴管、试剂瓶外,还需要______________。
②需量取质量分数为98%、密度为1.84 g•cm -3的浓硫酸的体积为______mL 。
③配制过程中需先在烧杯中将浓硫酸进行稀释,操作方法是:_______________。
【答案】0.25 0.4 mo•L -1 2.24 0.15 32 g•mo l -1 500mL 容量瓶 8.2 将浓硫酸沿烧杯内壁缓缓注入盛有水的烧杯中并用玻璃棒不断搅拌【解析】【分析】(1)硫酸钠为强电解质,完全电离,1molNa 2SO 4电离产生2molNa +和1molSO 42-; (2)依据m V n V =计算氯化氢的物质的量,依据n c V =计算溶液中氯化氢的物质的量浓度;(3)依据m V m n==V M结合氨气与硫化氢分子构成计算解答; (4)由钠离子物质的量计算Na 2X 的物质的量,根据mM=n 计算Na 2X 的摩尔质量,进而计算X 的相对原子质量;(5)①依据配制溶液的体积,选择需要的容量瓶;②依据1000c Mw ρ=计算硫酸的物质的量浓度,依据稀释过程中溶质的物质的量不变计算需要浓硫酸的体积; ③依据浓硫酸稀释的正确操作解答,注意浓硫酸的密度大于水,稀释产生大量的热。
2025届高考化学一轮复习专题一物质的量4含解析新人教版

物质的量(4)1、阿伏加德罗常数的值为N A下列说法不正确的是( )A.常温常压下,2g D2O中含中子数为N AB.标准状况下,22.4L已烷中碳原子数为6N AC.2.4g Mg在空气中充分燃烧,转移电子数为0.2N AD.28g乙烯与丙烯(C3H6)的混合气体中含有的碳氢键数目为4N A2、N A表示阿伏加德罗常数的值,下列说法正确的是( )A.标准状况下,11.2L水中含有分子的数目为0.5N AB.100mL 0.2mol·L-1的FeCl3溶液中,含Fe3+数为0.02N AC.l3溶液中,含Fe3+数为0.02NAC.1 mol Cl2与足量的NaOH溶液反应,转移的电子数为1NAD.在密闭容器中加入0.5 mol N2和1.5 mol H2,充分反应后可得到NH3分3、下列叙述错误的是( )A.5LCH4气体与5LNH3气体的原子个数之比为5:4B.常温常压下,11.2L O3中所含氧原子个数小于1.5N AC.同温、同压下,相同体积的N2和CO气体具有相同的分子数和相同的密度D.同温、同压下,等质量的一氧化碳和二氧化碳的密度比为7:114、N A代表阿伏加德罗常数的值。
下列叙述正确的是( )A.60g丙醇中存在的共价键总数为10N AB.1L0.1mol·L-1的NaHCO3-溶液中HCO3-和CO32-离子数之和为0.1N AC.钠在空气中燃烧可生成多种氧化物。
23g钠充分燃烧时转移电子数为1N AD.235g核互23592U发生裂变反应: 23592U+1n 9038Sr+13654U+10 1n净产生的中子(1n)数为10NA5、设N A为阿佛加德罗常数的值,下列叙述正确的是( )A.0.1L 0.5mol/L CH3COOH溶液中含有的氢离子数为0.05N AB.0.2 mol NaHSO4晶体中含有的阳离子数为0.4N AC.22.4L(标准状况)氩气含有的质子数为18N AD.标准状况下,4.48L CCl4含有的共价键数为0.8N A6、设N A为阿伏加德罗常数的值,下列叙述正确的是( )A.标准状况下,22.4L 二氯甲烷的分子数约为N AB.常温常压下,2.0g 重水(D 2O)中含N A 个中子C. 1310.1L mol L NaHCO -⋅溶液中含3HCO -和23CO -的离子数之和为0.1A ND.电解精炼铜时,若阴极得到的电子数为2N A ,则阳极质量削减64g7、设N A 代表阿伏加德罗常数的数值,下列说法正确的是( )A.22.0g T 2O 中含有的中子数为10N AB.肯定条件下,6.4g 铜与过量的硫反应,转移电子数目为0.2N AC.在标准状况下,2.8g N 2和2.24L CO 所含电子数均为1.4N AD.标准状况下,22.4L CH 2Cl 2中含C-H 键数为2N A8、下列叙述正确的是(用N A 代表阿伏加德罗常数的值)( )A.5.6g 铁与足量盐酸反应转移的电子数为0.3N AB.常温常压下,80g SO 3含有的氧原子数为3N AC.22.4L CH 4与18g H 2O 所含有的质子数均为10N AD.常温常压下,22.4L CO 2和SO 2混合气体含有2N A 个氧原子9、设N A 为阿伏加德罗常数的值,下列说法正确的是( )A.标准状况下,22.4L CCl 4中含CCl 4分子数为N AB.5.6g 铁和6.4g 铜分别与0.1mol 氯气完全反应,转移的电子数相等C.0.1mol·L -1 MgCl 2溶液中含Cl -数为0.2N AD.3.9g Na 2O 2晶体中含有的离子总数为0.2N A10、设阿伏加德罗常数为N A ,则下列说法正确的是( )A.标准状况下,22.4L CO 2含22N A 个电子B.22.4L O 3含3N A 个原子C.标准状况下,0.3mol SO 2中含氧原子数为0.3N A 个D.常温下,9.5克MgCl 2固体中含为0.2N A 个离子11、设N A 为阿伏加德罗常数的值,下列说法正确的是( )A.286g Na 2CO 3·10H 2O 晶体中CO 32-数目等于N AB.标准状况下,4.48L NO 和2.24L O 2完全反应,容器内气体分子数为0.2N AC.0.1mol Na 和氧气在肯定条件下反应生成3.5g 氧化物时,失去的电子数为0.2N AD.将含有1mol FeCl 3的饱和溶液滴入沸腾蒸馏水中,所得胶体中含胶粒数目为N A12、设N A表示阿伏加德罗常数的值。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
专题一 物质的量考点1 物质的量与阿伏加德罗常数1.[2021吉林长春一检]设N A 代表阿伏加德罗常数的值,下列说法正确的是 ( )A.常温常压下,11.2 L NO 和O 2混合气体的原子数为N AN AC.1 L 0.1 mol ·L -1N AN A2.[2021湖北武汉部分学校质量检测]设N A 是阿伏加德罗常数的值。
下列说法正确的是 ( )A.标准状况下,22.4 L CHCl 3中分子数为N AB.常温常压下,28 g N 2含有的原子数为2N AC.1 L 0.1 mol ·L -1CH 3N AD.常温下,28 g 铁片投入足量浓H 2SO 4中生成SO 2N A3.[2021四川成都摸底考试]设N A 是阿伏加德罗常数的值。
下列说法错误的是 ( )A.1 L 0.1 mol ·L -1 NH 4NO 3N AB.7.8 g Na 2O 2N AC.2.8 g CO 和N 2N AN A4.[2021河南名校一联改编]设N A 为阿伏加德罗常数的值,下列说法正确的是 ( )A.0.1 mol H 2N AB.1 mol N 2H 62+含有的电子数为20N AC.7.8 g Na 2O 2N AD.一定条件下,1 mol N 2和3 mol H 2充分反应生成NH 3的分子数为2N A5.[新素材][2021天津一中月考改编]设N A 为阿伏加德罗常数的值。
下列说法不正确的是( )2N AB.32 g S 8(分子结构:)中的共价键数目为N AC.2 g 由H 218O 和2H 2O 组成的混合物中含有的质子数为N AD.标准状况下,11.2 L Cl 2溶于水,溶液中Cl -、ClO -和HClO 的微粒数之和为N A6.[2020浙江1月选考,20]设[a X+b Y]为a 个X 微粒和b 个Y 微粒组成的一个微粒集合体,N A 为阿伏加德罗常数的值。
下列说法不正确的是( )2(g)+12O 2(g)H 2O(l) ΔH =-286 kJ ·mol -1,则每1 mol [H 2(g)+12O 2(g)]生成1 mol [H 2O(l)]放出286 kJ 热量2O 72−+n e -+14H+2Cr 3++7H 2O,则每生成1 mol Cr 3+转移电子数为3N A3++4OH-[Al(OH)4]-,说明1 mol Al(OH)3电离出H +数为N AD.1 mol CO 2与NaOH 溶液完全反应,则n (C O 32−)+n (HC O 3-)+n (H 2CO 3)=1 mol考点2 物质的量浓度7.25 ℃时,某硫酸铜溶液的溶质质量分数为w ,物质的量浓度为c mol ·L -1,密度为ρ g ·mL -1,将此溶液蒸去a g 水或再向原溶液中加入b g 无水硫酸铜粉末,充分静置并恢复至25 ℃时,均恰好全部转化为CuSO 4·5H 2O 。
则下列关系式正确的是( )A.c=ρρ160 B.w=ρ4ρa=9ba=16b8.[8分](1)给定条件下的物质:①常温下112 mL 液态水(水的密度近似为1 g/mL),②含有40 mol 电子的NH 3, ③含有16N A 个共价键的乙醇,④4 g 氦气,所含分子数目由多到少的顺序是 (填标号)。
(2)某混合气体只含有氧气和甲烷,在标准状况下,该气体的密度为1.00 g/L,则该气体中氧气和甲烷的体积之比为 。
(3)标准状况下,V L 氨气溶解在1 L 水中(水的密度近似为1 g/mL),所得溶液密度为ρ g/mL, 则所得溶液中溶质物质的量浓度是 mol/L 。
(4)将100 mL 硫酸和HCl 的混合溶液分成两等份,向一份中加入含0.2 mol NaOH 溶液时恰好中和,向另一份中加入含0.05 mol BaCl 2溶液时恰好沉淀完全,则原溶液中c (Cl -)= 。
9.[2021陕西西安中学第二次月考改编,12分](1)某同学用托盘天平称量烧杯的质量,天平平衡后的状态如图1所示。
由图可以看出,该同学在操作时的一个错误是 ,烧杯的实际质量为 g 。
图1图2(2)需配制150 mL 0.2 mol ·L -1NaCl 溶液,该同学转移溶液的示意图如图2所示。
指出实验中存在的两个错误: 。
(3)用质量分数为98%、密度为1.84 g ·cm -3的浓硫酸配制1 000 mL 0.1 mol ·L -1的稀硫酸。
①应用量筒量取浓硫酸 mL 。
②配制稀硫酸时需用到的仪器有量筒、小烧杯、玻璃棒、 。
(4)下列操作使所配制溶液的物质的量浓度偏高的是(填标号)。
C.往容量瓶中转移时,有少量液体溅出F.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线一、选择题(每小题6分,共36分)1.[2021湖北部分重点中学联考改编]设N A为阿伏加德罗常数的值。
下列说法正确的是( )A.2 L 0.1 mol·L-1 Na2SiO3溶液中含Si O32−N AB.反应3Si(NH)2Si3N4+N2↑+3H2↑,每生成1 mol N2,转移的电子数为6N AC.1 mol金刚石中含有的C—C键数目为4N AD.用C将6.0 g SiO2完全还原为单质Si,生成的CO2N A2.[2021四川绵阳一诊]设N A是阿伏加德罗常数的值。
下列说法正确的是( ) N AB.1 L CH3COONH4溶液pH=7,其中由水电离出的H+数为10-7N AC.标准状况下的22.4 L氯气与足量铁充分反应,转移的电子数为2N AD.常温常压下,1.12 L CO2与3.9 g Na2O2N A3.[2021湖北龙泉中学期中改编]设N A为阿伏加德罗常数的值。
下列说法正确的是( ) N AB.标准状况下,11.2 L CH2Cl2中所含碳氯键的数目为N AC.1 mol Na2O2与足量SO2反应,转移的电子数目为2N AD.1 mol CH3COOC2H5在稀硫酸中发生水解反应,断裂的化学键数目为N A4.[新角度][2021陕西西安期中改编]误服白磷可用硫酸铜溶液解毒,其原理为11P4+60CuSO4+96H2O20Cu3P+24H3PO4+60H2SO4。
设N A为阿伏加德罗常数的值,下列说法正确的是( )A.1 L 0.1 mol·L-1 H3PO4溶液中所含的H+N AB.该反应中,若消耗1.0 mol CuSO4N AC.3.1 g P4N AN A5.[新情境][2021广东茂名五校一联]海冰是海水冻结而成的咸水冰,海水冻结时,部分来不及流走的盐分(设以NaCl为主)以卤汁的形式被包围在冰晶之间,形成“盐泡”,其大致结构如图所示,若海冰的冰龄达到1年以上,融化后的水为淡水。
下列叙述正确的是( )A.海冰内层“盐泡”越多,密度越小B.海冰内层“盐泡”内的盐分主要以NaCl分子的形式存在C.海冰内层NaCl的浓度约为1×10-4 mol·L-1(设海冰的密度为0.9 g·cm-3)D.海冰冰龄越长,内层的“盐泡”越多6.[2021“四省八校”开学考试改编]N A为阿伏加德罗常数的值。
下列说法正确的是( )A.1 L 0.1 mol·L-1的Na2CO3N AB.常温下,78 g Na2O2中含有的共用电子对数目为2N AC.我国科学家发明了精准剪切碳氢键的新技术,1 mol C2H6O中可供剪切的C—H键数目为5N AN A2与O2的混合气体4 g,质子总数一定为2二、非选择题(共12分)7.[2021河北张家口质检,12分]人体血液里Ca2+的浓度一般采用mg·cm-3来表示。
抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用酸性KMnO4溶液滴定即可测定血液样品中Ca2+的浓度。
某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度。
Ⅰ.【配制KMnO4标准溶液】如图是配制50 mL KMnO4标准溶液的过程示意图。
①②③④⑤⑥(1)请你观察图示判断其中不正确的操作有(填标号)。
(2)其中确定50 mL溶液体积的容器是(填名称)。
(3)如果按照图示操作配制溶液,在其他操作均正确的情况下,所配制的溶液的浓度(填“偏大”或“偏小”)。
Ⅱ.【测定血液样品中Ca2+的浓度】抽取血样20.00 mL,经过上述处理后得到草酸,再用酸化的0.020 mol·L-1 KMnO4溶液滴定,使草酸转化成CO2逸出,这时共消耗12.00 mL 酸性KMnO4溶液。
(4)已知草酸与酸性KMnO4溶液反应的离子方程式为5H2C2O4+2Mn O4-+6H+2Mn x++10CO2↑+8H2O,则x= 。
(5)滴定时,根据现象,即可确定反应达到终点。
(6)经过计算,血液样品中Ca2+的浓度为mg·cm-3。
答案专题一物质的量1.B 常温常压下,11.2 L NO和O2混合气体的物质的量小于0.5 mol,故原子数小于N A,A项错误。
1个—CH3N A,B项正确。
根据元素守恒知,1 L 0.1 mol·L-1N A,C项错误。
苯分子中的碳碳键是一种处于单键、双键之间的特殊键,即苯中不存在碳碳双键,D项错误。
2.B 标准状况下CHCl3为液体,22.4 L CHCl3不为1 mol,所含分子数不为N A,A项错误;常温常压下28 g N2为1 mol,含有的原子数为2N A,B项正确;1 L 0.1 mol·L-1 CH3COOH的水溶液中CH3COOH和H2N A,C项错误;常温下,浓硫酸使铁发生钝化,D项错误。
3.B 由物料守恒可知1 mol NH4NO3中含有2 mol N原子,故1 L 0.1 mol·L-1NH4NO3N A,A项正确;根据反应2Na2O2+2H2O4NaOH+O2↑可知,7.8 g Na2O2,即0.1 mol Na2O2N A,B项错误;CO和N2的摩尔质量均为28 g·mol-1,二者均含14个质子,故2.8 g CO和N2混合气体,即0.1 mol CO和N2N A N A,D项正确。
4.A 一个水分子中有两个共价键,0.1 mol H2N A,A项正确。
1个N2H62+中含有18个电子,1 mol N2H62+中含有的电子数为18N A,B项错误。
Na2O2中含有的离子为Na+和O22−,7.8 g Na2O2N A,C项错误。
一定条件下氮气与氢气合成氨的反应为可逆反应,反应不能进行到底,故生成的氨气分子数少于2N A,D项错误。
