人教版高中化学必修二PPT课件
合集下载
人教版高中化学必修二第一章第三节《化学键》课件(共38张PPT)
活泼的金属元素和酸根离子形成的盐 把NH4+看作是活泼的金属阳离子
金属氧化物:Na2O,Al2O3等
强碱:NaOH Ba(OH)2等
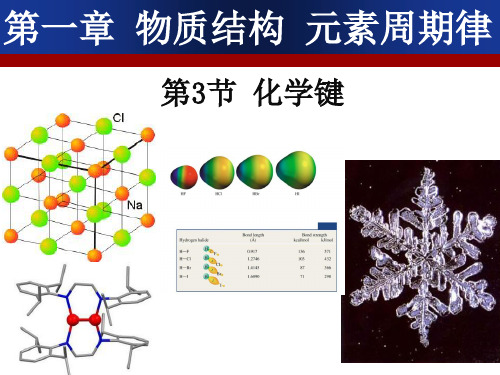
如何表示氯化钠的形成过程--电子式
•资料卡片
电子式 为方便起见,我们在 元素符号周围用“ · ”或 “×”来表示原子的最外 层电子(价电子)。这种 式子叫做电子式。例如:
归纳:分子间作用力与化学键的比较
作用微粒 作用力大小
意义
化学键 相邻原子间 作用力大 范德华力 分子之间 作用力小
影响化学性质和 物理性质
影响物理性质 (熔沸点等)
一些氢化物的沸点
讨论: 为什么HF、H2O和NH3的沸点会反
常呢?
2.氢键
1)形成条件:原子半径较小,非金属性很强的 原子(N、O、F)与H原子形成强极性共价键 ,与另一个分子中的半径较小,非金属性很强 的原子Y (N、O、F),在分子间H与Y产生
1.原子、离子都要标出最外层电子,离子须标明 电荷;
2.阴离子要用方括号括起来;
3.相同的原子可以合并写,相同的离子要单个写 ;
4.不能把“→”写成“====”;
⑴ 用电子式表示氧化镁的形成过程 ⑵ 用电子式表示硫化钾的形成过程
氢气在氯气中燃烧
写出该过程的化学方程式和实验现象 思考:活泼的金属元素和活泼非金属元素化 合时形成离子键。请思考,非金属元素之间 化合时,能形成离子键吗?为什么?
较强的静电吸引,形成氢键
2)表示方法:X—H…Y—H(X.Y可相同或不 同,一般为N、O、F)。
3)氢键能级:比化学键弱很多,但比分子间作 用力稍强
特征:具有方向性。
氢键作用:使物质有较高的熔沸点(H2O、HF 、 NH3) 使物质易溶于水
金属氧化物:Na2O,Al2O3等
强碱:NaOH Ba(OH)2等
如何表示氯化钠的形成过程--电子式
•资料卡片
电子式 为方便起见,我们在 元素符号周围用“ · ”或 “×”来表示原子的最外 层电子(价电子)。这种 式子叫做电子式。例如:
归纳:分子间作用力与化学键的比较
作用微粒 作用力大小
意义
化学键 相邻原子间 作用力大 范德华力 分子之间 作用力小
影响化学性质和 物理性质
影响物理性质 (熔沸点等)
一些氢化物的沸点
讨论: 为什么HF、H2O和NH3的沸点会反
常呢?
2.氢键
1)形成条件:原子半径较小,非金属性很强的 原子(N、O、F)与H原子形成强极性共价键 ,与另一个分子中的半径较小,非金属性很强 的原子Y (N、O、F),在分子间H与Y产生
1.原子、离子都要标出最外层电子,离子须标明 电荷;
2.阴离子要用方括号括起来;
3.相同的原子可以合并写,相同的离子要单个写 ;
4.不能把“→”写成“====”;
⑴ 用电子式表示氧化镁的形成过程 ⑵ 用电子式表示硫化钾的形成过程
氢气在氯气中燃烧
写出该过程的化学方程式和实验现象 思考:活泼的金属元素和活泼非金属元素化 合时形成离子键。请思考,非金属元素之间 化合时,能形成离子键吗?为什么?
较强的静电吸引,形成氢键
2)表示方法:X—H…Y—H(X.Y可相同或不 同,一般为N、O、F)。
3)氢键能级:比化学键弱很多,但比分子间作 用力稍强
特征:具有方向性。
氢键作用:使物质有较高的熔沸点(H2O、HF 、 NH3) 使物质易溶于水
人教版高中化学必修第二册第6章第2节第2课时课件

第六章 化学反应与能量
第二节 化学反应的速率与限度
第2课时 化学反应速率的影响因素
学习目标 素养目标
学法指导
通过实验探究了解 科学探究 1.通过实验探究,特别是实验现象的描述,
外界条件对化学反 与创新意 深刻认识化学反应速率的影响因素——温度、
应速率的影响 识
反应物浓度
结合生活、生产中
2.通过教材图6-16的模型,认识增大压强
• C.增加炭的量 • 【答案】C
D.通入少量CO2气体
• 【解析】A中块状炭变成炭粉,可增大接触面积,从而
增大化学反应速率;B中升高温度,化学反应速率加快;C中
增加炭的量,不能改变其浓度,化学反应速率不变;D中通
入少量CO2气体,c(CO2)增大,化学反应速率增大。
•
化学反应速率受条件的影响很大,下列肯定可以加快
应速率加快,①正确;②增加固体碳的用量,物质的浓度不
变,化学反应速率不变,②错误;③恒容通入CO2,会使 c(CO2)增大,化学反应速率加快,③正确;④恒压下充入N2, 会使容器的容积扩大,导致气体反应混合物的浓度减小,化
学反应速率减慢,④错误;⑤恒容下充入N2,反应混合物的 浓度不变,因此反应速率不变,⑤错误;根据上述叙述可知
• (5)固体表面积:固体颗粒越小,其单位质量的表面积越 大,与其他反应物的接触面积越大,化学反应速率越快。
• (6)反应物状态:一般来说,配成溶液或反应物是气体, 都能增大反应物之间的接触面积,有利于增大反应速率。
• (7)形成原电池,可以增大氧化还原反应的反应速率。
[典例精练]
• 下列有关化学反应速率的说法正确的是
• 【答案】D • 【解析】Fe在98%的浓硫酸中发生钝化,不生成H2,A 错误;盐酸中加入NaCl溶液相当于把盐酸稀释,c(H+)减小, 反应速率减小,B错误;升高温度,反应速率增大,C错误。
第二节 化学反应的速率与限度
第2课时 化学反应速率的影响因素
学习目标 素养目标
学法指导
通过实验探究了解 科学探究 1.通过实验探究,特别是实验现象的描述,
外界条件对化学反 与创新意 深刻认识化学反应速率的影响因素——温度、
应速率的影响 识
反应物浓度
结合生活、生产中
2.通过教材图6-16的模型,认识增大压强
• C.增加炭的量 • 【答案】C
D.通入少量CO2气体
• 【解析】A中块状炭变成炭粉,可增大接触面积,从而
增大化学反应速率;B中升高温度,化学反应速率加快;C中
增加炭的量,不能改变其浓度,化学反应速率不变;D中通
入少量CO2气体,c(CO2)增大,化学反应速率增大。
•
化学反应速率受条件的影响很大,下列肯定可以加快
应速率加快,①正确;②增加固体碳的用量,物质的浓度不
变,化学反应速率不变,②错误;③恒容通入CO2,会使 c(CO2)增大,化学反应速率加快,③正确;④恒压下充入N2, 会使容器的容积扩大,导致气体反应混合物的浓度减小,化
学反应速率减慢,④错误;⑤恒容下充入N2,反应混合物的 浓度不变,因此反应速率不变,⑤错误;根据上述叙述可知
• (5)固体表面积:固体颗粒越小,其单位质量的表面积越 大,与其他反应物的接触面积越大,化学反应速率越快。
• (6)反应物状态:一般来说,配成溶液或反应物是气体, 都能增大反应物之间的接触面积,有利于增大反应速率。
• (7)形成原电池,可以增大氧化还原反应的反应速率。
[典例精练]
• 下列有关化学反应速率的说法正确的是
• 【答案】D • 【解析】Fe在98%的浓硫酸中发生钝化,不生成H2,A 错误;盐酸中加入NaCl溶液相当于把盐酸稀释,c(H+)减小, 反应速率减小,B错误;升高温度,反应速率增大,C错误。
高中化学必修二PPT课件(9份打包) 人教课标版1

第二章
化学反应与能量
第二节
化学能与电能
病例分析
你能为她开一个药方吗?
能源
一次能源:直接从自然界取得的 能源。 二次能源:一次能源经过加工、 转换得到的能源。
一次能源:
水能
风能
石油
原煤 二次能源:
天然气
电能
蒸汽
电能(电力):二次能源
一、化学能与电能的相互转化 1,火力发电原理及过程
燃烧
4、考虑氧化反应和还原反应发生的条件和环境, 化学物质的选择。
5、从电学角度考虑仪器选择和组装问题。
【实验一】 分别把锌片和铜片插入到稀H2SO4中, 观察现象。
锌片上有气泡,铜片上没有气泡
Zn+ 2H+ = Zn2+ + H2↑
【实验二】
再用导线把锌片和铜片连接起来,观察 铜片上有无气泡产生? 在导线中间接入一个电流表, 观察电流表的指针是否偏转?
A 正极 负极 Zn Cu B Ag Cu C Cu Zn D Cu Zn
电解质溶液
CuCl2
H2SO4
CuSO4
FeCl2
例5 请根据反应: 2Fe3+ + Fe = 3 设计原电池,你有哪些可行方案?
Fe 2+
Fe-Cu
Fe-C
FeCl3
Fe(NO3)3
Fe-Ag
Fe2(SO4)3
根据反应设计原电池,你有哪些可行方案?
化学能
热能
蒸汽
机械能
发电机
电能
a.我国煤炭资源丰富,廉价方便.
b.电能清洁安全,又快捷方便.
a.排出大量的温室效应气体. b.有废气可能导致酸雨 c.废料废水
化学反应与能量
第二节
化学能与电能
病例分析
你能为她开一个药方吗?
能源
一次能源:直接从自然界取得的 能源。 二次能源:一次能源经过加工、 转换得到的能源。
一次能源:
水能
风能
石油
原煤 二次能源:
天然气
电能
蒸汽
电能(电力):二次能源
一、化学能与电能的相互转化 1,火力发电原理及过程
燃烧
4、考虑氧化反应和还原反应发生的条件和环境, 化学物质的选择。
5、从电学角度考虑仪器选择和组装问题。
【实验一】 分别把锌片和铜片插入到稀H2SO4中, 观察现象。
锌片上有气泡,铜片上没有气泡
Zn+ 2H+ = Zn2+ + H2↑
【实验二】
再用导线把锌片和铜片连接起来,观察 铜片上有无气泡产生? 在导线中间接入一个电流表, 观察电流表的指针是否偏转?
A 正极 负极 Zn Cu B Ag Cu C Cu Zn D Cu Zn
电解质溶液
CuCl2
H2SO4
CuSO4
FeCl2
例5 请根据反应: 2Fe3+ + Fe = 3 设计原电池,你有哪些可行方案?
Fe 2+
Fe-Cu
Fe-C
FeCl3
Fe(NO3)3
Fe-Ag
Fe2(SO4)3
根据反应设计原电池,你有哪些可行方案?
化学能
热能
蒸汽
机械能
发电机
电能
a.我国煤炭资源丰富,廉价方便.
b.电能清洁安全,又快捷方便.
a.排出大量的温室效应气体. b.有废气可能导致酸雨 c.废料废水
人教版高中化学必修二第一章完整ppt课件

第一章 物质结构 元素周期律 第一节 元素周期表
ppt精选版
1
第1课时 元素周期表
ppt精选版
2
学习目标
1.简单了解元素周期表的发展历程。 2.了解元素周期表的编排规则及结构。 3.能描述元素在元素周期表中的位置。
ppt精选版
3
一、元素周期表的完善历程 1. 第一张元素周期表 (1)时间 1869 年,俄国化学家门__捷__列__夫__绘制出第一张元素周期 表,是化学发展史上的重要里程碑。 (2)编排原则 ①将元素按照_相__对__原__子__质__量_____由小到大依次排列。 ②将_化__学__性__质_相似的元素放在一个纵行。
答案:C
ppt精选版
28
解析:考查元素周期表的结构。对主族元素,其族序数 等于最外层电子数,但副族则不是;18 列构成 16 个族,其 中第Ⅷ族包含 3 列。
ppt精选版
29
3. 已知某离子的结构示意图为 的是( )
A. 该元素位于第二周期第ⅡA 族 B. 该元素位于第二周期第Ⅷ族 C. 该元素位于第三周期第ⅡA 族 D. 该元素位于第三周期 0 族
ppt精选版
18
4. 确定该元素在周期表中的位置,形式为“第几周期第 几族”,要注意分清主族、副族、0 族、第Ⅷ族
在应用上述方法推断元素的族序数时,要特别注意第 六、七周期第ⅢB 族的锕系和镧系元素,它们的每个空格都 有 15 种元素,其后的元素需再减去 14,然后定位。
ppt精选版
19
例 2 俄罗斯科学家用含 20 个质子的钙的一种原子轰击 含 95 个质子的镅原子,结果 4 次成功合成 4 个第 115 号元 素的原子。这 4 个原子生成数微秒后衰变成第 113 号元素。 下列有关叙述正确的是( )
ppt精选版
1
第1课时 元素周期表
ppt精选版
2
学习目标
1.简单了解元素周期表的发展历程。 2.了解元素周期表的编排规则及结构。 3.能描述元素在元素周期表中的位置。
ppt精选版
3
一、元素周期表的完善历程 1. 第一张元素周期表 (1)时间 1869 年,俄国化学家门__捷__列__夫__绘制出第一张元素周期 表,是化学发展史上的重要里程碑。 (2)编排原则 ①将元素按照_相__对__原__子__质__量_____由小到大依次排列。 ②将_化__学__性__质_相似的元素放在一个纵行。
答案:C
ppt精选版
28
解析:考查元素周期表的结构。对主族元素,其族序数 等于最外层电子数,但副族则不是;18 列构成 16 个族,其 中第Ⅷ族包含 3 列。
ppt精选版
29
3. 已知某离子的结构示意图为 的是( )
A. 该元素位于第二周期第ⅡA 族 B. 该元素位于第二周期第Ⅷ族 C. 该元素位于第三周期第ⅡA 族 D. 该元素位于第三周期 0 族
ppt精选版
18
4. 确定该元素在周期表中的位置,形式为“第几周期第 几族”,要注意分清主族、副族、0 族、第Ⅷ族
在应用上述方法推断元素的族序数时,要特别注意第 六、七周期第ⅢB 族的锕系和镧系元素,它们的每个空格都 有 15 种元素,其后的元素需再减去 14,然后定位。
ppt精选版
19
例 2 俄罗斯科学家用含 20 个质子的钙的一种原子轰击 含 95 个质子的镅原子,结果 4 次成功合成 4 个第 115 号元 素的原子。这 4 个原子生成数微秒后衰变成第 113 号元素。 下列有关叙述正确的是( )
人教版高中化学必修二全册教学课件

● A.54 ● C.81
B . 11 6 C
D.88
● 解析:Ⅲ是奇数,第ⅢA的元素的原子序数都是奇数。题中四个选项中只有C选项的原子序数是 奇数,答案选C。
课堂探究研析
● 问题探究:
知识点1 元素周期表的结构
1.元素周期表中,周期序数由什么决定?主族族序数由什么决定? 2.元素周期表从左到右一共有 18 列,哪一列所含元素种类最多?
● 二、认识元素周期表的结构 ● 1.编排原则:
● 2.周期表中周期的划分和一般特点:
个数
元素周期表中有7个横行,共有____7______个周期
特点
同周期中的元素的_电__子_层__数____相同 周期序数=_电__子_层__数____
分类
短周期 长周期
共有___3_______个,包括第__1_、__2、__3___周期 共有___4 _______个,包括第4_、__5、__6_、_7___周期
18
4
36
长周
5
Rb~Xe
18
5
54
期
6
Cs~Rn
32
6
86
7
Fr~Uuo
32
7
118
位置与结 构的关系
周期序数 =电子层
数
● 2.族(每一纵行):
族
周期表中有18 个纵行,除第 8、9、10三个 纵行为第Ⅷ族 外,其余15个 7个 纵行,每个纵 主 行为一族;周 族 期表中包括7个 主族,7个副 族,一个0族,
1
新课标导学
化学
必修② ·人教版
第一章
物质结构 元素周期律
第一节 元素周期表
第1课时 元素周期表
高中化学人教版必修二《3.1.3同系物同分异构体》课件

2.下列物质中,分子式符合C6H14的是 ( )。
A. 2—甲基丁烷 B. 2,3—二甲基戊烷 C. 2—甲基己烷 D. 2,3—二甲基丁烷 答案:D
3.下列各对物质中互为同系物的是( A )
A.CH3—CH==CH2和CH3—CH2—CH==CH2 B.CH3—CH3和CH3—CH==CH2 C.CH3—CH2—CH3和CH3—CH==CH2 D.CH3—CH2—CH==CH2和CH3—CH2—CH3
CH3
CH3CHCH2CH2CH3 CH3
CH3-CH-CH CH3 CH3 CH3
[练习9]下列化学式能代表一种纯洁物的是( A) A. C3H8 B. C4H10 C. C5H12 D.C2H4Br2
[练习10] 乙烷在光照条件下与Cl2产生取代,最多可生成
几种有机产物( D )
A、4种 B、5种 C、8种 D、9种
(3)一定具有不同的分子式。相差n个-CH2(4)必须符合同一通式。但符合同一通式,且分子组成上相差
一个或若干个CCHH22原子团的物质不一定是同系物。
如: CH2
和 CH2 (环丙烷)
CH2=CH2 (乙烯)
同系物间的关系:
1.是否属于同类物质? 2.通式相同吗? 3.碳原子数目相同吗? 4.相对分子质量相差多少? 5.性质相同吗?
烷烃
谢谢大家
构简式. 必须具有对称结构
H
HH
H CH
HCCH
H
HH
H3C
CH3 C CH3 CH3
H3C
CH3 CH3 C C CH3 CH3 CH3
碳原子数 1 2 3 4 5 6 7 8 9 10 11 12 13 14 16 20
同分异构体数 1 1 1 2 3 5 9 18 35 75
人教版高中化学必修二第三章第三节《生活中两种常见的有机物》课件(共33张PPT)

三、乙酸的化学性质
??做鱼时放些酒和 醋,鱼就能去除腥味, 香味四溢,那是为什 么呢?
CH3—C—OH 醋 O
C2H5—OH 酒
2、酯化反应:
酸跟醇作用,生成酯和水的反应
O
O
浓H2SO4
CH3—ห้องสมุดไป่ตู้—OH+H—O—C2H5
CH3—C—O—C2H5 + H2O
乙酸乙酯 油状物,有香味
注意:酯化反应属于取代反应
不料,二旬后黄昏时,他经过此缸时,忽然闻到一 股香甘酸醇的特殊气味扑鼻而来。他好奇地走进小缸, 伸手指沾指一尝,虽然不是一般的酒味,但给人另外一 种鲜美爽口的特殊感觉。心想,这东西喝是不成的,但 用来拌菜和煮汤如何,很值得一试。于是就唤来徒儿们 ,用它干拌了一盆黄瓜又煮了一盆鲫鱼汤来试试。弄好 后大家一尝,无不拍手,齐声叫好。
3、下列物质中,既能与NaOH反应,又能与NaHCO3 反应的是( B )
A. —OH
B. CH3COOH
C.CH3CHO
D.CH3CH2OH
讨论:喝醋能解酒吗?
有人说:人是物理和化学反应的总和.其实,人是一个整体.他的整个生理过 程是不能简单的用化学和物理来衡量.同样,对于醋能否解酒,也是不能单 纯的用乙酸和乙醇的化学反应来解释.毕竟,它也是人的一种生理过程.
药品:镁粉、NaOH溶液、CuSO4溶液、Na2CO3粉末、
Na2SO3粉末、乙酸溶液、酚酞、石蕊
讨论:
1、乙酸具有酸的哪些通性?(设计实验、 观察实验现象,做好记录。)
2、乙酸的酸性与碳酸和亚硫酸比较, 酸性谁强谁弱? 酸性:H2SO3 >CH3COOH>H2CO3
这能行 吗?
● 2CH3COOH + CaCO3=(CH3COO)2Ca + H2O + CO2↑
人教版高中化学必修2-乙烯(共33张PPT)

Br Br CH2CH2 1,2-二溴乙烷
——可用于鉴别或除杂。 Br Br (CH2BrCH2Br) 无色油状液体, 密度比水大,
不溶于水,易溶于CCl4 。
迁移应用
试写出乙烯与H2 、HCl 、H2O发生加成反应 的化学方程式。
催化剂
CH2=CH2 + H-H △
CH3-CH3 乙烷
催化剂
CH2=CH2 + H-Cl
石油裂解气: 主要成分是乙烯, 还含有丙烯、异丁 烯、甲烷、乙烷、 异丁烷、硫化氢和 碳的氧化物等。
一、乙烯的分子结构
分子式
C2H4
球棍模型
电子式
结构式 结构简式 CH2= CH2
CH2CH2
比例模型
空间构型: 平面型分子 6个原子共平面
( 键角约120° )
六个原子共面
约120°
约120°
约120°
研究表明,石蜡油分解的产物 主要是烯烃和烷烃的混合物
资料卡片 石油的裂化、裂解
催化剂
CC168HH3146
△
催化剂
C8CH81H8 16
△
C4H10 C4H10
催化剂
△
催化剂
△
CC8H4H1810++CC8H4H168 辛烷 辛烯
C4H10 + C4H8 丁烷 丁烯
C2H4 + C2H6 乙烯 乙烷 CH4 + C3H6 甲烷 丙烯
• 8、普通的教师告诉学生做什么,称职的教师向学生解释怎么做,出色的教师示范给学生,最优秀的教师激励学生。上午10时55分 53秒上午10时55分10:55:5324.3.4
实验 通入酸性高锰酸钾溶液中
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
示化学键
构(立体形
状)
用于表示分
比例模型
用不同体积的小球表 子中各原子 示不同的原子大小 的相对大小
和结合顺序
二、2. 甲取代烷反的应取代反应
①甲烷与氯气的取代反应
实验 操作
气体颜色__变__浅____,试管
实验 现象
内壁有_油__状__液__滴_出现,同 时试管上方有白雾生成,
试管内液面逐渐
__上__升____。
电子成键情况的式子 型的物质
①具有分子式所能表 示的意义,能反映分子
结构; ②表示分子中原子的 结合或排列顺序的式 子,但不表示空间构型
①多用于研 究有机物的 性质②有机 反应常用结 构式表示;
结构简式
CH4
结构式的简便写法,着 同“结构
重突出结构特点
式”
用于表示分
球棍模型
小球表示原子,短棍表 子的空间结
第三章 第一节
最简单的有机化合物 ━甲烷
第1课时 甲烷的性质
学习目标
1. 了解有机化合物的概念。 2. 掌握甲烷的分子结构、了解甲烷的物理性质、存在和 用途。 3.认识取代反应的特点。
一二、甲烷的分子结构
1. 表示方法
甲烷的分子式和结构简式都是_C__H_4____,
结构式为________________________,
光的影响
强制弱的原则
反应中 电子得失
不一定有电子的转移
一定有电子的得失
例 2 把 1 体积 CH4 和 4 体积 Cl2 组成的 混合气体充入大试管中,将此试管倒立在盛有
AgNO3 溶液的水槽中,放在光亮处,片刻后发 现试管内壁上有油状液滴出现,该油状液滴可
应的化学方程式为:
C__H_4_+__C__l2_―__―光__→__C_H__3C__l+__H__C__l ___________________; C__H_3_C__l+__C__l2_―__光―__→__C_H__2C__l2_+__H__C_l_________________;
C__H_2_C__l2_+__C_l_2_―_光―__→__C__H_C__l3_+__H__C_l_________________; C__H_C__l3_+__C__l2_―__光―__→__C_C__l4_+__H__C_l___________________。
Cl
光
Cl[三氯甲烷(氯仿)液体]
Cl C H + Cl—Cl
Cl C Cl + H—Cl
Cl
Cl (四氯甲烷液体)
甲烷的取代反应应注意的问题
(1)反应条件:光照,但要避免日光直射)反应物状态:纯卤素,例如甲烷与溴水不反应,与
溴蒸气见光发生取代反应。
(3)甲烷的取代反应是分步且连锁进行的,所以甲烷
电子式为________。 注意:结构式只表示原子的连接顺序,不表示物质的空 间结构。
2. 空间构型 甲 烷 分 子 是 以 _碳__原__子___ 为 中 心 ,氢__原__子____ 为 顶 点 的 正__四__面__体__结构,其中 C—H 键的__长__度____和__强__度____相同, 夹角__相__等____。
_无__变__化___
结论
CH4 与 Cl2 在光照下 __反___应___
CH4 与 Cl2 在黑暗处 _不__反___应__
②取代反应
有机化合物分子里的__某__些___原__子__(或__原__子__团___) ________被 其他_原__子__(_或__原__子__团__)____代替的反应,如甲烷与 Cl2 发生反
以碳原子为中心, 体。键角:109 28
四个氢原子。心为ˊ 顶点的正四面
分子结构
如何证明甲烷分子是以碳原子为中心, 四个氢原子 心为顶点的正四面体结构? 科学事实1:已知CH4 中四个C-H键的键长相等、相邻的CH键 之间的夹角也相等。 科学事实2:已知CH2Cl2只有一种结构。
109°28′
平面四边形
正四棱锥
正四面体
3、有机物(以甲烷为例)的组成和结构的表示方法
种类 实例
含义
应用范围
分子式
CH4
反映出一个分子中原 多用于研究 子的种类和数目 物质组成
最简式 (实验式) CH4
表示物质组成的各元 素原子最简单整数比
的式子
有相同组成 的物质
电子式 结构式
用小黑点等记号代替 多用于表示
电子,表示原子最外层 离子型、共价
正方形结构,则 CH2Cl2 必有两种结构:
和
,
它们代表两种物质。若甲烷为正四面体结构,则 CH2Cl2 只
有一种结构。答案为 C。
[答案] C
三2、.取代反应和置换反应的比较
参与物质
反应物和生成物中不 反应物和生成物中
一定有单质
一定有单质
反应条件
反应受催化剂、温度、水 溶 液 中 置 换 遵 循
甲烷与氯气 光照条件下的取代反应
甲烷与氯气 光照条件下的取代反应
甲烷与氯气 光照条件下的取代反应
甲烷与氯气 光照条件下的取代反应
甲烷与氯气 光照条件下的取代反应
甲烷与氯气 光照条件下的取代反应
甲烷与氯气 光照条件下的取代反应
甲烷与氯气 光照条件下的取代反应
有机物分子里的某些原子或原子团 被其他原子或原子团所代替的反应叫做取代
H
H
光
H C H + Cl—Cl
H C Cl + H—Cl
H
H (一氯甲烷气体)
H
光
H
H C H + Cl—Cl
H C Cl + H—Cl
试C一l 试:仿照生成一C氯l (甲二氯烷甲的烷液化体)学方
C程l 式CH。H尝+试Cl写—C出l 一光 氯C甲l 烷CH 与Cl氯+气H—进C一l
步反Cl应的化学反应方程式Cl 。
与氯气的反应,会得到五种产物:一氯甲烷(CH3Cl )、 二氯甲烷(CH2Cl2 )、三氯甲烷(CHCl3 )、四氯甲烷
((又4)称反四应氯中化各碳物,质C量Cl的4 )关、系H:Cl每(1最m多o)l H 被取代,则有
1 mol Cl2 参加反应,生成1 mol HCl。
甲烷与氯气 光照条件下的取代反应
例 1 下列事实能证明甲烷分子是以碳原子为中心的正 四面体结构的是( )
A. CH2Cl2 有两种不同的结构 B. 常温常压下 CH2Cl2 是液体 C. CH2Cl2 只有一种空间结构 D. CHCl3 只有一种结构
[解析] 本题旨在考查甲烷分子的空间结构及例证。甲 烷分子中有 4 个等同的 C—H 键,结构对称,其空间构型可 能有两种:正四面体结构和平面正方形结构。若甲烷为平面
