第十二章 二羰基化合物在有机合成上的应用
合集下载
有机化学课后习题答案12第十二章醛和酮核磁共振谱(第5轮)答案

1. 2-丁烯醛
CH3CH=CHCHO
2,4-戊二酮
4-氯-4-甲基-2-戊烯醛
14. CH3COCH2CH2OH 15. (CH3)2 CHCH2CHO
4-羟基-2-丁醇
4-甲基丁醛
2. 二苯甲酮
C O
3. 2,2-二甲基环戊酮
O
C
CH3
CH3
4. 3-(间羟基苯基)丙醛
5. 甲醛苯腙
6. 丙酮缩氨脲
)。
A.糠醛
B.甲醛
C.乙醛
D.苯甲醛
9. 醛.酮与锌汞齐(Zn-Hg)和浓盐酸一起加热,羰基即被( C )。
A.氧化为羧基 B.转变成卤代醇 C.还原为亚甲基 D.还原为醇羟基
10. C6H5COCH2CH2C6H5 的系统命名法名称应该是:(B )
A.1,3-二苯基-3-丙酮
B.1,3-二苯基-1-丙酮
8.
CHCHO
CH3
2-环己基丙醛
9.
O CH3
CH3 C CHCH2CHO
3-甲基-4-氧代戊醛
10. CH3CHCH2COCH2CH3
CH2CH3
11. CH3COCH2COCH3
Cl
12.
(CH3)2CCH CHCHO
5-甲基-3-庚酮
13.
CH3 CH3C N OH
丙酮肟
二.写出下列化合物结构式
R CH R' OH
R CH2 R'
NH2NH2 , NaOH (HOCH2CH2)2O
R
CH2
R'
还原能力较强,还能还原碳碳不饱和键。 还原能力较弱,仅能将羰基还原成羟基。 还原能力比四氢硼钠稍强,能还原羧基。 Clemmensen 还原法 黄鸣龙还原法
12羰基化合物

入HCl气体来催化反应。有机化学 第十章
35
反应机理:
Hδ C
Oδ + H O R
快
R
H
H
R' 慢
C O +O
R
H
H
R' H O
HC OH
R' OH
R' O R'
H C O H +H O H
R
R
R' O
H
O
R' H
HC OH
R' O
HC
H O
H
H2O
H C
O
R
R'
R
R
R'
H
OH
CO
R
R'
R' H
O HC
甲醛分子的结构
在醛(Aldehydes)和酮(Ketones)分子中,都含有一 个共同的官能团—羰基,故统称为羰基化合物。
醛分子中,羰基至少要与一个氢原子直接相连,故
醛基一定位于链端。
有机化学 第十章
3
醛分子的结构
有机化学 第十章
4
(二)命名
1. 普通命名法
CH3CH2CHO
丙醛
CH2=CHCHO
应用:提纯醛酮 鉴别醛酮
C=O + H2N-Z
重结晶 稀酸
C=N-Z
C=O
H2N-OH 羟胺
(产物:肟)
H2N-NH2 肼
H2N-NH-C6H5 苯肼
(产有物机化:学 第腙十章)
(产物:苯腙) 33
H2N-NH-C6H3(NO2)2
O H2N NHCNH2
有机化学课件-二碳基化合物

COOC2H5
例2、制备己二酸
2 CH2(COOC2H5)2 C2H5ONa _ BrCH2CH2Br 2 CH(COOC2H5)2
CH2CH(COOC2H5)2 1) OHCH2CH(COOC2H5)2 2) H+ -CO2
CH2CH2COOH CH2CH2COOH
例3、制备环戊烷甲酸
CH2(COOC2H5)2
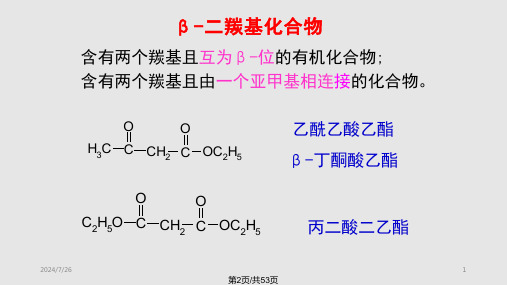
第十四章 -二羰基化合物
§14.1 -二羰基化合物的结构和重要代表物 §14.2 -二羰基化合物的性质 §14.3 -二羰基化合物在有机合成中的应用
§14.1 -二羰基化合物的结构和重要代表物
β-二羰基化合物
两个羰基中间为一个亚甲(CH2)隔开的化合物 重要代表物 β-二酮
CH3 O O C CH2 C CH3 CH3
O H3C C H2 C C O OC2H5 O H3C C OH + -H2C O C
OH + C2H5O
OH (40%)
-
OH H3C C O-
OH H2 C C OC2H5 O-
H2O O H3C C OH
H2O C2H5OH
b. 乙酰乙酸乙酯
(3)在合成上的应用
O H3C C
H2 C C
O OC2H5 H3C
O
O CH3COC2H5
C2H5ONa
O -CH2COC2H5
C2H5O-
CH3COC2H5
-O
OC2H5
O
CH3CCH2COC2H5
O O CH3CCH2COC2H5
C2H5ONa
O O CH3CCHCOC2H5 Na+ C2H5OH
CH3COOH
O O CH3CCH2COC2H5 + CH3COONa
有机化学二羰基化合物
碳氧双键处于共轭体系,发生了电子的离域,使体
系能量降低而趋于稳定。
:OH
H3C C CH
O C OC2H5
2024/7/26
4
第5页/共53页
影响烯醇式含量的其它因素:
① 活泼亚甲基上连有吸电子基团,烯醇式含 量↑,连有供电子基团,烯醇式含量↓。
O
O
O
O
H3C
C
CH
C OC2H5 > H3C
C
CH2
2+
Hg
+
H
OH CH CH2
O CH3C H
β-二羰基化合物的烯醇式结构稳定性:乙酰乙酸乙酯
实验事实:
① 能与NaHSO3、HCN等发生加成反应; ② 能与羟胺、苯肼反应,生成肟、苯腙等; ③ 能被还原成β-羟基酸酯; ④ 经水解、酸化后,可以脱羧生成丙酮。
O
O
H3C C CH2 C OC2H5
有羰基
O CH3C CH
O COC2H5
Na+
Br(CH2)4Br
O CH3C
C2H5ONa
COCH3
成酮分解
COOC2H5
O CH COC2H5 CH2(CH2)3Br
O
CCH3
2024/7/26
28
第29页/共53页
② 制二酮
2024/7/26
制β-二酮(1,3-二酮)
O CH3C CH
O COC2H5
第11页/共53页
三、丙二酸二乙酯的合成及应用
1、丙二酸二乙酯的制法 2、丙二酸二乙酯在有机合成上的应用
① 制备烃基取代乙酸 ② 制备二元羧酸
2024/7/26
有机化学:第十二章 醛和酮分析

第十二章 醛和酮
主要内容
1、掌握醛酮的分类和命名 2、理解醛酮的亲核加成反应机理 3、掌握醛酮的化学性质
醛、酮和醌的分子结构中都含有羰基,总称为羰基化合物。 羰基至少和一个氢原子结合的化合物叫醛 (-CHO 又叫醛 基 ,) ,羰基和两个烃基结合的化合物叫酮。醌是一类不饱 和环二酮,在分子中含有两个双键和两个羰基。
盖形成π 键。因此C=O双键是由一个σ 键和一个π 键组成的。
O
C
(a) sp2杂化的碳
(b)羰基的结构
C=O双键中氧原子的电负性比碳原子大,所以 π 电子云的分
布偏向氧原子,故羰基是极化的,氧原子上带部分负电荷,碳
原子上带部分正电荷。
C
O
π C O
δ C
δ O
电负性 C < O
π 电子云偏向氧原子
选含羰基的最长碳链为主链,从靠近羰基一端给主链编 号。醛基因处在链端,因此编号总为1。酮羰基的位置要标
出(个别例外)。
CH3 CHCH3
CH3 O CH3 CH C H H3C
O C CH2CH3 CH3CH2
O C
2-甲基丙醛
2—丁酮
2-甲基-3-戊酮
不饱和醛酮的命名是从靠近羰基一端给主链编号:
①电子效应
②空间效应。
醛常比酮活泼:
1 烷基有斥电子诱导效应 ,使羰基C正电性减少。
R1 R2 C O R O C H
2 烷基体积增大,空间位阻也增大。
1.与HCN的加成
C O + HCN C OH
HCN 是弱酸 不易电离, 可以提高溶 液 的 的 PH 值
CN α 羟基睛
反应范围:醛、脂肪族甲基酮、C8以下的环酮。ArCOR和ArCOAr 难反应。 芳香酮难与HCN反应的原因:
主要内容
1、掌握醛酮的分类和命名 2、理解醛酮的亲核加成反应机理 3、掌握醛酮的化学性质
醛、酮和醌的分子结构中都含有羰基,总称为羰基化合物。 羰基至少和一个氢原子结合的化合物叫醛 (-CHO 又叫醛 基 ,) ,羰基和两个烃基结合的化合物叫酮。醌是一类不饱 和环二酮,在分子中含有两个双键和两个羰基。
盖形成π 键。因此C=O双键是由一个σ 键和一个π 键组成的。
O
C
(a) sp2杂化的碳
(b)羰基的结构
C=O双键中氧原子的电负性比碳原子大,所以 π 电子云的分
布偏向氧原子,故羰基是极化的,氧原子上带部分负电荷,碳
原子上带部分正电荷。
C
O
π C O
δ C
δ O
电负性 C < O
π 电子云偏向氧原子
选含羰基的最长碳链为主链,从靠近羰基一端给主链编 号。醛基因处在链端,因此编号总为1。酮羰基的位置要标
出(个别例外)。
CH3 CHCH3
CH3 O CH3 CH C H H3C
O C CH2CH3 CH3CH2
O C
2-甲基丙醛
2—丁酮
2-甲基-3-戊酮
不饱和醛酮的命名是从靠近羰基一端给主链编号:
①电子效应
②空间效应。
醛常比酮活泼:
1 烷基有斥电子诱导效应 ,使羰基C正电性减少。
R1 R2 C O R O C H
2 烷基体积增大,空间位阻也增大。
1.与HCN的加成
C O + HCN C OH
HCN 是弱酸 不易电离, 可以提高溶 液 的 的 PH 值
CN α 羟基睛
反应范围:醛、脂肪族甲基酮、C8以下的环酮。ArCOR和ArCOAr 难反应。 芳香酮难与HCN反应的原因:
羰基化合物在有机合成上的应用

KOH, H 2O
O CH43;
R
O
CH 3 C CH 2 R
14
过程:
O
O
CH 3 C CH 2 C OEt
OC 2H5
O
O
CH3 C CH C OEt
O
O
CH3C CH COE t
O
O
O
RX
CH3 C CH
C
OE t
1. KOH, H 2O 2. H+
CH 3
C
CH 2
R
OO
CHH5 3乙-C酰-乙C酸H2乙-酯C-OC2 + CH3CH2O-
4
不具有a-H的酯可以与具有a-H的酯发 生交叉Claisen酯缩合反应:
O H-C-OC2H5 +
O H—CH2-C-OC2H5
C2H5ONa
OO H-C-CH2-C-OC2H5 + CH3CH2OH
COOC2H5
O
H—CH2-C-OC2H5 C2H5ONa
1. KOH, H 2O 2. H+
CH3CH2CH2 CH2COOH
23
1. 2EtONa CH2(COOC2H5)2
2. BrCH2CH2Br
C(COOC2H5)2
1. KOH, H 2O 2. H+
CCOOH
2). 合成二元羧酸
1. 2EtONa
CH 2 CH( CO 2C2H5)2
2CH 2(COOC 2H5)2 2. B rCH 2CH2Br CH 2 CH( CO 2C2H5)2
基本要求
掌握Claisen酯缩合反应,了解乙酰乙酸乙酯及丙二酸二乙酯在合成反应上的意义。 掌握酮型-烯醇型互变异构现象。
第十二章 保护基团在有机合成中的应用
+ H2NR
+ RNH2
磺酰胺衍生物法: 磺酰胺衍生物法:
O RNH2 + PhCCH2SO2Cl
R'X/K2CO3 碱
O RNHSO2CH2CPh R R' NH
O Zn/AcOH RNSO2CH2CPh 微 量HCl,室温 室 R'
苄胺保护法: 苄胺保护法:
R 碱 NH + PhCH2Cl R'
O
C6H5C-Cl+ HOR
C6H5C-OR
3.应用 应用 1)合成 HOCH2C
C-COOCH3
HC CCH OH+ 2
O EtMgX
干HCl
O
CO2
2 OCH C
CH
2 O OCH C CMgX
2 O OCH C COOMgX
CH3OH/H+
HOCHC 2
C-COOCH 3
2)合成
H H O CH3C-OCH2(CH2)5CH2C=C-CH2CH2CH3
2. 一元醇羟基的保护方法
+ HOR
O 干 HCl H+ O
3
O
OR
Me3SiCl + HOR
H2O,EtOH,
ROSiMe3
PhCH2Cl + HOR
H2 / Pd-C
ROCH2Ph
Ph3CCl
+ HOR
吡啶
Ph3COR
O
O OH ,H2O OH ,H2O
-
CH3C-Cl + HOR
O
CH3C-OR
H3C H KMnO4 OH2C H3C H O CH3 O O H
β二羰基化合物在有机合成中的应用
β二羰基化合物在有机合成中的应用
β-二羰基化合物是一类在有机合成中广泛应用的重要化合物。
它们的分子结构中含有两个相邻的羰基基团(C=O)。
这种基团具有很强的反应性和多种反应途径,因此能够在多种有机合成反应中作为反应物、中间体或产物起到重要作用。
2. 将β-二羰基化合物作为不饱和化合物的前体
β-二羰基化合物可以被还原形成α-羟基醛和醛,并且能够与其他分子加成反应生成新的化合物。
这些性质使得β-二羰基化合物成为制备多种不饱和化合物的重要前体,包括环己烯酮等。
其中一个典型的应用是环己烯酮的合成,反应式如下:
此外,β-二羰基化合物也可以通过Curtius重排反应,将两个羰基分别转化为亚胺基和异氰酸酯来制备不饱和化合物。
3. Michael加成反应的反应物和中间体
Michael加成反应是合成了酰胺、肽等化合物的重要反应。
β-二羰基化合物在这个过程中可以充当反应物或者中间体。
例如,在合成β-二羰基α,β-不饱和酰胺时,β-二羰基化合物可以与亲核试剂如乙烯基硫醇发生Michael加成反应。
在制备肽时,β-二羰基化合物可以作为α-氨基酸的突触剂,来促进和聚合。
4. 将β-二羰基化合物用作还原剂
β-二羰基化合物在还原过程中可以将它的两个羰基都还原为甲基,成为β-甲氧羰基化合物(M+2)(β-MeOc)。
β-MeOc可与亲电烯烃进行Diels-Alder反应,制备多环化合物。
例如,β-二羰基化合物与苯并苯的双烯烃反应可以得到稠杂芳烃骨架。
有机化学:第十二章缩合反应(含本章总结习题课)
当α C
NaOC2H5 , NaOH
H 只有一个时, 不易反应, 须加强碱:
(C6H5)3CNa , LDA, 叔丁醇钠 等.
4.2 混合酯缩合反应
一般选用
一个酯有 α H 一个酯没有 α H
用强碱
O C
OCH3
+ CH3
O C
NaH
OCH3
H+
O
O
C CH2 C OCH3
+ CH3OH
OO
O
C2H5O C C OC2H5 + CH3CH2C OCH3
O
O
NaOC2H5
CH3 C OC2H5 + CH3 C CH3
O
O
CH3 C CH2 C CH3 + C2H5OH
O
NaNH2 CH3I
O
不对称酮的酰基化及烃基化的区域选择性:
1.热力学控制:用三甲基氯硅烷实现
O CH3 (C2H5)3N
DMF
(CH3)3SiCl
CH3Li
O-Li+ CH3
CH3I
CH3COOH + HCHO + H N
H+ CH2COOH CH2 N
( HOOCCH2CH2
N
)
OH + HCHO + H N
OH H+
CH3CN + HCHO + H N
CH2 N H+
NCCH 2CH2 N
不对称酮 曼尼希碱
得 混合物. 霍夫曼消除反应
NCCH2CH2 N 或 碱 NC-CH=CH2 + H-N
2EtOEtOH
有机化学 第十二章 羧酸衍生物和碳酸衍生物
第十二章 羧酸衍生物和碳酸衍生物
第一节 第二节 第三节 羧酸衍生物 羧酸衍生物涉及碳负离子的反应及其 在合成中的应用 碳酸衍生物、油脂和原酸酯
第一节
一、结构
羧酸衍生物
O O O O O R C X R C O C R' R C OR' R C NH2
酰卤
酸酐
酯
酰胺
羧基中羟基被置换生成羧酸衍生物,它们经简单 的水解反应可转变为羧酸. 腈 ( RCN ) 水解生成羧酸,故也在本章予以讨论.
NHCOCH3
5-乙酰氨基-7-(2氧代丙基)-2-萘甲酸
2-乙酰氧基苯甲酸
乙酸(3-甲氧基-4氰基苯基)酯
三、物理性质
酰氯酸酐:低级的酰氯和酸酐是有刺鼻气味的液体, 高级的为固体。 酯:低级的酯具有芳香的气味,可作为香料。乙酸 异戊酯(香蕉味);丁酸甲酯(菠萝味); -辛內酯(椰子味)。十四碳酸以下的甲酯和 乙酯均为液体。 酰胺: 由于形成分子间氢键,沸点高。除甲酰胺外均是
4-Chlorocarbonylbezioc acid
普通命名法: -溴丁酰溴 IUPAC 命名法: 2-溴丁酰溴 对氯甲酰基苯甲酸 对甲氧基苯甲酰氯
4-氯甲酰基苯甲酸
2 酸酐的命名
单酐:在羧酸的名称后加酐字; 混酐:将简单的酸放前面,复杂的酸放后面再加酐字 O 环酐:在二元酸的名称后加酐字。
O O CH3COCCH3 Acetic anhydride O O CH3COCCH2CH3 O Aceticpropionic anhydride Succinic anhydride O
快
R'OH +RCO-
2. 酸性下水解
O C2H5CO18C2H5 + H2O
第一节 第二节 第三节 羧酸衍生物 羧酸衍生物涉及碳负离子的反应及其 在合成中的应用 碳酸衍生物、油脂和原酸酯
第一节
一、结构
羧酸衍生物
O O O O O R C X R C O C R' R C OR' R C NH2
酰卤
酸酐
酯
酰胺
羧基中羟基被置换生成羧酸衍生物,它们经简单 的水解反应可转变为羧酸. 腈 ( RCN ) 水解生成羧酸,故也在本章予以讨论.
NHCOCH3
5-乙酰氨基-7-(2氧代丙基)-2-萘甲酸
2-乙酰氧基苯甲酸
乙酸(3-甲氧基-4氰基苯基)酯
三、物理性质
酰氯酸酐:低级的酰氯和酸酐是有刺鼻气味的液体, 高级的为固体。 酯:低级的酯具有芳香的气味,可作为香料。乙酸 异戊酯(香蕉味);丁酸甲酯(菠萝味); -辛內酯(椰子味)。十四碳酸以下的甲酯和 乙酯均为液体。 酰胺: 由于形成分子间氢键,沸点高。除甲酰胺外均是
4-Chlorocarbonylbezioc acid
普通命名法: -溴丁酰溴 IUPAC 命名法: 2-溴丁酰溴 对氯甲酰基苯甲酸 对甲氧基苯甲酰氯
4-氯甲酰基苯甲酸
2 酸酐的命名
单酐:在羧酸的名称后加酐字; 混酐:将简单的酸放前面,复杂的酸放后面再加酐字 O 环酐:在二元酸的名称后加酐字。
O O CH3COCCH3 Acetic anhydride O O CH3COCCH2CH3 O Aceticpropionic anhydride Succinic anhydride O
快
R'OH +RCO-
2. 酸性下水解
O C2H5CO18C2H5 + H2O
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
7
几种纯液体化合物烯醇式平衡含量如下: 化合物(酮式) 化合物(酮式) O CH3—C—CH3 =O O O CH3-C-CH2-C-OC2H5 O O CH3-C-CH2-C-CH3 O O H—C-CH2-C—H 烯醇式含量(%) 烯醇式含量(%) 10-4 10-2 7 76.5 100
O CH3-C
9
O O CH3-C-CH2-C-OC2H5 酮式: 酮式:93%
O-H O CH3-C=CH-C-OC2H5 烯醇式: 烯醇式:7% Br2
参与酮的反应 室温下彼此转变的速度 很快,不能将二者分离; 很快,不能将二者分离;在 反应时可以全部以酮式或者 烯醇式进行反应, 烯醇式进行反应,表现为一 个单纯化合物. 个单纯化合物.在特殊条件 下可分离出两种异构体. 下可分离出两种异构体.
NH
CH3CH C(CO2Et)2
诺文葛尔反应( 反应) 诺文葛尔反应(Knoevengel 反应) 2). 发生迈克尔(Michael)反应(与不饱和的醛酮1,4加成) 发生迈克尔(Michael)反应(与不饱和的醛酮1,4加成 加成)
稀OH-
H+ O O CH3-C-CH2-C-OC2H5
浓OH-
O CH3CCH2CO2Na + C2H5OH H+ O CH3CCH3 + CO2 酮式分解 2 CH3CO2Na + C2H5OH 酸式分解
13
(40%NaOH)
§12.5 β-二羰基化合物的反应 β- 吸电子基团
O CH3 C CH2
O O CH3CCH2COCH2CH3
O O CH3CCHCOCH2CH3 2. ClCH2COOC2H5 CH2COOC2H5
1. EtONa
1. KOH, H2O 2. H
+
O CH3 C CH2 CH2COOH
注意:要上两个基团,必须分步进行,先上活性小的后上活性大的, 注意:要上两个基团,必须分步进行,先上活性小的后上活性大的, 先上位阻大的,后上位阻小的. 先上位阻大的,后上位阻小的.
11
O O C-CH2-C O O C-CH2-C -CH3 O O CH3 C-CH2-C-CH3
O-H
O C= CH-C O-H O C=CH-C-CH3 O CH3-C=CH-C-CH3 O-H (96.0%) (90.0%) (76.5%)
O O CH3-C-CH2-C-OC2H5 O O
O O R C CH2 C OR O O RO C CH2 C OR
ClCH2COOC2H5
26
3. 乙酰乙酸乙酯和丙二酸二乙酯还可发生下列反应 1). 与醛酮加成 含有活泼氢的化合物,缩合 与醛酮加成(含有活泼氢的化合物 缩合) 含有活泼氢的化合物,
O CH3 C H + CH2(CO2Et)2
1. KOH, H2O 2. H
+
上述是乙酰乙酸乙酯在合成上的第一个用途:制备甲基酮. 上述是乙酰乙酸乙酯在合成上的第一个用途:制备甲基酮.
16
应用 1:制备取代丙酮(甲基酮)类化合物 制备取代丙酮(甲基酮)
O OC2H5 O OC2H5 R O H3C R
O H3C
R X NaOEt H3C
O
(1) 稀 OH (2) H+,
O O O O C2H5ONa CH3-C-OC2H5 + H-CH2-C-OC2H5 -C H OH CH3-C-CH2-C-OC2H5
2 5
它是由具有α 它是由具有α-H的酯在碱的作用下与另一分子酯 发生类似醇醛缩合的反应称Claisen酯缩合反应 发生类似醇醛缩合的反应称Claisen酯缩合反应. 酯缩合反应.
19
应用3 通过α 卤代酮制备γ 应用3:通过α-卤代酮制备γ 二酮类化合物
O CH3 C CH2
O C OCH2CH3
1. EtONa O 2. RCCH2X
O CH3 C CH
O C OCH2CH3
CH2COR
1. 稀 KOH, H2O 2. H
+
O
O
CH3 C CH2 CH2 C R
20
应用4 通过α 应用4:通过α-卤代酯 制备γ 酮酸 制备γ
4
O CH3-C-OC2H5 O CH3-C-OC2H5
C2H5ONa -C2H5OH
O :CH2-C-OC2H5
-
O- CH3-C-OC2H5 CH2-C-OC2H5 O
O O CH3-C-CH2-C-OC2H5 + CH3CH2O乙酰乙酸乙酯
5
不具有α 不具有 α - H 的酯可以与具有 α - H 的酯发 的酯可以与具有α 交叉Claisen酯缩合反应 酯缩合反应: 生交叉Claisen酯缩合反应 O O C2H5ONa H-C-OC2H5 + H—CH2-C-OC2H5 O O H-C-CH2-C-OC2H5 COOC2H5 O H—CH2-C-OC2H5 + CH3CH2OH
O C OC2H5
活性亚甲基 烃化和酰化反应
14
乙酰乙酸乙酯和丙二酸酯合成法 一,活性亚甲基的烷基化和酰基化 1. 乙酰乙酸乙酯合成法(Methods of Acetoacetic
O CH3 C CH2 O C OCH2CH3
Ester Synthesis
1. EtONa 2. RX
O CH3 C CH R
H
+
O C OCH2CH3
KOH, H2O
O CH3 C CH R
O C OK
O CH3 C CH2 R
15
过程: 过程:
O CH3 C CH2 O C OEt OC2H5
O CH3 C CH
O CH3 C
O C OEt
O
O
CH3C CH COEt
O CH3 C CH2 R
RX
O CH R C OEt
1
掌握Claisen酯缩合反应,了解乙酰乙酸乙酯及丙 掌握Claisen酯缩合反应,了解乙酰乙酸乙酯及丙 二酸二乙酯在合成反应上的意义. 掌握酮型掌握酮型-烯醇型互变异构现象.
2
β-酮酸酯的基本结构
β-酮酸易于失羧,但β-酮酸酯是稳定的. 酮酸易于失羧, 酮酸酯是稳定的.
O R C CH2 O C R' R O C CH2 O C O OR' RO C CH2 O C OR'
能形成稳定烯醇式异构体的化合物, 答 :能形成稳定烯醇式异构体的化合物 , 具有 能形成稳定烯醇式异构体的化合物 以下结构特点: 以下结构特点:
① 分子中的亚甲基受两个相邻极性基团的影响, 分子中的亚甲基受两个相邻极性基团的影响, 亚甲基受两个相邻极性基团的影响 酸性增加,易于质子化. 使 H 酸性增加,易于质子化. ② 形成烯醇式异构体的分子中,其共轭体系有所 形成烯醇式异构体的分子中, 延伸,体系内能降低,更趋于稳定. 延伸,体系内能降低,更趋于稳定. ③ 烯醇式形成分子内氢键能增加其稳定性. 烯醇式形成分子内氢键能增加其稳定性. 分子内氢键能增加其稳定性
β-二酮
β-酮酸酯
丙二酸酯
O CH3 C CH2
O C OC2H5
NC CH2 COOC2H5
乙酰乙酸乙酯
氰乙酸酯
3
β 丁酮酸乙酯又叫做乙酰乙酸乙酯 , 工业上简 丁酮酸乙酯又叫做乙酰乙酸乙酯, 三乙 可由乙酸乙酯在醇钠作用下经Claisen 称三乙.可由乙酸乙酯在醇钠作用下经Claisen 缩合反应制得: 缩合反应制得:
24
CH2(COOC2H5)2
1. 2EtONa 2. BrCH2CH2Br
C(COOC2H5)2
1. KOH, H2O 2. H+
CCOOH
2). 合成二元羧酸
2CH2(COOC2H5)2
1. KOH, H2O 2. H+
1. 2EtONa
CH2 CH(CO2C2H5)2
2. BrCH2CH2Br CH2 CH(CO2C2H5)2
ClCH2COOH NaCN CH2COOH CN C2H5OH H+ CH2 COOEt COOEt
1). 合成一元羧酸
CH2(COOC2H5)2
1. EtONa, EtOH
CH(COOC2H5)2
2. CH3CH2CH2Cl CH2CH2CH3
1. KOH, H2O 2. H+
CH3CH2CH2 CH2COOH
C2H5O-C—CH2—C-OC2H5
O CH3-C=CH-C-OC2H5 (7.0%)
O-H O (7× C2H5O-C = CH-C-OC2H5 (7×10-4%)
O-H
O CH3—C—CH3
O-H CH3-C=CH2
(1.5× (1.5×10-4%)
12
乙酰乙酸乙酯的两类分解反应: 乙酰乙酸乙酯的两类分解反应: ——酮式分解 ——酮式分解和酸式分解 酮式分解和
总之:乙酰乙酸乙酯合成法可向合成的目标产物中提供 总之:
O H3C C CH
21
Question 5* 由乙酸乙酯合成下列化合物:
1. CH3-CO-CH2-CH2-CH2-CH3 2. -CH2-CH2-COOH
3. CH3-CO-CH-CH2-CH2-CH3 —C=O
22
O CH3 CCH2CH2CH3
C2H5ONa
COCH2COOC2H5 + CH3CH2OH
6
烯醇式互变异构( 二,酮式—烯醇式互变异构 tautomerism) 酮式 烯醇式互变异构 O H R-C—CHR' 酮式 O R-C—CHR' + H+ 烯醇负离子 碳负离子或氧负离子 OH R-C=CHR' 烯醇式
