免疫磁珠分离技术
免疫磁珠分选技术及应用

MACS细胞分选策略
1、阳性分选:
•
根据特异性标志分选细胞: 阳性分选是指目的细胞磁性标记
后,作为阳性的标记组分直接分选出来。
• 优点:
》高纯度,尤其是富集稀有的细胞 》高回收率 》操作简便、迅速
MD0 0 4 4 . 0 2
阳性分选策略
MACS® 微珠磁性标记 未标记细胞先行流出
将分选柱移出磁 场,洗脱阳性分
分选前标本制备:过滤
MACS预选滤器:30 m
MD0 1 9 7 . 0 2
Thereare a lot ofdifferentseparationtechniquesapart fromMagneticCellSorting. Some ofthemare also used to pre-enrichcells befor performinga megneticcellsorting.
MACS技术分选的CD8+ T 细胞
微珠
MD0 0 5 7 . 0 3
MACS微珠
直标微珠 多选微珠
间标微珠
MACS技术
设备与试剂
• MACS分选柱:
》填充有不同规格的铁珠。 》铁珠表面有亲水包被,不损伤细胞。 》无菌包装。 》可用于分选多种细胞及亚细胞物质、
细菌、病毒、mRNA和蛋白质。
• 专利产品 • 将磁场扩大1000-10000倍—
MACS技术原理
MACS(Magnetic Activated Cell Sorting): =免疫学+细胞生物学+磁力学
• 基于抗体对抗原的特异性识别 • 磁性微珠直接或者间接偶联在抗体上,从而与细胞相连 • 在高强度、梯度磁场中达到细胞磁性分离的目的
免疫磁珠分离技术
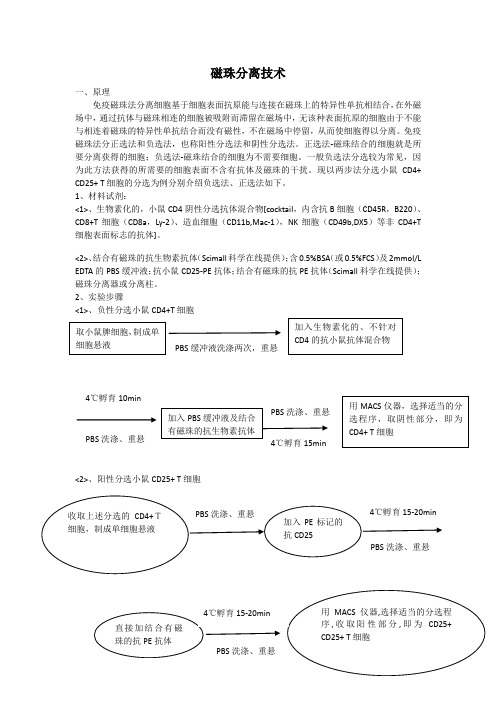
磁珠分离技术一、原理免疫磁珠法分离细胞基于细胞表面抗原能与连接在磁珠上的特异性单抗相结合,在外磁场中,通过抗体与磁珠相连的细胞被吸附而滞留在磁场中,无该种表面抗原的细胞由于不能与相连着磁珠的特异性单抗结合而没有磁性,不在磁场中停留,从而使细胞得以分离。
免疫磁珠法分正选法和负选法,也称阳性分选法和阴性分选法。
正选法-磁珠结合的细胞就是所要分离获得的细胞;负选法-磁珠结合的细胞为不需要细胞。
一般负选法分选较为常见,因为此方法获得的所需要的细胞表面不含有抗体及磁珠的干扰。
现以两步法分选小鼠CD4+ CD25+ T 细胞的分选为例分别介绍负选法、正选法如下。
1、材料试剂:<1>、生物素化的,小鼠CD4阴性分选抗体混合物[cocktail ,内含抗B 细胞(CD45R ,B220)、CD8+T 细胞(CD8a ,Ly-2)、造血细胞(CD11b,Mac-1),NK 细胞(CD49b,DX5)等非CD4+T 细胞表面标志的抗体]。
<2>、结合有磁珠的抗生物素抗体(Scimall 科学在线提供);含0.5%BSA (或0.5%FCS )及2mmol/L EDTA 的PBS 缓冲液;抗小鼠CD25-PE 抗体;结合有磁珠的抗PE 抗体(Scimall 科学在线提供);磁珠分离器或分离柱。
2、实验步骤<1>、负性分选小鼠CD4+T 细胞<2>、阳性分选小鼠CD25+ T 细胞二、注意事项:1、如果分离细胞用作培养,全过程注意无菌操作。
2、磁珠分离系统分离的细胞纯度可以达到80%-99%,得率在60%-90%左右,仅次于或相当于流式细胞仪的分选效率,与FACS相比,MACS设备简单,耗时极短,故而应用广泛。
设定不同的程序(细胞得率或纯度不可兼得),连续两次过柱分选可进一步提高分选细胞纯度,通常可达到95%-95%。
3、由于阳性分选得到的细胞表面结合有抗体及磁珠,有可能影响细胞的功能,故目前常用阴性分选的方法分离细胞。
免疫磁珠分离阳性杂交瘤细胞株的可行性

免疫磁珠分离阳性杂交瘤细胞株的可行性1、免疫磁珠的性质免疫磁珠由三部分组成, 核心是金属小颗粒(Fe2O3、Fe3O4), 核心的外层包裹一层高分子材料(如聚苯乙烯、聚氯乙烯等),最外层是功能基层, 如氨基(-NH4)、竣基(-COOH)、羟基(-OH)。
磁珠是均匀、球形、具有超顺磁性及保护性壳的粒子。
大小和形状的均一性,可使靶物质迅速和有效地结合到磁珠上,它的球形结构可消除与不规则形状粒子有关的非特异性结合超顺磁性可使磁珠置于磁场时,显示其磁性,从磁场移出时,磁性消除、磁珠分散保护性壳可防止金属微粒漏出[1]。
根据磁珠功能基结合的免疫配基不同分为:包被一抗的磁珠、包被二抗的磁珠、未包被的磁珠和包被抗生物素的磁珠。
2、免疫磁珠分离技术的原理免疫磁珠的功能基团可结合活性蛋白质(如抗体、抗原),利用磁珠上的抗体或抗原与相应的抗原或抗体发生特异性结合,形成免疫磁珠-抗体-抗原的复合物,这种复合物在磁场的作用下,发生力学移动,使复合物与其它物质分离,达到分离纯化的目的[2]。
3、免疫磁珠的应用3.1 免疫检测在免疫检测中,免疫磁珠作为固相载体,磁珠上的抗体与抗原特异性结合,形成抗原-抗体-磁珠复合物,在磁场的作用下,使特异性抗原与其它物质分离,起到了提纯与富集的作用,克服了放射免疫和酶联免疫检测的缺点。
这种分离检测方法具有灵敏度高,特异性强等优点。
磁珠标记的氯霉素直接竞争ELISA方法比常规直接竞争ELISA检测灵敏度提高50倍,达到0.002ng/mL[3]。
此外,免疫磁珠在病原微生物的检测方面也起了重要的作用,例如,能快速、准确的检测水中弓形虫[4]的情况。
3.2 细胞分离早在20 世纪80 年代初期,Ugelstad 就提出用磁性微粒分离细胞,后由挪威Dynal 公司制成免疫磁珠出售,可用于各种细胞的分离。
使用IMB 进行分离细胞有两种方式:直接从细胞混合液中分离出靶细胞的方法,称为阳性分离;用免疫磁珠去除无关细胞,使靶细胞得以纯化的方法,称为阴性分离。
外泌体磁珠分离法

外泌体磁珠分离法是一种基于免疫亲和原理的外泌体分离技术。
外泌体是细胞释放到外部环境中的小囊泡,它们在体内液体中的存在对于疾病诊断和治疗具有重要价值。
外泌体的分离和纯化是研究和应用这些微小囊泡的关键步骤。
磁珠分离法就是这样一种常用的分离方法,它的工作原理如下:
1. 特异性结合:外泌体表面带有特定的蛋白质标记,如CD63、CD9等。
这些蛋白质可以作为外泌体的特异性标记物。
2. 抗体包被磁珠:将针对这些表面蛋白的抗体包被在磁珠上。
当磁珠与外泌体混合孵育时,抗体会与外泌体表面的对应蛋白结合,形成抗体-抗原复合物。
3. 磁性分离:由于磁珠带有磁性,当施加外部磁场时,与磁珠结合的外泌体会被吸附并随磁珠一起从混合物中分离出来,实现外泌体的纯化。
适的磁珠试剂盒和操作流程。
免疫共沉淀磁珠法-概述说明以及解释

免疫共沉淀磁珠法-概述说明以及解释1.引言1.1 概述概述部分可以简要介绍免疫共沉淀磁珠法的定义和原理。
免疫共沉淀磁珠法是一种利用磁珠载体对特定抗原/抗体进行选择性结合的技术,通过磁场的作用实现对特定分子的快速分离纯化。
这种方法在生物学、医学和生物化学等领域有着广泛的应用,并且具有操作简便、效率高、成本低的优势。
在接下来的文章内容中,我们将对免疫共沉淀磁珠法的方法介绍、应用领域以及优势和局限性进行详细阐述。
1.2 文章结构文章结构部分的内容可以包括对整篇文章的结构和内容进行简要介绍,让读者对文章有一个整体的了解。
可以包括文章的各个章节内容和重点,以及各个部分之间的逻辑关系和连接。
此部分可以是对整篇文章的概述和导读,帮助读者更好地理解和阅读整篇文章。
部分的内容1.3 目的本文旨在介绍免疫共沉淀磁珠法在生物学和医学领域的应用和发展现状。
通过对该方法的详细介绍和分析,旨在帮助读者了解其原理、操作步骤和相关领域的实际应用。
同时,通过评估该方法的优势和局限性,旨在为研究人员提供参考,以便更好地应用和改进该方法。
最终目的是促进免疫共沉淀磁珠法在生物医学研究和临床诊断中的应用,并为未来的研究方向和方法改进提供启示。
2.正文2.1 方法介绍免疫共沉淀磁珠法是一种利用磁珠载体进行免疫共沉淀的方法,在生物医学领域有着广泛的应用。
该方法可以分为直接法和间接法两种。
直接法是指将特异性抗体直接连接到磁珠表面,然后将混合物中的抗原与抗体结合,再利用外加磁场将磁珠与非特异性物质分离。
该方法操作简单,灵敏度高,适用于大多数免疫学试验。
间接法是指首先将特异性抗体连接到磁珠表面,然后将待检测样品中的抗原与抗体结合,再加入第二抗体结合抗原,最后利用外加磁场将磁珠与非特异性物质分离。
该方法对于多肽和蛋白质分析有着较高的灵敏度和特异性。
免疫共沉淀磁珠法具有操作简便、试验时间短、结果准确等优点,同时也存在着磁珠分离效率与特异性抗体结合的选择性等局限性。
免疫磁珠分离法原理与应用

免疫磁珠分离法原理与应用标题:免疫磁珠分离法:原理与应用引言:随着生物技术的快速发展,分离和纯化靶标蛋白成为许多研究人员和生物制药公司关注的重要领域。
在过去的几十年里,形形色色的方法被开发用于从复杂的混合物中纯化特定蛋白质。
其中一种高效且广泛应用的方法是免疫磁珠分离法。
本文将深入探讨免疫磁珠分离法的原理、优点、应用领域以及未来的发展趋势。
一、原理:免疫磁珠分离法是一种基于抗原-抗体相互作用的技术,通过免疫磁珠与靶标蛋白质之间的特异性结合,实现目标蛋白的高效分离和纯化。
其基本原理可以概括为以下几个步骤:1. 免疫反应:免疫磁珠是一种通过磁力控制的微米级磁性颗粒,表面覆盖着特异性抗体。
当样品与免疫磁珠混合时,抗体会与目标蛋白发生特异性结合,形成免疫复合物。
2. 磁珠分离:通过外加磁场,免疫磁珠可以被快速沉降到离心管底部,而其它非特异性成分则会在上清中保持。
这种磁珠分离的特异性和高效性使得目标蛋白质能够被有效地分离和纯化。
3. 洗脱:经过磁珠分离后,目标蛋白质与非特异性成分被分离,而磁珠上的目标蛋白则需要被洗脱下来。
这可以通过改变洗脱缓冲液的pH 值、离子浓度或添加特定的解离剂来实现。
二、优点:免疫磁珠分离法具有许多优点,使其成为生物制药和生物研究领域的重要工具。
以下是一些主要的优点:1. 高度特异性:由于抗体的特异性,免疫磁珠分离法可以实现对目标蛋白的高度特异性结合,从而减少非特异性结合的可能性。
2. 高效性:免疫磁珠分离法可以在短时间内实现目标蛋白的高效分离和纯化。
3. 可逆性:与其他分离方法不同,免疫磁珠分离法可以通过简单地改变外部条件来逆转目标蛋白与磁珠的结合,实现目标蛋白的洗脱和回收。
4. 可扩展性:免疫磁珠分离法可适用于从微量到大规模的样品处理。
三、应用领域:免疫磁珠分离法在多个研究领域和应用中发挥着重要作用。
以下是一些主要的应用领域:1. 生物制药:免疫磁珠分离法已被广泛应用于生物制药领域,用于纯化重组蛋白和单抗等生物药物。
免疫磁珠

三、免疫磁性微球的应用
1接从细胞混合液中分离出靶细胞的方
法,称为阳性分离;用免疫磁珠去除无关细胞,使靶细胞得以纯化的方法称为阴
性分离。免疫磁珠技术可用来分离人类各种细胞如红细胞、外周血嗜酸/碱性粒细 胞,神经干细胞、造血细胞、T淋巴细胞、γδT淋巴细胞,人类关节滑膜细胞,树 突状细胞,内皮细胞、及多种肿瘤细胞等。 2、体外细胞扩增 树突状细胞(Dendriticcells,DC)、造血干、祖细胞等细胞在科研及临床上都具 有巨大的应用价值,但是在体内含量较少而且分布广泛,难以获得大量高纯度的 细胞,限制了该领域的发展。体外扩增辅以免疫磁珠技术有望解决这一难题。在 这一过程中, 用免疫磁性微球分离纯化出待扩增的细胞, 用特定的因子组合培 养,许多研究者用这样的方法寻找扩增的最佳细胞因子组合和移植的最佳时机。
• 前言 • 免疫磁珠分离技术介绍 • 免疫磁分离技术的应用
一、前言
• 免疫磁珠分离技术(Immunomagnetic
beads sep—aration techniques,IMB) 是 将免疫学反应的高度特异性与磁珠特有的 磁响应性相结合的一种新的免疫学技术; 是一种特异性强、灵质纯化敏度高的免疫 学检测方法和抗原纯化手段。是近年来国 内外研究较多的一种新的免疫学技术。 • 目前该项技术在细胞分离、蛋白、免疫学 及微生物学检测等方面均取得了较大的进 展,是目前最有推广价值的技术之一。
二、免疫磁珠分离技术 1、免疫磁珠分离技术原理 利用人工合成的内含铁成分,可被磁铁磁力 所吸引,外有功能基团,可结合活性蛋白 质(抗体)的磁珠,作为抗体的载体。当磁珠 上的抗体与相应的微生物或特异性抗原物 质结合后,则形成抗原-抗体-磁珠免疫复合 物,这种复合物具有较高的磁响应性,在 磁铁磁力的作用下定向移动,使复合物与 其他物质分离,而达到分离、浓缩、纯化 微生物或特异性抗原物质的目的。
磁珠分离细胞技术

磁分离效果
通过调整磁场强度和梯度 ,可以实现对不同种类或 状态的细胞进行高效、快 速的分离。
细胞保护
在磁场作用下,磁珠对细 胞产生一定的保护作用, 可以减少外界因素对细胞 的损伤。
03
磁珠分离细胞技术的实 验方法
实验材料与设备
01
02
03
04
磁珠
具有特定表面修饰的磁性微粒 ,用于与目标细胞结合。
密度梯度离心法利用细胞密度差异进行分离,适用于某些特定类型的细
胞。然而,该方法可能导致细胞活性降低或细胞损伤。相比之下,磁珠
分离技术对细胞活性的影响较小。
06
磁珠分离细胞技术的发 展趋势与展望
技术创新与改进方向
高通量磁珠分离技术
研发能够同时处理大量样本的高通量磁珠分离系统,提高分离效率 和吞吐量。
细胞样品
待分离的细胞悬液,可以是培 养细胞或组织样本。
磁场装置
用于产生磁场,使磁珠与细胞 结合后能够被分离。
试剂与溶液
包括细胞培养基、PBS缓冲液 、胰蛋白酶等,用于细胞培养
和实验操作。
实验步骤与操作
5. 后续处理
根据实验需求,对收集到的目标细胞进行 后续处理,如培养、检测、分析等。
1. 应用领域
基础医学研究
用于研究细胞信号传导 、基因表达调控等生命
过程。
临床医学诊断
用于疾病的早期诊断、 个性化治疗等。
生物工程
用于细胞培养、细胞治 疗、再生医学等领域。
药物研发
用于药物筛选、药效评 价等。
02
磁珠分离细胞技术的基 本原理
磁珠的特性与选择
1 2
超顺磁性
磁珠具有超顺磁性,即在外加磁场作用下能够被 磁化,而在磁场撤去后磁性迅速消失,避免了对 细胞的长期磁化影响。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
磁珠分离技术
一、原理
免疫磁珠法分离细胞基于细胞表面抗原能与连接在磁珠上的特异性单抗相结合,在外磁场中,通过抗体与磁珠相连的细胞被吸附而滞留在磁场中,无该种表面抗原的细胞由于不能与相连着磁珠的特异性单抗结合而没有磁性,不在磁场中停留,从而使细胞得以分离。
免疫磁珠法分正选法和负选法,也称阳性分选法和阴性分选法。
正选法-磁珠结合的细胞就是所要分离获得的细胞;负选法-磁珠结合的细胞为不需要细胞。
一般负选法分选较为常见,因为此方法获得的所需要的细胞表面不含有抗体及磁珠的干扰。
现以两步法分选小鼠CD4+ CD25+ T 细胞的分选为例分别介绍负选法、正选法如下。
1、材料试剂:
<1>、生物素化的,小鼠CD4阴性分选抗体混合物[cocktail ,内含抗B 细胞(CD45R ,B220)、CD8+T 细胞(CD8a ,Ly-2)、造血细胞(CD11b,Mac-1),NK 细胞(CD49b,DX5)等非CD4+T 细胞表面标志的抗体]。
<2>、结合有磁珠的抗生物素抗体(Scimall 科学在线提供);含0.5%BSA (或0.5%FCS )及2mmol/L EDTA 的PBS 缓冲液;抗小鼠CD25-PE 抗体;结合有磁珠的抗PE 抗体(Scimall 科学在线提供);磁珠分离器或分离柱。
2、实验步骤
<1>、负性分选小鼠CD4+T 细胞
<2>、阳性分选小鼠CD25+ T 细胞
二、注意事项:
1、如果分离细胞用作培养,全过程注意无菌操作。
2、磁珠分离系统分离的细胞纯度可以达到80%-99%,得率在60%-90%左右,仅次于或相当于流式细胞仪的分选效率,与FACS相比,MACS设备简单,耗时极短,故而应用广泛。
设定不同的程序(细胞得率或纯度不可兼得),连续两次过柱分选可进一步提高分选细胞纯度,通常可达到95%-95%。
3、由于阳性分选得到的细胞表面结合有抗体及磁珠,有可能影响细胞的功能,故目前常用阴性分选的方法分离细胞。
如果只能用阳性分离的方法,Scimall科学在线建议在分离后培养1-2天,使结合在细胞表面的抗体脱落。
4、抗体包被磁珠对死细胞、红细胞常有非特异性结合。
故而分选前去除死细胞、红细胞(如通过Ficoll分离去除)可以提高分离的效果。
三、阳性分选法和阴性分选法的优缺点比较。
