免疫磁珠技术
免疫磁珠技术及其在食品微生物检测中的应用

免疫磁珠技术及其在食品微生物检测中的应用随着食品安全问题的日益严重,食品微生物检测成为了食品安全监管的重要手段。
而免疫磁珠技术作为一种高效、快速、灵敏、特异性强的检测方法,已经在食品微生物检测中得到了广泛应用。
一、免疫磁珠技术的原理免疫磁珠技术是将特异性抗体固定在磁性微珠表面,并将其与待检测样品中的微生物结合,通过磁力分离技术将目标微生物从复杂的基质中分离出来,从而实现快速、高效、特异性强的检测方法。
二、免疫磁珠技术在食品微生物检测中的应用1. 检测食品中的病原微生物免疫磁珠技术可以用于检测食品中的多种病原微生物,如大肠杆菌、沙门氏菌、金黄色葡萄球菌等。
该技术具有高灵敏度、高特异性、快速、简便等优点,可以在短时间内检测出食品中的病原微生物,为食品安全监管提供了有力的技术支持。
2. 检测食品中的致病菌免疫磁珠技术还可以用于检测食品中的致病菌,如霉菌、酵母菌等。
该技术可以在短时间内检测出致病菌的存在情况,为食品生产企业提供了有效的质量控制手段。
3. 检测食品中的致敏物质免疫磁珠技术还可以用于检测食品中的致敏物质,如花生、虾、蟹等食品中的过敏原。
该技术可以在短时间内检测出食品中的致敏物质,为过敏人群提供了有效的食品安全保障。
三、免疫磁珠技术的优点1. 特异性强免疫磁珠技术采用特异性抗体,可以高效地捕捉目标微生物,避免误检和漏检。
2. 灵敏度高免疫磁珠技术具有高灵敏度,可以检测出微生物的极低浓度。
3. 快速、简便免疫磁珠技术操作简单,检测速度快,可以在短时间内完成检测。
4. 应用范围广免疫磁珠技术可以应用于多种食品中的微生物、致病菌和致敏物质的检测,具有广泛的应用前景。
四、免疫磁珠技术的发展趋势随着科技的不断发展,免疫磁珠技术在食品微生物检测中的应用将会越来越广泛。
未来,免疫磁珠技术将会进一步提高检测的灵敏度和特异性,加快检测速度,降低成本,为食品安全监管提供更加完善的技术支持。
五、结论免疫磁珠技术是一种高效、快速、灵敏、特异性强的检测方法,在食品微生物检测中得到了广泛应用。
免疫磁珠分离技术
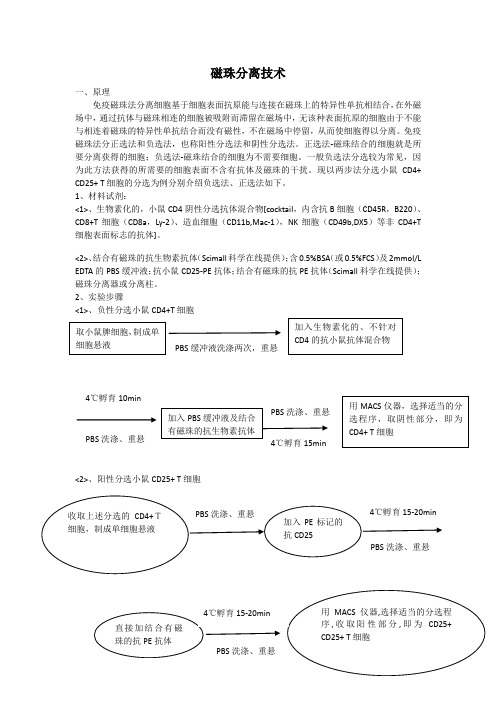
磁珠分离技术一、原理免疫磁珠法分离细胞基于细胞表面抗原能与连接在磁珠上的特异性单抗相结合,在外磁场中,通过抗体与磁珠相连的细胞被吸附而滞留在磁场中,无该种表面抗原的细胞由于不能与相连着磁珠的特异性单抗结合而没有磁性,不在磁场中停留,从而使细胞得以分离。
免疫磁珠法分正选法和负选法,也称阳性分选法和阴性分选法。
正选法-磁珠结合的细胞就是所要分离获得的细胞;负选法-磁珠结合的细胞为不需要细胞。
一般负选法分选较为常见,因为此方法获得的所需要的细胞表面不含有抗体及磁珠的干扰。
现以两步法分选小鼠CD4+ CD25+ T 细胞的分选为例分别介绍负选法、正选法如下。
1、材料试剂:<1>、生物素化的,小鼠CD4阴性分选抗体混合物[cocktail ,内含抗B 细胞(CD45R ,B220)、CD8+T 细胞(CD8a ,Ly-2)、造血细胞(CD11b,Mac-1),NK 细胞(CD49b,DX5)等非CD4+T 细胞表面标志的抗体]。
<2>、结合有磁珠的抗生物素抗体(Scimall 科学在线提供);含0.5%BSA (或0.5%FCS )及2mmol/L EDTA 的PBS 缓冲液;抗小鼠CD25-PE 抗体;结合有磁珠的抗PE 抗体(Scimall 科学在线提供);磁珠分离器或分离柱。
2、实验步骤<1>、负性分选小鼠CD4+T 细胞<2>、阳性分选小鼠CD25+ T 细胞二、注意事项:1、如果分离细胞用作培养,全过程注意无菌操作。
2、磁珠分离系统分离的细胞纯度可以达到80%-99%,得率在60%-90%左右,仅次于或相当于流式细胞仪的分选效率,与FACS相比,MACS设备简单,耗时极短,故而应用广泛。
设定不同的程序(细胞得率或纯度不可兼得),连续两次过柱分选可进一步提高分选细胞纯度,通常可达到95%-95%。
3、由于阳性分选得到的细胞表面结合有抗体及磁珠,有可能影响细胞的功能,故目前常用阴性分选的方法分离细胞。
免疫磁珠富集细胞步骤

免疫磁珠富集细胞步骤
免疫磁珠富集细胞是一种利用抗体包被的磁性微粒对目标细胞进行特异性标记和分离的技术,广泛应用于血液、组织液及其它生物样本中稀有细胞的高效纯化。
以下是免疫磁珠富集细胞的基本步骤:
1.准备磁珠:
选择针对目标细胞表面抗原的特异性抗体包被的免疫磁珠。
根据生产商推荐的方法稀释磁珠,并在适宜条件下活化。
2.样本处理:
收集待处理样本(如血液、骨髓、胸腔积液等),根据需要可能需要进行红细胞裂解或者其它预处理步骤以去除杂质细胞或血细胞成分。
将处理后的样本与已活化的免疫磁珠混合,在一定温度和时间条件下孵育,使磁珠上的抗体与目标细胞表面抗原结合,形成“玫瑰花结”结构。
3.磁性分离:
将孵育好的样品放置于磁场设备中(如MACS分选器或其他磁力架)。
在磁场作用下,结合了磁珠的目标细胞会迅速聚集到管壁或磁力板上,而未结合磁珠的非目标细胞则不会被吸引,从而实现初步的物理分离。
4.洗涤与收集:
温和地移除未结合磁珠的液体部分,通常需进行数次洗涤,以进一步去除非特异性结合的细胞和其他杂质。
当完成洗涤后,关闭或移除磁场,用适当的缓冲液或培养基收集富集的目标细胞。
5.后续操作:
可以直接对收集到的目标细胞进行下游实验分析,例如分子生物学检测、细胞培养、流式细胞术分析等。
6.质量控制:
对分离出的细胞进行计数、活力检测以及目的细胞标志物表达水平的确认,确保富集效果满足实验要求。
以上步骤为一般性的流程描述,具体操作时应参考所使用的免疫磁珠产品说明书和实验室规程。
免疫共沉淀磁珠法-概述说明以及解释

免疫共沉淀磁珠法-概述说明以及解释1.引言1.1 概述概述部分可以简要介绍免疫共沉淀磁珠法的定义和原理。
免疫共沉淀磁珠法是一种利用磁珠载体对特定抗原/抗体进行选择性结合的技术,通过磁场的作用实现对特定分子的快速分离纯化。
这种方法在生物学、医学和生物化学等领域有着广泛的应用,并且具有操作简便、效率高、成本低的优势。
在接下来的文章内容中,我们将对免疫共沉淀磁珠法的方法介绍、应用领域以及优势和局限性进行详细阐述。
1.2 文章结构文章结构部分的内容可以包括对整篇文章的结构和内容进行简要介绍,让读者对文章有一个整体的了解。
可以包括文章的各个章节内容和重点,以及各个部分之间的逻辑关系和连接。
此部分可以是对整篇文章的概述和导读,帮助读者更好地理解和阅读整篇文章。
部分的内容1.3 目的本文旨在介绍免疫共沉淀磁珠法在生物学和医学领域的应用和发展现状。
通过对该方法的详细介绍和分析,旨在帮助读者了解其原理、操作步骤和相关领域的实际应用。
同时,通过评估该方法的优势和局限性,旨在为研究人员提供参考,以便更好地应用和改进该方法。
最终目的是促进免疫共沉淀磁珠法在生物医学研究和临床诊断中的应用,并为未来的研究方向和方法改进提供启示。
2.正文2.1 方法介绍免疫共沉淀磁珠法是一种利用磁珠载体进行免疫共沉淀的方法,在生物医学领域有着广泛的应用。
该方法可以分为直接法和间接法两种。
直接法是指将特异性抗体直接连接到磁珠表面,然后将混合物中的抗原与抗体结合,再利用外加磁场将磁珠与非特异性物质分离。
该方法操作简单,灵敏度高,适用于大多数免疫学试验。
间接法是指首先将特异性抗体连接到磁珠表面,然后将待检测样品中的抗原与抗体结合,再加入第二抗体结合抗原,最后利用外加磁场将磁珠与非特异性物质分离。
该方法对于多肽和蛋白质分析有着较高的灵敏度和特异性。
免疫共沉淀磁珠法具有操作简便、试验时间短、结果准确等优点,同时也存在着磁珠分离效率与特异性抗体结合的选择性等局限性。
免疫磁珠分离法

免疫磁珠分离法介绍免疫磁珠分离法是一种先进的生物技术方法,可用于分离和纯化特定目标分子。
这种方法基于对特定分子的高度选择性结合,通过使用磁性珠子将目标分子与其他非特异性组分分离开来。
本文将详细介绍免疫磁珠分离法的原理、步骤和应用。
原理免疫磁珠分离法是利用特异性抗体与相关抗原之间的结合力来实现分离和纯化的。
在该方法中,磁性珠子上涂覆有特异抗体,这些抗体能够与目标分子高度选择性地结合。
当样品中包含目标分子时,抗体会与其结合,形成一个稳定的抗原-抗体复合物。
步骤1. 准备磁性珠子在免疫磁珠分离法中,选择合适大小和类型的磁性珠子非常重要。
通常,珠子的大小在1-5微米之间,表面覆盖有一层特异抗体。
磁性珠子可以通过商业供应商购买或自行制备。
2. 样品处理样品处理步骤包括样品的收集、预处理和溶解。
样品中可能包含大量的杂质和非特异性蛋白质,这些都会干扰免疫分离过程。
因此,为了获得高纯度的目标分子,必须对样品进行预处理。
3. 结合反应将磁性珠子加入样品中,并与目标分子进行结合反应。
一般需要在恒温和适当的时间下进行反应,以确保抗原与抗体结合的充分。
4. 磁珠分离利用磁性珠子的磁性特性,将珠子简单地用磁场固定在容器的一侧。
非特异性组分在重力的作用下沉淀到容器底部,而珠子与目标分子形成的复合物会留在悬浮液中。
这样就能够简单、快速地实现目标分子的分离。
应用免疫磁珠分离法在生命科学研究和生物医学领域有广泛的应用。
以下是免疫磁珠分离法的几个常见应用示例:1. 蛋白质纯化免疫磁珠分离法可用于纯化复杂混合物中的特定蛋白质。
通过使用与目标蛋白质结合的抗体修饰的磁性珠子,可以将目标蛋白质高效分离出来,并去除其他非特异性组分。
2. 细胞分离免疫磁珠分离法可用于分离不同类型或特定表面标志物的细胞。
通过选择性使用与目标细胞结合的抗体修饰的磁性珠子,可以实现对混合细胞群体的分离和纯化。
3. 病原体检测免疫磁珠分离法可用于病原体的快速检测。
通过与病原体相关的抗体修饰的磁性珠子,可以高效地将病原体与其他细菌或病毒区分开来,并进行快速分离和鉴定。
免疫磁珠纯化蛋白的原理

免疫磁珠纯化蛋白的原理免疫磁珠(Immunomagnetic Bead,IMB)技术是一种利用特定性抗体偶联在磁性珠子表面,通过抗原抗体的非共价结合及磁性珠能够吸附在磁场作用下实现快速、高效及特异性纯化目标蛋白的技术。
这种技术的主要原理是基于抗原和抗体相互作用的原理。
1.免疫复合物的形成免疫磁珠通常是从大肠杆菌酸生产工艺中制备出的磁性颗粒,表面覆盖有可选择某个目标蛋白的特异性抗体。
在蛋白的样品中,这些特异性抗体可以与目标抗原进行结合形成免疫复合物。
2.免疫磁珠的捕获将免疫磁珠加入蛋白样品中,磁性作用会使免疫磁珠快速从样品中被吸附,而目标蛋白结合在免疫磁珠表面的特异性抗体上,形成免疫复合物。
3.洗涤通过旋转磁体或磁珠分离器将免疫复合物从未结合的物质中分离出来,并先后进行多次洗涤以去除非特异物质,减少背景干扰。
4.洗脱将诱导免疫复合物大幅度变形或破裂或降解的缓冲溶液添加到磁珠上,使得免疫磁珠上已捕获目标蛋白质离开免疫磁珠,从而得到纯净的目标蛋白样品。
免疫磁珠纯化蛋白是目前最广泛使用的纯化技术之一,具有以下优点:1、具有高选择性免疫磁珠可以与目标蛋白高度特异性地结合,减少了背景干扰,并最大程度上使目标蛋白净化能够得到升级。
2、易于蛋白高效、快速纯化采用免疫磁珠纯化技术可以轻松地处理大量的样本,并能够快速提取出高纯度的目标蛋白样品。
3、广泛应用范围免疫磁珠技术的应用范围非常广泛,可以应用于蛋白质、抗体、病毒、激素、细胞因子及其它不同种类的分子的纯化和富集。
免疫磁珠纯化蛋白已成为目前重要的实验手段之一,其应用范围已涉及到许多领域,如基因组学、蛋白质组学、生物制药等等。
例如,目标蛋白质的纯化可以用于表达纯化蛋白、生物分子分离、分析和定量测定、抗体制备、生物学研究、诊断检测及疫苗生产等。
在药物研发和生产过程中,也可以应用免疫磁珠技术对生物药物进行纯化和快速纯化。
此外,免疫磁珠技术还可以用于疾病诊断之类的测试。
免疫磁珠分离法原理与应用
免疫磁珠分离法原理与应用标题:免疫磁珠分离法:原理与应用引言:随着生物技术的快速发展,分离和纯化靶标蛋白成为许多研究人员和生物制药公司关注的重要领域。
在过去的几十年里,形形色色的方法被开发用于从复杂的混合物中纯化特定蛋白质。
其中一种高效且广泛应用的方法是免疫磁珠分离法。
本文将深入探讨免疫磁珠分离法的原理、优点、应用领域以及未来的发展趋势。
一、原理:免疫磁珠分离法是一种基于抗原-抗体相互作用的技术,通过免疫磁珠与靶标蛋白质之间的特异性结合,实现目标蛋白的高效分离和纯化。
其基本原理可以概括为以下几个步骤:1. 免疫反应:免疫磁珠是一种通过磁力控制的微米级磁性颗粒,表面覆盖着特异性抗体。
当样品与免疫磁珠混合时,抗体会与目标蛋白发生特异性结合,形成免疫复合物。
2. 磁珠分离:通过外加磁场,免疫磁珠可以被快速沉降到离心管底部,而其它非特异性成分则会在上清中保持。
这种磁珠分离的特异性和高效性使得目标蛋白质能够被有效地分离和纯化。
3. 洗脱:经过磁珠分离后,目标蛋白质与非特异性成分被分离,而磁珠上的目标蛋白则需要被洗脱下来。
这可以通过改变洗脱缓冲液的pH 值、离子浓度或添加特定的解离剂来实现。
二、优点:免疫磁珠分离法具有许多优点,使其成为生物制药和生物研究领域的重要工具。
以下是一些主要的优点:1. 高度特异性:由于抗体的特异性,免疫磁珠分离法可以实现对目标蛋白的高度特异性结合,从而减少非特异性结合的可能性。
2. 高效性:免疫磁珠分离法可以在短时间内实现目标蛋白的高效分离和纯化。
3. 可逆性:与其他分离方法不同,免疫磁珠分离法可以通过简单地改变外部条件来逆转目标蛋白与磁珠的结合,实现目标蛋白的洗脱和回收。
4. 可扩展性:免疫磁珠分离法可适用于从微量到大规模的样品处理。
三、应用领域:免疫磁珠分离法在多个研究领域和应用中发挥着重要作用。
以下是一些主要的应用领域:1. 生物制药:免疫磁珠分离法已被广泛应用于生物制药领域,用于纯化重组蛋白和单抗等生物药物。
免疫磁珠技术及其在食品微生物检测中的应用
免疫磁珠技术及其在食品微生物检测中的应用随着食品安全问题的日益严重,对食品微生物检测的需求也越来越高。
传统的微生物检测方法存在着操作繁琐、时间长、灵敏度低等问题,因此需要开发一种更加快捷、准确的检测方法。
免疫磁珠技术作为一种新兴的分离和检测技术,具有操作简便、快速、灵敏度高等优点,在食品微生物检测中得到了广泛的应用。
一、免疫磁珠技术的原理及特点免疫磁珠技术是将磁性珠子与特异性抗体结合,通过磁性珠子的快速分离和富集目标微生物,从而实现对微生物的检测。
磁性珠子具有较强的磁性,可以通过外加磁场的作用来实现珠子与微生物的快速分离。
其特点是操作简单、快速、灵敏度高、重复性好、不受样品复杂性的影响,适用于多种样品类型和微生物种类的检测。
二、免疫磁珠技术在食品微生物检测中的应用1.肠道致病菌检测肠道致病菌是食品中最常见的致病微生物之一,其检测对于食品安全至关重要。
传统的肠道致病菌检测方法通常需要进行培养、分离、鉴定等多个步骤,耗时长且容易出现假阳性结果。
而免疫磁珠技术可以通过特异性的抗体富集目标微生物,避免了传统方法中的多个步骤,大大缩短了检测时间。
同时,免疫磁珠技术具有较高的灵敏度和特异性,可以检测到低浓度的微生物,并且不会产生假阳性结果。
2.食品中的真菌和酵母菌检测真菌和酵母菌是常见的食品污染源,其检测对于保障食品安全至关重要。
传统的真菌和酵母菌检测方法通常需要进行培养、分离、鉴定等多个步骤,耗时长且容易出现假阳性结果。
而免疫磁珠技术可以通过特异性的抗体富集目标微生物,避免了传统方法中的多个步骤,大大缩短了检测时间。
同时,免疫磁珠技术具有较高的灵敏度和特异性,可以检测到低浓度的微生物,并且不会产生假阳性结果。
3.食品中的病毒检测食品中的病毒是一种比较难以检测的微生物,其检测对于保障食品安全至关重要。
传统的病毒检测方法通常需要进行多个步骤,耗时长且容易出现假阳性结果。
而免疫磁珠技术可以通过特异性的抗体富集目标病毒,避免了传统方法中的多个步骤,大大缩短了检测时间。
免疫磁珠细胞分选法
免疫磁珠细胞分选法
免疫磁珠细胞分选法是一种常用的细胞分离技术,用于根据细胞表面特异性标记物的
表达情况,快速高效地分选目标细胞。
1. 准备工作:
- 细胞样品:将待分选细胞样品通过离心步骤得到细胞沉淀。
- 细胞培养基:根据所需的细胞类型选择适当的培养基,添加适量的BSA(牛血清蛋白)以防止非特异性结合。
- 免疫磁珠:选择对目标细胞表面特异性标记物具有高度亲和力的免疫磁珠。
2. 磁珠表面的功能化:
- 将免疫磁珠用细胞培养基悬浮,并离心去除上清液。
- 使用稀释的BSA溶液处理磁珠,以阻断非特异性结合位点。
- 添加富有活性羟基的化合物(如PEG–NH2)处理磁珠,使磁珠表面羟基化。
3. 细胞与磁珠的结合:
- 将培养基悬浮的免疫磁珠与细胞样品混合,在合适的温度和时间条件下进行孵育,
使细胞与磁珠结合。
- 磁珠表面的抗体与目标细胞的表面特异性标记物结合,并形成稳定的复合物。
4. 分离目标细胞与非目标细胞:
- 使用磁力分选系统,将培养基中的磁珠和细胞分离出来。
磁珠上的磁性能够快速吸
附到磁力分选系统上,而非目标细胞则会留在培养基中。
- 可以通过适当的洗涤步骤去除非特异性结合和杂质细胞,以得到纯净的目标细胞
群。
5. 目标细胞的后续处理:
- 可以将分选后的细胞用于进一步的实验研究,如细胞培养、分析、基因组学或蛋白
质组学研究等。
- 可以使用目标细胞进行细胞培养、移植、植入或治疗等应用。
免疫磁珠细胞分选法既快速又高效,适用于实验室中的细胞分离和纯化工作,为细胞生物学、医学研究和临床应用提供了重要的技术支持。
免疫磁珠分离技术及应用
免疫磁珠分离技术及应用一、前沿免疫磁珠分离技术(Immunomagnetic beads sep—aration techniques,IMB) 是将免疫学反应的高度特异性与磁珠特有的磁响应性相结合的一种新的免疫学技术;是一种特异性强、灵质纯化敏度高的免疫学检测方法和抗原纯化手段。
是近年来国内外研究较多的一种新的免疫学技术。
目前该项技术在细胞分离、蛋白、免疫学及微生物学检测等方面均取得了较大的进展,是目前最有推广价值的技术之一。
二、免疫磁珠分离技术介绍1、免疫磁珠分离技术原理利用人工合成的内含铁成分,可被磁铁磁力所吸引,外有功能基团,可结合活性蛋白质(抗体)的磁珠,作为抗体的载体。
当磁珠上的抗体与相应的微生物或特异性抗原物质结合后,则形成抗原-抗体-磁珠免疫复合物,这种复合物具有较高的磁响应性,在磁铁磁力的作用下定向移动,使复合物与其他物质分离,而达到分离、浓缩、纯化微生物或特异性抗原物质的目的。
2、免疫磁珠法分类⑴、阳性分离法磁珠结合的细胞就是所要分离获得的细胞⑵、阴性分离法磁珠结合不需要的细胞,游离于磁场的细胞为所需细胞。
一般而言,阴性分离法的磁珠用量比阳性分离法的大,阳性分离法用的更多。
磁性微珠是以金属离子为核心,外层均匀包裹高分子聚合体的固相颗粒。
磁性微珠上既可标记针对某种细胞表面抗原的特异性抗体(直接法); 也可标记羊抗鼠IgG抗体(间接法),使分离细胞的范围大大扩大。
3、免疫磁性微球的制备基本技术路线:制成磁性材料的微球,再在微球表面引入活性基团,通过载体表面偶联反应可将抗体结合到载体上,形成免疫磁性微球。
优质微载体的性能:合适且均一的磁响应强度,较小且均一的粒径,稳定均一、特异吸附的表面性能。
4、该技术的主要优点⑴、细小而均一的微球为配基与受体的反应提供了较大的接触面积⑵、磁珠的磁性使其可以用磁力收集器方便快速地获得分离,且对被分离物无损伤⑶、检测复杂的生物样本和食品样本等时受到颗粒性杂质等的影响较小⑷、作为一种流动性的固相支持物,其洗涤和反应都进行得更加充分三、免疫磁分离技术的应用1、用于细胞分离和提纯使用IMB进行分离细胞有两种方式;直接从细胞混合液中分离出靶细胞的方法,称为阳性分离;用免疫磁珠去除无关细胞,使靶细胞得以纯化的方法称为阴性分离。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
IMB技术的优点
IMB技术适用于各类食品基质中的沙门氏菌的快 速检测,能快速有效富集食品基质中的目标病原 菌,且有良好的灵敏度和特异性,检测限可达到 1—10cfu/25g;在检测时间方面可将常规检测方 法中的72小时检测周期缩短至40小时,而且能 有效减轻过程交叉污染;筛选结果既可以与常规 的细菌生化和血清学联用,也可以和显色培养基、 荧光PCR以及微生物全自动鉴定仪器等方法联 用,为食源性致病菌的检测和鉴定提供了有效的 快速筛选技术。
1.1.2
免疫磁珠的性质
由于免疫磁珠的大小和形状具有均一性, 从而可使 靶物质迅速和有效地结合到磁珠上,也可使生成的 新复合物在磁场中具有相同的磁响应性,且行为一 致 磁珠的球形结构可消除与不规则形状粒子有关的非 特异性结合 顺磁性可使磁珠置于磁场时显示其磁性,并做定向 移动, 从磁场移出时磁性消除, 磁珠分散, 由此可 方便地进行分离和磁性导向 保护性壳可防止磁性内核漏出或被载液腐蚀; 免疫配基可特异性地结合反应体系中相应的抗原、 抗体、核酸等生物活性物质。
金属小颗粒(Fe2O3、Fe3O4)
载体微球
高分子层
如聚乙烯亚胺、聚乙烯醇、聚醋酸乙 烯脂、聚丙烯酸、酶类、多糖(淀粉、 纤维素、葡聚糖、果胶等)、球蛋白 和牛血清白蛋白等,
功能基
如氨基(-NH2)、羧基(-COOH)、 羟基(-OH),使其表现具有疏水亲水、非极性-极性、带正电荷-带 负电荷等不同的物理性质。
2.1.2 单核细胞增生李斯特菌的检测
传统的单增李斯特菌检测方法检测周期长, 约5~14d,步骤繁琐且灵敏度低,而IMB技术 的优点在于在较低的菌液浓度时也可以通过 免疫磁珠的富集作用进行检测,缩短了检测 时间并进一步降低了单增李斯特菌的检测限。 2008年,我国将免疫磁珠检测单核细胞 增生李斯特菌的方法纳入了出入境检验检疫 行业标准中(SN/T 0184.3-2008)。
↓
↓
MUG-LST
36± 1oC 18h~24h
阳性
非O157细菌
阴性
↓ ↓
血清学试验 生化试验
↓
报告
具体操作步骤
增菌
免疫磁珠捕获与分离 1.将Eppendorff管按样品和质控菌株进行编号,每 个样品使用1支Eppendorff管,然后插人到磁板架 上。在漩涡混合器上轻轻振荡E. coli O157免疫磁 珠溶液后,用开盖器打开每支Eppendorff管的盖 子,每管加人20 μL E. coli 0157免疫磁珠悬液。 2.取mEC+n肉汤增菌培养物1 mL,加人到 Eppendorff管中,盖上盖子,然后轻微振荡10 s。 每个样品更换1支加样吸头,质控菌株必须与样品分 开进行,避免交叉污染。
2.1.1 大肠杆菌O157的检测
传统分离E.coli O157∶H7所采用的直接分离 法存在着鉴别力差、抑制杂菌能力弱、耗时长、 工作量大等缺点。 采用免疫磁珠技术,能够快速地从各种食品样 品中分离富集E.coli O157∶H7,满足流行病学 的研究要求和提高控制力度。 现在这种免疫磁珠的方法已经被英国公共健 康服务实验室认定为标准的分离方法,我国也 已将免疫磁珠法对大肠杆菌O157的检测纳入 国家标准(GB/T 4789.36-2008)和出入境检 验检疫行业标准(SN/T 1059.5-2006)。
1样品制备 2增菌 3免疫磁珠分离((IMS) 1)免疫捕获 混增菌培养液.沉淀所有的粗糙食物残渣.从增菌培 养液中移取1mL上层液体(要尽可能避免移取到食物 颗粒和脂肪颗粒)加人Eppendorf管中.加20μL准备 好的免疫磁珠。在旋涡混合器上混合该悬液。
2)分离 将Eppendorf管固定在磁架的管孔中。1800轻缓摆 动磁架5次--6次,使免疫磁珠聚集到磁极。小心地打开磁 架上的Eppendorf管管盖,从磁极对面一侧慢慢吸出液 体,注意不要接触管壁上的磁珠。每一个样品换一次枪 头;加1 mI灭菌的PBS ,并重新盖好盖子.将磁极从支 架上移走,1800轻缓摆动磁架5次一6次,使管内各成分 混合,后重新将磁极放回到支架上。重复该清洗步骤几 次。将离心管从磁性分离器上移开.并加100μL灭菌的 PBS到管中,重悬磁珠。如果实验室没有磁性分离器. ,可以用手摇代替. 4.分离培养 1)分离培养
检样25g(mL)
对225mLFB1増菌液(30 ℃士1℃ ,24h士1h)
单 增 李 斯 特 菌 的 检 测 方 法
1mL转种10mL FB2増菌液( 35℃ ,24h士1h)
通过免疫磁珠捕获李斯特菌,然后再用灭菌缓冲液洗涤
用0.1mL的灭菌缓冲液重新制成悬液
吸取50uL免疫磁珠悬液划线于CHROMagar 显色培养基, OXA/PALCAM琼脂平板(35 ℃ +1 ℃,24h~28h) 各挑选5个典型菌落 接种于TSA-YE琼脂平板,纯培养 鉴定和确认试验
免疫配基
免疫配基通过生物高分子的功能基团结合到 磁性载体微球上形成免疫磁珠。由于载体微 球制备材料和方法不同,其表现出的物理性 质也不同, 从而可结合不同的免疫配基, 如抗原、抗体、凝集素、DNA 和RNA 等。 配基必须具有生物专一性的特点, 而且载体 微球与配基结合要不影响或改变配基原有的 生物学特性, 保证磁珠的特殊识别功能。
1.免疫磁珠技术简介
1.1
免疫磁珠的结构与性质
1.1.1 免疫磁珠的结构 免疫磁珠(IMB), 也称免疫磁性微球, 是一 种均匀、具有超顺磁性及保护性壳的球形小粒子, 基本上由载体微球和免疫配基结合而成。其核心为 顺磁性粒子,核心外层包裹一层高分子料, 最外层 是免疫配基。
载体微球
磁性物质
GB/T 4789.36-2008 免疫磁珠捕获法检测程序
检样 25g(mL)+225mL改良EC肉汤(mEC+n),均质225mL
36± 1oC
↓ 18h~24h ↓
免疫磁珠捕获 涂布CT-SMAC平板和改良CHROMagar O157弧菌显色琼脂平板
36± 1oC
↓
18h~24h
挑取可疑菌落5个~10个,氧化酶阴性,革兰氏阴性杆菌接种TSI
例1:Notzon等用IMB-荧光PCR检测肉类中的 沙门氏菌,实验包括非选择性增菌、免疫磁珠 分离、DNA提取及PCR扩增,12~13h即可完 成检测过程,IMB-荧光PCR在检测自然感染肉 类和人工感染肉类都具有较高的敏感性和特异 性。
例2:Blackburn 等将用生物素标记的抗沙门 菌多价多克隆抗体连接到链霉亲和素包被的磁 珠上,以此试剂检测从不同食物中提取的活沙 门菌。此法的敏感性可达105cfu/g 食物,总的 检测时间从5d减少至1~2d。
3.结合:在18℃~30℃环境中,将上述Eppendorff管 连同磁板架放在Dynal MXl样品混合器上转动或用 手轻微转10 min,使E. coli O157与免疫磁珠充分 接触。 4.捕获:将磁板插人到磁板架中浓缩磁珠。在3 min 内不断地倾斜磁板架,确保悬液中与盖子上的免疫 磁珠全部被收集起来,此时,在Eppendorff管壁 中间明显可见圆形或椭圆形棕色聚集物。 5.吸取上清液:取1支无菌加长吸管,从免疫磁珠聚集 物对侧深人液面,轻轻吸走上清液。当吸到液面通 过免疫磁珠聚集物时,应放慢速度,以确保免疫磁 珠不被吸走。如吸取的上清液内含有磁珠,则应将 其放回到Eppendorff管中,并重复4步骤。每个样品 换用1支无菌加长吸管。
免疫磁珠技术(IMB)在食品 有害微生物检测中的应用
目录
1
免疫磁珠技 免疫磁珠技术
2
2.1
免疫磁珠技术的应用
IMB技术在食品有害微生物检测中的应用 2.2 免疫磁珠与其它检测手段的联用 2.3 免疫磁珠技术在其他领域的应用 2.4 免疫磁珠技术的优缺点及发展方向
单核细胞增生李斯特氏菌的检测
Skjerve等通过包被单克隆抗体的磁珠从 不同食物样品中分离李斯特菌,采用将磁 珠接种到琼脂平板培养的方法进行菌株鉴 定,此法的敏感性为102~104cfu/mL样品。 Hudson等研究表明,将免疫磁珠技术与PCR 结合,24h内即可检出火腿中的单增李斯特 菌。
2.1.3 沙门氏菌的检测
2 .免疫磁珠技术的应用
2.1 食品有害微生物检测中的应用
免疫磁珠技术与常规检验方法相比具有显著的 优点,它能从样品中迅速、有选择性地分离出 目的微生物,有效地减少了背景的干扰,提高 了精准性。 还能捕获受损伤的靶细菌,而目前所用的几种 常规方法则不具备这样的能力。目前,免疫磁 珠技术已经广泛应用于食品样品中致病微生物 的检测。
6.洗涤:洗涤免疫磁珠混合物。重复上述步骤 4~ 6 。 7.重复上述步骤4 ~ 5 。 8.免疫磁珠悬浮:将免疫磁珠重新悬浮在100 μL PBS-Tween 20洗液中。 9.涂布平板:用漩涡混合器将免疫磁珠混匀,用加样 器各取50 μL免疫磁珠悬液分别转移至CT-SMAC平 板和改良CHROMagar O157弧菌显色琼脂平板一 侧,然后用无菌涂布棒将免疫磁珠涂布平板的一半 ,再用接种环划线接种平板的另一半。待琼脂表面 水分完全吸收后,翻转平板,于36℃士1 0℃培养18 h---24 h 。
吸取50μL免疫磁珠悬液.加到显色培养基及任一 选择性培养基OXA、PALCAM琼脂平板上.用无菌 接种环划线.35℃士1℃培养22h-48h。 2)筛选 李斯特氏菌在CHROMagar显色培养基上菌落为 蓝色.且在其周围形成一个晕环。李斯特氏菌在OXA 琼脂平板上生长22 h后菌落呈现黑色.直径为1mm. 在其周围形成一个黑色环。培养48h,菌落仍呈黑色 .直径2mm --3mm.除在菌落周围有一环外.在菌落中 心部位的深层也形成黑点。李斯特氏菌在PALCAM 琼脂平板上与在()XA琼脂平板上菌落相似。在 CHROMagar显色培养基及OXA或PALCAM琼脂 平板上挑取5个或更多可疑菌落.接种于TSA-YE琼脂 平板上.纯培养后进鉴定。 5.鉴定和确认
